Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.6 Bogota Nov./Dec. 2007
-Estado del arte-
Parte 2 - Patologías de la aorta torácica y otras aplicaciones
-State of the art-
Part 2 - Pathologies of thoracic aorta and other applications
Departamento de Hemodinamia y Cardiología Intervencionista, Fundación Clínica Abood Shaio. Bogotá, DC., Colombia.
Correspondencia: Carlos E. Uribe, MD. Clínica Cardiovascular Santa María, Departamento de Hemodinámica y Cardiología Intervencionista, Calle 78B No. 75-21, Medellín, Colombia. Correo electrónico: uribemd72@hotmail.com
Recibido: 02/11/06. Aprobado: 14/06/07.
En la actualidad, el tratamiento endovascular de las patologías de aorta es una alternativa a la cirugía abierta. Éste ha demostrado ser seguro ya que arroja resultados iguales o superiores que el grupo quirúrgico.
En este artículo se presenta el estado actual del tratamiento con endoprótesis de las patologías de aorta, así como las indicaciones, las contraindicaciones y el futuro del tratamiento con este tipo de dispositivos.
Palabras clave: endoprótesis, estado del arte, indicaciones, contraindicaciones, evaluación, aneurismas de aorta, disección de aorta.
Endovascular treatment of aortic pathologies is actually an alternative to open surgery. It has proven to be safe, showing similar or better results to those achieved by surgery.
In this article, treatment of aortic pathologies by means of endoprosthesis is presented, as well as its indications, contraindications and future treatment with this kind of devices.
Key words: endoprosthesis, state of the art, indications, contraindications, evaluation, aortic aneurysms, aortic dissection.
Introducción
La primera cirugía abierta exitosa para el reparo de un aneurisma de aorta abdominal, fue realizada por Dubost en 1952 (1). Desde entonces, las mejorías en las técnicas quirúrgicas han reportado, en las series modernas, una mortalidad quirúrgica del 1% al 5%. No obstante, existen otros riesgos diferentes a la mortalidad cuando se realiza una laparotomía mayor; éstos incluyen complicaciones mayores (20% a 40%), hospitalización prolongada (5 a 10 días), recuperación prolongada (2 a 5 meses)y disfunción sexual (60% al 80%) (2, 3). Además, hay pacientes con comorbilidades serias que los hacen candidatos no opcionales a cirugía. Estas razones hicieron que se desarrollaran métodos alternativos para el tratamiento de los aneurismas de aorta.
Juan Parodi dio inicio al desarrollo de la técnica endovascular para el reparo de aneurismas, con el primer reporte de un implante de endoprótesis de aorta en 1991. Desde aquel momento, comenzaron a desarrollarse materiales y técnicas de manera vertiginosa (4).
De hecho, los estudios realizados a la fecha para el reparo endovascular de los aneurismas de aorta abdominal, demuestran una mortalidad menor a los 30 días y sobrevidas comparables al año contra el grupo quirúrgico, así como menores estancias hospitalarias e incidencia de complicaciones (5-10).
Hasta ahora, la Food and Drug Administration sólo ha aprobado cuatro endoprótesis comerciales para el reparo endovascular de aneurismas de aorta abdominal (2).
Se calcula que en los Estados Unidos de Norte América se han llevado a cabo aproximadamente 20.000 implantes de endoprótesis y 35.000 de ellos se han realizado en el mundo. En solo el 2004, se realizaron más de 8.000 implantes en ese país (11).
Aneurismas de aorta torácica
Hasta el momento la Food and Drug Administration no ha aprobado la colocación de endoprótesis torácica. En la actualidad se llevan a cabo estudios con tres endoprótesis torácicas para aprobación por esta entidad; éstas son: TX2 (Cook Inc.), Tag (Gore) y Talent (Medtronic) (Figura 1).

El empleo de esta tecnología en la aorta torácica hasta ahora ha mostrado tener un impacto mayor que en los aneurismas de aorta abdominal (2, 11).
Aunque los aneurismas de la aorta torácica son menos comunes que los abdominales, recientemente ha habido un incremento en su incidencia debido a la mayor cantidad de personas de tercera edad, y al empleo de métodos de diagnóstico mejores y más sensibles (12).
Los aneurismas de aorta torácica tienen mayor incidencia de ruptura que los de aorta abdominal, con el 70% de los pacientes muertos luego de cinco años de su diagnóstico (13).
Hasta hace pocos años, la única opción disponible para este grupo de pacientes era la cirugía abierta. Aun con la mejoría de las técnicas quirúrgicas y anestésicas, la mortalidad operatoria va del 10% al 30%; la paraplejía va del 5% al 15%, la falla respiratoria del 25% al 45%, el infarto del miocardio del 7% al 20% y las complicaciones renales del 8% al 30% (11).
La cifra del tamaño como criterio para llevar a un paciente a cirugía, aún no está definida. Cambria y colaboradores, reportaron 57 pacientes con aneurismas torácicos, quienes recibieron manejo médico con diámetros menores de 5 cm y ninguno presentó ruptura (14). El promedio del tamaño de la ruptura fue de 5,8 cm.
La enfermedad pulmonar obstructiva crónica, la insuficiencia renal crónica y los pacientes sintomáticos (dolor en la espalda) fueron unos de los factores de riesgo que más se asociaron con la ruptura (14).
El consenso general es tratar los aneurismas de aorta torácica con diámetros por encima de los 6 cm, tomando también en consideración los factores de riesgo antes mencionados (2).
El estudio EVTAR reportado por Ehrlich y colaboradores (15), mostró una clara superioridad del grupo con endoprótesis, con un tercio de la mortalidad operatoria (10% vs.30%), la mitad del tiempo operatorio (150 vs. 320 min) y un tercio de la estadía hospitalaria (4 vs.13 días). La isquemia medular estuvo ausente en el grupo de endoprótesis, mientras que en el grupo quirúrgico fue del 12%; sin embargo, 12% de los pacientes con endoprótesis, requirieron reintervención por parafugas (15).
Un estudio publicado recientemente con 99 pacientes (16), muestra que con los dispositivos de una generación más reciente, se consiguen resultados mejores que los publicados por Ehrlich y su grupo de investigadores, los cuales se llevaron a cabo con dispositivos de primera generación (16).
La mortalidad a 30 días reportada en este estudio, fue la mitad que la publicada por Ehrlich, con 5%. De otra parte, la incidencia de paraplejía fue del 2% y la de parafugas del 14% (16).
Indicaciones para el tratamiento de aneurismas de aorta torácica
1. Sintomáticos (dolor torácico o de espalda).
2. Diámetro mayor o igual a 6 cm o más del doble del diámetro de la aorta sana adyacente.
Disección aórtica tipo B
En cuanto a las disecciones de aorta torácica tipo B, las indicaciones de implante de endoprótesis se dan en aquellos casos con alguna complicación o no mejoría con el tratamiento médico. Sin embargo, las anteriores indicaciones están por cambiar una vez salgan a la luz los resultados del estudio INSTEAD (Investigation of stent grafts in patients with type B aortic dissection), el cual incluirá pacientes con disecciones tipo B no complicadas en quienes se comparará el tratamiento con endoprótesis vs. pacientes con disección B con el tratamiento tradicional (tratamiento médico) (15, 11).
El meta-análisis recientemente publicado por Eggebrecht y colaboradores (17) en pacientes con disección tipo B, mostró un éxito técnico de más del 95%, con complicaciones del 14% al 18%, mortalidad a 30 días del 5,3%, accidente cerebrovascular perioperatorio del 1,9% y paraplejía del 0,9% (17).
Cuando se comparan las sobrevidas a 30 días de los tres tratamientos del registro IRAD (International Registry of Acute Aortic Dissection), se observa una ventaja del tratamiento endovascular sobre las otras alternativas (Figura 2).
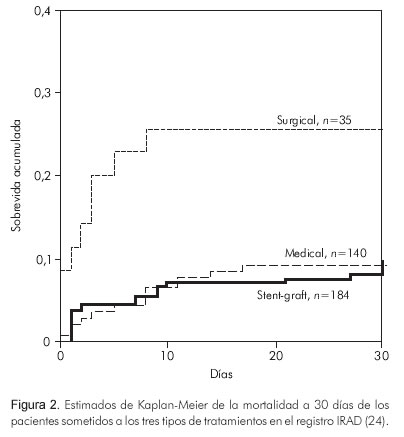
Las anteriores observaciones llevaron a diseñar el estudio INSTEAD, para buscar evidencia del beneficio del tratamiento endovascular con el uso de endoprótesis en pacientes con disecciones tipo B no complicadas (25). Este estudio se basó en el análisis histórico retrospectivo de 80 pacientes con características clínicas similares, el cual se comparó con el tratamiento médico tradicional (25) (Figuras 3 y 4).


En la actualidad este estudio se encuentra en fase de recolección (25)
El objetivo del tratamiento de las disecciones tipo B con endoprótesis, es conseguir excluir el sitio de entrada proximal, para lograr así la trombosis y remodelación del lumen falso. La extensión de la endoprótesis debe ser desde el origen proximal de la disección (subclavia) y distal hasta antes del origen del tronco celíaco. En casos donde la disección se extienda distal al tronco celíaco, no se aconseja la exclusión completa de la longitud del lumen falso más allá del tronco celíaco; únicamente con la exclusión proximal, se obtiene el objetivo del tratamiento, el cual es disminuir la presión en la luz falsa proximal para conseguir así la trombosis de la luz falsa e iniciar el proceso de remodelación de la aorta torácica.
Es común ver sitios de reentrada distal a la implantación de la endoprótesis a nivel de la aorta abdominal; sin embargo, aunque no existe evidencia disponible, el consenso general entre los expertos es que estos sitios de reentrada distal no deben tratarse debido a que esas reentradas no son factores de riesgo para la ruptura de la disección y en su intento de cerrarlas pueden hacerse difíciles y generar complicaciones asociadas como isquemia crítica visceral por exclusión de los vasos abdominales mayores (2, 11).
La fenestración con o sin stent de la luz falsa, se indica en casos de disecciones complicadas por isquemia crítica visceral o de las extremidades, ocasionados por la oclusión o compresión de los vasos abdominales y/o ilíacos (2, 11).
Indicaciones para el tratamiento de las disecciones aórticas tipo B
1. Dolor recurrente a pesar de un tratamiento médico óptimo.
2. Evidencia o sospecha de isquemia visceral (hepática, renal, mesentérica).
3. Evidencia de isquemia de miembros inferiores.
4. Hemotórax.
5. Formación de aneurisma mayor o igual a 6 cm.
Otras patologías de aorta que pueden tratarse con este método son la úlcera penetrante de cualquier tamaño y la hemorragia intramural.
Criterios técnicos de inclusión para la colocación de endoprótesis torácica
1. La distancia del cuello proximal debe ser de al menos 15 mm (la distancia del origen de la arteria subclavia o la carótida común izquierda al borde proximal de la endoprótesis).
2. La distancia del cuello distal debe ser de al menos 15 mm (la distancia del borde distal de la endoprótesis al origen del tronco celíaco).
3. El diámetro de los cuellos proximal y distal debe medir entre 18 mm y 42 mm.
4. El diámetro de la arteria ilíaca debe ser de al menos 7 mm. Esto tiene su excepción en cuanto se puede acceder a la arteria ilíaca común por disección retroperitoneal y colocar un conducto protésico suturado a la arteria para la introducción de la endoprótesis.
Estrategias de tratamiento en aneurismas torácicos complejos
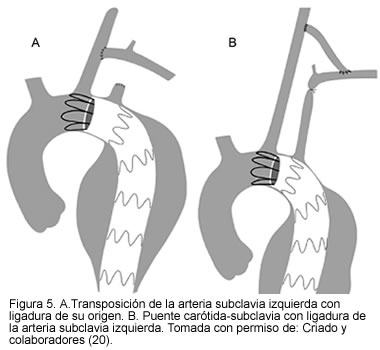
Para pacientes con cuellos proximales cortos, en los que el aneurisma esté muy cercano al origen de la arteria subclavia izquierda, la oclusión del origen de la subclavia izquierda no presenta inconvenientes, siempre y cuando se determine la permeabilidad de la arteria vertebral contralateral y la arteria mamaria interna no esté conectada al sistema coronario (cirugía de bypass previa). Algunos grupos incluso emplean esta técnica en forma rutinaria (en cuellos cortos realizan exclusión intencional de la arteria subclavia izquierda) y hacen un puente carótido-subclavio en casos de claudicación sintomática del miembro superior izquierdo o síndrome severo de subclavia ladrona. Los reportes de la literatura muestran que la exclusión intencional de la arteria subclavia es segura y bien tolerada por los pacientes; sin embargo, puede llegar a requerirse un nuevo procedimiento de bypass extra-anatómico o transposición a la carótida común del lado izquierdo en el 20% al 30% de los pacientes, debido a síndrome de robo subclavio o síntomas de claudicación en el miembro superior comprometido (18-21) (Figura 5).
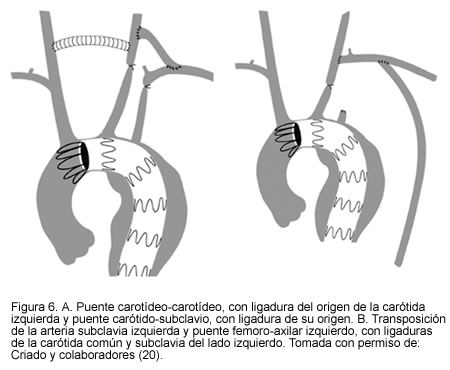
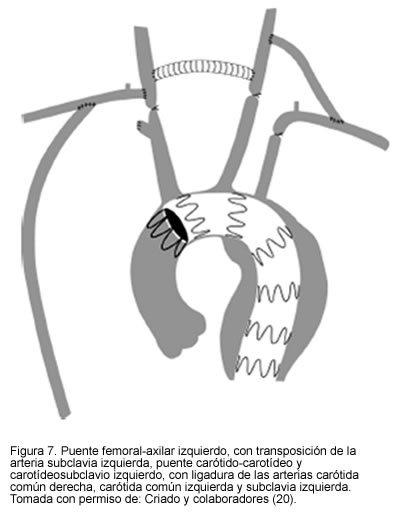
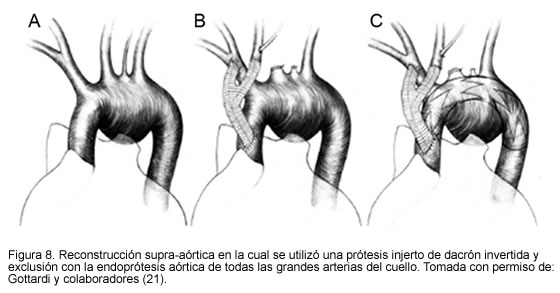
En casos aun más extremos en los que el aneurisma necesita excluir la carótida común del lado izquierdo, se puede recurrir a los puentes extra-anatómicos, a las transposiciones del origen o a la reimplantación proximal de los grandes vasos (18-21) (Figuras 6, 7 y 8.)
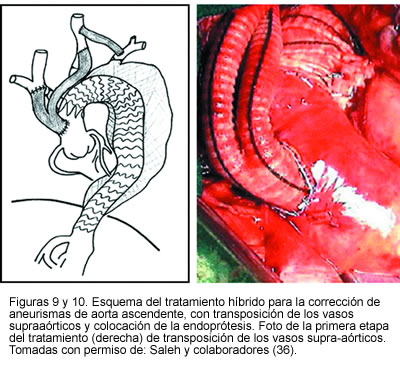
Un estudio reciente publicado por Saleh y colaboradores (36), con 15 pacientes a quienes se les realizó transposición de los vasos supra-aórticos, quienes además tenían serias comorbolidades y alto riesgo quirúrgico (puntaje ASA = 4), en donde la hipotermia y el paro cardio-circulatorio podrían complicar aún más el procedimiento, mostró un éxito del 100% y el seguimiento a los 18 meses evidenció permeabilidad de los puentes del 100%, sin ninguna complicación neurológica ni reporte de parafugas. A estos pacientes se les realizó la transposición supra-aórtica de manera secuencial, en un primer procedimiento, y luego se colocó la endoprótesis en un procedimiento aparte (36) (Figuras 9 y 10).
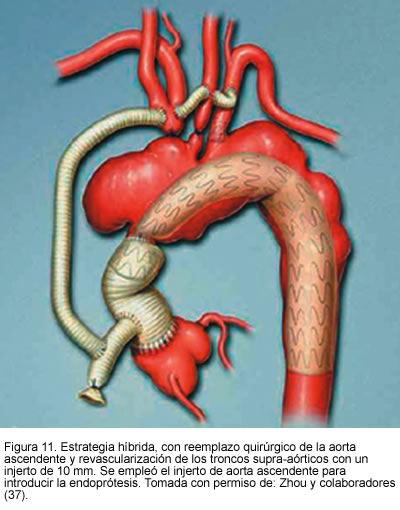
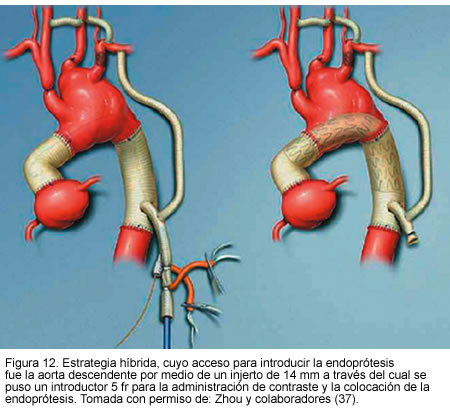
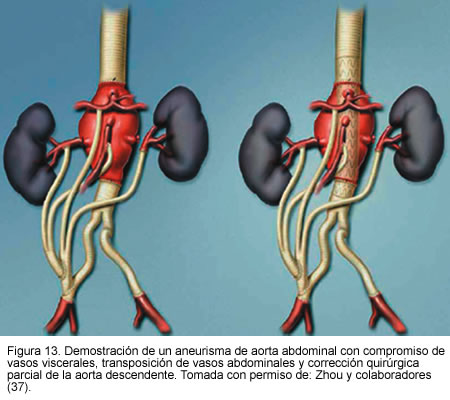
Otro estudio publicado por Zhou y colaboradores (37), de Baylor College of Medicine, presentado en el séptimo congreso asiático de cirugía vascular, mostró la experiencia con 31 pacientes de alto riesgo con aneurismas complejos, quienes fueron sometidos a tratamiento híbrido endovascular y quirúrgico, 16 con aneurisma de aorta ascendente y 15 con aneurismas que comprometían vasos viscerales abdominales. En tres pacientes se realizó reconstrucción del arco aórtico, en trece transposición de los vasos supra-aórticos y en quince puentes de vasos viscerales. El éxito técnico fue del 100%. Hubo una muerte perioperatoria por sangrado post-operatorio (3,2%); se encontraron endofugas tipo 2 inmediatas en dos pacientes (6,4%) las cuales se resolvieron completamente al mes de seguimiento. Además, en dos pacientes se presentó trombosis de puente renal. Durante el seguimiento de 16 meses ocurrieron dos muertes no relacionadas con el aneurisma y el resto de los pacientes no tuvo síntomas ni hubo aumento del tamaño del aneurisma.
Este estudio consolida la seguridad y efectividad del tratamiento híbrido, en pacientes con alto riesgo quirúrgico con aneurismas y anatomías complejas (Figuras 11, 12 y 13).
Complicaciones de las endoprótesis aórticas torácicas
Paraplejía
Al no existir pinzamiento de la aorta, además de evitarse las hipotensiones prolongadas, este tratamiento ha demostrado menos incidencia de paraplejía que la cirugía abierta. De hecho, los estudios han mostrado cifras que van de 0% a 5%, versus 5% a 25% de la cirugía abierta (11). Los estudios de paraplejía en pacientes con endoprótesis, muestran que la cirugía o reparo endovascular previo de aorta abdominal, es un factor importante para el desarrollo de paraplejía. Incluso hay autores y grupos que proponen preparar al paciente con cirugía previa de AAA, con catéter raquídeo para posible drenaje de líquido cefalorraquídeo durante y después del procedimiento para evitar la paraplejía (11, 2).
El hecho de existir menos paraplejía en este tipo de procedimientos percutáneos que en el grupo quirúrgico abierto, ha llevado a postular hipótesis del por qué de este fenómeno, y se han llegado a controvertir los conceptos clásicos de irrigación de la médula y de si en realidad existe o no una única arteria nutricia que la irriga (a nivel de T 11), conocida como la arteria de Adamkiewicz, o de si en realidad la irrigación de la médula es más compleja y densa de lo que se piensa, con múltiples anastomosis en todo su recorrido proveniente de diferentes fuentes como de las arterias intercostales y otras colaterales (23).
En un articulo publicado por Carroccio y colaboradores (23), se postula que debido a que no hay clampeo o interrupción del flujo sanguíneo de la aorta y que no hay hipotensión, se mantiene de este modo la presión de perfusión durante todo el procedimiento. Así mismo, debido a que se mantiene la circulación distal en la aorta durante todo el procedimiento endovascular, ésta puede ser una fuente de circulación colateral importante para la irrigación medular. También se cree que un factor importante en el desarrollo de paraplejía es el daño por la reperfusión debido al clampeo prolongado de la aorta y la isquemia visceral, la cual genera radicales libres de oxígeno y citoquinas que lesionarían la médula una vez se reinicia la circulación medular (23).
El tratamiento de la paraplejía consiste en el drenaje abierto del líquido cefalorraquídeo por medio de un catéter raquídeo, por un espacio de 48 horas, y en la colocación de altas dosis de esteroides en forma de bolo, como usualmente se hace en los protocolos de trauma raquídeo medular (23).
Parafugas
Es la complicación más común; no obstante es menos frecuente que en la endoprótesis de aorta abdominal (11).
El tipo de parafugas también es diferente cuando la endoprótesis implantada es torácica. Las parafugas más comunes ocurren en el sitio de implantación proximal y distal de la endoprótesis (parafugas tipo 1), mientras que en las endoprótesis de aneurisma de aorta abdominal prevalecen las parafugas tipo 2 (11).
Otras aplicaciones
Rupturas agudas
Uno de los campos en los que tiene mayor impacto el tratamiento endovascular, es en las rupturas agudas debido a que la cirugía abierta tiene elevada morbilidad y mortalidad (de más del 45% en las diferentes series reportadas) (Figura 14 A y B) (26).

Debido a lo escaso de su prevalencia, el diseño y la realización de estudios aleatorizados controlados es complejo, por lo que únicamente se dispone de registros locales multicéntricos, en los que cuando se comparan con los registros históricos de cirugía abierta, se les da una ventaja muy superior para el tratamiento endovascular (26).
Una de las razones del por qué no se ha implementado más esta tecnología en este grupo de pacientes, es porque a menudo éstos llegan hipotensos con ruptura libre y son llevados rápidamente al quirófano para controlar su sangrado por temor a que por vía endovascular no se obtiene control de la hemorragia. Sin embargo, con las nuevas tecnologías disponibles, entre las cuales están el balón de oclusión temporal que ocluye la aorta de manera proximal, se obtiene un efecto muy similar al del clampeo de la aorta.
Esta tecnología viene demostrando su eficacia desde las series iniciales en 1995 que incluyeron pacientes con rupturas agudas de aneurismas de aorta abdominal, los cuales eran rechazados por los cirujanos tratantes debido a abdómenes hostiles o comorbilidades asociadas, como fracción de eyección menor del 20%, y se escogía la vía endovascular como única opción disponible. En esta serie inicial con 12 pacientes se encontró una mortalidad del 17%.
En el estudio publicado por Doss y colaboradores, con 26 pacientes, se encontró una mortalidad del 17,8% en el grupo de cirugía abierta vs. 3,8% en el grupo endovascular. Así mismo, el porcentaje de paraplejía fue del 3,6% en el grupo quirúrgico y ninguno en el grupo endovascular. La falla renal también fue mayor en el grupo quirúrgico (27).
El estudio de Ott y colaboradores, publicado en el 2004, con 6 pacientes, también mostró una superioridad del grupo con endoprótesis vs. el grupo quirúrgico con 16% de mortalidad en el grupo quirúrgico contra ninguna muerte del grupo endovascular. También se encontró daño del nervio laríngeo en 8% del grupo quirúrgico (28).
En el registro multicéntrico global dirigido por el grupo de investigadores Internacionales para el estudio de Endoprótesis en las Rupturas de Aneurismas de Aorta, en cabeza del Dr. Frank Veith, y presentado en el Congreso Multidisciplinario de Terapia Endovascular (MEET) de 2005, se reportaron 538 pacientes con aneurismas rotos abdominales en forma aguda, y la mortalidad fue del 20% a 30 días. El 15% de los pacientes presentó shock y ruptura libre, y el restante ruptura contenida (26).
Trauma de aorta
El uso de endoprótesis en ruptura o sección traumática de la aorta, es un campo en ardua investigación. Hasta ahora, los estudios muestran un panorama promisorio para este tipo de tecnología, con un perfil de seguridad y efectividad muy favorables (38-49). El tratamiento tradicional de este tipo de trauma con cirugía, se asocia con morbilidad y mortalidad significativas. En una revisión de la literatura con 618 pacientes realizada por Jahromi y colaboradores (54), se encontró una mortalidad del 8% al 17% y paraplejías del 0% al 7% cuando se intervienen con cirugía abierta.
Los resultados de los estudios iniciales que compararon endoprótesis con cirugía abierta en trauma, mostraron mortalidades similares, con menor tasa de paraplejía en el grupo endovascular y menos tiempo de estancia hospitalaria (44, 45). En la experiencia de Munich (45) que recolectó 46 pacientes, se comparó de manera retrospectiva cirugía vs. endoprótesis. La mortalidad de los dos grupos no presentó diferencia estadística significativa (13,3% endoprótesis vs. 18,8% cirugía abierta), pero sí hubo un número menor de paraplejías y complicaciones neurológicas en el grupo tratado con endoprótesis (0% vs. 22,7%). Otro estudio con 20 pacientes, llevado a cabo por el grupo francés de Amabile y colaboradores (44), mostró mayor número de complicaciones (27%) y mayor mortalidad en el grupo quirúrgico (0% vs. 9,1%).
A pesar de los excelentes resultados de estos estudios, aún hay precaución con el uso de esta tecnología debido a que todavía no hay resultados a largo plazo, particularmente en este subgrupo de pacientes en su mayoría jóvenes con una expectativa de vida de 30 a 40 años. Sin embargo, debido a la ventaja del tratamiento endovascular en cuanto a la paraplejía cuando se compara con el tratamiento estándar de cirugía abierta, algunos grupos han adoptado el empleo rutinario del tratamiento endovascular con endoprótesis en este tipo de pacientes (46). Cuando se intervienen estos pacientes es importante hacer énfasis en el seguimiento y la adherencia a largo plazo, para detectar las posibles parafugas y complicaciones que se asocian a estos dispositivos.
La decisión de cuando intervenir este tipo de pacientes no es sencilla debido a que a menudo presentan traumas adicionales que incluso son más graves que el mismo trauma aórtico (49). La historia natural de los pacientes con trauma de aorta, muestra que el 80% al 90% se desangran en la escena del accidente, sólo el 10% al 20% alcanzan a llegar vivos al hospital, y de éstos el 15% al 38% muere posteriormente debido a politraumatismo asociado con otros órganos (47, 50, 51). Esto sugiere que los pacientes que no mueren en las primeras 24 horas, permanecen estables desde el punto de vista hemodinámico sólo con medidas de disminución agresiva de la presión arterial y del pulso con betabloqueadores (48).
Por este motivo, algunos han propuesto el retardo del tratamiento hasta que el paciente esté completamente estable, y en pacientes con politraumatismos serios en otros órganos, en donde la cirugía de corrección de aorta pondría en riesgo su vida (48-50). Diferentes grupos validan esta propuesta de manejo, incluso Maggisano y colaboradores (49), reportaron el tratamiento tardío en el 53% de los pacientes con trauma de aorta con rangos que van de un día hasta siete meses, con manejo agresivo de la presión arterial, sin hallar diferencias en la mortalidad al emplear este tipo de estrategia. Mattox y colaboradores (51), realizaron un recuento de la literatura disponible con más de 500 pacientes con la estrategia de manejo tardío, y hallaron que sólo el 2% presentaron rupturas y todos tenían niveles elevados de presión arterial.
Para el caso de la corrección con endoprótesis, el estudio de Reed (48) con 13 pacientes estables manejados de forma tardía con disminución agresiva de la presión arterial, mostró 0% de mortalidad, con una media de 6 días (1 día a 7 meses) del momento en el que se realizó el reparo aórtico endovascular.
El autor concluye que si el paciente está hemodinámicamente estable, permanece vivo más de cuatro horas en el hospital, no hay extravasación de contraste en la tomografía axial computarizada de admisión y no presenta otros politraumatismos serios que obliguen a abrir el tórax, el tratamiento retardado con endoprótesis con manejo agresivo de la presión arterial y el pulso, es seguro y efectivo (48).
El impacto que tiene este tipo de tecnología en el manejo de la ruptura traumática de la aorta torácica, se ve reflejado en los porcentajes de tratamientos endovasculares en uno de los principales centros de Norte América (Stanford University Medical Center), en donde progresivamente se está reemplazando el tratamiento quirúrgico por el endovascular. En este centro las cifras iniciales (antes de 2002) del tratamiento endovascular, eran del 8% y ahora (después del 2002) han alcanzado el 46% (29).
Úlcera penetrante y hematoma intramural
El hematoma aórtico intramural, se considera como un precursor de la disección aórtica y a menudo es letal cuando se encuentra localizada en la aorta ascendente. De hecho, para algunos autores se considera una disección aórtica sin flap de entrada y su manejo es muy similar a éste (31). Su prevalencia se encuentra en el 5,7% de todos los síndromes aórticos agudos (35).
Los hematomas intramurales progresan a disección aórtica en 28% a 47% de los pacientes y ésta se asocia a ruptura aórtica en el 21% al 47% (30). La regresión se observa aproximadamente en el 10% de los pacientes. El compromiso de la aorta ascendente se considera como una indicación urgente para cirugía, debido al riesgo inherente de taponamiento, ruptura o compresión de los ostium coronarios (30, 35).
Usualmente, los hematomas en la aorta distal (descendente), se manejan médicamente y sólo se intervienen si hay extensión, expansión o ruptura subaguda (31). Cada vez más se emplea la terapia endovascular en este tipo de pacientes.
La úlcera penetrante aórtica se define como aquella que rompe la lámina elástica interna y penetra la capa media (31). La localización más frecuente de la úlcera es en la aorta torácica descendente, seguido de la aorta abdominal. En general, se asocian a otras lesiones de aterosclerosis aórtica.
La úlcera puede progresar a hematoma intramural o a disección aórtica conformando así un espectro de enfermedades que se entrecruzan (30).
El hematoma intramural asociado a la úlcera penetrante, suele ser pequeño, limitado por la calcificación de la aorta que presenta este grupo de pacientes. Una evolución más frecuente es la dilatación aórtica progresiva con aneurisma. Es poco frecuente que la úlcera penetrante aórtica termine como una perforación aórtica transmural, y cuando se presenta, la mayoría se contiene. Otra manifestación frecuente es el embolismo distal a miembros inferiores o vísceras asociadas (31).
Aunque no hay un consenso claro para el manejo de los pacientes con úlcera penetrante aórtica, la mayoría de los grupos aconsejan tratamiento endovascular o quirúrgico en pacientes sintomáticos o con complicaciones asociadas (34).
Una cohorte con 26 pacientes, la mitad de los cuales era inoperable, sintomáticos, con úlcera penetrante de la aorta descendente, se trató mediante endoprótesis. El éxito del procedimiento se logró en el 92%, con una mortalidad perioperatoria del 12%, sin ningún caso de paraplejía, y dos pacientes con evidencia de parafugas tipo 1. Los estimativos de la sobrevida fueron del 81% a un año y del 65% a cinco años (35).
En un estudio reciente llevado a cabo por Eggebrecht y colaboradores (33), en el que se incluyeron 22 pacientes, se observó exclusión completa de la úlcera en el 96%, complicaciones neurológicas en un 5%, ninguna muerte a los 30 días y una parafuga tipo 1. El autor concluye que el tratamiento de las úlceras penetrantes con endoprótesis es seguro y efectivo; así mismo, la baja mortalidad a corto y mediano plazo la hacen una terapia promisoria cuando se compara con el curso natural de esta enfermedad (33).
Futuro
El futuro de este tipo de tecnología es prometedor y los resultados de los estudios hasta ahora disponibles, demuestran que ésta llegó para quedarse.
El diseño de endoprótesis con fenestraciones y divisiones para cada arteria comprometida (renales, mesentéricas o celíacas), está en desarrollo y algunas casas como Cook ya han lanzado los modelos comerciales con fenestraciones para cada rama arterial mayor. Estos diseños han expandido aun más la aplicabilidad de esta tecnología en anatomías difíciles (Figura 15).

Hoy se están desarrollando censores y mecanismos de monitoría remota de presión del saco aneurismático incluidos en la endoprótesis para poder vigilar, así, la aparición y progresión de parafugas, con lo cual se evitaría el control rutinario con la tomografía axial computarizada.
Conclusión
El tratamiento endovascular de las patologías de aorta es ahora una realidad y una alternativa segura a la cirugía abierta; sin embargo, los altos costos de estos dispositivos y el seguimiento de estos pacientes, aún constituyen una importante limitación en Colombia.
Bibliografía
1. Dubost D, Allary M, Oecomos NA. Preoperous du treatment des aneurismes de l' aorta. Arch Surg 1952; 64: 405-408. [ Links ]
2. Ohki T, Malas M. Endovascular treatment of abdominal and thoracic aortic aneurysm. Chap 11. In: Manual of Peripheral Vascular Intervention. Lippincott Williams and Wilkins; 2005. P. 183 - 213.
3. Noel AA, Gloviczki P, Cherry KJ Jr, Bower TC, Panneton JM, Mozes GI, et al. Ruptured abdominal aortic aneurysms: the excessive mortality rate of conventional repair. J Vasc Surg 2001; 34: 41-46. [ Links ]
4. Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991; 5: 491-499. [ Links ]
5. Criado FJ, Fairman RM, Becker GJ. Talent LPS AAA stent graft: results of a pivotal clinical trial. J Vasc Surg 2003; 37: 709-715. [ Links ]
6. Matsumura JS, Brewster DC, Makaroun MS, Naftel DC. A multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg 2003; 37: 262-271. [ Links ]
7. Ouriel K, Clair DG, Greenberg RK, Lyden SP, O’Hara PJ, Sarac TP, et al. Endovascular repair of abdominal aortic aneurysms: device-specific outcome. J Vasc Surg 2003; 37: 991-998. [ Links ]
8. Moore WS. The Guidant Ancure bifurcation endograft: five-year follow-up. Semin Vasc Surg 2003; 16: 139-143. [ Links ]
9. Zarins CK, White RA, Moll FL, Crabtree T, Bloch DA, Hodgson KJ, et al. The AneuRx stent graft: four-year results and worldwide experience 2000. J Vasc Surg 2001; 33: S135-S145. [ Links ]
10. Greenberg RK, Chuter TA, Sternbergh WC III, Fearnot NE. Zenith AAA endovascular graft: intermediate-term results of the US multicenter trial. J Vasc Surg 2004; 39: 1209-1218. [ Links ]
11. Katzen BT, Dake MD, MacLean AA, Wang DS. Endovascular repair of abdominal and thoracic aortic aneurysms. Circulation 2005; 112: 1663-1675. [ Links ]
12. Clouse WD, Hallett JW Jr, Schaff HV, Gayari MM, Ilstrup DM, Melton LJ. III. Improved prognosis of thoracic aortic aneurysms: a population-based study. JAMA 1998; 280: 1926-1929. [ Links ]
13. Bickerstaff LK, Pairolero PC, Hollier LH, Melton LJ, Van Peenen HJ, Cherry KJ, et al. Thoracic aortic aneurysms: a population-based study. Surgery 1982; 92: 1103-1108. [ Links ]
14. Cambria RP, Clouse WD, Davidson JK. Toracoabdominal aneurism repair: results with 337 operations performed over 15 year interval. Ann Surg 2002: 236; 471-479. [ Links ]
15. Ehrlich M, Grabenwoeger M, Cartes-Zumelzu F, Grimm M, Petzl D, Lammer J, et al. Endovascular stent graft repair for aneurysms on the descending thoracic aorta. Ann Thorac Surg 1998; 66: 19-24. [ Links ]
16. Appoo JJ, Moser WG, Fairman RM, et al. Endovascular stent graft repair for aneurysms on the descending thoracic aorta. J Thorac Cardiovasc Surg 2006; 131 (5): 1087-94. [ Links ]
17. Eggebrecht H, Nienaber CA, Neuhauser M. Endovascular stent-graft placement in aortic dissection – a meta-analysis. Eur Heart J 2005; 27: 489-498. [ Links ]
18. Gorich J, Asquan Y, Seifarth H, Kramer S. Initial experience with intentional stent-graft coverage of the subclavian artery during endovascular thoracic aortic repairs. J Endovasc Ther 2002 (suppl II); 9: 39-43. [ Links ]
19. Tissenhausen K, Hausegger K, Obelwalder P, Mahla E. Left subclavian artery management in endovascular repair of thoracic aortic aneurysms and aortic disecctions. J Card Surg 2003; 18: 429-435. [ Links ]
20. Criado FJ, Barnatan MF, Rizk Y, Clark N, Wang CF. Technical strategies to expand stent-graft applicability in the aortic arch and proximal descending thoracic aorta. J Endovasc Ther 2002 (suppl II); 9: 32-38. [ Links ]
21. Gottardi R, Seitelberger R, Zimpfer D, Lammer J. Alternative approach in treating an aortic arch aneurysm with an anatomic variant by supraaortic reconstruction and stent-graft placement. J Vasc Surg 2005; 42: 357-60. [ Links ]
22. Baril T, Silverberg D, Sharif H, et al. An eight-year experience with type ii endoleaks: natural history suggests selective intervention is a safe approach. Peter D. Samuels essay award winner. Presented at the 34th. SCVS annual symposium; March 2006. [ Links ]
23. Carroccio A, Marin ML, Ellozy S, Hollier LH. Pathophysiology of paraplegia following endovascular thoracic aortic aneurysm repair. J Cardiac Surg 2003; 18 (4): 359-366. [ Links ]
24. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA 2000; 283: 897-903. [ Links ]
25. Nienaber CA, Zannetti S, Barbieri B et al. INvestigation of STEnt grafts in patients with type B Aortic Dissection: Design of the INSTEAD trial: a prospective, multicenter, European randomized trial. Am Heart J 2005; 149: 592-9. [ Links ]
26. Veith FJ, Lipsitz E, Lachat M, Pamler R, et al. The EVAR for ruptured aneurysm investigators, presented at Cannes MEET; June 2005. [ Links ]
27. Doss M, Balzer J, Martens S, et al. Surgical versus endovascular treatment of acute thoracic aortic rupture: a single-center experience. Ann Thorac Surg 2003; 76: 1465-1470. [ Links ]
28. Ott MC, Stewart TC, Lawlor DK, Gray DK, Forbes TL. Management of blunt thoracic aortic injuries: endovascular stents versus open repair. J Trauma 2004; 56 (3): 565-70. [ Links ]
29. Lebl DR, Dicker RA, Spain DA, Brundage SI. Dramatic shift in the primary management of traumatic thoracic aortic rupture. Arch Surg 2006; 141 (2): 177-80. [ Links ]
30. Evangelista A, Mukherjee D, Mehta RH et al. Acute intramural hematoma of the aorta: a mystery in evolution. Circulation 2005; 111 (8): 1063-70. [ Links ]
31. Vilacosta I. Síndrome aórtico agudo. Rev Esp Cardiol 2003; 56 (Supl 1): 29-39. [ Links ]
32. Mukherjee D, Eagle KA. Aortic dissection-an update. Curr Probl Cardiol 2005; 30 (6): 287-325. [ Links ]
33. Eggebrecht H, Herold U, Schmermund A et al. Endovascular stent-graft treatment of penetrating aortic ulcer: results over a median follow-up of 27 months. Am Heart J 2006; 151 (2): 530-6. [ Links ]
34. Eggebrecht H, Baumgart D, Schmermund A, Penetrating atherosclerotic ulcer of the aorta: treatment by endovascular stent-graft placement. Curr Opin Cardiol 2003; 18 (6): 431-5. [ Links ]
35. Demers P, Miller DC, Mitchell RS et al. Stent-graft repair of penetrating atherosclerotic ulcers in the descending thoracic aorta: midterm results. Ann Thorac Surg 2004; 77: 81-86. [ Links ]
36. Saleh HM, Inglese L. Combined surgical and endovascular treatment of aortic arch aneurysms. J Vasc Surg 2006; 44: 460-6. [ Links ]
37. Zhou W, Reardon M, Peden EK. Hybrid approach to complex thoracic aortic aneurysms in high-risk patients: surgical challenges and clinical outcomes. J Vasc Surg 2006; Pub ahead of print. [ Links ]
38. Hoornweg LL, Dinkelman MK, Goslings JC. Endovascular management of traumatic ruptures of the thoracic aorta: a retrospective multicenter analysis of 28 cases in The Netherlands. J Vasc Surg 2006; 43 (6): 1096-102. [ Links ]
39. Tehrani HY, Peterson BG, Katariya K. Endovascular repair of thoracic aortic tears. Ann Thorac Surg 2006; 82 (3): 873-7. [ Links ]
40. Peterson BG, Matsumura JS, Morasch MD. Percutaneous endovascular repair of blunt thoracic aortic transection. J Trauma 2005; 59 (5): 1062-5. [ Links ]
41. Wellons ED, Milner R, Solis M. Stent-graft repair of traumatic thoracic aortic disruptions. J Vasc Surg 2004; 40 (6): 1095-100. [ Links ]
42. Iyer VS, Mackenzie KS, Tse LW. Early outcomes after elective and emergent endovascular repair of the thoracic aorta. J Vasc Surg 2006; 43 (4): 677-83. [ Links ]
43. Jahromi AS, Kazemi K, Safar HA, et al. Traumatic rupture of the thoracic aorta: cohort study and systematic review. J Vasc Surg 2001; 34: 1029-34. [ Links ]
44. Amabile P, Collart F, Gariboldi V. Surgical versus endovascular treatment of traumatic thoracic aortic rupture. J Vasc Surg 2004; 40 (5): 873-9. [ Links ]
45. Andrassy J, Weidenhagen R, Meimarakis G. Stent versus open surgery for acute and chronic traumatic injury of the thoracic aorta: a single-center experience. J Trauma 2006; 60 (4): 765-71. [ Links ]
46. Verdant A. Endovascular management of traumatic aortic injuries. Can J Surg 2006; 49 (3): 217. [ Links ]
47. Camp PC, Shackford SR. Outcome after blunt traumatic thoracic aortic laceration: identification of a high-risk cohort. Western Trauma Association Multicenter Study Group. J Trauma 1997; 43: 413-22. [ Links ]
48. Reed AB, Thompson JK, Crafton CJ. Timing of endovascular repair of blunt traumatic thoracic aortic transections. J Vasc Surg 2006; 43 (4): 684-8. [ Links ]
49. Maggisano R, Nathens A, Alexandrova NA, Cina C, Boulanger B, McKenzie R, et al. Traumatic rupture of the thoracic aorta: should one always operate immediately? Ann Vasc Surg 1995; 9: 44-52. [ Links ]
50. Holmes JH IV, Bloch RD, Hall RA, Carter YM, Karmy-Jones RC. Natural history of traumatic rupture of the thoracic aorta managed nonoperatively: a longitudinal analysis. Ann Thorac Surg 2002; 73: 1149-54. [ Links ]
51. Mattox KL, Wall MJ Jr. Historical review of blunt injury to the thoracic aorta. Chest Surg Clin North Am 2000; 10: 167-82. [ Links ]














