Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.15 no.2 Bogota Mar./Apr. 2008
(1) Medicina Interna, Universidad de Antioquia. Medellín, Colombia.
(2) Fundación Ciencia Vital, CEMDE S.A. Medellín, Colombia.
(3) Clínica de las Américas. Medellín, Colombia.
Correspondencia: Dr. Nicolás Jaramillo Gómez. Fundación Ciencia Vital, Centro de Medicina del Ejercicio y Rehabilitación Cardíaca (CEMDE). Calle 33 A No. 70 A-17. Teléfono: 4112780. Medellín-Colombia. Correo electrónico: cienciavital@yahoo.com
Recibido: 12/07/2008. Aceptado: 08/04/2008.
Las estatinas son medicamentos hipolipemiantes que han demostrado ser indispensables y seguros en el manejo de la dislipidemia y como prevención secundaria en pacientes de alto riesgo cardiovascular. Sin embargo, en ocasiones su uso se ve limitado por el desarrollo de intolerancia y toxicidad en algunos pacientes bien sea por respuesta individual, por interacciones farmacológicas o por comorbilidades, o por falla en alcanzar las metas de colesterol no-HDL en personas con dislipidemia mixta, lo que obliga al clínico a recurrir a estrategias para minimizar sus riesgos y obtener beneficios similares. Esta revisión pretende brindar herramientas para la toma de decisiones durante el tratamiento de estos pacientes de difícil manejo.
Palabras clave: estatinas, alto riesgo cardiovascular, intolerancia, toxicidad, opciones de tratamiento.
Statins are hypolipemic medicaments that have shown to be essential and safe in the management of dyslipidemia and as secondary prevention in patients at high cardiovascular risk. Nevertheless, in some occasions its use is limited by the development of intolerance and toxicity in some patients because of individual response, pharmacological interactions or comorbidities, or failure in reaching non-HDL cholesterol goals in patients with mixed dyslipidemia that obliges the clinician to turn to strategies oriented to diminish risks and get similar benefits. The aim of this review is to provide tools in the decision-making during the treatment of these difficult to manage patients.
Key words: statins, high cardiovascular risk, intolerance, toxicity, treatment options.
Introducción
Las estatinas son el grupo de medicamentos hipolipemiantes cuyo uso ha sido demostrado en múltiples estudios clínicos, como indispensable en pacientes con enfermedad coronaria, arterial periférica, carotídea y cerebrovascular, así como en diabetes y entidades de alto riesgo para enfermedades cardiovasculares (fumadores, síndrome metabólico, HDL bajo, historia familiar de enfermedad coronaria precoz), entidades que ameritan establecer niveles tan bajos de LDL de 70 mg/dL como meta que permite la estabilización e incluso posible regresión de la lesión aterosclerótica (1, 2).
Estudios como el Heart Protection, en el que la terapia con estatinas redujo de manera significativa la tasa de mortalidad coronaria (18%), primer infarto no fatal (38%) e incidencia de enfermedad cerebrovascular (25%) y revascularización coronaria (30%) ratifican la necesidad del control estricto del perfil lipídico para reducir el riesgo global de enfermedad cardiovascular y de mortalidad por esta causa. El estudio Pravastatin or Atorvastatin Evaluation and Infection Therapy trial (PROVE IT), demostró que los pacientes con enfermedad coronaria se benefician con el uso de estatinas en dosis suficientes para lograr metas estrictas y mejorar la sobrevida (3, 4).
Efectos benéficos
Las estatinas bloquean la hidroximetilglutaril coenzima A (HMG-CoA) reductasa, al inhibir la conversión de HMG-CoA en ácido mevalónico, el cual es un importante paso temprano en la síntesis de colesterol (Figura 1) (5).
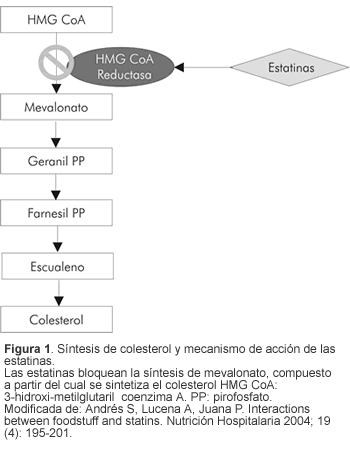
Las estatinas disminuyen el colesterol de baja densidad (LDL) en 30% a 40%, aumentan el colesterol de alta densidad (HDL) en 5% a 15% y reducen los triglicéridos (TG) en 10% a 30%. Además de sus efectos sobre el perfil lipídico, se les atribuye un efecto pleiotrópico que incluye reversión de la disfunción endotelial, disminución de la respuesta inflamatoria, estabilización e incluso regresión de la placa aterosclerótica, aumento en la disponibilidad del óxido nítrico por parte de la célula endotelial, inhibición de la respuesta inflamatoria y disminución de la trombogenicidad. Los últimos trabajos ya demuestran la utilidad clínica en el manejo de pacientes con insuficiencia cardiaca congestiva (6, 7).
Los efectos pleiotrópicos de las estatinas son independientes y no se correlacionan con la reducción de los niveles plasmáticos de LDL; se establecen en forma rápida y son reversibles al suspender el medicamento (8, 9). Son seguros y tienen poca interacción farmacológica; no obstante, sus efectos adversos en el músculo, son el aspecto limitante para su uso ya que se puede llegar a manifestaciones extremas de rabdomiólisis e inducción de falla renal y posible muerte (10).
Eventos adversos
Cuando se habla de «dosis estándar» de estatinas, se hace referencia a las dosis prescritas que reducen el LDL en 30% a 45% y que corresponden a una dosis determinada para cada estatina (atorvastatina 10-20 mg, fluvastatina 40-80 mg, lovastatina 40 mg, pravastatina 40 mg, rosuvastatina 10 mg y simvastatina 20-40 mg) (11). En pacientes con síndrome coronario agudo, el estudio PROVE IT (atorvastatina 80 mg vs. pravastatina 40 mg) y la fase Z del estudio A TO Z (simvastatina 80 mg vs. simvastatina 20 mg), probó la seguridad del uso de altas dosis de estatinas en comparación con dosis estándar, al encontrar elevación de las enzimas hepáticas (tres veces sobre el límite superior normal) en 3,3% y 0,9% de los pacientes tratados con altas dosis versus 1,1% y 0,4% de los tratados con dosis estándar, respectivamente. Además, se hallaron aumentos en la CK (10 veces sobre el límite superior normal o miopatía) en 0,1% y 0,4% vs. 0,15% y 0,04%. Solamente en el estudio que usó simvastatina a 80 mg, se reportaron tres casos de rabdomiólisis (0,1%). Los estudios Treating to New Targets (TNT: atorvastatina 80 mg vs. atorvastatina 10 mg) y el Incremental Decrease in clinical Endpoints through Agressive Lipid lowering (IDEAL: atorvastatina 80 mg vs. simvastatina 20-40 mg) en pacientes con enfermedad coronaria estable, encontraron resultados similares: aumento de enzimas hepáticas en 1,2% y 0,97% con altas dosis vs. 0,2% y 0,11% con dosis estándar respectivamente. Sólo en el IDEAL, se reportó mayor porcentaje de miopatía en el grupo de dosis bajas de simvastatina y no hubo diferencia en la proporción de casos de rabdomiólisis, que fue menor a 0,07% en todos los grupos. El estudio Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL: atorvastatina 80 mg vs. placebo) que se realizó en pacientes con enfermedad cerebrovascular o isquemia cerebral transitoria, encontró elevación de enzimas hepáticas en 2,2% de los pacientes tratados con atorvastatina vs. 0,5% de los pacientes que recibieron placebo. Se observó igual incidencia de miopatía (0,3%) y de rabdomiólisis (0,1%). En el estudio ASTEROID en el que se probó una dosis de rosuvastatina por encima de las estándar (40 mg), en pacientes con enfermedad coronaria no estenótica evaluada por ultrasonido intravascular, se encontró 6,8% de reducción del volumen de la placa ateromatosa con buen nivel de seguridad y bajos efectos adversos. El estudio Reversal of Atherosclerosis with Aggressive Lipid Lowering (REVERSAL), se realizó en pacientes con enfermedad coronaria sintomática, estenosis coronaria mayor al 20% y LDL entre 125 y 210 mg/dL, que recibieron pravastatina 40 mg/dL vs. atorvastatina 80 mg/dL durante 18 meses y que fueron evaluados por ultrasonido intravascular. Se encontró reducción de 46% del LDL para el grupo de atorvastatina vs. 25% para el grupo de pravastatina, además de reducción en los triglicéridos (20% vs. 7% respectivamente) e incremento en el HDL (2,9% y 5,6%). Así mismo, se demostró reducción del 0,4% en el volumen del ateroma para el grupo de atorvastatina vs. aumento en 2,7% para el grupo de simvastatina, sin incremento de los eventos adversos cardiovasculares y no cardiovasculares (6, 11-14).
La evidencia actual no sugiere que la terapia prolongada con estatinas lleve a daño muscular permanente o a miopatía progresiva en pacientes con enzimas musculares normales. En general, los ensayos clínicos demuestran la seguridad de las estatinas, y sus efectos adversos sintomáticos parecen estar limitados a una proporción relativamente pequeña de pacientes. Las alteraciones musculares (clínicas y de laboratorio) son reversibles luego de tres a cuatro semanas de su suspensión (15, 16).
Mecanismo de toxicidad muscular de las estatinas
El mecanismo por el cual las estatinas causan daño muscular aún está por definirse. Se intentó demostrar por medio de la vía de reducción de la coenzima Q10, pero se han dado otras explicaciones en los flujos de iones o en alteraciones de la estabilidad de membrana.
Ubiquinona o coenzima Q10 (CoQ10)
El paso de la HMG-CoA reductasa en la biosíntesis del colesterol, es una reacción preliminar en la síntesis de otras moléculas importantes como las hormonas esteroideas y es el principal paso regulador en la síntesis de ubiquinona o CoQ10 que actúa como antioxidante y que, posiblemente, es un componente en la señalización intracelular y de la cadena respiratoria mitocondrial. Así, desempeña un papel valioso en la producción de energía por parte de la célula muscular, como cofactor esencial para el acople de las proteínas mitocondriales. Se usa para termogénesis y en la producción de ATP, y tiene un rol esencial en el mantenimiento de las vitaminas A y C (Figura 2) (17-20).
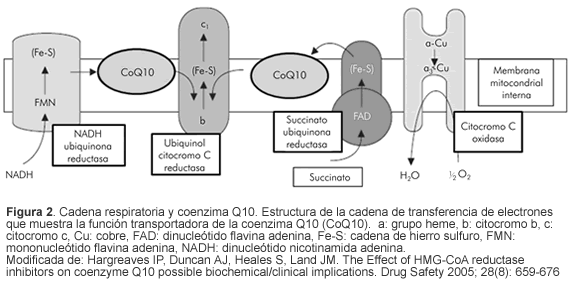
Luego de los 20 años de edad hay una disminución progresiva de los niveles de CoQ10 en el corazón y el cerebro. La deficiencia de CoQ10 se describe en algunos pacientes con aterosclerosis y enfermedades cardiovasculares y se relaciona con enfermedades neurodegenerativas. Los continuos y variables requerimientos energéticos del miocardio, lo hacen vulnerable a daños en el metabolismo mitocondrial; la reducción tisular de CoQ10 altera de forma significativa los sistemas antioxidantes necesarios para proteger los tejidos de los radicales libres que producen ese daño. Existe una hipótesis que plantea que en individuos susceptibles, las estatinas pueden interferir con vías metabólicas claves y dejar a las células con una deficiencia relativa de CoQ10, y que la reducción en la CoQ10 puede contribuir al daño muscular inducido por estatinas por medio de falla en el metabolismo energético y disminución de la capacidad antioxidante de la célula.
Otros mecanismos de miotoxicidad
Otros mecanismos que pueden estar implicados en la miotoxicidad incluyen aumento del influjo del calcio extracelular y disminución de la conductancia al cloro alterando la estabilidad de la membrana del miocito, lo cual conduce a disminución en la proliferación celular (alteraciones en las bombas Na+/Ca2+ ATPasa y Na+/K+ ATPasa) (20). Se describe un aumento en los depósitos lipídicos, miofibras negativas para citocromo-oxidasa y fibras rojas irregulares en biopsias musculares de pacientes en tratamiento con estatinas que desarrollan síntomas, pero tienen enzimas normales. Estos hallazgos sugieren como origen de la miopatía inducida por estatinas, la disfunción de la cadena respiratoria mitocondrial y las anormalidades metabólicas asociadas (21).
Factores de riesgo para toxicidad con estatinas
Características de las estatinas
La susceptibilidad al daño muscular difiere entre las distintas estatinas, si bien la pravastatina y la fluvastatina son las de menor toxicidad intrínseca. La simvastatina, la lovastatina y la atorvastatina son metabolizadas por la isoenzima CYP450-3A4 mientras que la fluvastatina se metaboliza por la CYP-2C9. La pravastatina y la rosuvastatina se excretan sin cambios a través del riñón y, en menor medida, por la bilis, por lo que tendrían menor toxicidad muscular al asociarse con medicamentos que se metabolicen por esta vía (6, 10, 11).
Características del paciente
La susceptibilidad a miopatía es mayor en mujeres, pacientes muy ancianos (mayores de 80 años) con constitución corporal pequeña, personas con historia de abuso de alcohol e individuos con el hábito de ingestión de jugo de toronja en grandes cantidades (usan el sistema CYP450-3A4 para su metabolismo). Con la simvastatina los polimorfismos en la CYP-2D6 pueden afectar tanto su eficacia como su tolerabilidad; los pacientes con uno o dos alelos mutantes, son más propensos a no tolerar el medicamento en comparación con aquellos que tienen los dos alelos naturales (6, 10, 11).
Comorbilidades
Hay mayor riesgo de efectos adversos en pacientes con enfermedad multisistémica, en especial falla renal (aguda o crónica), diabetes, hipotiroidismo no reconocido y antecedentes de enfermedad muscular o enfermedad hepática crónica (sólo el hígado graso, si se confirma, puede mejorar con el tratamiento hipolipemiante) (6, 10, 11).
Situaciones clínicas de alto riesgo
Períodos perioperatorios de cirugías mayores en los cuales la hipotensión no anticipada, la falla cardiaca o renal, o la necesidad de uso de medicaciones parenterales potentes incrementan el riesgo de toxicidad al medicamento (6, 10, 11).
Medicamentos concomitantes
El riesgo es mayor en pacientes que reciben terapia concomitante con medicamentos que inhiben la CYP-3A4: ciclosporina, fibratos (gemfibrozil, bezafibrato, fenofibrato y ciprofibrato), macrólidos (eritromicina y claritromicina), antifúngicos (itraconazol, ketoconazol y miconazol), inhibidores de proteasa (amprenavir, atazanavir, fosamprenavir, indinavir, lopinavir, nelfinavir, ritonavir y tipranavir) y antiarrítmicos (verapamilo, amiodarona). Aunque el ácido nicotínico se metaboliza por la CYP-3A4 y los estudios iniciales describieron casos de miopatía cuando se asociaba con estatinas, esta complicación es rara. La combinación de estos medicamentos con estatinas debe usarse con precaución y los beneficios deben sobrepasar los riesgos.
La pravastatina es la estatina de elección en quienes reciben ciclosporina, al igual que en pacientes tratados con gemfibrozilo; sin embargo, el fenofibrato sería de elección en los pacientes que requieren terapia combinada de estatinas y fibratos por su más baja incidencia de interacciones pues la glucuronidación, que es una vía importante para la excreción renal de las estatinas lipofílicas, parece ser inhibida en forma significativa por el gemfibrozil pero no por el fenofibrato, y por este mecanismo el gemfibrozil aumenta en dos a seis veces los niveles de estatinas. La clave para reducir la toxicidad muscular cuando se combinan una estatina y un fibrato, es estar alerta a los factores de riesgo para problemas musculares y aconsejar al paciente para reportar cualquier síntoma relacionado (6, 10, 11).
Tendencia al uso de altas dosis de estatinas
Con miras a buscar la reversibilidad de la placa ateromatosa y el beneficio de los efectos pleiotrópicos, el uso de dosis incrementales de estatinas se ha generalizado y los estudios, en general, indican un adecuado perfil de seguridad como se expuso al principio de esta revisión.
Monitorización del tratamiento con estatinas
La evidencia no muestra compromiso hepático, renal o neurológico por el uso de estatinas y no se recomienda de manera rutinaria la monitorización de estos sistemas en pacientes asintomáticos. Tampoco es necesaria la monitorización de los niveles de creatinina ni de proteinuria, aunque se aconseja la determinación de la función renal basal antes de iniciar el tratamiento.
A pesar del riesgo de miopatía, la monitorización de rutina de las enzimas musculares en pacientes en tratamiento con estatinas, no está indicada pero es útil, y queda a consideración del médico tener un valor basal de creatin quinasa (CK) antes de iniciar el tratamiento como referencia en caso de desarrollarse los síntomas. No es necesaria la medición periódica de ésta en pacientes asintomáticos. Se requiere juicio clínico para interpretar los niveles elevados de CK ya que éstos pueden aumentarse por hipotiroidismo o traumatismos, inyecciones intramusculares o ejercicio intenso. Una vez se ha iniciado la terapia, los síntomas pueden aparecer en cualquier momento. Si se presenta miositis o se sospecha, se suspende de inmediato la estatina, se miden los niveles de CK y se comparan con los niveles basales. Como el hipotiroidismo predispone a miopatía, se miden los niveles de hormona estimulante de tiroides (TSH); si no hay elevación de la CK, deben descartarse otras causas de mialgias como ejercicio extenuante o trabajo pesado y aconsejar al paciente moderar su actividad física. Con o sin la presencia de síntomas, un nivel de CK mayor a 10 veces el límite superior normal, probablemente es secundario a la estatina y es indicación para suspender el tratamiento. Si el paciente refiere mialgias o sensibilidad muscular, con la presencia o no de elevación moderada de CK (3-10 veces el límite superior normal), se realiza un seguimiento semanal de los síntomas y de los niveles de CK hasta normalizarlos o hasta que desaparezca la preocupación clínica o los síntomas o niveles empeoren hasta el punto de indicarse la suspensión de la terapia con estatinas. Para aquellos pacientes que desarrollen síntomas musculares o debilidad y que tengan aumento progresivo de los niveles de CK, se recomienda la reducción de la dosis o la suspensión provisional del medicamento.
De ser necesaria la restitución del tratamiento con estatinas, se hace a dosis menores de las que ocasionaron la alteración, y se siguen de manera muy cuidadosa y frecuente los síntomas y las enzimas musculares (4, 10).
Opciones para pacientes de alto riesgo cardiovascular y toxicidad con las estatinas
A pesar de los beneficios de la terapia con estatinas, aquellos pacientes que requieren su uso (pacientes de alto riesgo cardiovascular o con las patologías descritas) pero que a medida que se incrementan las dosis presentan síntomas o elevaciones enzimáticas y aún no alcanzan las metas, o peor aún, que no toleran dosis mínimas de estatinas, se convierten en un reto para el clínico.
Si bien es preciso tener en cuenta que las decisiones deben ser individualizadas, con respecto a estos pacientes existen diferentes opciones:
Suplementar con CoQ10
La CoQ10 es una quinona natural, liposoluble, localizada en la porción hidrofóbica de la membrana celular. Cerca de la mitad de la CoQ10 corporal, proviene de la ingestión de grasa; el resto se obtiene por síntesis endógena. Participa en el transporte de electrones durante la fosforilación oxidativa en la mitocondria, protege contra el estrés oxidativo producido por los radicales libres y regenera las formas activas de los antioxidantes ácido ascórbico y tocoferol (vitamina E).
Las estatinas bloquean la producción de farnesil pirofosfato, un intermediario en la producción de CoQ10. Este hecho, además del papel de la CoQ10 en la producción de energía celular y la importancia de la mitocondria en la función muscular, llevó a la formulación de la hipótesis de que la deficiencia de CoQ10 inducida por estatinas, participa en la miopatía asociada a estatinas. De acuerdo con esta teoría de deficiencia enzimática, algunos estudios demuestran que la administración de CoQ10 puede incrementar sus niveles en la sangre de los pacientes tratados con estatinas y que esto puede reducir los síntomas de miopatía inducida por estatinas en los pacientes tratados con dosis altas. Sin embargo, los estudios muestran resultados contradictorios en cuanto a la reducción de las concentraciones plasmáticas de CoQ10.
Aunque sólo hay evidencia limitada sobre el beneficio y no existen estudios clínicos controlados ni series con muchos casos y los resultados son discordantes, se sugiere que algunos pacientes se benefician de la suplementación con CoQ10 y que esta variabilidad en la respuesta puede explicarse por un efecto placebo o por variabilidad genética. Sin embargo, si el paciente requiere una estatina y experimenta toxicidad muscular, se sugiere probar suplementación con CoQ10 a una dosis de 150-200 mg/dL previo al re-tratamiento y durante el curso de la terapia con estatinas, y monitorear los niveles de CPK (17, 19).
Cambiar la estatina por otro hipolipemiante: alternativas existentes de moléculas con diferentes grados de eficiencia farmacológica
Resinas de ácidos biliares: disminuyen el LDL en 20% a 25% y aumentan el HDL en 0,8%. La dosis que se requiere para lograr una reducción del colesterol de 20% con colestiramina y colestipol, usualmente es de 16 a 24 g/día. No hay adecuada mejoría del perfil lipídico al usarse como monoterapia puesto son medicamentos de difícil adherencia por sus efectos adversos gastrointestinales (22).
Ezetimibe: es un inhibidor de la absorción de colesterol, que reduce el LDL en 15% a 20% con dosis de 10 mg/dL. Como monoterapia es difícil alcanzar las metas en pacientes de alto riesgo y no se evidencian cambios significativos en el perfil lipídico al aumentar las dosis. Su mayor utilidad se expresa al combinarla con estatinas ya que de este modo se han comprobado su eficacia y alta seguridad (23, 24).
Niacina: reduce el LDL en 15% a 25% con dosis de 1.000 a 2.000/dL; incrementa el HDL en 15 a 35% y disminuye los triglicéridos en 25% a 50%. Pese a ello, causa un estado de vasodilatación, especialmente en la cara, que es poco confortable y no permite incrementar las dosis en forma cómoda, y hay pacientes que requieren suspensión por intolerancia. Para mejorar su tolerancia y evitar o atenuar este efecto, están en investigación asociaciones de inhibidores de prostaglandinas (23, 24).
Fibratos: disminuyen los triglicéridos en 20% a 50% e incrementan el HDL en 10% a 35%, con efectos variables en el LDL por lo que no constituirían la terapia de elección en pacientes de alto riesgo cardiovascular (23, 24).
Rimonabant: es un antagonista selectivo del receptor cannabinoide 1 (CB1) que ha sido aprobado para el manejo del síndrome metabólico. También reduce el peso corporal, aumenta la saciedad, disminuye los triglicéridos, aumenta el colesterol HDL y disminuye la obesidad abdominal y el perímetro de cintura. Diferentes estudios demuestran disminuciones en los niveles de triglicéridos de 6,8% a 15,8% y aumento en el HDL de 18,2% a 23,4%, sin cambios significativos en el LDL por lo que no sería el tratamiento de primera línea. Además, aún existen consideraciones en cuanto a seguridad por sus efectos adversos neuro-psiquiátricos (insomnio, exacerbación de estados de ansiedad y depresión, convulsiones, ideas suicidas) (25).
Cambiar a otra estatina
El riesgo de miopatía parece ser menor con pravastatina (£ 0,1%). Las estatinas más hidrofílicas (pravastatina, rosuvastatina) pueden tener menor penetración dentro del músculo que las otras estatinas más lipofílicas; así mismo pravastatina y fluvastatina están menos implicadas en interacciones pues no son metabolizadas por la CYP3A4. La rosuvastatina no es metabolizada por la CYP3A4 y es hidrofílica, pero aún falta evidencia que dé soporte completo a este comportamiento (23, 24).
Disminuir la dosis de estatinas
La incidencia de miopatía asociada con la terapia con estatinas es dosis-dependiente; no obstante, en algunos pacientes no se logran las metas adecuadas con dosis estándar, lo que obliga a los médicos tratantes a intentar con dosis no convencionales para obtener los valores objetivos de LDL (23, 24).
Combinar otros hipolipemiantes, sin usar estatinas
Niacina y secuestradores de ácidos biliares: la niacina es un potente agente reductor de triglicéridos con efecto de aumento del colesterol HDL. Se prescribe en el tratamiento de pacientes con hipertrigliceridemia moderada a severa y usualmente no produce reducciones significativas del colesterol LDL. Las combinaciones de niacina con secuestradores de ácidos biliares, especialmente colestiramina y colestipol, son eficaces. Los efectos adversos de niacina son bien conocidos y usualmente limitan su uso. Al inicio, las altas dosis causan prurito y enrojecimiento facial (flushing), elevación de las enzimas hepáticas, cólico abdominal, diarrea, náuseas y vómito, además de alteraciones en el control glucémico de los diabéticos. Sin embargo, a bajas dosis y en combinación con los secuestradores de ácidos biliares, estos efectos adversos se pueden minimizar y ser muy útiles en la reducción de triglicéridos. Así mismo, se obtendrían reducciones en los niveles de colesterol en individuos con dislipidemia severa y una minimización aceptable de los niveles de LDL. En los estudios se describen reducciones de 41% de CT, de 48% de LDL y de 36% de triglicéridos con la combinación de colestiramina (16 g/dL) y niacina (3 g/dL) (22).
Fibratos y secuestradores de ácidos biliares: los fibratos disminuyen de forma efectiva los niveles de triglicéridos plasmáticos e incrementan la síntesis de HDL a nivel hepático. La combinación de fibratos y secuestradores de ácidos biliares produce la máxima respuesta deseada en todas las fracciones lipídicas (reducción del LDL, aumento del HDL y reducción de los triglicéridos). Se reportaron disminuciones del CT en 32% y de triglicéridos en 54% con el uso concomitante de colestiramina y gemfibrozilo (1.200 mg/dL) (22).
Fibratos y ezetimibe: estudios que combinaron fenofibrato con ezetimibe en pacientes con dislipidemia mixta, encontraron una disminución significativa en los niveles de LDL (20,4%) y triglicéridos (44%) y un incremento significativo del HDL (19%) (p <0,001). Estos medicamentos fueron bien tolerados y no se encontraron diferencias en la elevación de transaminasas o casos de miopatía (26, 27).
Policosanol y ezetimibe: el policosanol es un compuesto de larga cadena de alcohol derivado de la caña de azúcar, que tiene efecto en los lípidos séricos, comparable a los producidos por las estatinas. Puede actuar por medio de regulación a la baja de la expresión de HMG-CoA reductasa; además, aparentemente, carece de los riesgos y efectos adversos de las estatinas. Estudios futuros determinarán si la adición de policosanol al ezetimibe sería similar a la de estatinas y ezetimibe en cuanto a mejoría del perfil lipídico con presunciones de reducción de LDL hasta en 40% (28).
Combinar bajas dosis de estatinas con otros medicamentos hipolipemiantes
Al igual que se ha empleado en hipertensión arterial y diabetes mellitus tipo 2, la terapia de combinación de medicamentos también tiene validez en el manejo de la dislipidemia ya que busca alcanzar las metas de LDL y HDL en pacientes de alto riesgo con el mínimo de efectos adversos (Tabla 1).
Adicionar ezetimibe o resinas de ácidos biliares a la terapia con estatinas, puede producir una reducción en el LDL incluso mayor a 50%, sin aumentar los efectos adversos. Con la combinación de colesevelam (3,8 g/dL) y atorvastatina (10 mg/dL), se halló disminución del LDL en 48% (resultado superior al que reportan para cada uno por separado), así como valor estadísticamente significativo y similar al que se obtiene con dosis plenas de atorvastatina (53% con 80 mg/dL). Existen datos de eficacia semejante para colesevelam asociado a simvastatina y lovastatina. La combinación con fibratos, ácidos grasos omega 3 y niacina incrementa el HDL y disminuye los triglicéridos y el colesterol no-HDL en mayor medida que la monoterapia con estatinas. El perfil de seguridad de la combinación en terapia hipolipemiante, es aceptable si el riesgo global de enfermedad coronaria en el paciente es alto, y así se produce una estimación riesgo-beneficio favorable (23, 24).
Ezetimibe y simvastatina: la evidencia demuestra reducciones de LDL adicionales con la combinación (25,8%) vs. el placebo y simvastatina (2,7%) (p < 0,001) y porcentajes de logro de metas de LDL de 71% con la combinación en comparación con 20,6% para placebo y estatina (p < 0,001). Al confrontar la combinación contra atorvastastina, se encontraron reducciones de 47% a 59% vs. 36% a 53%, respectivamente, al igual que incrementos en el HDL mayores con la combinación que con diferentes dosis de atorvastatina (23, 24).
Estatinas y fibratos: la combinación fluvastatina-bezafibrato (40/400) es superior a fluvastatina-colestiramina y a la monoterapia para lograr reducción en los niveles de LDL (24%) y triglicéridos (38%) y aumentos en el HDL (22%) en pacientes con hipercolesterolemia heterocigótica familiar. El estudio Simvastatin plus Fenofibrato for Combined Hyperlipidemia (SAFARI) tomó 18 semanas e incluyó pacientes con hiperlipidemia combinada (triglicéridos > 150 y < 500 mg/dL y LDL >130 mg/dL) y comparó simvastatina 20 mg más fenofibrato 60 mg con simvastatina sola. Se observaron disminuciones de 43% y 20% en los triglicéridos respectivamente (p <0,001), reducciones de 31% y 26% en los niveles de LDL respectivamente (p <0,001) y aumentos de 19% y 10% en el HDL respectivamente (p <0,001). Ambos tratamientos fueron bien tolerados y en ninguno de los grupos se reportaron casos de miopatía clínica o elevaciones serias en las transaminasas. Esporádicamente se reporta riesgo de miopatía con la combinación estatina-fibrato, pero recibió gran atención luego del retiro de cerivastatina del mercado por el riesgo de rabdomiólisis. Con fenofibrato ocurren menos casos de rabdomiólisis que con gemfibrozilo al combinarlos con estatinas (0,58 reportes/1´000.000 prescripciones vs. 8,6 reportes/1´000.000 respectivamente) (23, 24).
Niacina y estatinas: luego de 48 semanas de tratamiento, Niaspan® como monoterapia (2.000 mg promedio) redujo el LDL en 18% y los triglicéridos en 24% e incrementó el HDL en 29%, mientras que Niaspan® con estatina disminuyó el LDL en 32% y los triglicéridos en 30%, y aumentó el HDL en 26%. En 2,6% de los pacientes se encontraron elevaciones reversibles de las transaminasas más de dos veces el rango normal y 4,8% de los pacientes suspendieron el medicamento debido a flushing. En una revisión de nueve ensayos clínicos de combinaciones de una estatina (fluvastatina 20 mg, lovastatina 20-40 mg o pravastatina 20-40 mg) más niacina (1-3 g), el LDL se redujo en 25% a 57% y el HDL aumentó en 13% a 36%. Evidencia de pequeños estudios, indica que cuando se usa ácido nicotínico para tratamiento como prevención secundaria en combinación con estatinas, se reduce la morbi-mortalidad por enfermedad aterosclerótica; sin embargo se requieren estudios clínicos más grandes que evalúen la combinación de estos medicamentos. El evento adverso más severo de la terapia con niacina es la hepatotoxicidad. La niacina de liberación sostenida que se administra varias veces al día, se asocia a toxicidad hepática de forma dosis-dependiente. La niacina de liberación inmediata a dosis mayores de 2 g/dL, se asocia con una anormalidad en la función hepática en una proporción menor a 3%, la cual no se ve afectada en forma adversa por la terapia combinada con estatinas. Los casos de miopatía que se relacionan con la combinación de niacina y estatinas, pueden explicarse por un daño hepático asociado a la toxicidad por niacina, lo cual resulta en una retardada depuración de la estatina y lleva a un incremento en el riesgo de miopatía (29).
Estatinas y ácidos grasos omega 3: la combinación de pravastatina o simvastatina 20 mg con 3 a 3,6 g/dL de ácidos grasos omega 3, disminuye los niveles de LDL y de triglicéridos (13% a 24% y 27% a 30% respectivamente) con incrementos poco significativos en el HDL (29).
Conclusiones
El enfoque de los pacientes de alto riesgo cardiovascular exige, además del adecuado manejo de otros factores, un estricto control del perfil lipídico, particularmente del LDL como objetivo primario. No obstante, en algunas ocasiones, esta labor no es sencilla, si se tiene en cuenta que la monoterapia con estatinas (los medicamentos de elección para este fin) se ve limitada por intolerancia a los aumentos en la dosis o predisposición a toxicidad por estatinas (en algunos pacientes) bien sea por respuesta individual, por interacciones farmacológicas o por comorbilidades, o por falla en alcanzar las metas de colesterol no-HDL en pacientes con dislipidemia mixta.
Para tomar la decisión sobre la conducta a seguir, debe considerarse el riesgo/beneficio, prescribir estatinas que tengan menos interacciones farmacológicas, emplear bajas dosis en combinación con otros hipolipemiantes, suplementar con CoQ10 en quienes se demuestre beneficio, realizar una monitorización metódica de las funciones hepática, renal y muscular en aquellos que hayan desarrollado eventos adversos previos y, en caso de requerirse la suspensión de la estatina, buscar combinaciones de hipolipemiantes que demuestren beneficios similares. El objetivo final es alcanzar metas de LDL y no-HDL con un mínimo de eventos adversos serios.
Bibliografía
1. Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (ATP III). JAMA 2001; 85: 2486-2497. [ Links ]
2. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Circulation 2004; 110: 227-239. [ Links ]
3. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360: 7-22. [ Links ]
4. Pasternak R, Smith S, MD, Bairey-Merz N, Grundy S, Cleeman J, Lenfant C. ACC/AHA/NHLBI Clinical advisory on the use and safety of statins. Circulation 2002; 106: 1024-1028. [ Links ]
5. Andrés S, Lucena A, Juana P. Interactions between foodstuff and statins. Nutrición Hospitalaria 2004; 19 (4): 195-201. [ Links ]
6. Stone NJ. Stopping statins. Circulation 2004; 110: 2280-2282. [ Links ]
7. Khush K, Waters D, Bittner V, Deedwania P, Kastelein J, Lewis S, Wenger N. Effect of high-dose atorvastatin on hospitalizations for heart failure: subgroup analysis of the Treating to New Targets (TNT) Study. Circulation 2007; 115: 576-583. [ Links ]
8. Echeverri D, Buitrago L, Montes F. Efectos pleiotrópicos de las estatinas. Características farmacológicas útiles en la prevención, tratamiento y regresión de la enfermedad cardiovascular. Rev Col Cardiol 2005; 12 (3): 95-102. [ Links ]
9. Davignon J. Beneficial cardiovascular pleiotropic effects of statins. Circulation 2004; 109: 39-43. [ Links ]
10. McKenney JM. An assessment of statin safety. Am J Managed Care 2006; 12: S310-S317. [ Links ]
11. Armitage J. The safety of statins in clinical practice. Disponible en: www.thelancet.com. Publicado en línea: June 7, 2007. [ Links ]
12. LaRosa JC, Grundy SM, Waters DD, et al. For the Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352: 1425-1435. [ Links ]
13. Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295(13): 1556-1565. [ Links ]
14. Nissen SE, Tuzcu M, Schoenhagen P, et al. For the REVERSAL Investigators. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis. A randomized controlled trial. JAMA 2004; 291: 1071-1080. [ Links ]
15. Grundy SM. Can statins cause chronic low-grade myopathy? Ann Intern Med 2002; 137: 617-618. [ Links ]
16. Bennett WE, Drake III AJ, Shakir KM. Reversible myopathy after statin therapy in patients with normal creatine kinase levels. Ann Intern Med 2003; 138(5): 435-439. [ Links ]
17. Hargreaves IP, Duncan AJ, Heales S, Land JM. The effect of HMG-CoA reductase inhibitors on coenzyme Q10 possible biochemical/clinical implications. Drug Safety 2005; 28(8): 659-676. [ Links ]
18. Yalcin A, Kilinic E, Sagcan A, et al. Coenzyme Q10 concentrations in coronary artery disease. Clinical Biochemestry 2004; 37: 706-9. [ Links ]
19. Marcoff L, Thompson P. The role of coenzyme Q10 in statin-associated myopathy. A Systematic review. J Am Coll Cardiol 2007; 49 (23): 2231-2237. [ Links ]
20. Owczarek J, Jasiñska M, Orszulak-Michalak D. Drug-induced myopathies. An overview of the possible mechanisms. Pharmacological Reports 2005; 57: 23-34. [ Links ]
21. Phillips PS, Haas RH, Bannykh S, et al. Statin-associated myopathy with normal creatine kinase levels. Ann Intern Med 2002; 137: 581-585. [ Links ]
22. Mandeville WH, Arbeeny C. Bile acid sequestrants: their use in combination with other lipid-lowering agents. Drugs 1999; 2 (3): 237-242. [ Links ]
23. Davidson MH. Reducing residual risk for patients on statin therapy: the potential role of combination therapy. Am J Cardiol 2005; 96 (9A): 3-13. [ Links ]
24. Vasudevan AR, Jones PH. Effective use of combination lipid therapy. Curr Atherosclerosis Reports 2006, 8: 76-84. [ Links ]
25. Gelfand EV, Cannon CP. Rimonabant: a cannabinoid receptor type 1 blocker for management of multiple cardiometabolic risk factors. JACC 2006; 47 (10): 1919-1926. [ Links ]
26. Farnier M, Freeman MW, Macdonell G, et al. For the Ezetimibe Study Group. Efficacy and safety of the coadministration of ezetimibe with fenofibrate in patients with mixed hyperlipidaemia. Eur Heart J 2005; 26: 897-905. [ Links ]
27. McKenney JM, Farnier M, Lo KW, et al. Safety and efficacy of long-term co-administration of fenofibrate and ezetimibe in patients with mixed hyperlipidemia. J Am Coll Cardiol 2006; 47(8): 1584-1587. [ Links ]
28. McCarty MF. An ezetimibe-policosanol combination has the potential to be an OTC agent that could dramatically lower LDL cholesterol without side effects. Medical Hypotheses 2005; 64: 636-645. [ Links ]
29. Carlson LA. Nicotinic acid and other therapies for raising high-density lipoprotein. Curr Op Cardiol 2006; 21: 336-344. [ Links ]














