Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.15 no.2 Bogota Mar./Apr. 2008
(1) Servicio de Medicina Interna. Clínica de Occidente. Cali, Colombia.
(2) Clínica de Occidente. Centro Médico de Cali. Cali, Colombia.
Correspondencia: Mauricio Zárate G., MD. Clínica de Occidente. Centro Médico de Cali. Calle 19N N° 5N-35. Cons. 607. Teléfono: 6601297-6603000 Ext.119. Correo electrónico: mzarate@coldecon.net.co
Recibido: 24/09/2007. Aceptado:18/03/2008.
El ventrículo no compacto o «esponjoso», es una entidad multifactorial, que se debe a una alteración en la embriogénesis normal del endocardio y el miocardio. Se clasifica según se presente de manera aislada o asociada a otras cardiomiopatías. Su manifestación clínica es variable, desde pacientes asintomáticos hasta aquellos que debutan con falla cardiaca, arritmias o fenómenos tromboembólicos sistémicos. El estándar de oro diagnóstico es el ecocardiograma Doppler color. El tratamiento se enfoca hacia el control de los síntomas de acuerdo con la presentación del cuadro, pero el trasplante cardiaco se convierte en la única medida salvadora. El pronóstico es ominoso; más de la mitad fallece o tiene falla cardiaca terminal en el seguimiento a diez años.
Palabras clave: ventrículo esponjoso, embriogénesis miocárdica, falla cardiaca, trasplante cardíaco.
Non-compact or «spongy» ventricle is a multi-factorial entity due to an alteration in normal embryogenesis of endocardium and myocardium. It is classified depending on its presentation, whether it is isolated or associated to other cardiomyopathies. Its clinical presentation varies from asymptomatic patients to those that present with heart failure, arrhythmia or systemic thromboembolic phenomena. The diagnostic gold standard is the color Doppler echocardiogram. Treatment is focused on the control of symptoms according to the clinical presentation, but cardiac transplant becomes the only life-saving measure. Prognosis is ominous; more than half patients die or have terminal heart failure in a ten years follow-up period.
Key words: spongy ventricle, myocardial embryogenesis, heart failure, cardiac transplant.
Introducción
Si bien existe un sinnúmero de nombres y designaciones para esta entidad, que pueden dar lugar a confusión (ventrículo «esponjoso», miocardio no compacto, cardiomiopatía esponjosa del ventrículo izquierdo), lo que sí es importante es tener claro que la clasificación se establece según se presente de manera aislada (IVNC) o en asociación con otras cardiomiopatías (NVM) (1, 2), y que se incluyen dentro de la categoría de cardiomiopatías no clasificadas según la Organización Mundial de la Salud (Tabla 1).

El primer caso se describió en 1984 y correspondió a una mujer de 33 años. Luego se observó un patrón similar en pacientes jóvenes con síntomas de falla cardiaca y alteraciones ecocardiográficas. Posteriormente, se publicaron series en pacientes pediátricos, hasta que Chin y colaboradores (3) publicaron un reporte de diez años de experiencia con series de pacientes adultos con IVNC (4).
Embriología y desarrollo
En la etapa embrionaria temprana, el miocardio es una red laxa de fibras entrecruzadas, separadas por recesos profundos que lo comunican con la cavidad ventricular. El proceso de formación de este «entramado» de fibras y recesos intertrabeculares o sinusoides, ocurre entre la semana quinta a octava de vida embrionaria, desde el epicardio hasta el miocardio, y de la base al ápex (5). La circulación coronaria se desarrolla de manera paralela a este proceso, y los recesos intertrabeculares se reducen a capilares. Ello involucra: liberación de factores de crecimiento del endocardio y factores de angiogénesis: factor de crecimiento endotelial vascular (EVGF) y angiopoyetina-1 (AP-1) (6). La falla en el proceso normal de morfogénesis endomiocárdica, da lugar a esta entidad (1).
Primero se describió en asocio a otras cardiopatías (NVM) (obstrucción del flujo de salida del ventrículo derecho, cardiopatías cianóticas complejas y anomalías arteriales coronarias), y se argumentaba que la sobrecarga de presión o isquemia miocárdica frenaba la involución de los sinusoides miocárdicos embrionarios y daba lugar a la persistencia de los recesos intertrabeculares que comunican la cavidad ventricular con la circulación coronaria (7).
Luego, en 1990, Chin y colaboradores explicaron el modelo para la IVNC, que consistía en una variante en la cual la morfología miocárdica embrionaria, persistía en ausencia de otras anomalías cardiacas que lo explicaran, y los recesos comunicaban sólo con la cavidad ventricular y no con la circulación coronaria (3, 8). Se propuso que el término IVNC se reemplazara por «ventrículo izquierdo hipertrabeculado», debido a que en menos de 50% de los casos, hay signos de afección del ventrículo derecho; sin embargo no hay total aceptación a esta recomendación, como se verá más adelante.
Anatomía patológica - Histología
Desde el punto de vista histológico, la IVNC y la NVM difieren en que en la primera los recesos intertrabeculares o sinusoides comunican con la cavidad ventricular, mientras que en la segunda lo hacen tanto con la cavidad ventricular como con la circulación coronaria (7). No obstante, no hay hallazgos patognomónicos. Se ha encontrado fibrosis en múltiples estudios como los de Hamamichi, quien reportó cinco casos de IVNC del ventrículo derecho en los cuales la biopsia informaba fibrosis intersticial (5/5) con engrosamiento endomiocárdico y fibroelastosis subendocárdica (3/5) (Figuras 1 y 2) (9, 10).
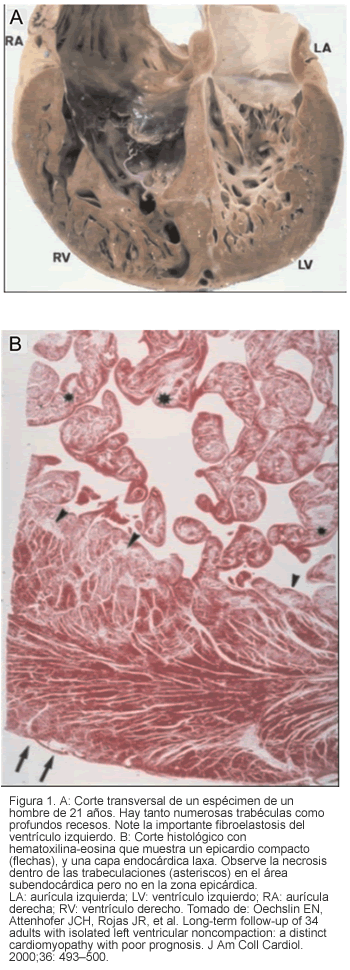
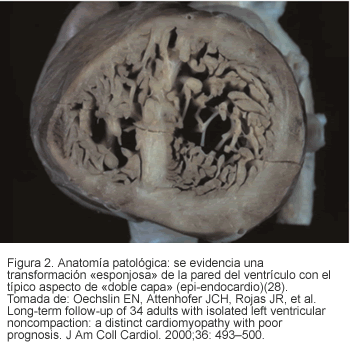
Bases genéticas
Se describen formas familiares y espontáneas. En la IVNC se ha demostrado recurrencia familiar en la mitad de los casos. En los estudios en población adulta hay asociación familiar en 18% de los casos (3, 7). Bleyl publicó una serie de IVNC en seis niños afectados, de una misma familia, con patrón de herencia ligado al X, con una mutación en el gen G4.5, cromosoma Xq28 (región compartida por otras miopatías: síndrome de Barth, distrofia muscular Emery-Dreifuss, miopatía miotubular) (6, 11). Se aisló un gen cardiaco específico CSX, que se ha implicado en el desarrollo de algunos casos de IVNC, por una deleción del cromosoma 5q que ocasiona la pérdida del gen (12, 13, 30). Basándose en modelos animales, otros autores afirman que la mutación del gen FKBP12 es la responsable de un grupo de defectos septales ventriculares y cardiomiopatías, entre ellas el ventrículo «esponjoso» (8).
Epidemiología y demografía
Los primeros casos de cardiomiopatía aislada (IVNC) que se reportan en la literatura, tienen una edad media de presentación de siete años con un intervalo entre 11 meses y 22 años (7, 14). Estudios ulteriores reportaron casos en adultos e incluso en ancianos. La prevalencia global es de 0,014%, sin embargo la prevalencia real no es clara a causa del sub-registro y la demora en el diagnóstico diferencial. Por lo general, los hombres se ven más afectados que las mujeres (56%-82%) (8, 15).
Características clínicas y fisiopatología
Esta entidad se puede presentar con tres manifestaciones mayores: falla cardiaca, arritmias o eventos embólicos sistémicos.
Falla cardíaca
Se documentan casos asintomáticos hasta disfunción severa del ventrículo izquierdo. Casi dos terceras partes ocurre con síntomas de insuficiencia cardiaca congestiva (7). En pacientes con IVNC Chin reportó disminución de la función ventricular sistólica en 63% de los casos (3). La disfunción diastólica se explica por alteraciones en la relajación, sumado a un patrón restrictivo causado por las trabéculas prominentes. Los mecanismos que intervienen en la disfunción sistólica no son del todo claros; al parecer la hipoperfusión subendocárdica y la disfunción microcirculatoria, desempeñan un papel importante (4, 16). Al estudiar estos defectos en la perfusión subendocárdica con resonancia magnética cardiaca (RMI) y tomografía con emisión de positrones (PET), se hallan defectos de perfusión transmural que se correlacionan con las áreas «esponjosas» del miocardio (17). La alteración en la función microvascular conlleva disfunción contráctil por fracaso en el desarrollo de la microcirculación coronaria con el incremento de la masa muscular y compresión del lecho coronario por el miocardio hipertrofiado (18).
Arritmias
En esta patología son un hallazgo frecuente. Se ha encontrado fibrilación auricular en 25% de la población adulta con IVNC y taquicardia ventricular en 47% de la misma serie (4); así como la muerte súbita explica 50% de las causas de muerte en series de pacientes con INVM (5). También se reportan casos con taquicardia supraventricular paroxística y bloqueo atrioventricular completo.
El electrocardiograma en reposo puede mostrar hipertrofia ventricular izquierda, cambios inespecíficos de repolarización, ondas T invertidas, cambios en el segmento ST, desviación del eje, anomalías en la conducción intraventricular y bloqueos aurículoventriculares (12, 19, 20). Se halla síndrome de Wolff-Parkinson-White en 15% de estudios en pacientes pediátricos (21).
Eventos embólicos
Pueden tener manifestaciones de enfermedad cerebrovascular, accidente isquémico transitorio, embolia pulmonar o infarto mesentérico en 21% a 38% de los casos. Las complicaciones embólicas se relacionan con el desarrollo de trombos en un ventrículo «hipertrabeculado», función sistólica disminuida y presencia de fibrilación auricular (3, 4, 7).
Otros
Chin y colaboradores encontraron dismorfismos faciales: frontal abombado, orejas de baja implantación, estrabismo y micrognatia, en un tercio de las series pediátricas (3, 12). Otro dato clínico importante es la coexistencia de algún tipo de desorden neuromuscular en 82% de los casos (22).
Diagnóstico
Ecocardiograma bi-dimensional Doppler a color
Es el estándar de oro diagnóstico porque demuestra la presencia de múltiples trabéculas ventriculares prominentes, así como el flujo sanguíneo entre las trabéculas o sinusoides en continuidad con la cavidad ventricular (23). En el ventrículo izquierdo los segmentos con mayor compromiso son la región apical, la pared inferior y la pared medio-lateral (80%) (Figura 3). En el ventrículo derecho la afección se da en la región apical (41%) (28). Se observa disfunción sistólica con una fracción de eyección estimada de 33% en las diferentes series (7) y disfunción diastólica con patrón restrictivo de llenado en 36% de los casos. Además, se ha observado hipocinesia tanto en miocardio afectado como sano (teoría del daño microcirculatorio coronario global) (24, 25).
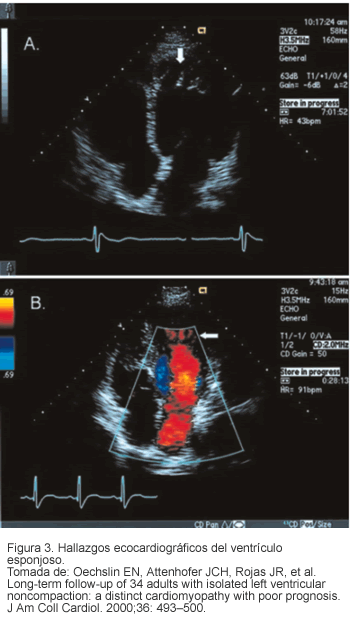
Otros métodos diagnósticos útiles son: ventriculograma con contraste, tomografía computarizada cardiaca, tomografía con emisión de positrones y resonancia magnética principalmente para definir la localización y extensión del miocardio lesionado (17, 18).
Diagnóstico diferencial
Debe pensarse en otras cardiomiopatías como cardiomiopatía apical hipertrófica, cardiomiopatía dilatada y displasia arritmogénica del ventrículo derecho, y en otras entidades como fibroelastosis endocárdica, metástasis cardiacas y trombos intramurales del ventrículo izquierdo. En este caso puede ser muy útil el ecocardiograma contrastado (26, 32) (Tabla 2).

Manejo
El objetivo es abarcar las tres manifestaciones cardinales:
1. Falla cardiaca: se dirige al manejo de la disfunción sisto-diastólica. Hay evidencia del uso de un b-bloqueador como carvedilol para mejorar no sólo la función ventricular sino el disbalance neurohormonal (27). Sin embargo, en los casos de insuficiencia cardiaca congestiva refractaria al manejo médico, el trasplante cardiaco permanece como la única alternativa.
2. Arritmias: según el tipo de trastorno el manejo antiarrítmico se acompaña de monitoreo electrocardiográfico anual (Holter electrocardiograma), hasta la posibilidad de implantación de un cardiodesfibrilador (7, 29).
3. Eventos embólicos: el control de factores de riesgo cardioembólico, como el manejo juicioso de la fibrilación auricular, sumado a la anticoagulación profiláctica a largo plazo, son las opciones recomendadas por la literatura para disminuir la incidencia de fenómenos tromboembólicos en esta entidad (4, 7).
Pronóstico
Si bien es variable, según la edad de aparición de los síntomas y la forma de presentación, entre otros, en varios estudios se observa que 60% muere o requiere trasplante cardiaco en los seis años siguientes al diagnóstico (4, 7, 31) (Figura 4).
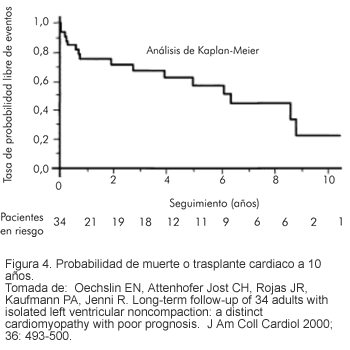
Las principales causas de muerte en series de pacientes asintomáticos son: taquicardia ventricular sostenida y muerte súbita; así como las complicaciones e incluso la muerte, son considerablemente menores en las series de pacientes pediátricos. Chin y colaboradores realizaron un seguimiento a 10 años en el que aproximadamente 90% de los pacientes desarrollaban algún grado de disfunción ventricular izquierda (3).
Como factores de mal pronóstico se aceptan:
- Mayor diámetro del ventrículo izquierdo al final de diástole en el momento del diagnóstico.
- Clase funcional NYHA III-IV.
- Fibrilación auricular permanente o persistente.
- Bloqueo de rama completo.
Conclusiones
- Es una entidad multifactorial, de etiología aún por aclarar.
- Es subdiagnósticada porque no se sospecha o se piensa primero en otras cardiomiopatías.
- Tiene una presentación clínica variable.
- Es necesario establecer una clasificación que permita optimizar intervenciones de tamizaje, diagnóstico y tratamiento.
- Se recomienda tamizaje anual con ecocardiograma en familiares de primer grado de pacientes afectados, por la alta recurrencia familiar (31).
- El tratamiento es individualizado según el caso; puede ir desde manejo médico hasta trasplante cardiaco.
- El pronóstico es ominoso en la mayoría de los casos.
Bibliografía
1. Jenni R, Oechslin EN, van der Loo B. Isolated ventricular non-compaction of the myocardium in adults. Heart 2007; 93: 11-15. Originally published online 2 May 2006; [ Links ]
2. Restrepo G, Castaño RI, Marmol A. Ventrículo no compacto/ventrículo izquierdo hipretrabeculado. Rev Colomb Cardiol 2005; 12: 20-24. [ Links ]
3. Chin TK, Perloff JK, Williams RG, et al. Isolated noncompaction of left ventricular myocardium: a study of eight cases. Circulation 1990; 82: 507-13. [ Links ]
4. Ritter M, Oechslin E, Sütsch G, Attenhofer C, Schneider J, Jenni R. Isolated noncompaction of the myocardium in adults. Mayo Clin Proc 1997; 72(1): 26-31. [ Links ]
5. Weiford BC, Subbarao VD. Mulhern KM. Noncompaction of the ventricular myocardium. Circulation 2004; 109; 2965-2971. [ Links ]
6. Zambrano E, Marshalko SJ, Jaffe CC, et al. Isolated noncompaction of the ventricular myocardium: clinical and molecular aspects of a rare cardiomyopathy. Lab Invest 2002; 82: 117-122. [ Links ]
7. Oechslin EN, Attenhofer Jost CH, Rojas JR, et al. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J Am Coll Cardiol 2000; 36: 493-500. [ Links ]
8. Rigopoulos A, Rizos IK, Aggeli C, et al. Isolated left ventricular noncompaction: an unclassified cardiomyopathy with severe prognosis in adults. Cardiology 2002; 98: 25-32. [ Links ]
9. Daimon Y, Watanabe S, Takeda S, et al. Two-layered appearance of noncompaction of the ventricular myocardium on magnetic resonance imaging. Circ J 2002; 66: 619-621. [ Links ]
10. Hamamichi Y, Ichida F, Hashimoto I, et al. Isolated noncompaction of the ventricular myocardium: ultrafast computer tomography and magnetic resonance imaging. Int J Cardiovasc Imaging 2001; 17: 305-314. [ Links ]
11. Bleyl SB, Mumford BR, Brown-Harrison MC, et al. Xq28-linked noncompaction of the ventricular myocardium: prenatal diagnosis and pathologic analysis of affected individuals. Am J Med Genet 1997; 72: 257-265. [ Links ]
12. Ichida F, Tsubata S, Bowles KR, et al. Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome. Circulation 2001; 103: 1256-1263. [ Links ]
13. Pauli RM, Scheib-Wixted S, Cripe L, et al. Ventricular noncompaction and distal chromosome 5q deletion. Am J Med Genet 1999; 85: 419-423. [ Links ]
14. Stollberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol 2002; 90: 899-902. [ Links ]
15. Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. J Am Coll Cardiol 2002; 39: 450-454. [ Links ]
16. Hamamichi Y, Ichida F, Hashimoto I, et al. Clinical features of isolated noncompaction of the ventricular myocardium: long-term, clinical course, hemodynamic properties, and genetic background. J Am Coll Cardiol 1999; 34: 233-240. [ Links ]
17. Soler R, Rodriguez E, Monserrat L, et al. MRI of subendocardial perfusion deficits in isolated left ventricular noncompaction. J Comput Assist Tomogr 2002; 26: 373-375. [ Links ]
18. Junga G, Kneifel S, Von Smekal A, et al. Myocardial ischemia in children with isolated ventricular non-compaction. Eur Heart J 1999; 20: 910-916. [ Links ]
19. Ritter M, Oechslin E, Sutsch G, et al. Isolated noncompaction of the myocardium in adults. Mayo Clin Proc 1997; 72: 26-31. [ Links ]
20. Reynen K, Bachmann K, Singer H. Spongy myocardium. Cardiology 1997; 88: 601-602. [ Links ]
21. Bezold, Clunie S, Fernbach S, et al. A relatively common form of cardiomyopathy clinical characterization of left ventricular noncompaction in children. Circulation 2003; 108: 2672-2678. Originally published online Nov 17, 2003. [ Links ]
22. Stollberger C, Finsterer J, Blazek G, et al. Left ventricular non-compaction in a patient with Becker's muscular dystrophy. Heart 1996; 76: 380. [ Links ]
23. Barón A, Cuenca G. Contraste miocárdico en el diagnóstico de la miocardiopatia no compacta: descripción de dos casos. Rev Colomb Cardiol 2007; 14: 223-227. [ Links ]
24. Finsterer J, Stollberger C, Feichtinger H. Histological appearance of left ventricular hypertrabeculation/noncompaction. Cardiology 2002; 98: 162-164. [ Links ]
25. Jenni R, Wyss CA, Oechslin EN, et al. Isolated ventricular noncompaction is associated with coronary microcirculatory dysfunction. J Am Coll Cardiol 2002; 39: 450-454. [ Links ]
26. Koo BK, Choi D, Ha J, et al. Isolated noncompaction of the ventricular myocardium: contrast echocardiographic findings and review of the literature. Echocardiography 2002; 19: 153-156. [ Links ]
27. Toyono M, Kondo C, Nakajima Y, et al. Effects of carvedilol on left ventricular function, mass, and scintigraphic findings in isolated left ventricular non-compaction. Heart 2001; 86: e4-e6. [ Links ]
28. Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001; 86: 666-71. [ Links ]
29. Duru F, Candinas R. Noncompaction of ventricular myocardium and arrhythmias. J Cardiovasc Electrophysiology 2000; 11: 493. [ Links ]
30. Xing Y, Ichida F, Matsuoka T, et al. Genetic analysis in patients with left ventricular noncompaction and evidence for genetic heterogeneity. Mol Genet Metab 2006; 88: 71. [ Links ]
31. Murphy RT, Thaman R, Blanes JG, et al. Natural history and familial characteristics of isolated left ventricular non-compaction. Eur Heart J 2005; 26: 187. [ Links ]
32. Frischknecht BS, Jost CH, Oechslin EN, et al. Validation of noncompaction criteria in dilated cardiomyopathy, and valvular and hypertensive heart disease. J Am Soc Echocardiogr 2005; 18: 865. [ Links ]














