Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cardiología
versão impressa ISSN 0120-5633
Rev. Colom. Cardiol. v.16 n.1 Bogota jan./fev. 2009
(1) Unidad de Ultrasonido, Instituto de la Mujer, Clínica las Américas, Medellín, Colombia.
(2) SONOFETAL, Medellín, Colombia.
Correspondencia: Dr. Juan F. Jaramillo, Unidad de Ultrasonido, Instituto de la Mujer, Clínica las Américas, Diagonal 75B No. 2A-80, Teléfono: 345-83-42. Correo electrónico: jdaza@une.net.co
Recibido: 20/11/07. Aceptado: 19/02/09.
Las frecuencias anormalmente rápidas sobre un corazón con una estructura menos distensible, rodeado por una coraza que sólo le permite defenderse con la frecuencia cardiaca para sostener el gasto cardiaco, hacen que este sea un corazón con márgenes estrechos de tolerancia frente a las taquiarritmias.
Las frecuencias persistentes y superiores a 220 latidos por minuto, generan presiones anormalmente altas sobre todo el corazón y el sistema venoso. Hidrops y edema placentario son secuelas finales antes de la muerte fetal, y aún hasta este punto se pueden controlar y revertir.
Aunque en teoría cualquier tipo de arritmias común en la vida extrauterina se podría desencadenar en el feto, 90% de éstas están incluidas en la taquicardia supraventricular reciprocante y en el flutter.
Ambos tipos de arritmias pueden responder a la digoxina, aunque algunas son refractarias a este medicamento. La aplicación de ultrasonido sobre el corazón, permite no sólo descartar anomalías cardiacas asociadas, sino realizar protocolos de tratamiento. La medición de la relación de los tiempos ventrículo atrial:atrio ventricular, permite considerar otro tipo de arritmias como la taquicardia ectópica de la unión y la forma permanente reciprocante de la unión, etc., e incluir otros anti-arrítmicos, como amiodarona, flecainida, sotalol, entre otros.
La principal vía de uso de los anti-arrítmicos es la transplacentaria. Por lo tanto, no sólo el feto se expone a posibles efectos secundarios, sino también la madre. Un grupo multidisciplinario enfrentará esta situación con el fin de ofrecer el mejor resultado para los dos.
Palabras clave: taquiarritmia fetal, taquicardia fetal, ecocardiografía fetal, tratamiento arritmias.
A heart with a not much distensible structure, surrounded by a membrane, and only able to react with the heart rate for maintaining its cardiac output, has a narrow margin of tolerance in front of tachyarrhythmias.
Persistent heart rates >200/min generate abnormally high pressure on the heart and the venous system. Hydrops and placental edema are common final outcomes before fetal death, that still at this point can be controlled and reverted.
Although theoretically any type of arrhythmias could be developed in the fetus, 90% of fetal tachyarrhythmias correspond to supraventricular reciprocant tachycardia and flutter.
Both types of arrhythmias may respond to digoxin, although some are refractory to this drug. Ultrasound application to the heart allows not only to rule out associated heart anomalies, but to realize treatment protocols. The measurement of the relation between ventricular-atrial and atrio-ventricular times allows to consider another type of arrhythmias such as junctional ectopic tachycardia, permanent junctional reprocicant tachycardia, etc., and to include other antiarrhythmics such as amiodarone, flecainide and sotalol among others.
The main administration route of antiarrhythmics is the transplacental. Therefore not only the fetus but also the mother is exposed to drug side effects. A multidisciplinary group will confront this situation in order to offer both mother and fetus the best result.
Key words: fetal tachyarrhythmia, fetal tachycardia, fetal electrocardiography, arrhythmia treatment.
Introducción
Las anormalidades del ritmo cardiaco fetal se presentan en alrededor de 2% de todas las gestantes. Sin embargo, se caracterizan por ser esporádicas y transitorias en su mayoría, y sin ningún efecto adverso. Un escaso número de éstas desencadenan taquiarritmia sostenida que puede poner en alto riesgo la salud del feto (1).
La mayoría de las taquiarritmias son toleradas por el feto, pero algunas de ellas desarrollan complicaciones severas como cardiomiopatía, hidrops y muerte fetal. La identificación y aplicación de tratamiento médico previene estas complicaciones.
Se acepta como taquicardia fetal la frecuencia que supera los 160 latidos por minuto (lpm), pero con los movimientos del feto ésta puede subir fisiológicamente hasta alrededor de 180 lpm, por lo tanto se considera taquiarritmia fetal aquella que supera este último valor de forma constante y sin relación con la actividad fetal.
La imposibilidad de contar con estudios prácticos que permitan una evaluación electrocardiográfica del ritmo cardiaco fetal, nos dirige al estudio ecocardiográfico como la herramienta más útil con la que se cuenta en la actualidad. Aunque está lejos de una precisión diagnóstica, permite una aproximación suficiente como para plantear un tratamiento farmacológico.
Esta revisión se enfocará exclusivamente en las taquiarritmias sin anomalías estructurales. Se revisará, en forma simple, su mecanismo para lograr una mayor comprensión de su fisiopatogenia, al igual que las alternativas de tratamiento.
Clasificación de las taquiarritmias
Las taquiarritmias del feto se pueden dividir de una forma más simple que la clasificación establecida en la población pediátrica (Tabla 1). Un sistema autonómico aún sin madurez completa y la ausencia de factores arritmogénicos secundarios, simplifican la variedad de trastornos electrofisiológicos presentes en este grupo (2).

Epidemiología
Las taquiarritmias se presentan en 0,5% de todas las embarazadas (3, 4). Las más frecuentes son la taquicardia supraventricular (70%-90%) y el flutter auricular (20%-30%) (3). La taquicardia ventricular, la fibrilación auricular, las taquicardias reciprocantes de la unión y la taquicardia de re-entrada nodal aurículo-ventricular, etc., sólo hacen parte de 1% de las taquiarritmias durante este período (5). A partir de esta información se evidencia que la mayoría de las arritmias del feto son de tipo supraventricular y en más de 90% de los casos se producen por mecanismos de reentrada.
El hidrops fetal afecta por igual a las taquicardias supraventriculares como al flutter, con un alto porcentaje de muertes (6). Esto hace imperativo el tratamiento en los casos persistentes y la vigilancia estrecha de los estados no persistentes.
Algunas arritmias pueden relacionarse con anomalías estructurales. Esta frecuencia varía según la serie entre 2% a 5%, son algo más frecuentes en el flutter. La comunicación interventricular y la anomalía de Ebstein, son las más relacionadas. Con menor frecuencia se encuentran lesiones de la válvula pulmonar y aórtica de tipo obstructivas con regurgitación transvalvular aurículo-ventricular. También se reportan tumores cardiacos (6, 7).
La edad gestacional más frecuente al diagnóstico, varía entre 28 a 32 semanas (6). La mortalidad general que se reporta en la revisión de Krapp y colaboradores (6) fue de 8,9% y 8% para taquicardia supraventricular y flutter, respectivamente.
Afortunadamente la mitad de las remisiones por arritmia fetal, se encuentra en ritmo regular al momento de la evaluación.
Los factores más condicionantes para el pronóstico son la presencia de hidrops y las anomalías estructurales cardiacas asociadas. El hidrops fetal no sólo se relaciona con mayor compromiso hemodinámico sino también con menor efectividad de los tratamientos y mayor mortalidad. Alrededor de 38% a 45% de los casos de flutter y taquicardia supraventricular, desarrollan hidrops, y la mortalidad en estas circunstancias varía entre 20% a 60% (6-8).
Novedosas herramientas en el área prenatal, como el Doppler tisular, facilitan el diagnóstico y la clasificación de la arritmia, sin embargo su interpretación aún se basa en fenómenos mecánicos. La magnetocardiografía fetal permite una mayor aproximación electrofisiológica, pero por la exigencia de la prueba, ésta continúa siendo menos práctica en nuestro medio para su aplicación de rutina. Se aleja de la actual revisión una explicación más amplia sobre estas últimas técnicas, por lo cual se remite al lector a recientes publicaciones sobre ese tema (9-11).
Mecanismo de la arritmia
Como ya se mencionó, las arritmias más comunes se producen a través de vías eléctricamente disponibles ubicadas entre la aurícula y el ventrículo como en el caso de la taquicardia aurículo-ventricular reciprocante, o por vías accesorias intra auriculares como en el flutter auricular (12). El 90% de las taquiarritmias supraventriculares ocurre por fenómenos de re-entrada.
La energía se desplaza por la vía de conducción normal hacia nodo AV y de allí a los ventrículos, para luego ascender por la vía accesoria desde el ventrículo hacia la aurícula. Esto se conoce como conducción accesoria de tipo ortodrómico (13). Este mecanismo explica por qué en estos casos existe una relación 1:1 entre las frecuencias auriculares y ventriculares; información útil para diferenciarla de otras taquiarritmias. La frecuencia cardiaca en estos casos se encuentra entre 200 y 300 latidos por minuto. Al activarse la aurícula por la vía accesoria, la cual es más rápida que la vía normal, se producirán tiempos ventrículo-auriculares muy cortos. Estos tiempos se pueden valorar por medio de la ecocardiografía y son útiles para sugerir tanto el mecanismo subyacente como para dirigir el tipo de tratamiento (Figura 1) (13, 14).
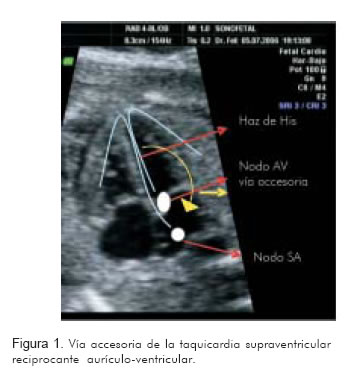
Por otro lado, cuando la dirección de la vía accesoria se conduce al contrario, es decir, desciende despolarizando desde la aurícula al ventrículo, y asciende a la aurícula por el sistema propio Hiz, nodo AV, se conoce como mecanismo de reentrada antidrómica. El fenómeno de pre-excitación utiliza esta vía accesoria y en esta dirección, con activación simultánea de la vía propia sinusal; sin embargo, la vía accesoria presenta una velocidad mayor y no pasa por el lapso de tiempo fisiológico del nodo AV, con la cual se logra muy rápido la activación ventricular, con tiempos atrio-ventriculares muy cortos no diferenciables por ultrasonido (15). Este mecanismo explica el síndrome de Wolff-Parkinson-White, un tipo de taquicardia supraventricular particularmente refractaria a la digoxina e imposible de diferenciar en la actualidad por medio de la ultrasonografía prenatal. En una publicación reciente, en la que Strassburger y colaboradores (16) utilizaron magnetocardiografía como instrumento diagnóstico, encontraron una frecuencia de alrededor de 25% de fenómenos de pre-excitación.
El inicio de este tipo de arritmias se debe, en su mayoría, al estímulo acoplado de una extrasístole supraventricular. Esta alteración del ritmo tiene inicio y final paroxístico, que ocurre de forma espontánea cuando la última reentrada encuentra al sistema de conducción eléctricamente incapaz de conducir el nuevo ciclo (14).
El flutter debe su origen a vías accesorias intra-auriculares (Figura 2) (17). La frecuencia del mismo tiende a ser superior a 300 latidos por minuto por lo que es más frecuente que se halle un ventrículo sin capacidad de responder a la misma frecuencia (18). Aproximadamente, en 83% de los casos la respuesta ventricular es la mitad de la activación auricular 2:1 y a veces con mayor disociación. Sin embargo, la respuesta ventricular 1:1 se presenta en 17% de los casos (6, 19).
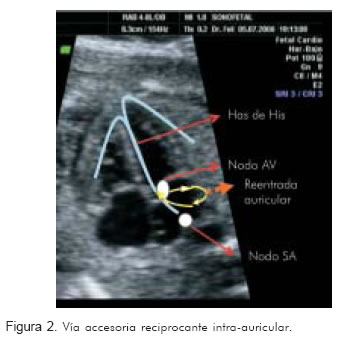
Otras causas de taquicardia supraventricular menos frecuentes en el feto incluyen las ectopias auriculares unifocales o monomórficas y las multifocales, las cuales corresponden a uno o varios focos auriculares que estimulan la vía de conducción y obtienen respuesta ventricular (20). La taquicardia ectópica auricular puede desarrollar hidrops. Pueden tener respuesta ventricular 1:1 o bloqueos aurículo-ventriculares bigeminales, y como se verá más adelante, tiene tiempos ventrículo-atriales prolongados (relación de tiempo ventrículo atrial:atrio ventricular >1).
Aún menos frecuentes son la taquicardia reciprocante permanente de la unión, la taquicardia nodal aurículo-ventricular y la taquicardia ectópica de la unión. Las dos primeras tienen en común un mecanismo de reentrada, mientras que la última se debe a desencadenamientos automáticos. La taquicardia reciprocante permanente de la unión no presenta disociación aurículo-ventricular, relación 1:1, al igual que la taquicardia supraventricular reciprocante. Se diferencian por una frecuencia menor, alrededor de 180 a 250 lpm, y la vía accesoria tiene una dirección antidrómica, lo que se relaciona con tiempos ventrículo-atriales más largos (15, 21).
La taquicardia reciprocante nodal aurículo-ventricular, es todavía menos frecuente. El mecanismo de re-entrada está en el nodo AV, donde coexisten una vía lenta y una rápida, «fisiología dual del nodo AV». La aurícula puede despolarizarse casi de manera simultánea con el ventrículo donde la onda P no se identificaría, se oculta en el tiempo QRS del electrocardiograma; el tiempo ventrículo-atrial sería demasiado corto. Existe una relación 1:1, como en la taquicardia aurículo-ventricular reciprocante. Es una arritmia poco frecuente en el período fetal y aún en la infancia (15, 21).
La taquicardia ectópica de la unión se puede sospechar en casos de frecuencia auricular menor que la ventricular y frente a ritmos alternantes de bradicardias y taquicardias en el mismo feto. La relación de actividad atrio:ventricular es < 1:1 (15).
La precisión diagnóstica del mecanismo de estas arritmias sólo se podrá hacer de manera postnatal por medio de estudios electrofisiológicos.
Fisiopatogenia
Es excepcional que episodios de taquicardia supraventricular cortos o no persistentes y frecuencias del corazón fetal menores de 220 lpm, generen descompensación hemodinámica (22). Por el contrario, en las formas persistentes (23), el ritmo acelerado de respuesta ventricular no permite un llenado ventricular diastólico adecuado, en especial en el corazón fetal, un corazón en el que dicho llenado depende casi exclusivamente de la sístole auricular. Las características propias del miocardio fetal, su menor distensión, un tórax bajo la presión intrauterina y un circuito en paralelo, trasmitirán estas presiones de las cámaras auriculares al sistema venoso pulmonar y sistémico (24).
La disfunción ventricular empeora cuando se desarrolla cardiomiopatía por arritmias. Como consecuencia de las presiones intracavitarias incrementadas persistentemente al final de diástole y por falta de una relajación completa, se genera miocardiopatía con dilatación de las cavidades. Los anillos valvulares se amplían y producen insuficiencia de la válvula tricúspide (25).
La disminución del gasto cardiaco y la alteración de la relación presión/volumen diastólico, pueden disminuir la perfusión coronaria con mayor deterioro de la función miocárdica (26).
La condición puede empeorar aún más cuando existe pre-excitación auricular izquierda. La aurícula derecha se encontrará con un foramen oval parcialmente cerrado lo cual producirá mayor presión venosa sistémica (25).
Otro fenómeno agravante ocurre cuando la contracción de las aurículas encuentra cerradas las válvulas aurículo-ventriculares y se produce mayor incremento de la presión venosa sistémica.
El incremento en la presión hidrostática conlleva congestión sistémica y se genera extravasación de plasma al espacio intersticial. De igual forma, se incrementa la presión en el drenaje linfático disminuyendo su acción sobre el líquido extravasado. Las presiones intrahepáticas afectan su función disminuyendo la producción de proteínas. La distensión auricular y la liberación del péptido natriurético promueven la permeabilidad vascular. Finalmente, se desarrolla hidrops; la placenta se edematiza y el intercambio feto-placentario disminuye, lo cual incluye el paso de medicamentos (27, 28).
Otros efectos adversos que se reportan poco se refieren a lesiones cerebrales de tipo hipóxico aun en casos sin hidrops. Este fenómeno podría deberse a la descompensación hemodinámica en gestaciones muy tempranas (29).
Diagnóstico
En general, estas arritmias se identifican de forma incidental durante la evaluación clínica de la frecuencia cardiaca fetal por medio de fonendoscopio, Doppler manual o monitoreo electrónico.
Para la evaluación se aplican diferentes herramientas ultrasonográficas como la observación con el modo B, el modo M y el Doppler pulsado.
Otras herramientas que aún no se usan de forma general son la magnetocardiografía, las técnicas de aplicación del electrocardiograma fetal y el Doppler tisular. Un registro electrocardiográfico fetal sería ideal para el diagnóstico específico de la arritmia y para el planteamiento de un tratamiento más seguro, sin embargo las dificultades técnicas y el costo de algunos equipos como la magnetocardiografía, demoran la introducción de esta tecnología en nuestro medio (30).
Tratando de llevar un esquema organizado mas no estricto, se propone el siguiente abordaje.
Luego de la identificación de la arritmia se debe hacer una ecocardiografía. En primer lugar, se identifica el tipo de arritmia, en segunda instancia se descartan anomalías estructurales del corazón y luego se evalúa la función cardiaca y se diagnostican signos de descompensación miocárdica. Además, se realiza una evaluación de la anatomía del feto por medio de un ecografista de nivel avanzado (clasificación de la Federación Colombiana de Perinatología - FECOPEN).
Paso 1
Consiste en aplicar el Doppler pulsado a la arteria umbilical. Rápidamente permitirá identificar la frecuencia cardiaca, su ritmo y regularidad. En casos de taquicardia atrio-ventricular reciprocante, se identificará una frecuencia regular entre 200 y 300 lpm. Frecuencias superiores a 300 lpm orientan hacia flutter auricular. Si las ondas son totalmente irregulares y rápidas, la fibrilación auricular podría ser una probabilidad. Si sólo hay ondas anormales ocasionales, seguidas por trayectos amplios de ondas normales, la mayor probabilidad son las extrasístoles (Figuras 3 y 4).
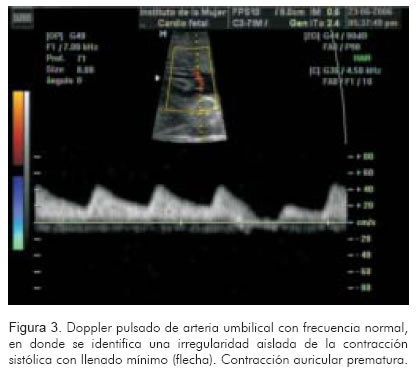
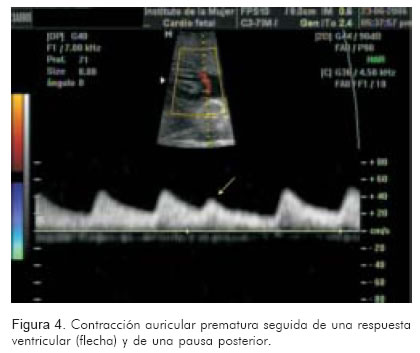
En casos de taquiarritmias con bloqueo, pueden encontrarse frecuencias normales o disminuidas a nivel de la artera umbilical aún en frente de arritmias graves como el flutter; hallazgo propio del bloqueo del nodo AV tipo 2:1 o mayores (15).
Paso 2
Se aplica el modo M o Doppler en el corazón. Ambas herramientas son complementarias. Aplicarlas depende de la familiaridad, la posición fetal y el registro ultrasonográfico.
La aplicación del modo M es una herramienta bastante útil; sin embargo su interpretación presenta dificultades que exigen mayor precisión. Pacientes obsesos, la posición del feto y situaciones de miocardio hipocontráctil como las secundarias a miocardiopatía por arritmias, no facilitan un registro definido y en tales casos se hace difícil su interpretación.
Técnica
Imagen de 4 cámaras
- Aplicar la línea de muestra incluyendo un ventrículo y una aurícula.
- Dar profundidad o zoom a la imagen.
- Modular la velocidad de registro para permitir una imagen amplia sin perder definición.
- Variar las ganancias, la profundidad y el rango dinámico para permitir una mejor visualización (Figuras 5 y 6).
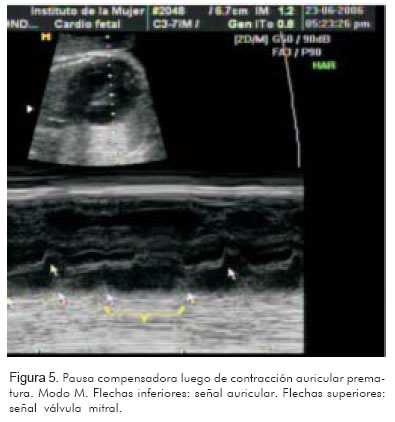
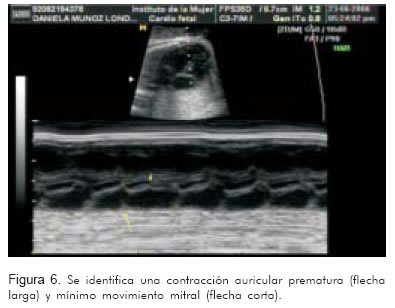
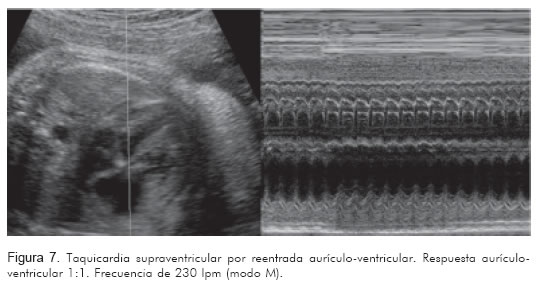
El registro de estas dos cavidades permitirá identificar la actividad mecánica auricular y ventricular de manera simultánea. Si la frecuencia de la aurícula está entre 200 y 300 lpm y va seguida por una contracción ventricular, con relación 1:1, el diagnóstico más probable será taquicardia atrio-ventricular reciprocante (Figura 7).
Si la frecuencia auricular está por encima de 300 lpm, es regular y se asocia con una frecuencia ventricular de 150, el diagnóstico corresponderá a flutter auricular. El bigeminismo es la forma más común de presentación (dos contracciones auriculares por una ventricular) (31).
La fibrilación auricular se caracteriza por una frecuencia superior a 300 lpm, irregular y siempre disociada de la frecuencia ventricular. Aunque el ventrículo puede llevar un ritmo regular, en la mayoría de los casos presenta una frecuencia variable. En la taquicardia ventricular el ventrículo lleva una frecuencia superior y disociada de la aurícula. No obstante, en algunos casos se presenta una respuesta auricular por cada contracción ventricular. Siendo así, no es posible diferenciarlo de una patología supraventricular (12).
Paso 3
Doppler de corazón
Para la evaluación de las arritmias mediante la aplicación del Doppler, se requiere que la muestra registre, de forma simultánea, una estructura que represente la contracción auricular y otra que represente la eyección o contracción ventricular.
Para este fin se han evaluado más comúnmente tres zonas del corazón fetal:
1. Doppler de la vena cava superior/aorta ascendente (Figura 8).
2. Doppler de la vena pulmonar/arteria pulmonar (Figura 9).
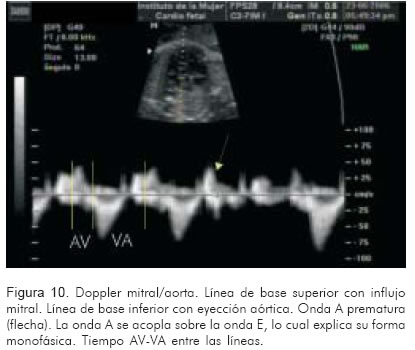
3. Doppler de la válvula mitral (entrada al ventrículo izquierdo)/válvula aórtica (salida del ventrículo izquierdo) (Figura 10).
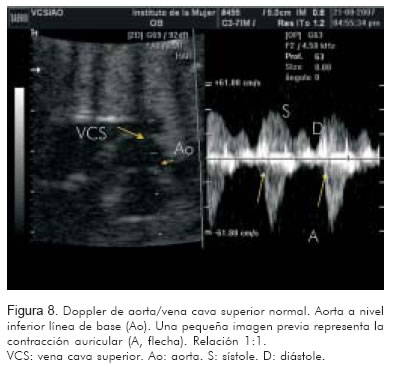
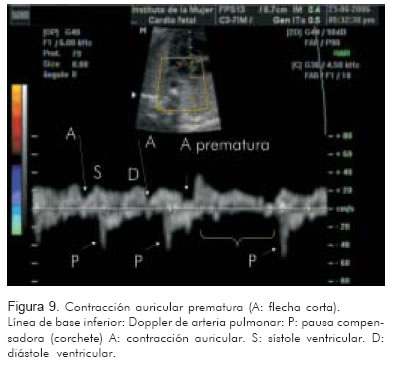
La evaluación de estos vasos permite identificar a un lado de la línea de base la onda trifásica de la vena cava superior o la vena pulmonar, con la onda A como representación de la contracción auricular. A nivel de la válvula mitral, la onda A representará también la contracción auricular. Al otro lado de la línea de base, se identificará la onda propia de la aorta o de la arteria pulmonar como representación de la contracción ventricular.
Identificar una onda A venosa, por cada contracción de la arteria (pulmonar o aorta), corresponde a una relación 1:1 entre aurícula y ventrículo. Relaciones 1:1 con frecuencias entre 200 y 300 sugieren, con alta probabilidad, taquicardia atrio-ventricular reciprocante sin diferenciar entre la forma ortodrómica o antidrómica. La taquicardia nodal aurículo-ventricular puede verse de igual manera; sin embargo es menos frecuente.
Al igual que en el modo M, si esta frecuencia es superior a 300 lpm y específicamente cuando hay bloqueo AV, es decir, dos ondas A por una de eyección ventricular, el diagnóstico más probable es flutter auricular. Un ritmo caótico y rápido en la onda A, con una respuesta ventricular igualmente irregular, explicaría una fibrilación auricular. Encontrar una relación AV menor de 1, es decir, una frecuencia superior en la onda arterial comparada con la frecuencia de la onda A auricular, sugiere taquicardia ventricular o taquicardia ectópica de la unión (Tabla 2) (15).
Con la intención de aproximarse a la fisiopatogenia y finalmente a un tratamiento dirigido más efectivo y con la menor probabilidad de efectos adversos tanto para la madre como para el feto, se han estudiado los tiempos atrio-ventricular (AV) y ventrículo atrial (VA) (Figura 10).
Las vías accesorias son más rápidas que las fisiológicas, por lo tanto el tiempo medido entre la contracción ventricular y la auricular (tiempo ventrículo-atrial) es muy corto cuando la vía accesoria asciende desde el ventrículo hacia la aurícula. Cuando este tiempo está alrededor de 70 milisegundos, o cuando la relación de tiempo VA:AV es < 1, la vía accesoria de tipo ortodrómico, o la forma reciprocante nodal, son las opciones más probables. Tienen buena respuesta a la digoxina, y es el tratamiento de elección (32).
En los casos donde este tiempo es mayor a 70 milisegundos, o que el tiempo ventrículo atrial es prolongado, alrededor de dos veces el tiempo AV, como en los casos de taquicardia antidrómica, o en las formas permanentes de la unión, la digoxina podría prolongar aún más el tiempo en el nodo aurículo-ventricular y disminuir el período refractario de la vía accesoria. En esta situación se podría desencadenar una fibrilación auricular. Se desconoce la frecuencia de este fenómeno, que ya se ha descrito en adultos. En su revisión Kleinman (15) reportó que se podría presentar en aproximadamente 1% durante la infancia o en los fetos. Medicamentos diferentes a la digoxina serían una opción, entre ellos, el propranolol.
Tratamiento
Como se explicó previamente, el tratamiento depende de varios factores:
1. Edad gestacional.
2. Presencia de hidrops.
3. Malformaciones asociadas.
4. Tipo de arritmia.
La decisión de iniciar un tratamiento farmacológico sólo está dada en casos de taquiarritmias persistentes con frecuencias de 220 latidos por minuto o más. En casos intermitentes o con frecuencias inferiores, se hará un seguimiento protocolario y estricto, que puede consistir en una evaluación ecográfica semanal. La definición de taquiarritmia persistente no es precisa entre los autores. Strassburger (23) y colaboradores la definen como aquella que dura al menos doce horas continuas, con algunos períodos de pocos minutos de ritmo normal. La mayoría de los autores todavía la catalogan como aquella que dura al menos la mitad del período de evaluación ecocardiográfica de cuarenta y cinco minutos a una hora. Otros autores no deciden iniciar tratamiento sino hasta el diagnóstico de hidrops (23, 33, 34).
La temprana interrupción de embarazos puede agregar morbilidad. La finalización de la gestación no debe aportar más morbilidad y el parto se indica principalmente por tres razones: embarazo a término, madurez pulmonar comprobada y descompensación hemodinámica fetal (hidrops) refractaria al tratamiento combinado (33, 34).
Aunque la mortalidad fetal por fenómenos proarrítmicos es variable y no ha sido claramente reportada, las muertes súbitas cerca al inicio del tratamiento, probablemente obedecen a esta causa.
El tratamiento combinado ha demostrado ser el más efectivo en casos de hidrops. La digoxina hace parte de este esquema combinado. El medicamento de segunda elección tiene en la actualidad una base menos sólida. Los más usados son: amiodarona, sotalol, flecainida y procainamida (35).
La aplicación directa fetal, principalmente intramuscular, aunque también venosa o intra-amniótica, se ha reservado para ser considerada en prematuros extremos con hidrops y luego de afirmar resistencia al tratamiento transplacentario (36).
En vista de la dificultad de discriminar el mecanismo de las taquiarritmias, la digoxina es el medicamento de elección para todos los casos de taquicardia supraventricular, cuyo uso empírico ha tenido éxito puesto que la mayoría de estas arritmias del feto son taquicardias del tipo de reentradas con tiempos ventrículo-atriales cortos.
Sin embargo algunos autores aconsejan dirigir el tratamiento según el mecanismo electrofisiológico. El ultrasonido actual sólo puede hacer una aproximación mecánica de un evento eléctrico. En estudios previos se mostró la correlación entre estos dos eventos (37, 38).
Un equipo de ultrasonido adecuado con Doppler pulsado, permite lograr una aproximación básica al medir el tiempo ventrículo-atrial tal como se explicó anteriormente (Figura 9). Algunos autores tienen protocolizada la evaluación de estos tiempos antes de iniciar un tratamiento farmacológico. Sin embargo hasta la fecha no hay suficientes estudios que validen un enfoque terapéutico que incluya la evaluación o no de estos tiempos (32).
Fouron y colaboradores (39) evaluaron los resultados perinatales aplicando esta metodología en una muestra pequeña de 18 pacientes. Fetos en el grupo 1 con taquicardia supraventricular con relación 1:1 y tiempos ventrículo-atriales cortos, recibían digoxina. El grupo dos estaba conformado por fetos con tiempos ventrículo-atriales prolongados, y se empezaba sotalol. En los casos de flutter el medicamento inicial era la digoxina. En caso de hidrops el tratamiento combinado, sotalol o adenosina más digoxina. Con este enfoque los resultados fueron bastante aceptables. Hubo una muerte neonatal por cardiomiopatía por arritmia y conversión in útero de nueve casos. Se presentaron dos casos de Wolff-Parkinson-White, que respondieron a la digoxina sin complicaciones.
En otra publicación, Fouron y colaboradores (40) recopilaron nuevamente algunos casos mostrando sus resultados con este enfoque de manejo. En los pocos casos con tiempos ventrículo-atriales prolongados (VA:AV >1), no hubo respuesta a la digoxina ni al sotalol. Pero tampoco presentaron hidrops y la frecuencia cardiaca fetal no fue superior a 220 lpm.
El medicamento con mayor perfil de seguridad, con la más baja frecuencia de mortalidad general por el número de pacientes tratados ha sido la digoxina. La vía ideal de uso para la mayoría de los autores es intravenosa materna. La vía oral tiene una absorción menos constante y más lenta, sin embargo es una ruta socorrida por algunos especialistas específicamente en ausencia de hidrops. Se han publicado varios esquemas. Dosis de carga IV de 0,5 a 1 mg, seguido de 0,25 mg cada 8 horas vía oral de mantenimiento. Otros autores aplican dosis IV entre 0,25-0,5 mg cada 8 horas por dos a tres días, para luego continuar el tratamiento oral. Los esquemas con tratamiento oral inician con 0,25 a 0,5 mg vía oral cada 8 horas. En todos los esquemas se buscan niveles de digoxina sérica materna entre 1,5 a 2,5 ng/mL (34).
En la amplia revisión de Krapp (6) la frecuencia de éxito en el tratamiento de taquicardia supraventricular y flutter sin hidrops, con digoxina como único medicamento fue de 58,5%. En los casos con hidrops fue de 24,6%. En revisiones más recientes, la frecuencia de éxito como único medicamento es superior; 80% a 85% para las taquicardias supraventriculares y de 60% a 65% para flutter (35).
En conclusión, la aplicación empírica de la digoxina ha sido un éxito en vista de que, como se explicó, la mayoría ocurre por mecanismos de reentradas y principalmente son de carácter ortodrómico. Responden adecuadamente a este medicamento. Por el contrario, un grupo minoritario de estas arritmias, taquicardia reciprocante permanente de la unión, taquicardia auricular ectópica y taquicardia ventricular, se caracterizan por mayor resistencia al tratamiento con digoxina.
Amiodarona
Antiarrítmico con actividad clase III principalmente. Contiene yodo, el cual atraviesa la placenta y por tanto puede desarrollar hipotiroidismo fetal. Aunque su paso transplacentario es relativamente bajo, con una relación feto:madre de 0,2-0,4, se reportan algunos efectos adversos como, restricción del crecimiento fetal, parto prematuro y bradicardias (41).
Janette y colaboradores (42) publicaron una revisión de 26 casos de taquicardia supraventricular con hidrops o disfunción miocárdica en fetos menores de 36 semanas, a quienes se les agregó amiodarona luego de considerar refractaria la respuesta a la digoxina. La conversión fue alta en casos de taquicardia supraventricular 14/15; en casos de flutter el resultado fue inferior, 3/9 normalizaron su ritmo. Las otras arritmias, una taquicardia ventricular y un caso de taquicardia ectópica de la unión, respondieron exitosamente. No se presentaron partos prematuros, muertes perinatales ni restricción del crecimiento. Se interrumpió un tratamiento por efecto sobre la gestante, dermatitis por fotosensibilidad y trombocitopenia. Hubo hipotiroidismo en 6/26 neonatos. En cuatro se normalizó sin tratamieto a las dos semanas, uno se perdió del seguimiento y finalmente otro desarrolló hipotiroidismo a los tres meses de edad. No se realizaron pruebas posteriores de neurodesarrollo.
En otra publicación (43) se reportó una incidencia de hipotiroidismo neonatal asociado al uso de la amiodarona de aproximadamente 9%. Los trabajos con mejor seguimiento han informado que este es un efecto bioquímico transitorio (44). Magree y colaboradores, realizaron un seguimiento a once fetos expuestos a la amiodarona. El coeficiente intelectual fue normal; sin embargo, reportaron una disminución en la habilidad del lenguaje. (45) La dosis oral generalmente utilizada varía entre 1.200 a 2.400 mg/día como dosis de carga por dos a siete días, para luego reducir a 400-600 mg/día. Cuando se combina con digoxina, se reduce a la mitad (42).
En conclusión, es un medicamento con alta efectividad en casos de taquiarritmias excepto en el flutter. No hay estudios amplios sobre el neurodesarrollo infantil luego de su exposición a este medicamento. Se considera de segunda línea en arritmias refractarias, para casos de hidrops o disfunción miocárdica.
Flecainida
Es un antiarrítmico clase IC. Enlentece la conducción en la mayoría de las vías cardiacas, incrementa el período refractario y tiene también un efecto inotrópico negativo. Su absorción aún en casos de hidrops es relativamente buena, dándole una gran ventaja en estas situaciones. Su efectividad se ha mostrado en casos de taquicardia supraventricular, al igual que en otras arritmias con tiempos VA:AV>1 (46).
La frecuencia de conversión está alrededor de 80% a 90% en fetos sin hidrops y de aproximadamente 43% a 80% en los casos de hidrops (46). Simpson y su grupo de investigadores (47) aplicaron flecainida como primera elección en fetos con hidrops por taquiarritmia. Cuatro casos con diagnóstico de Flutter. La conversión prenatal se produjo en 16/27 casos. Ebenroth y colaboradores (48) usaron flecainida en trece fetos con taquicardia supraventricular refractaria a la digoxina; doce de trece convirtieron a ritmo sinusal. El otro caso respondió luego de usar amiodarona. En niños ha sido efectivo en controlar este tipo de arritmias, sin embargo su uso en flutter, taquicardias ventriculares y casos asociados a anomalías estructurales del corazón, no es aconsejable. (6, 41, 46).
En conclusión, se considera un medicamento relativamente seguro y efectivo en el tratamiento de las taquiarritmias del feto con y sin hidrops, excepto en flutter. La mayoría de los autores lo ubican como segunda línea en casos refractarios a la digoxina, y como primera línea en fetos con hidrops, en vista de los bajos niveles de digoxina fetal en esta situación (20%-50% de los niveles maternos). La gestante debe vigilarse con electrocardiograma, electrolitos y valoración de niveles de flecainida para mantenerlos idealmente entre 500 y 1.000 mg/L. Las dosis más usadas en las publicaciones varían entre 300 y 400 mg/día, con tratamiento vía oral, como 100 mg cada seis a ocho horas vía oral (49).
Sotalol
Es un betabloqueador con propiedades anti-arrítmicas clase III. Oudijk y colaboradores (50), convirtieron a ritmo sinusal diez de catorce casos de taquicardia supraventricular aplicando sotalol como único medicamento. De los cuatro restantes, dos lograron un ritmo sinusal luego de adicionarles digoxina. El mismo autor evaluó la absorción del sotalol con mediciones en sangre fetal y líquido amniótico. La relación feto:madre es de 1.1. También evaluó los niveles séricos maternos relacionados con el efecto terapéutico siendo de 1,5 mg/L aproximadamente. Convierte entre 40% a 60% de los fetos en casos de taquicardia supraventricular. Su efectividad en flutter es de aproximadamente 80% al combinarse con digoxina. El principal temor al uso de este medicamento es el efecto pro-arrítmico que se reporta en la población pediátrica. La incidencia de este efecto puede ser hasta de 22% en este grupo (51, 52). El mismo autor y su grupo de colaboradores (51), reportaron tres muertes en diez fetos con taquicardia supraventricular tratados con sotalol, las cuales ocurrieron, durante la primera semana de inicio o incremento de la dosis. Sin causa clara, es posible que haya sido por una arritmia fatal. Por esto efectos proarrítmicos relacionados principalmente con taquicardia supraventricular, y la menor efectividad en este grupo, los autores concluyen en sus dos publicaciones que sotalol es recomendable en casos de flutter con o sin hidrops, incluso como primera línea. Recomiendan, además, agregar digoxina en el último caso (41, 50). Es recomendado también en arritmias con tiempo ventrículo-atrial prolongado, en donde se sospeche taquicardia auricular ectópica (53). El medicamento ha sido administrado vía oral a dosis de 80 mg cada doce horas, con incrementos graduales hasta un máximo de 160 mg cada ocho horas. Se prefieren dosis de inicio bajas ya que los efectos pro-arrítmicos se relacionan con las dosis.
Adenosina
Es un nucleósido de la purina con actividad anti-arrítmica muy corta y rápida (34). Disminuye la velocidad de conducción en el nodo AV y puede detener los circuitos de reentrada. Su aplicación es directa sobre el cordón umbilical. La arritmia controlada puede seguirse posteriormente con otro de los medicamentos en mención porque su efecto es transitorio (54, 55). Se usa una dosis de 0,1-0,2 mg/kg de peso fetal estimado. Aunque hay pocos reportes de su uso, no se informan efectos adversos considerables en la gestante o efectos teratogénicos.
Otros medicamentos
Los medicamentos que se reportan a continuación tienen una información menos clara con relación a la baja frecuencia de su uso. La procainamida es un anti-arrítmico clase IA, del que se han obtenido resultados variables. Su metabolito activo, la N-acetil procainamida, tiene propiedades de antiarrítmico clase III. Mulder y colaboradores (56) no encontraron efectividad en cuatro casos de taquicardia supraventricular con hidrops. Otros reportes mostraron una efectividad parcial. Se observó corrección de la arritmia en seis de catorce fetos (57).
El propranolol es un beta bloqueador no selectivo, que incrementa el período refractario en el nodo AV y disminuye el gasto cardiaco y el consumo de oxígeno. Cruza fácilmente la placenta, con relaciones feto:madre de 0,2-1,3. Los principales efectos adversos que se reportan en la gestante son: hipotensión, mareos, debilidad, bradicardia y broncoespasmo. El bajo peso fetal, la restricción del crecimiento y la hipoglicemia son efectos que se reportan en los neonatos expuestos, especialmente luego de exposiciones prolongadas y desde la primera mitad del embarazo. Su seguridad y efectividad reportadas en algunos casos, su uso oral sin necesidad de estudios de laboratorio ni de hospitalización, y su aplicación mientras se logra la atención en centros especializados donde se puedan monitorizar los otros medicamentos aconsejados, son el fundamento para su aplicación. No es recomendable en situaciones con hidrops, en casos refractarios y desde temprana edad gestacional, menor de 24 a 26 semanas (58). Tampoco se recomienda en casos de flutter. La dosis varía entre 120 a 320 mg al día dividido en cuatro dosis.
Medidas generales
En todos los casos se realiza una evaluación interdisciplinaria por cardiología infantil y de adulto, neonatólogo, y obstetra capacitado en el área de medicina materno-fetal.
Se ingresa a la paciente para control inicial intrahospitalario. Se efectúan análisis de función hepática, renal, estudio de electrolitos y electrocardiograma previo al inicio de cualquier anti-arrítmico.
Se hacen evaluaciones diarias del ritmo cardiaco fetal con ecografía. Una vez se controla la arritmia o ésta se reduce a un estado que no afecte la salud del feto, se continúa el control ambulatorio. Inicialmente, se evalúa el ritmo una a dos veces por semana.
Conclusión
Aunque las arritmias cardiacas del feto son patologías poco frecuentes, sus efectos adversos son bastante considerables, y al ser potencialmente tratables, ameritan un mayor estudio y comprensión. Las miocardiopatías y el hidrops son consecuencias asociadas a alta mortalidad y con el uso de los medicamentos se pueden prevenir y controlar. La digoxina es el medicamento de elección por su relativa seguridad y efectividad, sin embargo en casos de hidrops, no lo es tanto, y se obtiene mayor respuesta cuando se combina con otro antiarrítmico. La elección de otro antiarrítmico no se apoya en un suelo tan firme como el de la digoxina. La amiodarona tiene efectos sobre la función tiroidea fetal y aunque la mayoría son autolimitadas, se desconocen los posibles efectos a largo plazo. La procainamida se ha relacionado con pro-arritmias, especialmente en fetos con hidrops. Aunque el sotalol deja dudas en el tratamiento de las taquicardias supraventriculares, en el flutter mostró superior efectividad. La flecainida muestra su mayor efectividad en casos de hidrops. Para disminuir los efectos adversos tanto en la gestante como en el feto, la medición del tiempo ventrículo-auricular por ultrasonido, se convierte en la medida más aproximada que podría dirigir el tratamiento más acertado. Cuenta con un fundamento fisiológico adecuado y podría mostrar resultados favorables. Sin embargo, esta medición no es del todo comparable con el tiempo eléctrico, y además no ha sido estudiada aún en un número relevante de casos en los cuales se traten con esta intención.
Bibliografía
1. Simpson JM, Silverman NH. Diagnosis of cardiac arrhythmias during fetal life. En: Yagel S, Silverman NH, Gembruch U. Fetal cardiology, Martin Dunitz; 2004. p. 333-343. [ Links ]
2. Artman M, Mahony L, Teitel DF. Common arrhythmias. En: Neonatal Cardiology: Mc Graw Hill; 2004. p. 161-189. [ Links ]
3. Van Den Heuvel, Bink-Boelkens MT, Sarvaas GM, Berger RM. Drug management of fetal tachyarrhythmias: are we ready for a systematic and evidence-based approach? PACE 2008; 31: S54-S57. [ Links ]
4. Vergani P, Mariani E, Ciriello E, Locatelli A, et al. Fetal arrhythmias: natural history and management. Ultrasound in Medicine and Biology 2005; 31: 1-6. [ Links ]
5. Kleinman CS. Fetal cardiac therapy. En: Evans MI, Johnson MP, Yaron Y, Drugan A. Prenatal Diagnosis, Mc Graw-Hill; 2006. p. 671-682. [ Links ]
6. Krapp M, Kohl T, Simpson JM, Sharland GK, Katalinic A, Gembruch U. Review of diagnosis, treatment and outcome of fetal atrial flutter compared with supraventricular tachycardia. Heart 2003; 89: 913-917. [ Links ]
7. Buldt T, Eronen M, Andersson S. Long-term outcome in fetuses with cardiac arrhythmias. Obstet Gynecol 2003; 102: 1372-1379. [ Links ]
8. Lisowski LA, Verheijen PM, Benatar AA, et al. Atrial flutter in the perinatal age group: diagnosis, management and outcome. J Am Coll Cardiol 2000; 35: 771-777. [ Links ]
9. Rein AJJ, O´Donell C, Geva T, et al. Use of tissue velocity in the diagnosis of fetal cardiac arrhythmias. Circulation 2002; 106: 1827-1833. [ Links ]
10. Tylor MJ, Smith MJ, Thomas M, et al. Non invasive fetal electrocardiography in singleton and multiple pregnancies. Br J Obstet Gynecol 2003; 110: 668-678. [ Links ]
11. Menendez T, Achembach S, Beinder E, et al. Usefulness of magnetocardiography in singleton and multiple pregnancies. Br J Obstet Gynecol 2008; 110: 668-678. [ Links ]
12. Kleinman CS, Copel JA. Electrophysiological principles and fetal antiarrhythmic therapy. Ultrasound Obstet Gynecol 1991; 1: 286-297. [ Links ]
13. Kothari DS, Skinner JR. Neonatal tachycardias: and update. Arch Dis Child Fetal Neonatal 2006; 91: 136-144. [ Links ]
14. Etienne Delacrétaz. Supraventricular tachycardia. N Eng J Med 2006; 354: 1039-1051. [ Links ]
15. Kleinman CS, Nehgme RA. Cardiac arrhythmias in the human fetus. Pediatr Cardiol 2004; 25: 234-251. [ Links ]
16. Strasburger JF. Prenatal diagnosis of fetal arrhythmias. Clin Perinatol 2005; 32: 891-912. [ Links ]
17. Karpawich PP, Pettersen MD, Gupta P, Shah N. Infants and children with tachycardia: natural history and drug administration. Current Pharmaceutical Design 2008; 14: 743:752. [ Links ]
18. Jaeggi E, Fouron JC, Drblik SP. Fetal atrial flutter: diagnosis, clinical features, treatment, and outcome. J Pediatr 1998; 132: 335-339. [ Links ]
19. Jaeggi E, Nii M. Fetal brady and tachyarrythmias: New and accepted diagnostic and treatment methods. Seminars in Fetal and Neonatal Medicine 2005; 10: 504-514. [ Links ]
20. Calabro MP, Cerrito M, Luzza F, Oreto G. Supraventricular tachycardia in infants: epidemiology and clinical management. Current Pharmaceutical Design 2008; 14: 723-728. [ Links ]
21. Vignati G, Annoni G. Characterization of supraventricular tachycardia in infants: clinical and instrumental diagnosis. Current Pharmaceutical Design 2008; 14: 729-735. [ Links ]
22. Naheed ZJ, Strassburger JF, Deal NJ, Benson W, Gidding S. Fetal tachycardia: mechanisms and predictors of hydrops fetalis. J Am Coll Cardiol 1996; 27: 1736-1740. [ Links ]
23. Strassburger JF, Cheulkar B, Wichman HJ. Perinatal arrhythmias: diagnosis and management. Clin Perinatol 2007; 34: 627-652. [ Links ]
24. Maheshwari S, Copel JA, Kleinman CS. Treatment of fetal arrhythmias. En: Kurjak A, Chervenak FA. Textbook of Perinatal Medicine: Informa; 2006. p. 1166-1176. [ Links ]
25. Gembruch U, Krapp M, Germer U, Baumann P. Venous Doppler in the sonographic surveillance of fetuses with supraventricular tachycardia. Eur J Obstet Gynecol Reproductive Biol 1999; 84: 187-192. [ Links ]
26. Spinale FG, Holzgrefe HH, Mukherjec R, et al. Left ventricle and myocite structure and function after early recovery from tachycardia induced cardiomyopathy. Am J Physiol. Heart Circ Physiol 1995; 268: 836-847. [ Links ]
27. Gembruch U, Holzgreve W. Cardiac diseases in association with hydrops fetalis. En: Yagel S, Silverman NH, Gembruch U. Fetal cardiology, Martin Dunitz; 2004. p. 373-401. [ Links ]
28. Apkon M. Pathophysiology of hydrops fetalis. Semin Perinatol 1995; 19: 437-446. [ Links ]
29. Oudijk MA, Gooskens RHJ, Stoutenbeek P, Vries LS, Visser GHA, Meijbooms EJ. Neurological outcome of children who were treated for fetal tachycardia complicated by hydrops. Ultrasound Obstet Gynecol 2004; 24: 154-158. [ Links ]
30. Martens SM, Rabotti C, Mischi M, Sluijter R. A robust fetal ECG detection method for abdominal recordings. Physiological Measurement 2007; 28: 373-388. [ Links ]
31. Oudijk MA, Visser GHA, Meijboom EJ. Fetal tachyarrhythmia. Part I: Diagnosis. Indian Pacing and Electrophysiology Journal 2004; 4 (3): 104-113. [ Links ]
32. Carvalho JS, Prefumo F, Ciardelli V, Sairam S, Bhide A, Shinebourne EA. Evaluation of fetal arrhythmias from simultaneous pulsed wave Doppler in pulmonary artery and vein. Heart 2007; 93: 1448-1453. [ Links ]
33. Strasburger JF. Fetal arrhythmias. Progress in Pediatric Cardiology 2000; 11: 1-17. [ Links ]
34. Api O, Carvalho JS. Fetal dysrhythmias. Best Practice and Research Clinical Obstetrics and Gynaecology 2008; 22 (1): 31-48. [ Links ]
35. Hornberger L, Sahn DJ. Rhythm abnormalities of the fetus. Heart 2007; 93: 1294-1300. [ Links ]
36. Mongiovi M, Pipitone S. Supraventricular tachycardia in fetus: how can we treat? Current Pharmaceutical Design 2008; 14: 736-742. [ Links ]
37. Glickstein JS, Buyon J, Friedman D. Pulsed Doppler echocardiographic assessment of the fetal PR interval. Am J Cardiol 2000; 86: 236-239. [ Links ]
38. Fouron JC, Proulx F, Miro J, Gosselin J. Doppler and M mode ultrasonography to time fetal atrial and ventricular contractions. Obstetrics and Gynecology 2000; 96: 732:736. [ Links ]
39. Fouron JC, Proulx F, Lamarche J, Bigras JL, Boutin C, Brassard M et al. Management of fetal tachyarrhythmia based on superior vena cava/aorta Doppler flow recordings. Heart 2003; 89: 1211-1216. [ Links ]
40. Fouron JC. Fetal arrhythmias: the Saint-Justine hospital experience. Prenatal Diagnosis 2004; 24: 1068-1080. [ Links ]
41. Oudijk MA, Visser GHA, Meijboom EJ. Fetal tachyarrhythmia. Part II: Treatment. Indian Pacing and Electrophysiology Journal 2004; 4 (4): 185-194. [ Links ]
42. Strassburger JF, Cuneo BF, Michon MM, et al. Amiodarona therapy for drug-refractory fetal tachycardia. Circulation 2004; 109: 375-379. [ Links ]
43. Chow T, Galvin J, McGovern B. Antiarrhythmic drug therapy in pregnancy and lactation. Am J Cardiol 1998; 82: 58I-62I. [ Links ]
44. Jouannic JM, Delahaye S, Fermont L, et al. Fetal supraventricular tachycardia: a role for amiodarona as second-line therapy? Prenat Diagn 2003; 23 (2): 152-156. [ Links ]
45. Magree LA, Nulman I, Ravert JF, Karen G. Neurodevelopment after in uter amiodarona exposure. Neurotoxicol Teratol 1999; 21: 261-265. [ Links ]
46. Krapp M, Baschat AA, Gembruch U, Geipel A, Germer U. Flecainide in the intrauterine treatment of fetal supraventricular tachycardia. Ultrasound Obstet Gynecol 2002; 19: 158-164. [ Links ]
47. Simpson JM, Sharland GK. Fetal tachycardias: management and outcome of 127 consecutive cases. Heart 1998; 79: 576-581. [ Links ]
48. Ebenroth ES, Cordes TM, Darragh RK. Second-line treatment of fetal supraventricular tachycardia using flecainida acetate. Pediatr Cardiol 2001; 22: 483-487. [ Links ]
49. Kleinman CS, Copel JA, Nehgme R. The fetus with cardiac arrhythmia. In: Harrison MR, Evans MI, Adzick NS, Holzgreve W. The Unborn Patient: the Art and Science of fetal Therapy. Philadelphia: Saunders; 2001. p. 417-441. [ Links ]
50. Oudijk MA, Ruskamp JM, Ververs FF,et al. Treatment of fetal tachycardia with sotalol: transplacental pharmacokinetics and pharmacodynamics. J Am Coll Cardiol 2003; 42: 765-770. [ Links ]
51. Oudijk MA, Michon MM; Kleinman CS, et al. Sotalol in the treatment of fetal dysrhythmias. Circulation 2000; 101: 2721-2726. [ Links ]
52. Pfmmatter JP, Paul T. New antiarrhythmic drug in pediatric use: sotalol. Pediatr Cardiol 1997; 18: 28-34. [ Links ]
53. Jaeggi E, Fouron JC, Fournier A, van Doesburg N, Drblik SP, Proulx F. Ventriculo-atrial time interval measured on M mode echocardiography: a determining element in diagnosis, treatment, and prognosis of fetal supraventricular tachycardia. Heart 1998; 79: 582-587. [ Links ]
54. Kohl T, Tercanli S, Kececioglu D, Holzgreve W. Direct fetal administration of adenosine for the termination of incessant supraventricular tachycardia. Obstet Gynecol 1995; 85: 873-874. [ Links ]
55. Ito S, Magee L, Smallhorn J. Drug therapy for fetal arrhythmias. Clin Perinatol 1994; 21: 543-572. [ Links ]
56. Frohn-Mulder IM, Stewart PA, Witsenburg M, Den Hollander NS, Wladimiroff JW, Hess J. The efficacy of flecainide versus digoxin in the management of fetal supraventricular. Prenat Diag 1995; 15: 1297-1302. [ Links ]
57. Oudijk MA, Ruskamp JM, Ambachtsheer BE, et al. Drug treatment of fetal tachycardias. Pediatr Drugs 2002; 4: 49-63. [ Links ]
58. Jaramillo JF. Propranolol, una alternativa para la taquicardia supraventricular del feto. Rev Colomb Cardiol 2007; 12: 117-120. [ Links ]














