Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.2 Bogota Apr./June 2009
Departamento de Electrofisiología y Estimulación Cardiaca, Fundación Clínica Abood Shaio, Bogotá, DC., Colombia.
Correspondencia: Dr. Alejandro Velasco. Fundación Clínica Abood Shaio. Bogotá, DC., Colombia. Diagonal 115A No. 70C-75. Teléfono: 57-1-2717064. Correo electrónico: alejovela@hotmail.com
Recibido: 20/10/2008. Aceptado: 25/03/2009.
La taquicardia ventricular polimórfica catecolaminérgica es una entidad de reciente descripción gracias a los avances diagnósticos en genética y electrofisiología. Consiste en una patología hereditaria que se caracteriza por la inducción de taquicardia ventricular bidireccional en la presencia de catecolaminas sin una anormalidad estructural cardiaca de base. Mutaciones en el gen RyR2 del receptor de rianodina se han identificado como responsables por la forma hereditaria autosómica dominante, mientras que mutaciones en el gen de la calsecuestrina CASQ2 se relacionan con formas autosómicas recesivas. La edad media de inicio es entre los siete y los nueve años de edad, y sus implicaciones clínicas van desde síncope hasta muerte súbita. Su diagnóstico se confirma documentando la inducción de taquicardias ventriculares con una prueba de esfuerzo o durante una infusión de agentes simpaticomiméticos como isoproterenol, apoyado con la codificación de los genes RyR2 o CASQ2. El manejo farmacológico con anti-arrítmicos aun no ha demostrado eficacia por lo que la implantación de cardiodesfibriladores se mantiene como una opción válida. Para casos especiales una alternativa es la denervación simpática cardiaca. Esta entidad abre un campo en la investigación de nuevos medicamentos antiarrítmicos y de la posible utilización de la terapia génica en electrofisiología.
Palabras clave: taquicardia ventricular polimórfica, muerte súbita, genética, arritmias.
Catecholaminergic Polymorphic Ventricular Tachycardia is an inherited heart rhythm disorder recently discovered by genetic and electrophysiological diagnostic advancements. It consists of an inherited disorder characterized by the induction of bi-directional ventricular tachycardia in the presence of catecholamines, without a structural cardiac abnormality. Mutations in the Ryanodine receptor gene RyR2, have been linked with an autosomic dominant form, while mutations in the Calsequestrin gene CASQ 2 have showed correlation with an autosomic recessive form. The average age of onset is between 7 and 9 years of age, and clinical symptoms vary from syncope to sudden cardiac death. The diagnosis is confirmed by inducting ventricular tachycardia through a stress test or during an infusion of sympathicomimetic drugs like Isoproterenol, aided by the identification of mutations in the RyR2 and CASQ2 genes through gene analysis. Implantable cardiodefibrillator devices remain a valid therapeutic option in many cases due to the fact that antiarrhythmic drugs have not shown efficacy. Sympathetic cardiac denervation can be useful in some special cases. Catecholaminergic Polymorphic Ventricular Tachycardia opens a wide field for the development of new antiarrhythmic drugs and the use of gene therapy for cardiac rhythm disorders.
Key words: polymorphic ventricular tachycardia, sudden cardiac death, genetic.
Introducción
La taquicardia ventricular polimórfica catecolaminérgica, se define como un desorden hereditario que se caracteriza por la inducción de taquicardias ventriculares bidireccionales, en la presencia de catecolaminas, sin una anormalidad estructural cardiaca de base (1). Su prevalencia se estima en 1:10.000 personas y en ciertos casos puede llevar a síncope y muerte súbita (1). Es una entidad relativamente nueva, descrita por primera vez por Reid en 1975 en una niña de seis años y posteriormente en series de casos por Coumel en 1978 y Leenhart en 1995 (2-4). Sin embargo, no fue sino hasta el año 2001 cuando Priori y Lahat (5, 6) descubrieron respectivamente mutaciones en el gen RyR2 del receptor de rianodina y en el gen de la calsecuestrina cardiaca CASQ2 que se relacionaban con formas hereditarias autosómicas dominantes y recesivas de esta patología (7). Conforma, junto con otras entidades como el síndrome de Brugada, el de intervalo QT largo y el de QT corto, las patologías genéticas causantes de taquicardia y fibrilación ventricular.
Bases genéticas y moleculares
Existen tres tipos de receptores de rianodina: el tipo 1 se encuentra en el músculo esquelético, el 2 en el tejido cardiaco y el 3 en el cerebro. El RyR2 o receptor de rianodina tipo 2, está compuesto por 4.967 amino-ácidos y su gen se localiza en el cromosoma 1 (1q42-q43) (8, 9). El canal RyR2 (receptor de rianodina tipo2) está acoplado a los canales de calcio tipo L en el retículo sarcoplasmático del miocito y es responsable de la liberación de calcio mediada por calcio esencial para la contracción cardiaca (10).
En el receptor RyR2 se han caracterizado más de 70 mutaciones, la mayoría en la región carboxiterminal ligada a la proteína reguladora FKBP12.6 (8). Estudios in vitro concluyen que la mutación lleva a una actividad aumentada en reposo e incremento de la sensibilidad del canal a estimulantes como la cafeína y a probabilidad de apertura espontánea del canal, lo cual lleva a una sobrecarga de calcio intracelular (11). Otra teoría es la salida espontánea de calcio del retículo sarcoplasmástico debido a una inestabilidad del receptor RyR2 (12).
Todo esto lleva a un estado de acumulación de calcio intracelular que facilita la arritmogénesis por post-despolarizaciones tardías en la presencia de estimulación catecolaminérgica (8). Se ha observado que algunas mutaciones se asocian con el sitio de unión de la proteína FKBP12.6, encargada de regular la función del receptor RyR2, y por esta misma razón son objeto de investigaciones para el tratamiento de la taquicardia ventricular polimórfica catecolaminérgica (13, 14).
El gen CASQ2 se encuentra en el cromosoma 1 (1p13- p21)(13) ligado a la proteína calsecuestrina, encargada de la recaptación de calcio dentro del retículo sarcoplasmástico durante la diástole (8). Mutaciones muestran defectos en la recaptación del calcio e interferencia en el proceso de contracción miocárdica y en la salida espontánea de calcio a través del retículo sarcoplasmástico (15, 16), lo cual aumenta el riesgo de postdespolarizaciones tardías.
Electrofisiología
El patrón electrofisiológico de la taquicardia ventricular polimórfica catecolaminérgica, se asemeja a las taquicardias inducidas por postdespolarizaciones tardías cuando hay aumento del calcio intracelular e intoxicación digitálica (7). Mientras la presentación clínica de este tipo de taquicardia es similar a la de otros síndromes como el de intervalo QT largo, la morfología de la taquicardia es diferente debido a que en el síndrome de intervalo QT largo ocurre una taquicardia polimórfica tipo Torsades des pointes, mientras que en la taquicardia ventricular polimórfica catecolaminérgica ocurre una taquicardia bidireccional en la que entre latido y latido el QRS sufre una rotación de 180° (8). La frecuencia de la taquicardia es más rápida y el intervalo de acoplamiento más corto que en otros tipos de taquicardia bidireccional más lenta como la descrita en el síndrome de Andersen-Tawil, caracterizado por prolongación del intervalo QT, ondas U prominentes y fenotipo extracardiaco (dismorfismo facial y parálisis periódica) (Figura 1).
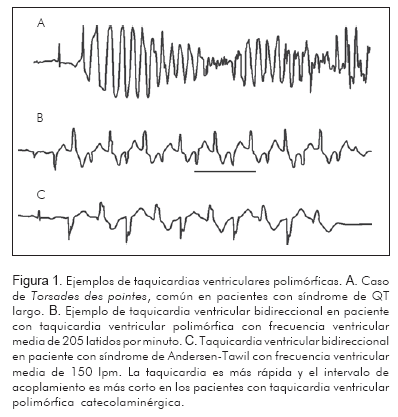
Se cree que los pacientes con la variedad del gen CASQ2 tienen leve prolongación del intervalo QT y muchas veces desarrollan taquicardias polimórficas no bidireccionales.
La susceptibilidad de estas arritmias a ser generadas por catecolaminas, se demostró en ratones infectados por adenovirus que expresan CASQ2 mutantes (15, 16). Mutaciones en el receptor RyR2 indicaron aumento de la susceptibilidad para generar arritmias ventriculares bidireccionales en ratones, con la administración de cafeína y epinefrina (17).
Clínica
Los pacientes con taquicardia ventricular polimórfica catecolaminérgica desarrollan síncope causado por ejercicio o tensión emocional, y en algunos casos su forma de presentación es la muerte súbita, en situaciones que van desde tomar el bus hasta realizar ejercicio intenso (18, 19). En la figura 2 se observa una taquicardia ventricular polimórfica inducida por el ejercicio durante una prueba de esfuerzo.
La edad promedio para la aparición de esta enfermedad oscila entre los siete y nueve años, sin embargo, un estudio de cohorte en 119 pacientes mostró que sólo 20% de éstos están libres de taquicardia, síncope o muerte súbita a los 40 años de edad (18). Otro 30% tienen historia familiar positiva de muerte súbita antes de los 40 años (19). Dada la temprana edad de presentación, muchos niños reciben el diagnóstico erróneo de síncope vasovagal, y así se retarda el manejo de una patología con muy alta letalidad (18, 19).
Diagnóstico
El electrocardiograma en reposo es normal excepto por casos aislados de bradicardia sinusal. El ecocardiograma no muestra alteraciones estructurales (20). El test de Holter puede identificar taquicardia bidireccional en algunos casos en los que el paciente sufre alguna descarga adrenérgica durante la monitoría electrocardiográfica. Para confirmar el diagnóstico se reproduce la taquicardia en un ambiente clínicamente controlado como una prueba de esfuerzo o un estudio electrofisiológico. En la prueba de esfuerzo, la actividad ectópica aparece cuando la frecuencia cardiaca está entre 110-120 latidos por minuto; si el ejercicio continúa la ectopia se convierte en taquicardia bidireccional, luego degenera en taquicardia polimórfica y eventualmente en fibrilación ventricular. Las taquicardias supraventriculares son comunes durante la prueba de esfuerzo (18, 21). En el estudio electrofisiológico invasivo se realiza estimulación cardiaca programada convencional y con isoproterenol. Priori y colaboradores (19) mostraron que sólo 11% de los pacientes desarrollan taquicardia ventricular con estimulación cardiaca programada, mientras 31% responden a infusión de isoproterenol. Sin embargo, Sumitomo y colaboradores (22) en un estudio con 29 pacientes con taquicardia ventricular polimórfica catecolaminérgica, observaron que en 100% de los casos la prueba de ejercicio fue positiva para la inducción de taquicardia, en 75% fue positiva la infusión de isoproterenol y ninguno de los pacientes desarrolló taquicardia con estimulación cardiaca programada.
De 50% a 70% de los pacientes con taquicardia ventricular polimórfica catecolaminérgica presentan una mutación en el gen RyR2 (19). La codificación es larga y dispendiosa debido a que es un gen de gran tamaño y es necesaria su codificación entera para tener una buena sensibilidad (23). La caracterización del gen CASQ2 se recomienda en pacientes con una forma autosómica recesiva y en casos esporádicos de taquicardia ventricular o fibrilación ventricular en donde no se han comprobado mutaciones en el gen RyR2 (24). Encontrar consanguinidad en la historia familiar orienta más hacia el gen CASQ2 dada su herencia autosómica recesiva.
Tratamiento
La terapia con betabloqueadores ha sido la primera opción terapéutica debido a la fisiopatología de esta entidad (7). Se utiliza nadolol (1-2 mg /kg/día) y propanolol (2,5-3,5 mg/kg/dL), buscando siempre la dosis más alta de beta-bloqueador que tolere el paciente (7). Sin embargo, la eficacia de los beta-bloqueadores aún no se ha demostrado. Priori y colaboradores (21) mostraron que sólo en 18 de 39 pacientes la terapia evitó nuevos episodios de taquicardia y en los demás, a doce de ellos se les implantó un cardiodesfibrilador y seis recibieron descargas eléctricas a pesar de los beta-bloqueadores. Otro estudio con 28 pacientes mostró que sólo 39% de los casos pudieron controlarse con beta-bloqueadores (22). El verapamilo también se emplea para el tratamiento de taquicardia ventricular polimórfica catecolaminérgica e incluso un estudio en cinco pacientes mostró que el uso de beta-bloqueadores más calcio-antagonistas, redujo el número de extrasístoles durante el ejercicio en comparación con beta-bloqueadores como monoterapia (25). El cardiodesfibrilador implantable se indica en la prevención secundaria de muerte súbita (Clase I, evidencia C) y en pacientes sintomáticos a pesar de la farmacoterapia (Clase IIa, evidencia C) (26). Una opción interesante es la denervación simpática cardiaca. Ésta se realiza por medio de una incisión en la base izquierda del cuello, para así, de manera extrapleural, cauterizar la parte inferior del ganglio estrellado junto con el segundo, tercero y cuarto ganglio torácico del lado izquierdo. El lado superior del ganglio estrellado se preserva para prevenir el síndrome de Horner. En un reporte de casos del New England Journal of Medicine, en tres pacientes sintomáticos con beta-bloqueador más cardiodesfibrilador implantable, después del procedimiento se observó que el primer paciente no volvió a sufrir descargas eléctricas; el segundo permaneció asintomático aunque se indujo taquicardia con una carga elevada de ejercicio, y el último presentó nuevamente taquicardias ventriculares con una carga mucho más alta de ejercicio (27). Dada la pobre efectividad de los beta-bloqueadores y el efecto de proarrítmico que tienen los desfibriladores en niños debido al miedo y liberación de catecolaminas que producen al dar una descarga eléctrica, la simpatectomía cardiaca aumenta en importancia como opción para el tratamiento de la taquicardia polimórfica ventricular catecolaminérgica.
Conclusiones
Es recomendable conocer y sospechar de esta rara enfermedad debido a su alta letalidad. El análisis genético es una herramienta muy importante para diferenciarla de otras patologías benignas; sin embargo, la caracterización del gen RyR2 es costosa (18) y no está disponible en nuestro medio. Se precisan más estudios para evaluar la efectividad de los beta-bloqueadores e incluso el desarrollo de nuevos fármacos dirigidos al receptor de rianodina, al receptor de calsecuestrina o a sus proteínas reguladoras. Además, en un futuro, en este tipo de taquicardia la terapia génica puede mostrar resultados importantes. El cardiodesfibrilador implantable se indica en la prevención secundaria de muerte súbita, aunque por su posible arritmogenicidad, la denervación simpática cardiaca se convierte en una alternativa interesante.
Bibliografía
1. Marks A, Priori S, Memmi M, et al. Involvement of the cardiac ryanodine receptor/calcium release channel in catecholaminergic polymorphic ventricular tachycardia J Cell Physiol 2002; 190: 1-6. [ Links ]
2. Reid DS, Tynan M, Braidwood L, et al. Bidirectional tachycardia in a child. A study using His bundle electrography. Br Heart J 1975; 37: 339-344. [ Links ]
3. Coumel P, Fidelle J, Lucet V, et al. Catecholamine induced severe ventricular arrhythmias with Adams-Stokes syndrome in children: report of four cases. Br Heart J 1978; 40 (Suppl): 28-37. [ Links ]
4. Leenhardt A, Lucet V, Denjoy I, et al. Catecholaminergic polymorphic ventricular tachycardia in children. A 7-year follow-up of 21 patients. Circulation 1995; 91: 1512-1519. [ Links ]
5. Priori SG, Napolitano C, Tiso N, et al. Mutations in the cardiac ryanodine receptor gene (hRyR2) underlie catecholaminergic polymorphic ventricular tachycardia. Circulation 2001; 103: 196-200. [ Links ]
6. Lahat H, Pras E, Olender T, et al. A missense mutation in a highly conserved region of CASQ2 is associated with autosomal recessive catecholamine-induced polymorphic ventricular tachycardia in Bedouin families from Israel. Am J Hum Genet 2001; 69: 1378-1384. [ Links ]
7. Nian L, Ruan Y, Priori S. Catecholaminergic polymorphic ventricular tachycardia. Prog Cardiovasc Dis 2008; 51 (1): 23-30. [ Links ]
8. Mohamed U, Napolitano C, Priori S. Molecular and electrophysiological bases of catecholaminergic polymorphic ventricular tachycardia. J Cardiovasc Electrophysiol 2007; 18 (7): 791-797. [ Links ]
9. Otsu K, Fujii J, Periasamy M et al. Chromosome mapping of five human cardiac and skeletal muscle sarcoplasmic reticulum protein genes. Genomics 1993; 17: 507-509. [ Links ]
10. Stokes DL, Wagenknecht T. Calcium transport across the sarcoplasmic reticulum: Structure and function of Ca2+-ATPase and the ryanodine receptor. Eur J Biochem 2000; 267: 5274-5279. [ Links ]
11. Wehrens XH, Lehnart SE, Huang F, et al. FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exercise-induced sudden cardiac death. Cell 2003; 113: 829-840. [ Links ]
12. Jiang D, Wang R, Xiao B, et al. Enhanced store overload-induced Ca2+ release and channel sensitivity to luminal Ca2+ activation are common defects of RyR2 mutations linked to ventricular tachycardia and sudden death. Circ Res 2005; 97: 1173-1181. [ Links ]
13. Wehrens XH, Lehnart SE, Reiken S, et al. Enhancing calstabin binding to ryanodine receptors improves cardiac and skeletal muscle function in heart failure. Proc Natl Acad Sci USA 2005; 102: 9607-9612. [ Links ]
14. Wehrens XH, Lehnart SE, Reiken SR, et al. Protection from cardiac arrhythmia through ryanodine receptor-stabilizing protein calstabin2. Science 2004; 304: 292-296. [ Links ]
15. Viatchenko-Karpinski S, Terentyev D, Gyorke I, et al. Abnormal calcium signaling and sudden cardiac death associated with mutation of calsequestrin. Circ Res 2004; 94: 471-477. [ Links ]
16. Terentyev D, Nori A, Santoro M, et al. Abnormal interactions of calsequestrin with the ryanodine receptor calcium release channel complex linked to exercise-induced sudden cardiac death. Circ Res 2006; 98: 1151-1158. [ Links ]
17. Cerrone M, Napolitano C, Priori SG et al. Bidirectional ventricular tachycardia and fibrillation elicited in a knock-in mouse model carrier of a mutation in the cardiac ryanodine receptor (RyR2). Circ Res 2005; 96: e77-e82. [ Links ]
18. Napolitano C, Priori SG Diagnosis and treatment of catecholaminergic polymorphic ventricular tachycardia. Heart Rhythm 2007; 4 (5): 675-678. [ Links ]
19. Priori SG, Napolitano C, Memmi M, et al. Clinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia. Circulation 2002; 106: 69-74. [ Links ]
20. Postma AV, Denjoy I, Kamblock J, et al. Catecholaminergic polymorphic ventricular tachycardia: RYR2 mutations, bradycardia, and follow up of the patients. J Med Genet 2005; 42: 863-870. [ Links ]
21. Cerrone M, Colombi B, Bloise R, et al. Clinical and molecular characterization of a large cohort of patients affected with catecholaminergic polymorphic ventricular tachycardia. Circulation 2004; 110 (Suppl II): 552. [ Links ]
22. Sumitomo N, Harada K, Nagashima M, et al. Catecholaminergic polymorphic ventricular tachycardia: electrocardiographic characteristics and optimal therapeutic strategies to prevent sudden death. Heart 2003; 89: 66-70. [ Links ]
23. Tester DJ, Makielski JC, Ackerman MJ, et al. Genotypic heterogeneity and phenotypic mimicry among unrelated patients referred for catecholaminergic polymorphic ventricular tachycardia genetic testing. Heart Rhythm 2006; 3: 800-805. [ Links ]
24. Raffale di Barletta M, Viatchenko-Karpinski S, Nori A, et al. Clinical phenotype and functional characterization of CASQ2 mutations associated with catecholaminergic polymorphic ventricular tachycardia. Circulation 2006; 114: 1012-1019. [ Links ]
25 . Rosso R, Kalman JM, Rogowski O, et al. Calcium channel blockers and beta blockers versus betablockers alone for preventing exercise-induced arrhythmias in catecholaminergic polymorphic ventricular tachycardia. Heart Rhythm 2007; 4: 1149-1154. [ Links ]
26. Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eurospace 2006; 8: 746-837. [ Links ]
27. Wilde AA, Bhuiyan ZA, Crotti L, et al. Left cardiac sympathetic denervation for catecholaminergic polymorphic ventricular tachycardia. N Engl J Med 2008; 358: 2024-9. [ Links ]














