Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.2 Bogota Apr./June 2009
Clínica Cardiovascular Santa María, Medellín, Colombia.
Correspondencia: Dr. Miguel Ruz, Clínica Cardiovascular Santa María, Calle 78B No. 75-21, Medellín, Colombia. Correo electrónico: miguelruzm@yahoo.es
Recibido: 24/07/08. Aceptado: 25/09/08.
Introducción: el síndrome de ventrículo izquierdo hipoplásico, es una cardiopatía congénita compleja que requiere corrección quirúrgica en los primeros días de vida. El tratamiento es paliativo y el procedimiento de Norwood es la primera cirugía que se realiza. En esta intervención el ventrículo derecho es sistémico y la circulación pulmonar ocurre a través de una fístula sistémica-pulmonar o ventrículo-pulmonar.
Objetivo: comunicar nuestra experiencia con la cirugía de Norwood en el tratamiento de los pacientes con diagnóstico de síndrome de ventrículo izquierdo hipoplásico.
Métodos: estudio retrospectivo, observacional y descriptivo, en el cual se incluyen pacientes que ingresaron con diagnóstico de síndrome de ventrículo izquierdo hipoplásico y se llevaron a cirugía tipo Norwood entre diciembre de 2001 y octubre de 2007. Se clasificaron en dos grupos de acuerdo con el tipo de técnica utilizada; grupo I: fístula Blalock-Taussig, grupo II: conducto entre el ventrículo derecho y la arteria pulmonar.
Resultados: se incluyeron 32 pacientes; 12 (37,5%) pertenecieron al grupo I y 20 (62,5%) al II. La distribución por géneros fue de 19 hombres (59,4%) y 13 mujeres (40,6%). El promedio de días de vida al momento de la cirugía, fue de 14,7. Se detectaron 14 (43,7%) pacientes con atresia aórtica y mitral. El promedio de tiempo en circulación extracorpórea fue de 192 minutos, con un rango de 95 a 310 minutos y la media de paro circulatorio fue de 60 minutos. El promedio de horas de ventilación mecánica fue de 153 y el cierre esternal se realizó en promedio a las 56 horas. La mortalidad en el grupo I fue de 83% y en el II de 50%, para una mortalidad global de 62% hasta 2006; para 2007 la mortalidad fue de 0%.
Conclusiones: los avances actuales en técnicas de diagnóstico prenatal, tratamiento médico, intervención hemodinámica y técnicas quirúrgicas son prometedoras para mejorar la sobrevida de estos pacientes. En la actualidad se cuenta con tres opciones de manejo: transplante cardiaco, cirugía de Norwood (implementada en nuestro servicio con un aumento en la tasa de supervivencia en el último año) y procedimiento híbrido como alternativa en pacientes con factores de alto riesgo para cirugía de Norwood I.
Palabras clave: síndrome de ventrículo izquierdo hipoplásico, Norwood, circulación extracorpórea, técnica Sano.
Introduction: hypoplastic left heart syndrome is a complex congenital heart disease that requires surgical correction during the first days of life. Treatment is paliative and Norwood's operation is the first surgery to be performed. In this intervention the right ventricle is systemic and the pulmonary circulation occurs through a systemic-to-pulmonary or ventricle-to-pulmonary fistula.
Objective: inform our experience with Norwood's operation in patients diagnosed with hyoplastic left heart syndrome.
Methods: retrospective, observational and descriptive study. 32 patients admitted with diagnosis of hypoplastic left heart syndrome were included. They underwent Norwood surgery between December 2001 and October 2007. Patients were classified into two groups according to the type of technique used. Group I: Blalock-Taussig fistula and group II: fistula between the right ventricle and the pulmonary artery.
Results: 32 patients were included; 12 (37.5%) belonged to group I and 20 (62.5%) to group II. 19 (59.4%) were men and 13 (40.6%) were women. Mean days of life at the time of surgery was 14.7 days. 14 (43.7%) patients had mitral-aortic atresia. Mean extracorporeal circulation time was 192 minutes with a range of 95 to 310 min and the mean time for the circulatory stop was 60 min. The average of mechanical ventilation was 153 hours and the sternal closure was realized at a media of 56 hours. Mortality in group I was 83% and in group II 50%, for an overall mortality of 62% until 2006; for 2007, mortality was 0%.
Conclusions: current advances in prenatal diagnostic techniques, medical treatment, hemodynamic intervention and surgical techniques are promising for improving the survival of these patients. Nowadays we rely on three management options: cardiac transplant, Norwood operation (implemented in our service with an increased survival rate in the last year) and a hybrid procedure as alternative for patients at high risk for Norwood I surgery.
Key Words: hypoplastic left heart syndrome, Norwood, extracorporeal circulation, Sano technique.
Introducción
En el síndrome de ventrículo izquierdo hipoplásico se agrupan una serie de malformaciones congénitas que tienen como denominador común las lesiones obstructivas en el lado izquierdo del corazón y comparten una característica básica: la hipoplasia del ventrículo izquierdo.
Esta alteración fue descrita por primera vez en 1952 por Lev, y el término fue acuñado por Noonan y Nadas en 1958.
Su incidencia es de 0,05 a 0,25 por 1.000 recién nacidos vivos con un ligero predominio en el género masculino, y representa 1,5% de todas las cardiopatías congénitas. Se asocia a malformaciones extracardiacas en aproximadamente 10% de los pacientes. La posibilidad de recurrencia en hermanos es de 0,5% para síndrome de ventrículo izquierdo hipoplásico en relación con 2,2% para todos los tipos de anomalías congénitas del corazón. Se ha descrito en asociación con alteraciones genéticas o cromosómicas como: Turner, Holt-Oram, Noonan, trisomía 13-18, entre otras. Dada la severidad de esta malformación cerca de 95% de los pacientes fallece antes del primer mes de vida; se calcula que es responsable de 10% de las muertes por cardiopatía en el período neonatal.
El tratamiento es de carácter paliativo y el procedimiento de Norwood es la primera cirugía que se realiza. En ésta se logra que el ventrículo derecho funcione como ventrículo sistémico y se brinda circulación pulmonar a través de una fístula sistémica-pulmonar o ventrículo-pulmonar según sea la técnica a utilizar (1, 8, 14).
Las principales desventajas de esta técnica quirúrgica consisten en la inestabilidad hemodinámica que la misma conlleva, dado el cambio en la fisiología que se da a los circuitos tanto sistémico como pulmonar (2, 3).
Las primeras intervenciones se llevaron a cabo con la técnica que hoy se conoce como clásica, en donde el flujo sanguíneo pulmonar era dado por una fístula sistémico-pulmonar tipo Blalock-Taussig. Fue hasta 2003, cuando el doctor Shunji Sano introdujo la modificación de la técnica, la cual consistía en la sustitución de la fístula por un tubo no valvulado entre el ventrículo derecho y la arteria pulmonar (4, 7).
El objetivo de este trabajo es mostrar nuestra experiencia en el tratamiento del síndrome del ventrículo izquierdo hipoplásico.
Método
Tipo de estudio
Estudio de corte transversal en pacientes con síndrome de ventrículo izquierdo hipoplásico desde diciembre 2001 a septiembre de 2007.
Población
Se incluyeron 32 pacientes con diagnóstico de síndrome de ventrículo izquierdo hipoplásico que se sometieron a intervención en la Institución.
Se clasificaron en dos grupos; grupo: I 12 pacientes operados con fístula Blalock-Taussig y grupo II: 20 pacientes con fístula del ventrículo derecho a la arteria pulmonar. Se tuvieron en cuenta factores preoperatorios de ventilación mecánica, choque cardiogénico e infección previa a la cirugía.
Intervención quirúrgica
Se realizó con una media de edad de 14,7 días. En el momento el centro realiza tres formas de tratamiento paliativo en este síndrome; así:
Norwood primer estadio (clásico)
Se practica estereotomía media y se realiza disección del arco aórtico y el ductus. Se hace canulación arterial a nivel del tronco braquiocefálico con cánula 6 Fr. DLP y venosa con una cánula única a nivel de la auriculilla derecha 16 Fr. punta metálica angulada DLP. Se entra en circulación extracorpórea, se liga el ductus y se enfría a 18 a 20 grados centígrados. En el proceso de enfriamiento se termina de realizar la disección de aorta y sus ramas se reparan con torniquetes. A nivel del tronco braquiocefálico derecho, se anostomosa una fístula de PTEF del tamaño requerido para su peso. Se secciona el tronco pulmonar y se cierra el orificio de las ramas pulmonares en forma directa o con parche de pericardio bovino para evitar la estrechez de sus bocas.
Al llegar a la temperatura deseada, se cierran los torniquetes y se pinza la aorta descendente y por un lúer de la cánula arterial se da cardioplejía anterógrada fría sanguínea. Luego se traslada la cánula arterial para la fístula y se da flujo selectivo cerebral anterógrado. Después se retira todo el tejido ductal posible sin seccionar la aorta y se abre todo el arco aórtico con aorta ascendente hasta el nivel del tronco pulmonar y allí se fija con sutura con polipropileno 6/0 a la aorta ascendente con el tronco pulmonar y se inicia la ampliación del arco aórtico con parche de pericardio bovino (adquirido en el Laboratorio de Válvulas Banco de tejidos de la Clínica Cardiovascular Santa María). Al terminar su implantación se extrae el aire de la aorta y se reubica la cánula arterial en la aorta ascendente. Se inicia el calentamiento y al mismo tiempo se amplía la CIA por la aurícula derecha y luego se anastomosa el otro extremo de la fístula Blalock-Taussig a la rama pulmonar derecha.
Sano primer estadio
Se practica el mismo abordaje descrito. Se realiza la misma disección de la aorta y sus ramas y su reparo con torniquetes, y cuando se está en el proceso de enfriamiento, se secciona el tronco pulmonar y se coloca parche de pericardio bovino a las ramas pulmonares. En ese parche, con un punch de 5 mm, se abre la boca donde se anastomosa la fístula de PTEF de 5 mm. Luego se continúa el mismo proceso de abertura de la aorta previa colocación de la cánula arterial al tronco braquiocefálico. Se amplía la aorta con parche de pericardio bovino y antes de terminar se localiza el sitio avascular del ventrículo derecho. Se hace una ventriculotomía y se amplía con el mismo punch cerciorándose de que quede en forma cónica de base amplia a la cavidad ventricular. Finalmente, se inicia el calentamiento y allí se anastomosa el otro extremo de la fístula, para ampliar la CIA.
Técnica del híbrido
Se practica estereotomía media. Se presenta el pericardio, seguido de la disección de las ramas pulmonares a las cuales se les coloca cerclaje (banding) en forma individual para llevar la saturación arterial del neonato hasta 75%. Luego se coloca un catéter guía por el tronco pulmonar para que los hemodinamistas inserten por allí un stent en el ductus para mantenerlo abierto. Se da por terminado el procedimiento y se cierra el esternón en la forma tradicional. Este procedimiento se lleva hasta el cuarto y sexto mes cuando se realiza la ampliación de la aorta y un Glenn bidireccional.
Resultados
Entre las características demográficas y anatómicas de los 32 pacientes incluidos en el estudio, puede observarse en la tabla 1 la distribución por años.
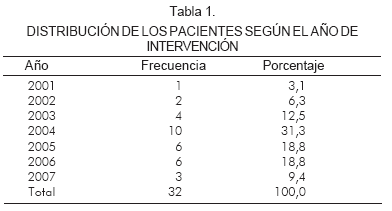
De acuerdo con los datos obtenidos, los pacientes pueden describirse así: género masculino 59,4% y femenino 40,6%, edad promedio de la cirugía 14,7 días. La media diámetro de la aorta ascendente fue 2,8 mm con un promedio entre 1,5 y 5 mm. El diámetro de aorta transversa fue de 3,2 mm con un promedio de 2 a 6,2 mm. 14 pacientes presentaron atresia aórtica y mitral, 11 atresia aórtica o mitral y 7 hipoplasia severa mitral o aórtica. Todos tenían perfusión coronaria y de aorta ascendente por vía retrógada a través del ductus.
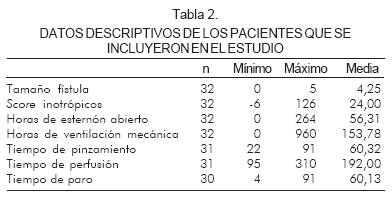
Entre las variables prequirúrgicas se halló: choque cardiogénico en 9,4% (3 pacientes), ventilación mecánica en 37,5% (12 pacientes) y enterocolitis en uno (3,1%). Ninguna de estas variables tuvo significancia estadística al relacionarlas con mortalidad.
Los tiempos de circulación extracorpórea fueron: media en perfusión de 192 minutos, pinzamiento aórtico de 60 minutos y paro circulatorio de 60 minutos. El 100% de los pacientes salieron con esternón abierto. La mortalidad en el quirófano fue de 25%, que representó un total de 40% de los pacientes que fallecieron (Tabla 2). Con la técnica clásica se operaron 12 pacientes, de los cuales 11 tuvieron fístula No. 3,5 y uno fístula de 3 mm. En los pacientes con técnica Sano, el tamaño de la fístula fue de 5 mm.
Según la técnica quirúrgica se distribuyeron 12 pacientes para la técnica clásica y 20 para la técnica Sano (Tabla 3).

Tratamiento post-operatorio
En la UCIP se continúo el tratamiento iniciado en el quirófano, con el objetivo de garantizar una buena perfusión y mantener un gasto cardiaco adecuado. La media de score de inotrópico fue de 24. Se sedaron con midazolam y fentanilo y se relajaron con pancuronio hasta cerrar el esternón con una media de 56 horas. Se iniciaba el desmonte del ventilador sólo cuando los pacientes tuvieran un solo inotrópico a dosis bajas, FiO2 < 40% con saturación entre 75% y 85%, y balance negativo. La media de ventilación mecánica fue de 153 horas.
La mortalidad en el grupo I fue de 83% y de 50% en el II, para una mortalidad global de 62% hasta 2006; en 2007 la mortalidad fue de 0% (Figura 1).
De los pacientes que fueron llevados a Norwood, 25% murieron en el quirófano lo cual representa el 40% de los pacientes que fallecieron.
Discusión
El tratamiento quirúrgico de los pacientes con diagnóstico de síndrome de ventrículo izquierdo hipoplásico, es motivo de preocupación para los equipos médico-quirúrgicos de centros cardiovasculares, dada su alta morbimortalidad. Aunque muchos centros reportan una disminución en la mortalidad de estos pacientes, ésta ha ido ligada a la mejoría en la técnica quirúrgica, el entrenamiento del equipo multidisciplinario (cirujanos, anestesiólogos, pediatras, cardiólogos, hemodinamistas y grupo de apoyo) y la consecución de ayuda tecnológica que permita realizar un soporte hemodinámico posquirúrgico adecuado. Este hecho se relaciona en parte con la introducción de una modificación de la técnica clásica por la técnica Sano, en la que se hizo sustitución de la fístula por un tubo que conecta el ventrículo derecho con la arteria pulmonar. Este cambio en la técnica permite un crecimiento más homogéneo de la vasculatura pulmonar.
Desde el punto de vista fisiopatológico, en los pacientes con síndrome de ventrículo izquierdo hipoplásico el flujo venoso pulmonar pasa a la aurícula derecha a través de una comunicación interatrial donde se mezcla con la sangre venosa sistémica. Continúa hacia el ventrículo derecho y la arteria pulmonar y a través de un conducto arterioso hacia la aorta descendente y de manera retrógrada irriga a la aorta ascendente y a las arterias coronarias. La gravedad y presentación clínica, dependerán de la permeabilidad del conducto arterioso, la restricción del flujo a través de la comunicación interatrial y del equilibrio entre las resistencias sistémicas y pulmonares. En los neonatos con síndrome de ventrículo izquierdo hipoplásico, conforme se cierra el conducto arterioso habrá menos flujo a través del circuito pulmonar pero también de manera paralela a nivel sistémico, lo que ocasiona hipoperfusión generalizada, que se presenta en las primeras 72 horas de vida. El inicio temprano de la sintomatología en las primeras 24 horas de vida, se explica por la presencia de foramen ovale o por comunicación interatrial restrictiva.
Uno de los principales avances con los que se cuenta en la actualidad, es el diagnóstico fetal de esta cardiopatía, lo cual permite mejorar los planes de manejo de los recién nacidos y su sobrevida. El reconocimiento prenatal del síndrome de corazón izquierdo hipoplásico, anormalidades cromosómicas y malformaciones extracardiacas sirve para proporcionar un consejo oportuno a las familias y realizar un planeamiento adecuado del manejo del paciente al momento de nacer.
Los estudios de seguimiento de ecocardiografía fetal permiten observar que las estructuras fetales cardiacas pequeñas, tienden a hacerse aun más pequeñas según avanzan los meses de embarazo, situación que se considera como la historia natural de esta cardiopatía. Además, ésta tiene múltiples variaciones anatómicas y asociaciones frecuentes con alteraciones genéticas y compromiso de otros órganos, lo cual es vital al momento de realizar la valoración inicial y el diagnóstico preoperatorio, para emitir un concepto sobre el pronóstico, independiente de la técnica a utilizar y el grupo de cuidado posquirúrgico (10-12).
Según datos de Allan y colaboradores, al realizar el diagnóstico fetal temprano de síndrome de corazón izquierdo hipoplásico, la mayoría de los padres escogen interrumpir el embarazo luego de discutir las opciones y el pronóstico. Sólo se encontró 42% de sobrevida en pacientes que fueron sometidos a todas las etapas del manejo quirúrgico, en contraste con una sobrevida de 70%, luego de ser sometidos al primer estadio de la cirugía de Norwood, lo que hace claros los riesgos a enfrentar para alcanzar el estadio final de este procedimiento quirúrgico (5, 6, 9, 13).
En nuestra serie, la mortalidad fue más alta en el grupo de pacientes a quienes se les realizó técnica clásica que técnica Sano, lo cual concuerda con los reportes de otros centros. Además, el entrenamiento del equipo no sólo quirúrgico sino multidisciplinario donde se incluye personal de cuidado intensivo, cardiólogos y hemodinamistas, permite mostrar que la curva de entrenamiento del personal a cargo del paciente se relaciona de forma directa con la morbimortalidad.
Diferente a otros autores, en nuestro estudio el tiempo de circulación extracorpórea entre los grupos de sobrevida y mortalidad, no tuvo diferencia estadística, siendo de 195,68 minutos en promedio para los pacientes que fallecieron y de 186,16 minutos para los que sobrevivieron. Otro factor de riesgo para mortalidad descrito por la literatura, es el cierre esternal primario como generador de síndrome de bajo gasto y compresión cardiaca. Por este motivo, desde que se inició este tipo de procedimiento quirúrgico, a los pacientes del estudio se les realizó cierre diferido al lograrse estabilidad hemodinámica, disminución de soporte inotrópico, estabilidad oximétrica con fracciones inspiradas de oxígeno bajas y balance de líquidos negativo, momento que se consideró optimo para el cierre, lo cual en promedio ocurrió a las 56 horas del evento quirúrgico.
En nuestro estudio, la presencia de factores prequirúrgicos como choque cardiogénico, tiempo de ventilación mecánica y enterocolitis no constituyó un factor estadístico significativo al momento de cruzar estas variables con mortalidad.
De los pacientes sometidos a este procedimiento, sobrevivieron doce y de éstos actualmente 58,3% se encuentran en el estadio II de Norwood y 8,3% en el III . El porcentaje restante está a la espera de su segunda cirugía. Hoy todos están en tratamiento con diuréticos y vasodilatadores sistémicos, con clase funcional I.
Conclusiones
El síndrome de ventrículo izquierdo hipoplásico es una patología de alta complejidad médica y quirúrgica que genera gran preocupación en todos los grupos quirúrgicos de cardiopatías congénitas. Los avances actuales en las técnicas de diagnóstico prenatal, manejo médico multidisciplinario, intervención hemodinámica y técnicas quirúrgicas son prometedores para mejorar la sobrevida de estos pacientes. Al presente se cuenta con tres opciones de manejo: el transplante cardiaco -el cual se dificulta en nuestro medio por la ardua consecución de donantes-, la cirugía de Norwood -la cual ha sido implementada en nuestro servicio con un aumento en la tasa de supervivencia en el ultimo año- y el procedimiento híbrido como última alternativa en pacientes con factores de alto riesgo para cirugía de Norwood I.
Bibliografía
1. Mahle WT, Spray TL, Wernovsky G, Gaynor JW, Clark BJ. 3rd. Survival after reconstructive surgery for hypoplastic left heart syndrome: a 15-year experience from a single institution. Circulation 2000;102(Suppl 3): III136-1. [ Links ]
2. Gaynor JW, Mahle WT, Cohen MI, et al. Risk factors for mortality after the Norwood procedure. Eur J Cardiothorac Surg 2002; 22: 82-9. [ Links ]
3. Poirier NC, Drummond-Webb JJ, Hisamochi K, Imamura M, Harrison AM, Mee RB. Modified Norwood procedure with a high-flow cardiopulmonary bypass strategy results in low mortality without late arch obstruction. J Thorac Cardiovasc Surg 2000;120: 875-84. [ Links ]
4. Ishino K, Stumper O, De Giovanni JJV, et al. The modified Norwood procedure for hypoplastic left heart syndrome: early to intermediate results of 120 patients with particular reference to aortic arch repair. J Thorac Cardiovasc Surg 1999;117: 920-30. [ Links ]
5. Mahle WT, Spray TL, Gaynor JW, Clark BJ. The incidence of unexpected death after palliative surgery for hypoplastic left heart syndrome. Ann Thorac Surg 2001;71:61-5. [ Links ]
6. Bartram U, Grunenfelder J, Van Praagh R. Causes of death after the modified Norwood procedure: a study of 122 postmortem cases. Ann Thorac Surg 1997;64:1795-802. [ Links ]
7. Imoto Y, Kado H, Shiokawa Y, Minami K, Yasui H. Experience with the Norwood procedure without circulatory arrest. J Thorac Cardiovasc Surg 2001;122:879-82. [ Links ]
8. Kishimoto H, Kawahira Y, Kawata H, Miura T, Iwai S, Mori T. The modified Norwood procedure on a beating heart. J Thorac Cardiovasc Surg 1999;118:1130-2. [ Links ]
9. Chopra HK, Nanda NC, Fan P, et al. Can two-dimensional echocardiography and Doppler color flow mapping identify the need for tricuspid valve repair? J Am Coll Cardiol 1989;14:1266-74. [ Links ]
10. Tabbutt S, Ramamoorthy C, Montenegro LM, et al. Impact of inspired gas mixtures on preoperative infants with hypoplastic left heart syndrome during controlled ventilation. Circulation 2001;104(Suppl 1):I159-64. [ Links ]
11. Tweddell JS, Hoffman GM, Fedderly RT, et al. Patients at risk for low systemic oxygen delivery after the Norwood procedure. Ann Thorac Surg 2000;69:1893-9. [ Links ]
12. Fogel MA, Rychik J, Vetter J, Donofrio MT, Jacobs ML. Effect of volume unloading surgery on coronary flow dynamics in patients with aortic atresia. J Thorac Cardiovasc Surg 1997; 113:718-27. [ Links ]
13. Forbess JM, Cook N, Roth SJ, Serraf A, Mayer JE, Jonas RA. Ten-year institutional experience with palliative surgery for hypoplastic left heart syndrome; risk factors related to stage I mortality. Circulation 1995; 92 (Suppl II): II-262-6. [ Links ]
14. Molina JE, Edwards JE, Bianco RW, Clack RW, Lang G, Molina JR. Composite and plain tubular synthetic graft conduits in right ventricle-pulmonary artery position: fate in growing lambs. J Thorac Cardiovasc Surg 1995; 110: 427-35. [ Links ]














