Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.3 Bogota May/June 2009
(1) Unidad de Biología Celular y molecular. Corporación para Investigaciones Biológicas. Medellín, Colombia.
(2) Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
(3) Departamento de Cardiología no invasiva, Clínica Medellín. Medellín, Colombia.
Correspondencia: Dr. Dagnóvar Aristizábal O. Clínica Medellín, Calle 54 No. 46-27, Cons. 1405, Teléfono: (4) 511 7378, Medellín, Antioquia. Correo electrónico: dagnovar@une.net.co
Recibido:16/12/2008. Aceptado: 19/03/2009.
La cardiografía de impedancia es una técnica no invasiva que permite una determinación rápida, continua y reproducible del gasto cardiaco latido a latido. Mide los cambios en la resistencia eléctrica del tórax que se producen por las variaciones en el volumen sanguíneo en la aorta durante el ciclo cardiaco. La medición continua del cambio en la impedancia o las fluctuaciones del volumen sanguíneo durante la sístole y la diástole, permite determinar el volumen latido, el gasto cardiaco, la contractilidad miocárdica y el contenido total de fluido del tórax. Entre las ventajas de esta técnica se incluyen su fácil implementación y asequibilidad, así como la posibilidad de ser realizada por prácticamente cualquier miembro del equipo de salud. La precisión de la cardiografía de impedancia ha sido validada en numerosos estudios en diferentes escenarios clínicos: hipertensión arterial, falla cardiaca, hipertensión pulmonar, optimización de la terapia de resincronización cardiaca y en pacientes críticos, situaciones en las que provee información sobre el estado hemodinámico sin los riesgos de otras técnicas invasivas o mínimamente invasivas. Es además un método de fácil aplicación y costo-efectivo para el diagnóstico y seguimiento de la respuesta a las intervenciones terapéuticas en múltiples patologías. La técnica representa así un cambio en los paradigmas del monitoreo hemodinámico.
Palabras clave: cardiografía de impedancia, volumen latido, gasto cardiaco, evaluación hemodinámica.
Impedance cardiography (ICG) is a non-invasive technique that allows a rapid, continuous and reproducible beat-to-beat cardiac output estimation. This technique measures thoracic electrical resistance changes produced by variations in the blood volume in the aorta during the cardiac cycle. Continuous measurement of impedance changes or fluctuations of blood volume during systole and diastole allow the determination of stroke volume, cardiac output, myocardial contractility, and total thoracic fluid content. Between the advantages of this technique are included its easy implementation and accessibility, as well as the possibility of its measurement by practically any member of the health team. Impedance cardiography accuracy has been validated in several clinical scenarios such as arterial hypertension, heart failure, pulmonary hypertension, optimization of cardiac resynchronization therapy, and in critically ill patients, situations where it provides information about the hemodynamic state without the risks and costs of other invasive or minimally invasive techniques. It is also an easy to use, cost-effective method for the diagnosis and follow-up of the response to therapeutic interventions in multiple clinical scenarios. Thus, this technology represents a change in the paradigms of hemodynamic monitoring.
Key words: impedance cardiography, stroke volume, cardiac output, hemodynamic evaluation.
Introducción
Las técnicas no invasivas para la determinación del gasto cardiaco fueron desarrolladas en un intento por superar algunas de las limitaciones de las técnicas invasivas como el catéter de Swan-Ganz (1-3).
Las técnicas mínimamente invasivas para estimar el volumen latido incluyen: monitoreo Doppler esofágico (4), ecocardiografía transesofágica (5, 6), método derivativo de Fick (7, 8), termodilución transpulmonar (9), técnicas de dilución con litio (10), análisis del contorno de la onda de pulso (11-13) y análisis de poder de la onda de pulso (14).
La cardiografía de impedancia es tal vez la única técnica realmente no invasiva que permite una determinación rápida, continua, reproducible y confiable del gasto cardiaco latido a latido (3, 15, 16). Entre sus ventajas se incluyen su fácil implementación y asequibilidad, así como la posibilidad de ser realizada por prácticamente cualquier miembro del equipo de la salud. Provee además información sobre el estado hemodinámico sin los riesgos, costos y requerimientos técnicos de otras técnicas invasivas o mínimamente invasivas (16).
En esta revisión se describen los principios básicos de la técnica, su validación y algunas de sus aplicaciones clínicas.
Evolución de la cardiografía de impedancia
El desarrollo de la cardiografía de impedancia, a través de los últimos 50 años, ha sido un proceso continuo y escalonado de mejoras e innovaciones. Partiendo de la aplicación de los principios bioeléctricos y el desarrollo de la teoría para el cálculo del volumen sistólico, logró convertirse en una técnica válida y confiable para la determinación no invasiva del gasto cardiaco (3).
A mediados de los años 60, los investigadores de la NASA (National Aeronautical and Space Administration) y William Kubiceck, desarrollaron el primer método práctico de cardiografía de impedancia aplicando el concepto de bioimpedancia eléctrica del tórax (TEB, su sigla en Inglés) para estudiar los efectos de la gravedad cero sobre el estado hemodinámico de los astronautas (17). El cardiógrafo de Minessota, el primer dispositivo de cardiografía de impedancia diseñado, se utilizó con tal propósito (18). Sólo a partir de 1983, y luego de varias modificaciones al cardiógrafo de Minessota, la cardiografía de impedancia se convirtió en una tecnología comercialmente disponible. Inicialmente, algunas limitaciones de la técnica llevaron al escepticismo entre los clínicos que utilizaron los primeros cardiógrafos, las cuales se debían principalmente a la complejidad para el análisis de la señal y la interpretación del trazado. Hoy, gracias a las múltiples modificaciones y a la contribución que varios investigadores han realizado en el proceso de validación de la técnica, las aplicaciones clínicas de la cardiografía de impedancia han podido definirse con claridad (3).
Principios de la técnica
Principios electrofisiológicos y teoría de la determinación del volumen latido
Según la ley de Ohm el flujo de una corriente eléctrica (I) es igual a la caída del voltaje (E) entre las dos terminales de un circuito, dividido por la resistencia o impedancia (Z) al flujo de la corriente (19):
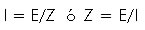
La impedancia extiende el concepto de resistencia para poder aplicar la ley de Ohm cuando la corriente no es constante. Si la corriente permanece constante, los cambios en el voltaje a través del circuito serán iguales a los cambios en la impedancia al flujo de la corriente. Como la impedancia (Z) depende del área de corte transversal (A), la longitud (L) y la resistividad (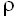 ) del material conductor, cualquier cambio de Z puede relacionarse con cambios en el volumen (V) por la siguiente expresión:
) del material conductor, cualquier cambio de Z puede relacionarse con cambios en el volumen (V) por la siguiente expresión:
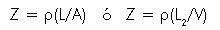
Donde V = A • L y la resistividad (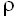 ) es una constante específica de la composición del material medida en
) es una constante específica de la composición del material medida en  /cm. Este es el concepto sobre el cual se basa la cardiografía de impedancia.
/cm. Este es el concepto sobre el cual se basa la cardiografía de impedancia.
Kubicek investigó la posibilidad de medir el contenido total de sangre dentro de la aorta (el cual representa el gasto cardiaco) examinando los cambios en la impedancia a través del tórax bajo la influencia de una corriente de alta frecuencia y magnitud constante, y acuñó el término «bioimpedancia eléctrica del tórax» (TEB) (17, 19- 21).
Kubicek asumió el tórax como un simple cilindro con un área seccional (A) y una longitud (L) que serviría como un conductor eléctrico no homogéneo (17) (Figura 1).
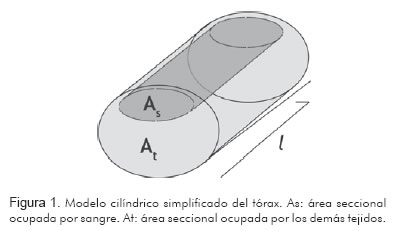
La mayoría de las estructuras que se encuentran en el tórax -músculos, pulmones, grasa, piel, huesos y aire- presentan altas resistividades (entre 200 y 5.000 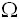 /cm) (18). La sangre, aunque sólo ocupa el 15% del volumen total del tórax, presenta por el contrario una baja resistividad (plasma: 65
/cm) (18). La sangre, aunque sólo ocupa el 15% del volumen total del tórax, presenta por el contrario una baja resistividad (plasma: 65 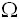 /cm, y sangre total 130
/cm, y sangre total 130 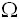 /cm).
/cm).
La mayor parte de la corriente eléctrica, siguiendo la vía de menor resistencia, pasa a través de los grandes vasos (aorta y vena cava) en su recorrido a través del tórax. A partir de esta observación Kubicek concluyó que los cambios en la impedancia del tórax eran un reflejo de los cambios en el volumen dentro de los grandes vasos, y utilizando la información derivada de los cambios en la impedancia durante el ciclo cardiaco (Figura 2), logró desarrollar una fórmula para la estimación del volumen latido (17).
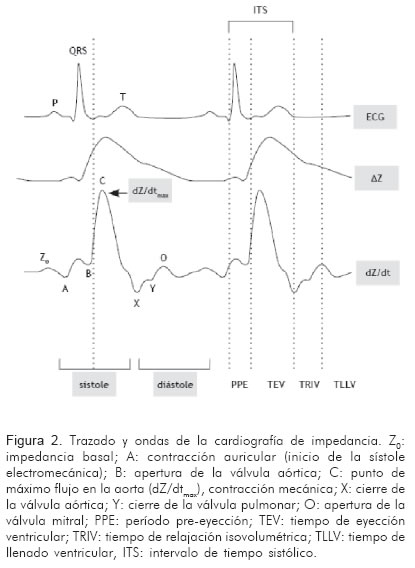
Como el área bajo la curva de presión de pulso refleja de forma precisa el volumen sistólico, ésta puede estimarse al multiplicar el cambio en el pico de presión (dP/dtmax) por el tiempo de eyección total (22, 20). La ecuación para el pico de flujo, se convirtió posteriormente en la ecuación de Kubicek:
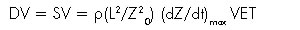
Esta ecuación asume que los cambios observados en la impedancia se deben primariamente al incremento en el volumen de sangre en la aorta (17-21).
Buscando una ecuación más precisa, Sramek en 1994, propuso un modelo que consideraba el tórax en forma de cono truncado, el cual coincidía mejor con el verdadero campo de distribución de la electricidad en éste (20, 21). El volumen de este cono representa sólo un tercio del cilindro propuesto por Kubicek, y su longitud (L) corresponde al 17% de la estatura (H) del individuo. Esto se resume en la siguiente ecuación:
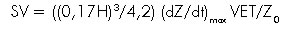
Donde 0,17 • H3/4,2 corresponde al volumen de tejido torácico que participa en la transmisión eléctrica (VEPT). Bernstein introdujo una modificación adicional en esta ecuación al normalizarla con un factor 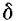 para el peso corporal ideal (23, 18, 21) obteniéndose la ecuación de Sramek-Bernstein:
para el peso corporal ideal (23, 18, 21) obteniéndose la ecuación de Sramek-Bernstein:
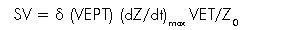
Aunque se ha presentado alguna controversia respecto a cuál de los modelos es el más apropiado para la estimación precisa del volumen latido, esta puede lograrse, independientemente de la ecuación utilizada, al determinar las dos variables más importantes: el dZ/dtmax y el VET (ventricular ejection time).
Origen fisiológico de la señal y ondas de impedancia
La cardiografía de impedancia utiliza una serie de electrodos en la superficie del tórax que proveen la conexión necesaria para la medida de la corriente eléctrica que fluye en dirección paralela a la columna (20, 18).
La mayoría de los dispositivos de cardiografía de impedancia modernos, utilizan un sistema de electrodos tetrapolar (Figura 3). A través de dos electrodos (uno en la parte alta del abdomen y otro en la parte alta del cuello) ingresa una corriente constante de alta frecuencia y baja magnitud creando en el tórax un campo eléctrico homogéneo. Los otros dos electrodos (uno en la raíz del cuello y el otro a nivel de la apófisis xifoides) detectan los cambios en el voltaje y la señal del electrocardiograma (3).
La impedancia (Z) en el tórax, es inversamente proporcional al contenido de líquido en el tórax. Con cada latido el corazón bombea la sangre hacia la aorta, lo cual aumenta el contenido de líquido en el tórax produciendo una disminución dramática de la impedancia al flujo de corriente eléctrica (3).
La cardiografía de impedancia convierte la medida de la impedancia (Z) eléctrica del tórax, -variable durante el ciclo cardiaco- en un trazado de ondas, del cual pueden derivarse una variedad de parámetros, relacionados con diferentes eventos fisiológicos (3).
Los parámetros más importantes para determinar el volumen sistólico y el gasto cardiaco son el dZ/dt y el VET. Mientras en el electrocardiograma se registran los eventos eléctricos del corazón, la cardiografía de impedancia produce un trazado de las fases mecánicas de la contracción cardiaca. La evaluación conjunta de los intervalos y segmentos del ECG y la señal dZ/dt de la cardiografía de impedancia, permite determinar el (dZ/dt)max y los intervalos de tiempo sistólicos como el VET y el PEP (pre-ejection period), y hacer un análisis general de otras actividades electromecánicas (3). Las principales ondas del trazado de la cardiografía de impedancia aparecen representadas en la figura 2 (3).
Determinación del dZ/dT max
La impedancia del tórax está determinada por tres componentes que varían durante el ciclo cardiaco:
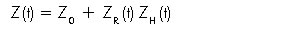
Z0 corresponde a la impedancia basal de los tejidos, líquido y aire contenidos en el tórax; su valor normalmente es de 25 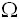 , y no se modifica de manera aguda en el tiempo. La impedancia respiratoria (ZR(t)) y la impedancia hemodinámica (ZH(t)) varían durante los ciclos respiratorio y cardiaco respectivamente, y son las que determinan los cambios en el trazado y ondas de la cardiografía de impedancia. El componente respiratorio (ZR(t)) induce cambios de 1
, y no se modifica de manera aguda en el tiempo. La impedancia respiratoria (ZR(t)) y la impedancia hemodinámica (ZH(t)) varían durante los ciclos respiratorio y cardiaco respectivamente, y son las que determinan los cambios en el trazado y ondas de la cardiografía de impedancia. El componente respiratorio (ZR(t)) induce cambios de 1 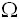 en la impedancia y el componente hemodinámico (ZH(t)) de 0,1 a 0,2
en la impedancia y el componente hemodinámico (ZH(t)) de 0,1 a 0,2 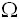 . Este último representa sólo entre 0,3% y 0,5% de la impedancia total del tórax. Las primeras derivaciones de estos cambios en la impedancia con respecto al tiempo (
. Este último representa sólo entre 0,3% y 0,5% de la impedancia total del tórax. Las primeras derivaciones de estos cambios en la impedancia con respecto al tiempo (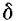 Z/
Z/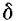 t) mostraron que las variaciones en la impedancia basal inducidas por la frecuencia respiratoria, eran prácticamente nulas y en realidad los reflejaban únicamente cambios en ZH(t). Esto, se debe a que la frecuencia cardiaca (70 lpm en promedio) es mucho mayor que la frecuencia respiratoria (14 rpm en promedio).
t) mostraron que las variaciones en la impedancia basal inducidas por la frecuencia respiratoria, eran prácticamente nulas y en realidad los reflejaban únicamente cambios en ZH(t). Esto, se debe a que la frecuencia cardiaca (70 lpm en promedio) es mucho mayor que la frecuencia respiratoria (14 rpm en promedio).
Mediante el uso de esta metodología derivativa pudo determinarse que prácticamente todos los cambios en la impedancia del tórax se debían a los cambios de volumen dentro de la aorta torácica (18- 20, 23). De esta forma los cambios en la impedancia eléctrica del tórax (dZ/dt) son un reflejo de los cambios en el flujo de sangre en la aorta, y su valor máximo (dZ/dt)max, es proporcional al pico de flujo sanguíneo en la aorta.
Período pre-eyección (PEP) y tiempo de eyección ventricular (VET)
El intervalo de tiempo sistólico (STI) comienza en el punto del ECG donde inicia la contracción ventricular y termina con la eyección de la sangre de los ventrículos y cierre de la válvula aórtica. El STI está determinado por dos componentes, el período pre-eyección (PEP) y el tiempo de eyección ventricular (VET), ambos relacionados a través de la siguiente fórmula:
STI = PEP + VET
El PEP corresponde al retraso en la conducción aurículo-ventricular en el ECG o al tiempo de contracción isovolumétrica de los ventrículos. El VET es el tiempo que transcurre desde la apertura de la válvula aórtica hasta su cierre al final en la sístole. El VET es el principal componente de las ecuaciones utilizadas para calcular el volumen latido, por lo cual debe ser estimado de forma precisa a partir del análisis del trazado de la cardiografía de impedancia. Como los trazados del ECG y la cardiografía de impedancia se producen en la misma escala de tiempo, pueden alinearse para determinar el momento en que ocurre la apertura y el cierre de la válvula aórtica (3) (Figura 2).
El PEP puede ir de 40 a 120 ms y el VET puede durar entre 200 y 350 ms. La relación entre estos dos intervalos es una medida que refleja la contractilidad ventricular, y aunque pueden modificarse por variaciones en factores hemodinámicos como la frecuencia cardiaca y la presión arterial, la mayoría de estudios de correlación han encontrado una alta concordancia entre los tiempos sistólicos determinados por cardiografía de impedancia y los determinados por otras técnicas tanto invasivas como no invasivas (3).
Parámetros hemodinámicos determinados mediante cardiografía de impedancia (Tabla 1)
Volumen latido y gasto cardiaco
El volumen latido puede determinarse a partir del análisis de la magnitud de los cambios en la conductancia eléctrica que sufre la corriente eléctrica cuando pasa por el tórax a través de la aorta; y el gasto cardiaco puede estimarse al multiplicar el volumen latido por la frecuencia cardiaca (18, 19). Una vez determinado el gasto cardiaco, pueden derivarse otras variables como el índice cardiaco, la resistencia periférica total y la compliance aórtica.
Volumen central de fluido
La impedancia basal (Z0) y su inverso, el índice de volumen de fluido torácico total (TFVI) muestran una gran correlación con el volumen de líquido intravascular en el tórax y pueden afectarse de manera significativa en ciertas condiciones como el edema agudo de pulmón (24). Este índice provee una medida continua y no invasiva del estado de volumen a nivel central y de sus modificaciones con la terapia (19, 24).
Intervalos cardiacos
Determinar los intervalos sistólico y diastólico resulta sencillo a través de la cardiografía de impedancia (25, 26). El PEP corresponde al intervalo de contracción isovolumétrica que inicia con la onda Q del QRS y termina en el punto donde comienza la sístole mecánica del corazón. El tiempo de eyección del ventrículo izquierdo (LVET) comienza al final del PEP y termina con el cierre de la válvula aórtica en el punto X (fin de la eyección). Los intervalos de tiempo diastólicos coinciden con la segunda deflexión del trazado de la cardiografía de impedancia. El período que va del punto X al punto O, representa el tiempo de relajación isovolumétrica (IVRT), un indicador de la función diastólica y la relajación ventricular activa. El comienzo del QRS en el ECG y el inicio de la primera deflexión de la cardiografía de impedancia, representan el final de la diástole.
Contractilidad y fracción de eyección
El punto máximo de la segunda derivada de la impedancia (d2Z/dt2)max es un reflejo de la máxima aceleración del flujo sanguíneo en la aorta, y es un indicador del estado inotrópico. Este parámetro se normaliza usualmente para la impedancia basal constituyendo el índice de aceleración (26, 20).
La relación PEP/LVET para determinar la fracción de eyección, fue poco utilizada inicialmente dadas las dificultades técnicas para calcular el PEP y el LVET (27). En la actualidad estos intervalos pueden determinarse de manera precisa mediante la cardiografía de impedancia. Capan y colaboradores validaron un método similar para calcular la fracción de eyección utilizando la cardiografía de impedancia (28).
Otros parámetros
Parámetros adicionales como la resistencia periférica total, la compliance aórtica y la presión de cuña pulmonar pueden ser derivados y calculados a partir del análisis del trazado de la cardiografía de impedancia (18, 29). Ciertas patologías como la regurgitación mitral y la estenosis subaórtica hipertrófica idiopática, pueden generar patrones característicos en el trazado de la cardiografía de impedancia (30).
Validación de la técnica
Diferentes estudios comparan la cardiografía de impedancia con la termodilución, tradicionalmente considerada como el «gold standard» para la determinación del volumen latido. La termodilución requiere la colocación de un catéter en la arteria pulmonar, lo cual implica riesgos como infección, sangrado y daño a estructuras vasculares; es además un método costoso que exige entrenamiento y experiencia por parte de quien lo realiza (2). Dados los riesgos inherentes a los métodos invasivos para determinar el volumen latido, los escenarios clínicos donde se han realizado muchos de los estudios de validación de la cardiografía de impedancia corresponden a pacientes con patologías cardiovasculares graves, o situaciones que por su gravedad justifiquen los riesgos asociados con el cateterismo de la arteria pulmonar. Múltiples estudios demuestran que los nuevos cardiógrafos, que utilizan técnicas avanzadas de análisis y procesamiento de datos, aportan información y datos significativamente más precisos que los obtenidos con las primeras generaciones de cardiógrafos (31). Varios estudios adicionales de validación de la cardiografía de impedancia (32-37) que usaron cardiógrafos de impedancia de última generación, demuestan una alta correlación y precisión de la cardiografía de impedancia al compararla con las técnicas invasivas para la determinación del volumen latido (Tabla 2).
En la literatura se han reportado alrededor de doscientos estudios de correlación que evalúan la determinación del gasto cardiaco por cardiografía de impedancia y otras técnicas invasivas, y aunque algunos de ellos no muestran una buena correlación, varios meta-análisis encuentran una correlación general (r) entre 0,82 y 0,93 (38, 39).
La termodilución, considerada como el «gold standard» clínico para la determinación del gasto cardiaco, ofrece problemas técnicos y presenta alta variabilidad, lo que hace necesario utilizar el método de Bland-Altman (40) cuando se realizan comparaciones con la cardiografía de impedancia. Este método estadístico permite encontrar una alta concordancia entre la cardiografía de impedancia y la termodilución (41).
Van De Water y colaboradores (31), evaluaron la reproducibilidad relativa de las medidas del gasto cardiaco mediante cardiografía de impedancia y termodilución, en pacientes hospitalizados a quienes se había colocado un catéter en la arteria pulmonar para monitoreo hemodinámico, luego de realizar un by-pass coronario. Las medidas seriadas del gasto cardiaco en un mismo paciente mostraron mejor reproducibilidad con la cardiografía de impedancia que con la termodilución.
Los investigadores concluyeron que gracias a los recientes avances tecnológicos de la cardiografía de impedancia, pueden alcanzarse niveles de concordancia equivalentes a los de la termodilución. De esta manera, los hallazgos de estos estudios dan soporte a la utilidad clínica de la cardiografía de impedancia para la medición seriada del gasto cardiaco en pacientes con enfermedad cardiovascular.
En un grupo de pacientes, estables desde el punto de vista clínico, y en forma ambulatoria, Verhoeve y colaboradores (42) demostraron una alta reproducibilidad de las medidas del volumen latido efectuadas en un mismo día, y una buena sensibilidad de la cardiografía de impedancia para detectar las variaciones fisiológicas diarias en diferentes variables hemodinámicas. La variación promedio en las lecturas del gasto cardiaco, la resistencia vascular sistémica y el contenido de líquido en el tórax, realizadas en forma seriada con una semana de diferencia en 96 pacientes clínicamente estables, fue de 3% a 7% (Figura 4).
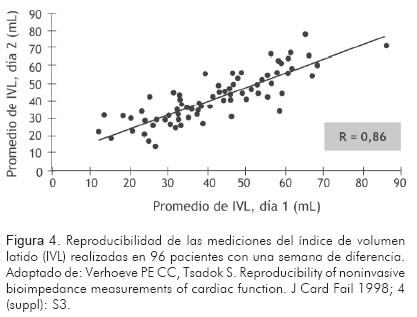
Limitaciones de la cardiografía de impedancia
La cardiografía de impedancia es una técnica de fácil aplicación clínica que permite obtener información acerca del estado hemodinámico en forma rápida y sin ningún riesgo para el paciente. Sin embargo, tiene algunas limitaciones debidas tanto a factores propios del paciente como a la técnica misma.
Se han encontrado pequeñas discrepancias entre los diferentes modelos matemáticos empleados para el análisis de la señal, por lo cual las ecuaciones no son intercambiables y los resultados de los estudios realizados con diferentes metodologías no pueden ser comparados (19, 21, 30, 43). Las anormalidades en la señal del electrocardiograma y los bajos valores en la impedancia que se presentan en algunas ocasiones, son limitaciones propias de la técnica. Deben considerarse también los artefactos de movimiento producidos por los estados de ansiedad, agitación, hiperventilación, temblor, etc. así como factores que impiden el buen contacto de los electrodos con la piel del paciente como el sudor, la obesidad y la grasa (18, 30).
El incremento excesivo en el contenido de líquido del tórax, como sucede en casos de derrame pleural, falla cardiaca severa, neumonía complicada, hemotórax y toracotomía abierta, interfieren con la transmisión de la señal (18).
Son limitaciones absolutas el taponamiento cardiaco, las malformaciones cardiacas o del tórax, y las compresiones cardiacas durante la reanimación cardio-cerebro-pulmonar.
Finalmente, las taquiarritmias, los estados hiperdinámicos, la cirrosis avanzada y la taquicardia, pueden llevar a subestimar los parámetros hemodinámicos (18, 30).
Aplicaciones clínicas de la cardiografía de impedancia
La precisión de la cardiografía de impedancia ha sido validada en numerosos escenarios clínicos, incluyendo la hipertensión arterial (44-49), la falla cardiaca (32), el post by-pass coronario (35, 31), la hipertensión pulmonar (36) y los pacientes críticos (50).
Hipertensión arterial
La determinación de los diferentes parámetros hemodinámicos por cardiografía de impedancia permite clasificar los pacientes hipertensos, hacer una selección adecuada de la medicación y titular las dosis, así como evaluar la eficacia del régimen terapéutico (45).
Cuando la cardiografía de impedancia se usa para la valoración del paciente hipertenso, ofrece la posibilidad de mejorar las tasas de control de las cifras de tensión y determinar qué pacientes tienen mayor riesgo de complicaciones a largo plazo. La implementación de estrategias de este tipo, contribuiría a una utilización más eficiente de los recursos en salud. Además, la cardiografía de impedancia sería una herramienta útil para identificar aquellos pacientes clasificados como prehipertensos, quienes se encuentran en mayor riesgo de desarrollar hipertensión o eventos clínicos.
Varios estudios en los que se ha asignado el tratamiento antihipertensivo de acuerdo con el perfil hemodinámico del paciente, indican que el tratamiento guiado por cardiografía de impedancia mejora significativamente el control de las cifras de tensión (44, 45, 48). Taler y colaboradores (48) realizaron un estudio donde 104 pacientes hipertensos no controlados con dos o más medicamentos, fueron asignados a uno de dos brazos de tratamiento: guiado por cardiografía de impedancia o tratamiento estándar dirigido por un especialista en hipertendión arterial, durante tres meses. En este estudio el control de la presión arterial, definido como el alcance de cifras de tensión por debajo de 140/90 mm Hg, fue logrado 70% más frecuentemente en los pacientes que recibieron tratamiento guiado por cardiografía de impedancia (Figura 5).
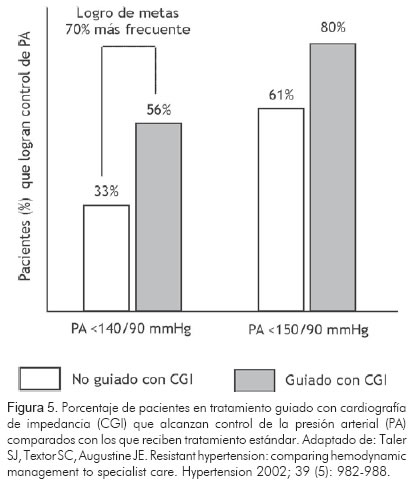
El mejor control de las cifras de tensión en quienes el tratamiento fue guiado por cardiografía de impedancia, se logró gracias a la reducción en el índice de resistencia vascular sistémica y al uso más intensivo de diuréticos según el contenido de líquido del tórax. El estudio permitió concluir que la determinación de los parámetros hemodinámicos por cardiografía de impedancia es más efectiva que el examen físico aislado para orientar la selección del tratamiento antihipertensivo.
Sharman y colaboradores (49) siguieron una cohorte de pacientes con hipertensión arterial resistente durante siete meses. Estos fueron tratados con base en un algoritmo que consideraba diferentes parámetros hemodinámicos determinados por cardiografía de impedancia para la asignación de la terapia (Figura 6). El uso de la cardiografía de impedancia en este estudio permitió lograr un control de 57,1% de los pacientes que no estaban controlados. Los investigadores concluyeron que la cardiografía de impedancia es segura, costo-efectiva y de gran utilidad para orientar el tratamiento de la hipertensión arterial resistente. Adicionalmente, en el estudio de Smith y colaboradores (44), el grupo de hipertensos con seguimiento hemodinámico con cardiografía de impedancia, alcanzó con mayor frecuencia y de forma significativa, tanto las metas de presión arterial mínimas (<140/90 mm Hg) como otras más estrictas (<130/85 mm Hg). Concluyeron que la optimización de la terapia antihipertensiva resulta significativamente más efectiva cuando se utiliza la cardiografía de impedancia como guía, en lugar del sistema terapéutico tradicional.
Falla cardíaca
El curso de los pacientes con falla cardiaca crónica está marcado por episodios periódicos de descompensación clínica, que además de afectar la calidad de vida pueden ser fatales. Esto implica costos sustanciales para el sistema de salud dada la alta demanda de recursos durante la hospitalización (52). La predicción confiable de estos eventos permitiría a los médicos realizar intervenciones tempranas reduciendo la necesidad de hospitalización y el riesgo de desenlaces adversos. Varios estudios sugieren que la determinación de las variables hemodinámicas permitiría identificar los pacientes con mayor riesgo de deterioro clínico durante el seguimiento (53- 55). Algunos estudios han utilizado la cardiografía de impedancia para determinar el gasto cardiaco y las presiones de llenado en pacientes con y sin falla cardiaca (32, 33, 47, 56-58). Un estudio publicado recientemente (59), evaluó de forma prospectiva 212 pacientes con falla cardiaca, clínicamente estables, luego de un episodio reciente de descompensación. Se realizaron evaluaciones clínicas y por cardiografía de impedancia seriadas cada dos semanas durante 26 semanas. La determinación de parámetros hemodinámicos como el índice de velocidad, el índice de contenido de fluido del tórax y el tiempo de eyección del ventrículo izquierdo, sirvieron como predictores de gran poder de un nuevo episodio de descompensación en los catorce días siguientes (p= 0,0002). Sus resultados sugieren que la evaluación con cardiografía de impedancia a intervalos regulares, de los pacientes con falla cardiaca con un episodio reciente de descompensación clínica, permite identificar pacientes con alto riesgo de descompensación recurrente. Con los dispositivos más recientes, ya es posible realizar las mediciones hemodinámicas a distancia desde cualquier lugar donde se encuentre el paciente y ser transmitidas a la clínica de falla cardiaca por medios inalámbricos utilizando teléfonos móviles o la Internet.
Optimización de dispositivos de resincronización cardiaca
Los dispositivos de resincronización cardiaca se han hecho cada vez más complejos. En la actualidad muchos de ellos pueden programarse en intervalos de tiempo tanto AV como VV (60, 61). Adaptar estos intervalos en forma individualizada a cada paciente mejora de manera significativa los beneficios de la terapia de resincronización. Los métodos invasivos para la determinación del gasto cardiaco no se recomiendan para el seguimiento de rutina de estos pacientes. Los métodos no invasivos utilizados para la optimización de los dispositivos de terapia de resincronización cardiaca incluyen la ecocardiografía, la ventriculografía con radionucleótidos, la fotopletismografía digital y más recientemente la cardiografía de impedancia (62, 63) que ya ha sido utilizada para la optimización de marcapasos bicamerales (64, 65). Varios estudios confirman la utilidad de la cardiografía de impedancia para la optimización de marcapasos e incluso la proponen como una alternativa a la ecocardiografía (46, 51, 62, 63). Un estudio reciente evaluó 46 pacientes con falla cardiaca -FE <30%, clase III-IV de la clasificación de la NYHA y bloqueo de rama derecha en ritmo sinusal- tres a cinco días luego de la implantación del dispositivo de TRC. La proporción de no respondedores a la terapia se redujo en 56% al modificar los intervalos AV y VV utilizando la cardiografía de impedancia (66).
Otros escenarios clínicos
En ciertas situaciones clínicas, como es el caso de aquellos pacientes potencialmente críticos que llegan a los servicios de urgencias, se requieren una evaluación y control rápidos del estado hemodinámico (67). En tales casos, conocer las variables hemodinámicas del paciente es clave para orientar el diagnóstico y tomar una conducta terapéutica adecuada, que en ciertos casos puede incluir el inicio temprano de medidas de reanimación. Varios estudios proponen la cardiografía de impedancia como una alternativa a la cateterización de la arteria pulmonar en la evaluación del paciente crítico (50).
Con frecuencia, a los pacientes con hipertensión pulmonar se les somete a cateterismo invasivo para determinar su estado hemodinámico. La termodilución y el método directo de Fick, son como se ha dicho, los métodos más comunes para la determinación del gasto cardiaco, pero son costosos y no exentos de complicaciones. La última generación de dispositivos de cardiografía de impedancia permite la estimación no invasiva del gasto cardiaco. Un estudio reciente comparó la medida del gasto cardiaco por cardiografía de impedancia, termodilución y método directo de Fick, en pacientes con hipertensión pulmonar (36). La precisión en la determinación del índice cardiaco entre la CGI y el método de Fick, fue de 0,46 L/min/m2, entre la termodilución y el método de Fick de 0,41 L/min/m2, y entre la cardiografía de impedancia y la termodilución de 0,92 L/min/m2. La correlación en la medición del gasto cardiaco entre la cardiografía de impedancia y el método de Fick, la termodilución y el método de Fick y la cardiografía de impedancia y la termodilución, fue de 0,84, 0,89 y 0,80, respectivamente. De esta forma la cardiografía de impedancia demostró ser un método preciso, útil y costo-efectivo para la determinación del gasto cardiaco en pacientes con hipertensión pulmonar, y una herramienta clave para el seguimiento de la respuesta a las intervenciones terapéuticas.
Conclusiones
Dada la relevancia que tiene la determinación del gasto cardiaco en el enfoque y seguimiento de los pacientes con enfermedad cardiovascular, hoy su medición se considera esencial, no sólo con fines diagnósticos y terapéuticos sino también pronósticos. La cardiografía de impedancia ofrece una alternativa de fácil aplicación en diversos escenarios de la cardiología, donde actualmente predomina la utilización de otras técnicas. La implementación clínica de esta tecnología permitiría, además del manejo hospitalario de pacientes con enfermedades cardiovasculares crónicas, su seguimiento en forma ambulatoria (Tabla 3).
Reconocimientos
Este trabajo fue realizado gracias al proyecto 221340820451 financiado por COLCIENCIAS y al proyecto de sostenibilidad CODI 2007-2008.
Bibliografía
1. Swan HJ, Ganz W, Forrester J, Marcus H, Diamond G, Chonette D. Catheterization of the heart in man with use of a flow-directed balloon-tipped catheter. N Engl J Med 1970; 283 (9): 447-451. [ Links ]
2. Mathews SR. Swan-Ganz catheter in haemodynamic monitoring. J Anaesth Clin Pharmacol 2006; 22: 335-345. [ Links ]
3. Summers RL, Shoemaker WC, Peacock WF, Ander DS, Coleman TG. Bench to bedside: electrophysiologic and clinical principles of noninvasive hemodynamic monitoring using impedance cardiography. Acad Emerg Med 2003;10 (6): 669-680. [ Links ]
4. Singer M, Clarke J, Bennett ED. Continuous hemodynamic monitoring by esophageal Doppler. Crit Care Med 1989; 17 (5): 447-452. [ Links ]
5. Savino JS, Troianos CA, Aukburg S, Weiss R, Reichek N. Measurement of pulmonary blood flow with transesophageal two-dimensional and Doppler echocardiography. Anesthesiology 1991; 75 (3): 445-451. [ Links ]
6. Perrino AC, Jr., Harris SN, Luther MA. Intraoperative determination of cardiac output using multiplane transesophageal echocardiography: a comparison to thermodilution. Anesthesiology 1998; 89 (2): 350-357. [ Links ]
7. Jaffe MB. Partial CO2 rebreathing cardiac output -operating principles of the NICO system. J Clin Monit Comput 1999; 15 (6): 387-401. [ Links ]
8. Haryadi DG, Orr JA, Kuck K, McJames S, Westenskow DR. Partial CO2 rebreathing indirect Fick technique for non-invasive measurement of cardiac output. J Clin Monit Comput 2000; 16 (5-6): 361-374. [ Links ]
9. von Spiegel T, Wietasch G, Bursch J, Hoeft A. Cardiac output determination with transpulmonary thermodilution. An alternative to pulmonary catheterization? Anaesthesist 1996; 45 (11): 1045-1050. [ Links ]
10. Band DM, Linton RA, O'Brien TK, Jonas MM, Linton NW. The shape of indicator dilution curves used for cardiac output measurement in man. J Physiol. 1997; 498 ( Pt 1): 225-229. [ Links ]
11. Bourgeois MJ, Gilbert BK, Von Bernuth G, Wood EH. Continuous determination of beat to beat stroke volume from aortic pressure pulses in the dog. Circ Res 1976; 39 (1): 15-24. [ Links ]
12. Burkhoff D, Alexander J, Jr., Schipke J. Assessment of Windkessel as a model of aortic input impedance. Am J Physiol 1988; 255 (4 Pt 2): H742-753. [ Links ]
13. Linton NW, Linton RA. Estimation of changes in cardiac output from the arterial blood pressure waveform in the upper limb. Br J Anaesth. 2001; 86 (4): 486-496. [ Links ]
14. Cecconi M, Fawcett J, Grounds RM, Rhodes A. A prospective study to evaluate the accuracy of pulse power analysis to monitor cardiac output in critically ill patients. BMC Anesthesiol 2008; 8: 3. [ Links ]
15. Fortin J, Habenbacher W, Heller A, Hacker A, Grullenberger R, Innerhofer J, et al. Non-invasive beat-to-beat cardiac output monitoring by an improved method of transthoracic bioimpedance measurement. Comput Biol Med 2006; 36 (11): 1185-1203. [ Links ]
16. Mathews L, Singh RK. Cardiac output monitoring. Ann Card Anaesth. 2008; 11 (1): 56-68. [ Links ]
17. Kubicek WG KJ, Patterson RP, Witsoe DA, Mattson RH. Development and evaluation of an impedance cardiac output system. Aerosp Med1966; 37: 1208-1212. [ Links ]
18. Newman DG, Callister R. The non-invasive assessment of stroke volume and cardiac output by impedance cardiography: a review. Aviat Space Environ Med 1999; 70 (8): 780-789. [ Links ]
19. Winter UJ KR, Kubicek WG, Niederlag W. Thoracic impedance measurements in Clinical Cardiology. New York: Thieme Medical Publishers; 1994. [ Links ]
20. Sramek BB. Thoracic electrical bioimpedance measurement of cardiac output. Crit Care Med 1994; 22 (8): 1337-1339. [ Links ]
21. Bernstein DP. A new stroke volume equation for thoracic electrical bioimpedance: theory and rationale. Crit Care Med 1986; 14 (10): 904-909. [ Links ]
22. Hamilton WF RJ. The measurement of the stroke volume from the pulse pressure. Am J Physiol 1947; 14: 148-151. [ Links ]
23. Tsadok S. The historical evolution of bioimpedance. AACN Clin Issues 1999; 10 (3): 371-384. [ Links ]
24. Saunders CE. The use of transthoracic electrical bioimpedance in assessing thoracic fluid status in emergency department patients. Am J Emerg Med 1988; 6 (4): 337-340. [ Links ]
25. Mattar JA, Shoemaker WC, Diament D, Lomar A, Lopes AC, De Freitas E, Stella FP, et al. Systolic and diastolic time intervals in the critically ill patient. Crit Care Med 1991; 19 (11): 1382-1386. [ Links ]
26. Summers RL, Kolb JC, Woodward LH, Galli RL. Differentiating systolic from diastolic heart failure using impedance cardiography. Acad Emerg Med 1999; 6 (7): 693-699. [ Links ]
27. Garrard CL, Jr., Weissler AM, Dodge HT. The relationship of alterations in systolic time intervals to ejection fraction in patients with cardiac disease. Circulation 1970; 42 (3): 455-462. [ Links ]
28. Capan LV BD, Patel KP, Sanger J, Turndorf H. Measurement of ejection fraction by bioimpedance method. Crit Care Med 1987; 15: 402. [ Links ]
29. Woltjer HH, Bogaard HJ, Bronzwaer JG, de Cock CC, de Vries PM. Prediction of pulmonary capillary wedge pressure and assessment of stroke volume by noninvasive impedance cardiography. Am Heart J 1997; 134 (3): 450-455. [ Links ]
30. Summers RL. Noninvasive Hemodynamic monitoring using impedance cardiography. Crit Care Int 1999; 9: 9-12. [ Links ]
31. Van De Water JM, Miller TW, Vogel RL, Mount BE, Dalton ML. Impedance cardiography: the next vital sign technology? Chest 2003; 123 (6): 2028-2033. [ Links ]
32. Albert NM, Hail MD, Li J, Young JB. Equivalence of the bioimpedance and thermodilution methods in measuring cardiac output in hospitalized patients with advanced, decompensated chronic heart failure. Am J Crit Care 2004; 13 (6): 469-479. [ Links ]
33. Drazner MH, Thompson B, Rosenberg PB, Kaiser PA, Boehrer JD, Baldwin BJ, et al. Comparison of impedance cardiography with invasive hemodynamic measurements in patients with heart failure secondary to ischemic or nonischemic cardiomyopathy. Am J Cardiol 2002; 89 (8): 993-995. [ Links ]
34. Ziegler D GL, Krucke G. Comparison of cardiac output measurements by TEB vs. intermitent bolus thermodilution in mechanical ventilated patients. . Chest 1999; 116: 281S. [ Links ]
35. Sageman WS, Riffenburgh RH, Spiess BD. Equivalence of bioimpedance and thermodilution in measuring cardiac index after cardiac surgery. J Cardiothorac Vasc Anesth 2002; 16 (1): 8-14. [ Links ]
36. Yung GL, Fedullo PF, Kinninger K, Johnson W, Channick RN. Comparison of impedance cardiography to direct Fick and thermodilution cardiac output determination in pulmonary arterial hypertension. Congest Heart Fail 2004; 10 (2 Suppl 2): 7-10. [ Links ]
37. Belardinelli R, Ciampani N, Costantini C, Blandini A, Purcaro A. Comparison of impedance cardiography with thermodilution and direct Fick methods for noninvasive measurement of stroke volume and cardiac output during incremental exercise in patients with ischemic cardiomyopathy. Am J Cardiol 1996; 77 (15): 1293-1301. [ Links ]
38. Fuller HD. The validity of cardiac output measurement by thoracic impedance: a meta-analysis. Clin Invest Med 1992; 15 (2): 103-112. [ Links ]
39. Raaijmakers E, Faes TJ, Scholten RJ, Goovaerts HG, Heethaar RM. A meta-analysis of three decades of validating thoracic impedance cardiography. Crit Care Med 1999; 27 (6): 1203-1213. [ Links ]
40. Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet 1986; 1 (8476): 307-310. [ Links ]
41. Shoemaker WC, et al. Multicenter study of noninvasive monitoring systems as alternatives to invasive monitoring of acutely ill emergency patients. Chest 1998; 114 (6): 1643-1652. [ Links ]
42. Verhoeve PE CC, Tsadok S. Reproducibility of noninvasive bioimpedance measurements of cardiac function. J Card Fail 1998; 4 (suppl): S3. [ Links ]
43. Srameck BB. Thoracic electrical bioimpedance: basic principles and phisiologic relationship. Noninvas Cardiol 1994; 3: 83-88. [ Links ]
44. Smith RD, Levy P, Ferrario CM. Value of noninvasive hemodynamics to achieve blood pressure control in hypertensive subjects. Hypertension. 2006; 47 (4): 771-777. [ Links ]
45. Ventura HO, Taler SJ, Strobeck JE. Hypertension as a hemodynamic disease: the role of impedance cardiography in diagnostic, prognostic, and therapeutic decision making. Am J Hypertens 2005; 18 (2 Pt 2): 26S-43S. [ Links ]
46. Santos JF, Caetano F, Parreira L, Madeira J, Cardoso P, Fonseca N, et al. Tissue Doppler echocardiography for evaluation of patients with ventricular resynchronization therapy. Rev Port Cardiol 2003; 22 (11): 1363-1371. [ Links ]
47. Yancy C, Abraham WT. Noninvasive hemodynamic monitoring in heart failure: utilization of impedance cardiography. Congest Heart Fail 2003; 9 (5): 241-250. [ Links ]
48. Taler SJ, Textor SC, Augustine JE. Resistant hypertension: comparing hemodynamic management to specialist care. Hypertension 2002; 39 (5): 982-988. [ Links ]
49. Sharman DL, Gomes CP, Rutherford JP. Improvement in blood pressure control with impedance cardiography-guided pharmacologic decision making. Congest Heart Fail 2004; 10 (1): 54-58. [ Links ]
50. Silver MA, Cianci P, Brennan S, Longeran-Thomas H, Ahmad F. Evaluation of impedance cardiography as an alternative to pulmonary artery catheterization in critically ill patients. Congest Heart Fail 2004; 10 (2 Suppl 2): 17-21. [ Links ]
51. Santos JF, Parreira L, Madeira J, Fonseca N, Soares LN, Ines L. Non invasive hemodynamic monitorization for AV interval optimization in patients with ventricular resynchronization therapy. Rev Port Cardiol 2003; 22 (9): 1091-1098. [ Links ]
52. Berry C, Murdoch DR, McMurray JJ. Economics of chronic heart failure. Eur J Heart Fail 2001; 3 (3): 283-291. [ Links ]
53. Forrester JS, Diamond G, Chatterjee K, Swan HJ. Medical therapy of acute myocardial infarction by application of hemodynamic subsets (first of two parts). N Engl J Med 1976; 295 (24): 1356-1362. [ Links ]
54. Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, Mudge GH, et al. Clinical assessment identifies hemodynamic profiles that predict outcomes in patients admitted with heart failure. J Am Coll Cardiol 2003; 41 (10): 1797-1804. [ Links ]
55. Franciosa JA, Wilen M, Ziesche S, Cohn JN. Survival in men with severe chronic left ventricular failure due to either coronary heart disease or idiopathic dilated cardiomyopathy. Am J Cardiol 1983; 51 (5): 831-836. [ Links ]
56. Moshkowitz Y KE, Milo O, Vered Z, Cotter G. Recent developments in cardiac output determination by bioimpedance: comparison with invasive cardiac output and potential cardiovascular applications. Curr Opin Cardiol 2004; 19: 229-237. [ Links ]
57. Spinale FG, Hendrick DA, Crawford FA, Carabello BA. Relationship between bioimpedance, thermodilution, and ventriculographic measurements in experimental congestive heart failure. Cardiovasc Res 1990; 24 (5): 423-429. [ Links ]
58. Greenberg BH, Hermann DD, Pranulis MF, Lazio L, Cloutier D. Reproducibility of impedance cardiography hemodynamic measures in clinically stable heart failure patients. Congest Heart Fail 2000; 6 (2): 74-80. [ Links ]
59. Packer M, Abraham WT, Mehra MR, Yancy CW, Lawless CE, Mitchell JE, et al. Utility of impedance cardiography for the identification of short-term risk of clinical decompensation in stable patients with chronic heart failure. J Am Coll Cardiol 2006; 47 (11): 2245-2252. [ Links ]
60. O'Donnell D, Nadurata V, Hamer A, Kertes P, Mohamed U. Long-term variations in optimal programming of cardiac resynchronization therapy devices. Pacing Clin Electrophysiol 2005; 28 (Suppl 1): S24-26. [ Links ]
61. van Gelder BM, Bracke FA, Meijer A, Lakerveld LJ, Pijls NH. Effect of optimizing the VV interval on left ventricular contractility in cardiac resynchronization therapy. Am J Cardiol 2004; 93 (12): 1500-1503. [ Links ]
62. Tse HF, Yu C, Park E, Lau CP. Impedance cardiography for atrioventricular interval optimization during permanent left ventricular pacing. Pacing Clin Electrophysiol 2003; 26 (1 Pt 2): 189-191. [ Links ]
63. Braun MU, Schnabel A, Rauwolf T, Schulze M, Strasser RH. Impedance cardiography as a noninvasive technique for atrioventricular interval optimization in cardiac resynchronization therapy. J Interv Card Electrophysiol 2005; 13 (3): 223-229. [ Links ]
64. Ovsyshcher I, Gross JN, Blumberg S, Furman S. Precision of impedance cardiography measurements of cardiac output in pacemaker patients. Pacing Clin Electrophysiol 1992; 15 (11 Pt 2): 1923-1926. [ Links ]
65. Kindermann M, Frohlig G, Doerr T, Schieffer H. Optimizing the AV delay in DDD pacemaker patients with high degree AV block: mitral valve Doppler versus impedance cardiography. Pacing Clin Electrophysiol 1997; 20 (10 Pt 1): 2453-2462. [ Links ]
66. Heinroth KM, Elster M, Nuding S, Schlegel F, Christoph A, Carter J, et al. Impedance cardiography: a useful and reliable tool in optimization of cardiac resynchronization devices. Europace 2007; 9 (9): 744-750. [ Links ]
67. Panacek EA. Intensive care unit care in the emergency department? Acad Emerg Med 1999; 6 (7): 675-677. [ Links ]














