Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.4 Bogota July/Aug. 2009
Un nuevo abordaje y alternativa
A new approach and alternative
(1)Universidad Militar Nueva Granada. Facultad de Medicina. Tr. 5 No. 49-00, Bogotá, DC., Colombia.
Correspondencia: Dr. Enrique Melgarejo. Universidad Militar Nueva Granada. Facultad de Medicina. Tr. 5 No. 49-00, Bogotá, DC., Colombia. Correo electrónico: emelgarejo@etb.net.co
Recibido: 17/12/2008. Aceptado: 11/05/2009.
Desde hace mucho tiempo se sabe que en las diferentes escalas zoológicas la frecuencia cardiaca es un factor que determina la esperanza de vida en años. En la especie humana parece suceder algo similar. En un reciente estudio (BEAUTIFUL), en enfermos con falla cardiaca y enfermedad coronaria, los pacientes con una frecuencia cardiaca > 70 lpm obtuvieron un beneficio significativo en eventos coronarios, hospitalización por infarto del miocardio y revascularización coronaria, al reducirla con un nuevo medicamento que actúa exclusivamente en la corriente If del nodo sinusal, reduciéndola sin componente hemodinámico asociado (esto es, no efecto inotrópico negativo).
La enfermedad isquémica cardiaca se ha visto como un disbalance entre la oferta y la demanda de oxígeno en el miocardio. Por tal motivo, los medicamentos que disminuyen su consumo (betabloqueadores y algunos calcioantagonistas), a través del efecto inotrópico negativo, se han convertido en el pilar fundamental para el manejo de este proceso. Sin embargo, el efecto betabloqueador tiene un sobrecosto el cual es el efecto vasoconstrictor mediado por el efecto alfa que se libera al bloquear los receptores beta. De ahí que los betabloqueadores con efecto vasodilatador -carvedilol, nebivolol- no tengan esta desventaja. Recientemente, surgió una nueva clase terapéutica que puede coadyuvar en el manejo de enfermos coronarios, al disminuir de manera selectiva la frecuencia cardiaca y prolongar el tiempo de llenado diastólico, mejorando la perfusión miocárdica sobre todo en la zona más vulnerable: el sub-endocardio. El primer medicamento de esta clase es la ivabradina. Se hace una revisión sobre el papel de la frecuencia cardiaca en el sistema cardiovascular, la corriente If, la fisiología de la enfermedad isquémica cardiaca y los beneficios de la ivabradina al disminuir exclusivamente la frecuencia cardiaca con su impacto adicional sobre la pared vascular y más específicamente en la hemodinámica de la placa aterosclerótica.
Palabras clave: isquemia cardiaca, frecuencia cardiaca, ivabradina, enfermedad coronaria.
We have known for many years that in the different zoological scales the heart rate is a determinant of life expectancy in years. It seems that something similar occurs in the human species. In a recent study (BEAUTIFUL), performed in patients with heart failure and coronary heart disease, patients with heart rate higher or equal to 70 beats per minute had a significant benefit in coronary events, hospitalization for cardiac infarct and coronary revascularization, by reducing it with a new drug that acts exclusively in the sinus node If current, without any hemodynamic associated component (this is, no inotropic negative effect).
Ischemic heart disease has been seen as an imbalance between oxygen supply and demand in the myocardium. Therefore, medications that decrease its consumption (betablockers and some calcium antagonists) have become the mainstay for the management of this process, due to its negative inotropic effect. Nevertheless, betablocker effect has an extra cost that is the vasoconstrictor effect, mediated by the alfa effect that is liberated when blocking the beta receptors. For that reason, betablockers with vasodilator effect-carvediol, nebivolol- do not have this disadvantage. Recently, a new therapeutic class that may help in coronary patients management emerged, by selectively decreasing the heart rate and prolonging diastolic filling time, improving myocardial perfusion especially in the most vulnerable zone: the subendocardium. The first specific heart rate-lowering agent is ivabradine. A review of the heart rate role on the cardiovascular system, the If current, ischemic heart disease physiology, and ivabradine benefits when exclusively decreasing the heart rate with its additional impact on the vascular wall and more specifically in the atheroesclerotic plaque hemodynamics, is made.
Key Words: cardiac ischemia, heart rate, ivabradine, coronary disease.
Introducción
Desde hace varios años se ha demostrado que la frecuencia cardiaca es un factor determinante en la expectativa de vida de las especies. Las que manejan frecuencias cardiacas rápidas, duran mucho menos en comparación con las que manejan frecuencias cardiacas relativamente lentas (1). Por ejemplo, la drosófila con una frecuencia cardiaca de 1.000 latidos por minuto (lpm) dura sólo días, mientras que las tortugas o las marmotas y elefantes que manejan una frecuencia cardiaca alrededor de 30 a 40 lpm duran muchos más años. Curiosamente, las especies más pequeñas manejan una frecuencia cardiaca más alta y duran menos, mientras que las más grandes manejan una frecuencia cardiaca más lenta y duran más (adaptación, epigenética?).
En humanos, la frecuencia cardiaca alta en reposo tiene una correlación directa tanto para mortalidad total como cardiovascular, hecho que se desprende de diversos estudios epidemiológicos a gran escala, como el Framingham, el Chicago y el NHANES I (2-4). Este hecho ya documentado en la población general, también lo ha sido en poblaciones más específicas tales como: sujetos añosos, hipertensos, pacientes con infarto agudo del miocardio, diabéticos y revascularizados mediante by-pass aorto-coronario (5-9). Un reciente estudio en cerca de 25.000 pacientes con enfermedad coronaria, también encontró que la frecuencia cardiaca en reposo es un factor predictor independiente de mortalidad total y cardiovascular, las cuales se incrementan de manera proporcional en la medida en que se eleva la frecuencia cardiaca (10). Pero quizás lo más interesante de todos estos estudios, es que el riesgo parecería aumentar a partir de una frecuencia cardiaca basal de 60 lpm, lo cual ha sido corroborado en un estudio francés hecho en población de bajo riesgo, en donde sujetos con una frecuencia cardiaca mayor de 60 lpm tuvieron mayor mortalidad total y cardiovascular (11) (Figura 1).
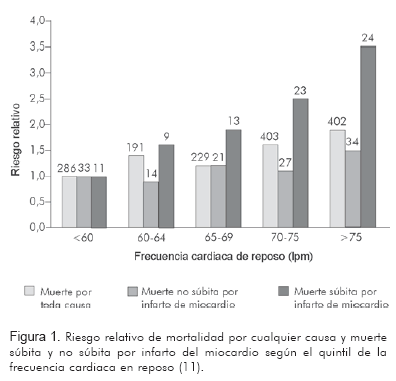
Dos publicaciones recientes confirman el valor pronóstico de la frecuencia cardiaca. Por un lado, un estudio prospectivo que incluyó 379.843 pacientes de 40 a 45 años, encontró una asociación entre la frecuencia cardiaca y la mortalidad total y cardiovascular, aunque esta asociación fue más débil después de ajustar las diferencias en relación con otros factores de riesgo (12). Finalmente, un estudio francés (13) realizado en sujetos aparentemente jóvenes, encontró que aquellos que reducían su frecuencia cardiaca durante cinco años, tenían una disminución del riesgo de mortalidad de -14% (RR 0,86, 95% IC 0,74 a 1,00; p = 0,05), mientras que aquellos con un incremento de la frecuencia cardiaca durante cinco años, tenían un +19% en riesgo de mortalidad (RR 1,19, IC 95% 1,04 a 1,37; p <0,012), concluyendo que la frecuencia cardiaca en reposo en un período de cinco años, es un predictor independiente de mortalidad.
Recientemente el estudio BEAUTIFUL con casi 11.000 pacientes con enfermedad coronaria crónica y disfunción ventricular izquierda (14), demostró que la frecuencia cardiaca elevada (> 70 o más lpm) identifica a los pacientes con riesgo incrementado de desenlaces cardiovasculares. Además, este estudio evaluó el beneficio de la reducción de la frecuencia cardiaca con un medicamento que disminuye exclusivamente la frecuencia cardiaca (la ivabradina) en pacientes con enfermedad coronaria crónica, mostrando precisamente que la reducción de la frecuencia cardiaca crónica en enfermos que tuvieron una frecuencia cardiaca basal > 70 lpm, disminuyó significativamente el riesgo de hospitalización por infarto del miocardio y la revascularización coronaria (15).
La fisiología compleja de la frecuencia cardiaca
El corazón no es simplemente un músculo
El corazón ya no se mira ni se trata simplemente como un músculo especializado tal y como era visto hasta hace pocos años: como una bomba hemodinámica que nutre los órganos y tejidos del organismo. Ahora se ha expandido el concepto de funcionalidad de este órgano como una glándula mecano-eléctrica. Glándula porque 70% de su estructura es matriz extracelular, y si se involucra además el endocardio y el endotelio, en su gran conjunto extra-miocítico, allí confluyen sustancias con funciones paracrinas, autocrinas y endocrinas (angiotensina tisular, endotelina, óxido nítirico, prostaciclina, tromboxano A2, catecolaminas, aldosterona, hormona tiroidea, paratohormona, interleukinas etc.). De igual forma, el corazón involucra un complejo mecanismo metabólico auto-regulatorio, que se verá más adelante, todo lo cual incide de modo directo o indirecto en la modulación de la frecuencia cardiaca.
Por otra parte, su desempeño como músculo (30% constituido por cardiomiocitos) le imprime una función mecánica influenciada por estímulos eléctricos, lo cual le permite comportarse como una víscera cíclica y armónica con propiedades de automaticidad.
La función eléctrica del corazón
Está dada por los dos tipos de potencial de acción: los responsables del automatismo (canales lentos calcio-dependientes los cuales están más concentrados en las células P del nodo sinoatrial), y los potenciales de acción de despolarización y acople electro-mecánico (canales rápidos Na+ y Ca++ dependientes), que están distribuidos a lo largo y ancho de las fibras de trabajo del miocardio. Los primeros son responsables de la automaticidad, y los segundos, de la propagación de los estímulos y al mismo tiempo del acople electro-mecánico.
La corriente If
Es una corriente iónica crucial de baja amplitud, que se origina en los canales HCN y tiene el papel de determinar la pendiente de despolarización diastólica, regulando y controlando la frecuencia cardiaca. Si no fuera por la corriente If tan sólo viviríamos una gloriosa sístole.
En 1979, Di Francesco describió por primera vez, en conjunto con Brown y Noble, una corriente iónica responsable de la generación de actividad espontánea, la corriente If, f por «funny» (curiosa) debido a propiedades inusuales en comparación con otras corrientes conocidas en la época (Figura 2) (16).
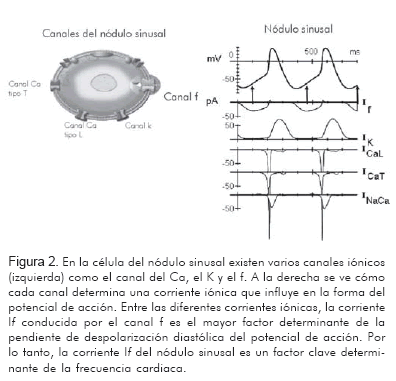
La corriente If y su intervención farmacológica
La frecuencia cardiaca está autorregulada por los requerimientos metabólicos y por el influjo adrenérgico, siendo la determinante más importante para el consumo de oxígeno miocárdico, y contribuyendo también al aporte de oxígeno miocárdico, el cual es predominante en la diástole. De tal manera que un ritmo más lento (mayor diástole), aumenta el tiempo de llenado diastólico facilitando en mayor medida el tiempo y la magnitud de la perfusión miocárdica, y más hacia el territorio subendocárdico, el más vulnerable ante la isquemia (Figura 3).
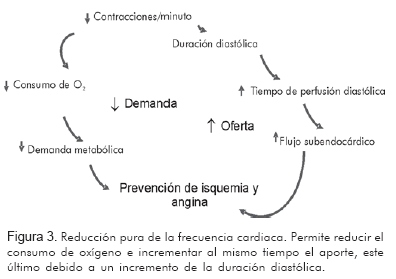
Al modificar exclusivamente la corriente If y disminuir de esta forma la frecuencia cardiaca, se logran los beneficios mencionados, sin ningún efecto secundario o deletéreo asociado a nivel inotrópico o lusitrópico, preservando así la integridad de la contractilidad ventricular (17).
La energética cardiaca y su relación con la frecuencia cardiaca
El corazón humano se contrae más de 100.000 veces por día, 37 millones de veces por año, y así sucesivamente durante 70 a 80 años. Consume 30 Kg de ATP por día, es decir 11.000 Kg por año. Cada latido cardiaco tiene un costo de 300 mg de ATP. Es así como disminuir la frecuencia cardiaca 10 lpm se traduce en ahorrar 5 Kg de ATP cada día (18).
De tal manera que cualquier intervención que reduzca la frecuencia cardiaca (condicionamiento cardiaco por ejercicio, medicamentos, bio-feedback, etc), tendrá un impacto en el consumo energético del corazón, de enorme valor e importancia, en especial en el enfermo coronario.
Beneficios clínicos de la reducción de la frecuencia cardiaca
Como ya se mencionó, se ha evidenciado que la frecuencia cardiaca en reposo se asocia con la mortalidad cardiovascular y total. Ahora bien, el simple ejercicio practicado de manera rutinaria, entre otros efectos benéficos, reduce la frecuencia cardiaca basal al lograrse un acondicionamiento físico del corazón.
Además, el empleo de algunos medicamentos que disminuyen la frecuencia cardiaca ha mostrado beneficio sobre la mortalidad en sujetos con enfermedad coronaria y falla cardiaca crónica, como es el caso de los betabloqueadores, los cuales tienen un efecto anti-isquémico preponderante por la reducción de la frecuencia cardiaca (19), ya que éste se pierde cuando se realiza sobre-estimulación atrial con marcapasos (20).
Otro hecho demostrado es que la mayoría de los factores de riesgo (hipertensión arterial, diabetes, tabaquismo, dislipidemia, sedentarismo y obesidad), se asocian con una hiperactividad del sistema simpático, lo cual se traduce en mayor frecuencia cardiaca con relación a la población no expuesta.
Se sabe que en enfermos con enfermedad coronaria, cualquier incremento de la frecuencia cardiaca por cualquier vía (ejercicio, estrés mental, frío, etc.), puede desencadenar angina o isquemia silente, independientemente de la terapéutica utilizada (betabloqueadores, calcioantagonistas, nitratos, antiplaquetarios, etc.).
Así mismo, es necesario recordar que a la mayoría de episodios isquémicos los precede un incremento de la frecuencia cardiaca. Andrews y colaboradores (21) encontraron que 81% de los episodios de isquemia están precedidos por un incremento de la frecuencia cardiaca de 5 lpm o más en una evaluación durante monitoreo ambulatorio Holter en pacientes con enfermedad coronaria (Figura 4).
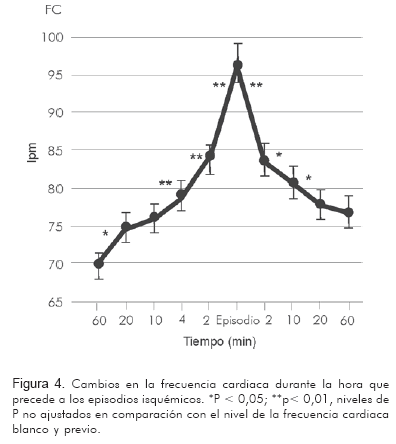
Puede esperarse que la intervención de la frecuencia cardiaca mediante un medicamento que la disminuya -independientemente de causar efectos hemodinámicos-, incida de manera favorable en la sintomatología y en la morbi-mortalidad en enfermos cardiovasculares, y más específicamente en enfermos coronarios.
Agentes que reducen exclusivamente la frecuencia cardiaca
El concepto de buscar medicamentos que pudieran influenciar directa y exclusivamente la frecuencia cardiaca, surge desde hace cerca de 25 años a raíz del descubrimiento de los canales HCN (hyperpolarization-activated cyclic nucleotide-gated). Como ya se mencionó, el papel de estos canales es modular la corriente de despolarización diastólica del tejido especializado del nodo sinusal.
Se han identificado a su vez cuatro isoformas de estos canales (HCN1 a HCN4), que grosso modo, varían en su distribución en diferentes tejidos.
De las isoformas identificadas, la que más se expresa en el nódulo sinusal es la HCN4, mientras que existe una débil expresión de HCN1 o HCN2 (22-24). La HCN4 también está presente en el nodo AV y en las fibras de Purkinje, permanece en estas últimas estructuras en forma inactiva, y eventualmente se activa en condiciones anormales tales como falla cardiaca e hipertrofia del miocardio (lo cual explicaría la aparición de ectopias en estas circunstancias).
La expresión de estos canales y la densidad de esta corriente en el corazón, cambian durante el desarrollo (25), en los estados de enfermedad y en respuesta a la hormona tiroidea (26).
La frecuencia cardiaca, la isquemia y su intervención
En presencia de circulación coronaria normal, el metabolismo celular autorregula el proceso de vasodilatación supliendo la mayor demanda de oxígeno en caso de requerirse. Es decir, cualquier aumento en la demanda de oxígeno, de manera refleja, incrementa la frecuencia cardiaca lo cual acorta la duración de la diástole y por consiguiente el ciclo cardiaco. De esta manera, en un corazón intacto se mantiene el flujo y el aporte de oxígeno de forma armónica y proporcionada. Pero si existe una obstrucción al flujo, cualquier incremento de la frecuencia cardiaca altera este balance, ocasionando incluso el efecto de «robo» a la circulación colateral o a los pequeños vasos distales a la obstrucción, empeorando la isquemia, especialmente en el territorio subendocárdico.
Los betabloqueadores de primera y segunda generación (sin efecto vasodilatador), reducen la frecuencia cardiaca y por ende el consumo de oxígeno, pero disminuyen además el estado inotrópico, un impacto hemodinámico no siempre deseado. Aunado a lo anterior, al bloquear los receptores beta predominan los alfa -efecto vasoconstrictor-, si el betabloqueador empleado no tiene efecto alfa bloqueador asociado o efecto vasodilatador directo, generándose vasoconstricción distal. Esto explica por qué los enfermos que reciben betabloqueadores de primera y segunda generación (no selectivos y beta-1 selectivos respectivamente como por ejemplo: metoprolol o propranolol) se quejan de extremidades frías y fatiga, y explica también el por qué están contraindicados en enfermedad vascular arterial periférica.
En otros estudios en los cuales se utilizaron betabloqueadores en enfermos coronarios, se observó que donde hubo mayor impacto de beneficios fue en aquellos en quienes se logró disminuir más la frecuencia cardiaca (27).
Fue precisamente esto lo que motivó la investigación hacia un fármaco que disminuyera exclusivamente la frecuencia cardiaca sin repercusión hemodinámica, ni comprometer el gasto cardiaco o la circulación coronaria y periférica. Así surgió la ivabradina.
Reducción pura de la frecuencia cardiaca por inhibición selectiva y específica de la corriente If con ivabradina. Una nueva perspectiva de la enfermedad isquémica cardiaca
Diferentes estudios clínicos aleatorizados demuestran que ivabradina es un fármaco anti-isquémico eficaz, que reduce la frecuencia cardiaca y mejora la capacidad al esfuerzo.
Ejerce un bloqueo de la corriente If cuando entra en el poro del canal HCN4 desde el lado intracelular y se une a un sitio localizado en la zona de flujo iónico (Figura 5).
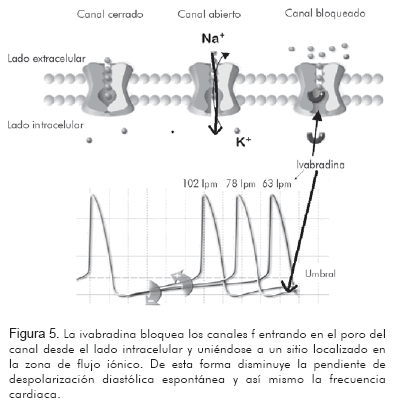
La unión y desunión de ivabradina a este sitio, sólo puede ocurrir cuando el canal está abierto; de esta forma, el bloqueo depende del uso de este canal. Por lo tanto, el grado de bloqueo será mayor cuanto más alta sea la frecuencia cardiaca, lo que es ventajoso en la práctica clínica ya que la reducción de la frecuencia cardiaca será proporcional a la frecuencia cardiaca basal (28).
La ivabradina no interfiere con la conducción de los impulsos eléctricos a lo largo o ancho del miocardio (no altera la anisotropía).
Los efectos de la reducción exclusiva de la frecuencia cardiaca mediante la inhibición selectiva de los canales If con el empleo de ivabradina, se traducen básicamente en disminuir el consumo de oxígeno y mejorar el aporte, esto último debido a una mejoría del tiempo de perfusión diastólica que es superior al que se obtiene con betabloqueadores (29). Además, la ivabradina preserva la contractilidad miocárdica (30) y la vasodilatación coronaria durante el ejercicio (15). También protege al miocardio en condiciones de isquemia aguda y ha demostrado efectos favorables sobre el remodelado (31).
Adicionalmente, los efectos mecano-hemodinámicos que significan reducir la frecuencia cardiaca en la enfermedad coronaria, se traducen en un beneficio anti-aterogénico y estabilización de la placa -ver más adelante-.
El sistema nervioso simpático en el continuum aterotrombótico
El sistema nervioso simpático está involucrado en cuanto a causa y magnificación del daño vascular incluyendo la aterosclerosis. Es así como las consecuencias de su activación, tales como taquicardia, hipertensión arterial, presión de pulso elevada, aumento de la viscosidad sanguínea y cambios metabólicos (hiperinsulinemia, hiperglicemia, dislipidemia hipertiroidismo y obesidad), inciden como causa o efecto del daño vascular.
Específicamente, el incremento de la frecuencia cardiaca -como ya se mencionó- se asocia a mayor morbimortalidad por aterosclerosis, independientemente de otros factores de riesgo.
En estudios experimentales se ha visto que a mayor frecuencia cardiaca se desarrolla más aterosclerosis (32), y así la disminución de la frecuencia cardiaca, ya sea farmacológica o con ablación del nodo SA (33), reduce la aterosclerosis en carótidas y arterias coronarias. Existe evidencia con ivabradina a nivel experimental en el mismo sentido (34).
La isquemia cardiaca y la hemodinámica del daño vascular
Las lesiones ateroscleróticas se localizan más en los puntos de bifurcación y en las curvaturas. Esto se debe en gran parte a la fuerza de rozamiento y a la fuerza tensional. La fuerza de rozamiento es la fuerza tangencial derivada de la fricción de la sangre sobre la superficie endotelial y se define como el producto de la viscosidad sanguínea (m) y la tasa de rozamiento sobre las paredes (dv/ds).
Esta tasa representa qué tan rápido cambia la velocidad de la sangre entre el centro del vaso y la pared. La fuerza tensional, también conocida como estrés circunferencial, constituye la primera derivada fuerza/presión impuesta de manera circunferencial a la pared vascular, la cual se relaciona en forma proporcional con el radio de la luz y el diámetro de la pared (32). Una frecuencia cardiaca alta incrementa la naturaleza pulsátil del flujo sanguíneo arterial y expone las regiones susceptibles a un mayor estrés mecánico y fuerza de rozamiento (35).
De tal manera, la interacción de estas dos fuerzas es más crítica en los sitios de bifurcación y/o en arterias de menor calibre o tortuosas, facilitando o magnificando el daño endotelial, y por consiguiente el inicio del proceso aterogénico en la pared vascular.
Hemodinámica del flujo coronario
El mayor determinante del flujo coronario es la resultante de la oposición que ejerce el ventrículo en cada sístole y la presión endocavitaria de los ventrículos (especialmente el ventrículo izquierdo), la cual es mayor al final de la diástole. Vista de otra manera, es la resultante de la diferencia entre la presión aórtica y la intraventricular. Es por esto que la perfusión es mayor en la diástole que en la sístole.
Hemodinámica local y aterosclerosis
Las células endoteliales tienen propiedad de mecano-transducción (36), la cual consiste en detectar fuerzas hemodinámicas y convertirlas en señales bioquímicas, para generar finalmente una expresión genética mediada por la des-represión de la súper-familia de factores de transcripción KB, llegando aún a modificar su fenotipo, que incluso puede y suele ser pro-aterosclerótico, es decir, una célula pegajosa (expresa moléculas de adhesión), inflamada y oxidada.
La frecuencia cardiaca aumentada en forma prolongada, además altera el cito-esqueleto de la célula endotelial y promueve la apoptosis, haciendo al endotelio más permeable a macromoléculas incluyendo al LDL y las células inflamatorias (monocitos, linfocitos T, mastocitos, etc.). A su vez el aumento de la presión tangencial ocasiona daño directo endotelial facilitando también el paso de macromoléculas, así como la expresión de mediadores inflamatorios, incluyendo las metaloproteinasas, las cuales pueden desestabilizar las placas ateroscleróticas al degradar la capa fibrosa.
Otro hecho crucial, desde el punto de vista hemodinámico, es la interrelación entre la frecuencia cardiaca, la presión arterial media y la presión de pulso, los cuales aisladamente y en conjunto ocasionan un «estrés de fatiga» en la célula endotelial, permitiendo así el proceso de aterogénesis, simplemente por la disfunción endotelial.
La frecuencia cardiaca amplifica el daño estructural coronario
Las arterias coronarias son los vasos más susceptibles al desarrollo de aterosclerosis, debido a su compleja estructura anatómica aunada a los cambios dinámicos propios del ciclo cardiaco. Los vasos epicárdicos sufren constante movimiento y presión durante cada sístole y diástole, ya que están estrechamente adheridos al miocardio latiente, y sufren además un movimiento de torsión y de curvatura en cada sístole-diástole. Cualquier incremento sostenido de la frecuencia cardiaca, magnifica estos cambios (mayor «estrés de fatiga»), promoviendo aún más el proceso aterogénico. Con todo lo anterior, si persiste de manera sostenida una frecuencia cardiaca elevada, se facilita el proceso aterotrombótico al producirse fatiga de la placa, y finalmente el desenlace aterotrombótico (37).
Ivabradina, estrés oxidativo, endotelio y aterogénesis
La disfunción endotelial precede los desenlaces cerebro-cardio-reno-angio-vasculares. La ivabradina, en forma experimental, ha demostrado restaurar la vasodilatación dependiente del endotelio sin afectar la presión arterial o el perfil lipídico. En un estudio experimental redujo de manera significativa el volumen de la placa aterosclerótica, a pesar de una hiperlipidemia persistente a la que se expusieron los animales de experimentación (43).
Es de anotar que la ivabradina ha mostrado inhibir significativamente la actividad de la NADPH-oxidasa al igual que la liberación del radical superóxido, reduciendo la peroxidación lipídica y evitando, por consiguiente, la oxidación de la fracción LDL del colesterol (43, 44).
Parece ser que la reducción crónica de la frecuencia cardiaca mediante ivabradina, inhibe el estrés oxidativo y la disfunción endotelial, y reduce en consecuencia el proceso aterogénico. Si este es un mecanismo primario o un epifenómeno, está por demostrarse.
Experiencia clínica con ivabradina
Varios estudios clínicos han documentado los efectos y beneficios de la reducción exclusiva de la frecuencia cardiaca con ivabradina en pacientes con enfermedad coronaria crónica, actuando específicamente a través de una reducción pura de la frecuencia cardiaca, con lo cual se mejore el aprote, se disminuye la demanda y se mantiene al mismo tiempo la contractilidad y la vasodilatación coronaria.
Estudios que evalúan el efecto anti-isquémico y antianginoso, y la mejoría en la capacidad de ejercicio
En un primer estudio aleatorizado, controlado con placebo, en 360 pacientes con angina estable y enfermedad arterial coronaria documentada, la ivabradina produjo reducciones de la frecuencia cardiaca en reposo y en ejercicio de aproximadamente 15 y 14 lpm respectivamente, acompañándose de una eficacia anti-isquémica y anti-anginosa significativa y dosis-dependiente (medida por los aumentos del tiempo para depresión de 1 mm del segmento ST y del tiempo para el inicio de la angina, respectivamente) durante la prueba de esfuerzo. Al mismo tiempo se documentó una reducción significativa de la frecuencia de las crisis de angina que los pacientes reportan en su vida cotidiana (38).
De otra parte, el estudio INITIATIVE (INternatIonal TrIAl on the Treatment of angina with IVabradinE versus atenolol), que comparó ivabradina con atenolol durante cuatro meses en 939 pacientes con angina de pecho estable, mostró que la duración total del ejercicio evaluada en prueba de esfuerzo aumentaba 86,8 y 91,7 segundos con ivabradina de 7,5 y 10 mg, respectivamente, y en 78,8 segundos con atenolol de 100 mg. La magnitud de la mejoría en la duración del esfuerzo tendió a ser superior con ivabradina en comparación con el grupo atenolol, mostrando que por cada latido de reducción de la frecuencia cardiaca hay un incremento en la duración total del ejercicio de 10,1 segundos con ivabradina versus 5,6 segundos con atenolol (Figura 6) (39).
En otro estudio doble ciego controlado en 1.195 pacientes, se evidenció que ivabradina es tan eficaz como amlodipino en pacientes con angina crónica estable y enfermedad coronaria documentada. La duración total del ejercicio, el tiempo a la angina limitante, el tiempo al inicio de la angina y el tiempo en que aparecía la depresión de 1 mm del segmento ST incrementaron de forma consistente en los pacientes tratados con ivabradina, confirmándose la no inferioridad en comparación con amlodipino (40).
La eficacia antianginosa de ivabradina a largo plazo se documentó en un estudio de un año de duración sin desarrollo de tolerancia farmacológica (41).
Su eficacia se ha evaluado no sólo como monoterapia sino también en asociación con otras terapias anti-isquémicas y antianginosas. El estudio ASSOCIATE (42) evaluó 889 pacientes con enfermedad coronaria documentada, previamente tratados con atenolol, y demostró que la adición de ivabradina produce una mejoría significativa de la capacidad de ejercicio, siendo paralelamente bien tolerado, con bajo riesgo de bradicardia.
Ivabradina y enfermedad coronaria con disfunción ventricular
En pacientes con disfunción ventricular izquierda, la ivabradina reduce la frecuencia cardiaca en reposo sin alterar la contractilidad miocárdica (45). Por tanto, en la clínica se puede conseguir una reducción exclusiva de la frecuencia cardiaca como resultado de una inhibición específica y selectiva de la corriente If (exclusivo efecto cronotrópico negativo), y sin comprometer otras funciones cardiacas fundamentales para el rendimiento cardiaco y la perfusión vascular (inotropismo, lusitropismo, batmotropismo, vasodilatación etc.).
Además, en pacientes con disfunción ventricular sistólica del ventrículo izquierdo, al disminuir la frecuencia cardiaca se prolonga el tiempo de llenado diastólico, y por lo tanto el llenado ventricular con el consiguiente mejoramiento de la fracción de eyección.
Un estudio doble ciego en pacientes con enfermedad coronaria y disfunción ventricular izquierda moderada (fracción de eyección de 30% a 45%) en clase funcional II, mostró que después de tres meses de tratamiento, la frecuencia cardiaca se redujo significativamente en 16 lpm, mientras que la función mostró una tendencia a una reducción a los volúmenes de fin de diástole y sístole sugiriendo que la ivabradina mejora la geometría en la disfunción sistólica (31).
El estudio SHIfT (The Systolic Heart failure treatment with the If inhibitor ivabradine Trial) actualmente en curso, evalúa el beneficio de la ivabradina en la mortalidad cardiovascular y la hospitalización por insuficiencia cardiaca en pacientes con insuficiencia cardiaca y fracción de eyección menor a 35% (46).
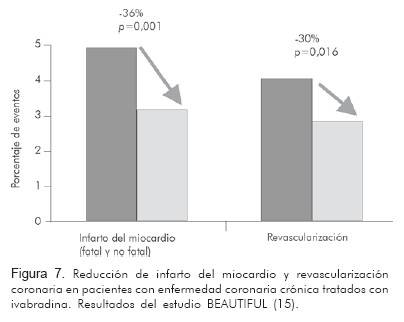
Recientemente se publicaron los resultados del BEAUTIFUL (15), un estudio multicéntrico, internacional, aleatorizado, doble ciego, diseñado para evaluar los efectos de la ivabradina en el pronóstico de los pacientes con enfermedad coronaria crónica documentada y disfunción del ventrículo izquierdo con o sin insuficiencia cardiaca. Los pacientes recibían con anterioridad terapia «óptima», utilizándose betabloquedores en 87%, fármacos del eje renina-angiotensina en 89%, antitrombóticos en 94% y estatinas en 76%. Luego de incluir casi 11.000 pacientes, con una fracción de eyección promedio de 32%, se demostró que la administración de ivabradina reduce la incidencia de eventos coronarios en los pacientes con una frecuencia cardiaca basal en reposo mayor o igual a 70 lpm. De hecho, la administración de este medicamento redujo la admisión hospitalaria por infarto del miocardio fatal y no fatal en 36% (RR 0,64, 95% CI 0,49—0,84; p=0,001) y la revascularización coronaria en 30% (RR 0,70, 95% CI 0,52-0,93; p=0,016) (Figura 7).
Es de anotar que el end-point primario compuesto en los enfermos con falla cardiaca, fue negativo (muerte cardiovascular, admisión hospitalaria por infarto del miocardio y admisión hospitalaria por insuficiencia cardiaca nueva o empeorada), esto en contraposición con los end-points «coronarios» citados previamente.
Una posible explicación a la ausencia de significancía en los end-points relacionados con insuficiencia cardiaca podría ser el hecho de que los pacientes con insuficiencia cardiaca suelen manejar (por su misma fisiopatología) frecuencias cardiacas más elevadas. El criterio de inclusión del estudio BEAUTIFUL fue una frecuencia cardiaca basal mayor o igual a 60 lpm (realmente baja en caso de falla), rango que le resta poder estadístico al estudio. El estudio SHIFT aclarará el rol de la ivabradina en desenlaces vinculados con insuficiencia cardiaca.
Ivabradina y transplante cardiaco
Debido a la denervación, los pacientes sometidos a transplante cardiaco pueden tener taquicardia sinusal que en ocasiones amerita un tratamiento farmacológico. En pacientes sometidos a trasplante cardiaco este medicamento ha demostrado ser eficaz y potencialmente mejor tolerado que los betabloqueadores (47).
Perspectivas clínicas
A pesar de la evidencia que sostiene la importancia de la frecuencia cardiaca en el desarrollo de enfermedades cardiovasculares, como factor determinante y gatillante de la isquemia y la angina en pacientes con enfermedad coronaria y su valor pronóstico, aún no existe conciencia sobre el impacto de la frecuencia cardiaca aumentada y por ende no ha sido sistemáticamente adoptada como un factor de riesgo independiente y se ha mirado como una sobre-estimulación o una hiperrespuesta del sistema adrenérgico, que de todas maneras es deletéreo.
Pero, recientemente, las guías Europeas sobre prevención de enfermedad cardiovascular en la práctica clínica, toman en consideración la inclusión de la frecuencia cardiaca aumentada -una variable fácil de medir, reproducible y modificable- en la lista de factores de riesgo, incluso como un elemento que predice una futura aterosclerosis (48).
Es probable que en un futuro cercano la frecuencia cardiaca se mire sistemáticamente como un factor de riesgo independiente y como un objetivo terapéutico en pacientes con enfermedad coronaria crónica o falla cardiaca.
Efectos adversos
En el programa clínico de desarrollo, la ivabradina ha demostrado un buen perfil de seguridad. El efecto adverso que se reporta con mayor frecuencia son los síntomas visuales, fosfenos, en su mayoría leves y transitorios, los cuales se resuelven durante el tratamiento. El estudio BEAUTIFUL (15) confirmó la seguridad de ivabradina en relación con la presencia de fosfenos. Estos síntomas son dosis-dependientes y son causa de retiro del tratamiento en menos de 1% de los pacientes.
Conclusiones
Los resultados de los estudios experimentales farmacológicos y clínicos, respaldan el concepto de reducción pura de la frecuencia cardiaca como estrategia para mejorar la isquemia y la capacidad de esfuerzo en pacientes con angina estable, y posiblemente optimizar el pronóstico de enfermedad arterial coronaria e insuficiencia cardiaca crónica.
La ivabradina es en la actualidad el único agente que reduce clínicamente la frecuencia cardiaca sin ningún otro efecto (especialmente sobre la conducción y contractilidad), y la experiencia adquirida hasta ahora sugiere firmemente que se podrían aplicar muchas de las ventajas potenciales de la reducción exclusiva de la frecuencia cardiaca en diferentes condiciones cardio-vasculares.
Es, por lo tanto, una nueva alternativa y un nuevo complemento para el manejo de la enfermedad isquémica cardiaca con o sin síntomas (angina o isquemia silente), y un coadyuvante para el manejo de la falla cardiaca.
En patologías asociadas a alteraciones eléctricas tales como taquicardia sinusal inapropiada o taquicardia ortostática, e incluso ectopias secundarias a daño estructural cardiaco, ivabradina podría desempeñar un papel importante, pues estas patologías serían un blanco racional.
Probablemente el futuro demuestre otras aplicaciones clínicas y beneficios resultantes de la intervención de disminuir de forma exclusiva la frecuencia cardiaca y la corriente If en otras patologías cardio-cerebro-reno-angio-vasculares.
Por ahora tan sólo el tiempo y las investigaciones tienen la respuesta para otras aplicaciones futuras.
Bibliografía
1. Levine H. Rest heart rate and life expectancy. J Am Coll Cardiol 1997; 30: 1104-1106. [ Links ]
2. Kannel WB, Kannel C, Paffenbarger RS, et al. Heart rate and cardiovascular mortality: the Framingham Study. Am Heart J 1987; 113: 1489-94. [ Links ]
3. Greenland P, Daviglus ML, Dyer AR, et al. Resting heart rate is a risk factor for cardiovascular and noncardiovascular mortality: the Chicago Heart Association Detection Project in Industry. Am J Epidemiol 1999; 149: 853-862. [ Links ]
4. Gillum RF, Makuc DM, Feldman JJ. Pulse rate, coronary heart disease, and death: the NHANES I epidemiologic follow-up study. Am Heart J 1991; 121: 172-177. [ Links ]
5. Benetos A, Thomas F, Bean K, et al. Resting heart rate in older people: a predictor of survival to 85. J Am Geriatr Soc 2003; 51: 284-5. [ Links ]
6. Palatini P, Thijs L, Staessen JA, et al. Systolic Hypertension in Europe (Syst-Eur) Trial Investigators. Predictive value of clinic and ambulatory heart rate for mortality in elderly subjects with systolic hypertension. Arch Intern Med 2002; 162: 2313-2321. [ Links ]
7. Disegni E, Goldbourt U, Reicher-Reiss H, et al. Secondary Prevention Reinfarction Israeli Nifedipine Trial (SPRINT) Study Group. The predictive value of admission heart rate on mortality in patients with acute myocardial infarction. J Clin Epidemiol 1995; 48: 1197-1205. [ Links ]
8. Singh N. Diabetes, heart rate, and mortality. J Cardiovasc Pharmacol Ther 2002; 7: 117-29. [ Links ]
9. Fillinger MP, Surgenor SD,Hartman GS, et al. The association between heart rate and in-hospital mortality after coronary artery bypass graft surgery. Anesth Analg 2002; 95: 1483-8. [ Links ]
10. Diaz A, Bourassa MG, Guertin MC, Tardif JC. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 2005; 26: 967-974. [ Links ]
11. Jouven X, Empana JP, Schwartz PJ, Desnos M, Courbon D, Ducimetiere P. Heart-rate profile during exercise as a predictor of sudden death. N Engl J Med 2005; 352: 1951-1958. [ Links ]
12. Tverdal A, Hjellvik V, Selmer R. Heart rate and mortality from cardiovascular causes: a 12 year follow-up study of 379 843 men and women aged 40—45 years Eur Heart J 2008; 29 (22): 2772-81.
13. Jouven X, Empana JP, Escolano S et al. Relation of heart rate at rest and long-term (>20 years) death rate in initially healthy middle-aged men. Am J Cardiol Published online before print November 7, 2008. DOI:10.1016/j.amjcard.2008.08.071. [ Links ]
14. Fox K, Ford I, Steg PG, Tendera M, Robertson M, Ferrari R. BEAUTIFUL investigators. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomized controlled trial. Lancet 2008; 372: 817-21. [ Links ]
15. Fox K, Ford I, Steg PG, Tendera M, Ferrari R. BEAUTIFUL Investigators.Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomized, double-blind, placebo-controlled trial. Lancet 2008; 372: 807-16. [ Links ]
16. Brown HF, DiFrancesco D, Noble SJ. How does adrenaline accelerate the heart? Nature 1979; 280: 235-236. [ Links ]
17. Simon L, Ghaleh B, Puybasset L, Giudicelli JF, Berdeaux A. Coronary and haemodynamic effects of S16257, a new bradycardic agent, in resting and exercising conscious dogs. J Pharmacol Exp Ther 1995; 275: 659-666. [ Links ]
18. Kjekshus J, Gullestad L. Heart rate as a therapeutic target in heart failure. Eur Heart J 1999; 1 (Suppl. H): H64-H69. [ Links ]
19. Nagatsu M, Spinale FG, Koide M, et al. Bradycardia and the role of ß-blockade in the amelioration of left ventricular dysfunction. Circulation 2000; 101: 653-659. [ Links ]
20. Simonsen S, Ihlen H, Kjekshus JK. Haemodynamic and metabolic effects of timolol (Blocadren) on ischaemic myocardium. Acta Med Scand 1983; 213: 393-8. [ Links ]
21. Andrews TC, Fenton T, Toyosaki N, et al. Subsets of ambulatory myocardial ischemia based on heart rate activity. Circadian distribution and response to anti-ischemic medication. The Angina and Silent Ischemia Study Group (ASIS). Circulation 1993; 88: 92-100. [ Links ]
22. Barbuti A, Baruscotti M, Di Francesco D. The pacemaker current: from basics to the clinics. J Cardiovasc Electrophysiol 2007; 18: 342-7. [ Links ]
23. Baruscotti M, Bucchi A, DiFrancesco D. Physiology and pharmacology of the cardiac pacemaker («funny») current. Pharmacol Ther 2005; 107: 59-79. [ Links ]
24. Robinson RB, Siegelbaum SA. Hyperpolarization-activated cation currents: from molecules to physiological function. Annu Rev Physiol 2003; 65: 453-480. [ Links ]
25. Cerbai E, Pino R, Sartiani L, Mugelli A. Influence of postnatal development on If occurrence and properties in neonatal rat ventricular myocytes. Cardiovasc Res 1999; 42: 416-423. [ Links ]
26. Dillmann WH. Cellular action of thyroid hormone on the heart. Thyroid 2002; 12 (6): 447-452. [ Links ]
27. Lechat P, Hulot JS, Escolano S, et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation 2001; 103: 1428-1433. [ Links ]
28. Camm J, Savelieva I, Borer JS. Low incidence of significant bradycardia during therapy with an If current inhibitor ivabradine: heart rate reduction depends on baseline heart rate. J Am Coll Cardiol 2007; 49 (suppl A): abstr 1007-195. [ Links ]
29. Colin P et al. Am J Physiol Heart Circ Physiol 2003; 284: H676-H682. [ Links ]
30. Monnet X, Colin P, Ghaleh B, Hittinger L, Giudicelli JF, Berdeaux A. Heart rate reduction during exercise-induced myocardial ischaemia and stunning. Eur Heart J 2004; 25: 579-586. [ Links ]
31. Jondeau G, Korewicki J, Vasiliauskas D. Effect of ivabradine in patients with left ventricular systolic dysfunction and coronary artery disease. Eur Heart J 2004; 25 (suppl. 2637): 451. [ Links ]
32. Giannoglou GD, Chatzizisis YS, Zamboulis C, Parcharidis GE, Mikhailidis DP, Louridas GE. Elevated heart rate and atherosclerosis: an overview of the pathogenetic mechanisms. Int J Cardiol 2008; 126 (3): 302-12. [ Links ]
33. Beere PA, Glagov S, Zarins CK. Retarding effect of lowered heart rate on coronary atherosclerosis. Science 1984; 226: 180-182. [ Links ]
34. J.-C. Tardif J-C, Grégoire J, Lallier P.L, Joyal M. Chronic heart rate reduction with ivabradine and prevention of atherosclerosis progression assessed using intravascular ultrasound. Eur Heart J 2003; 5 (Suppl G): G46-G51. [ Links ]
35. Bassiouny HS, Zarins CK, Kadowaki MH, Glagov S. Hemodynamic stress and experimental aorto-iliac atherosclerosis. J Vasc Surg 1994; 19: 426-34. [ Links ]
36. Chien S. Mechanotransduction and endothelial cell homeostasis: the wisdom of the cell. Am J Physiol Heart Circ Physiol 2007; 292: H1209-24. [ Links ]
37. Heidland UE, Strauer BE. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation 2001; 1477-1482. [ Links ]
38. Borer JS, Fox K, Jaillon P, Lerebours G. Antianginal and antiischemic effects of ivabradine, an If inhibitor, in stable angina: a randomized, double-blinded, multicentered, placebo-controlled trial. Circulation 2003; 107: 817-823. [ Links ]
39. Tardif JC, Ford I, Tendera M, Bourassa MG, Fox K. The INITIATIVE investigators. Efficacy of ivabradine, a new selective I(f) inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J 2005; 26: 2529-2536. [ Links ]
40. Ruzyllo W, Tendera M, Ford I, Fox KM. Antianginal efficacy and safety of ivabradine compared with amlodipine in patients with stable effort angina pectoris: a 3-month randomized double-blind, multicentre, noninferiority trial. Drugs 2007; 67: 393-405. [ Links ]
41. López-Bescos L, Filipova S, Martos R. Long term safety and efficacy of ivabradine in patients with chronic stable angina. Cardiology 2007; 108: 387-396. [ Links ]
42. Tardif J.C, Ponikowski P, Kahan T, Anti-anginal and anti-ischaemic effects of the If current inhibitor ivabradine in patients with stable angina pectoris receiving beta-blockers. A 4-month randomised, double-blind, multicenter trial. Eur Heart J 2008; 29 (Abstract Suppl.): 386. [ Links ]
43. Custodis F, Baumhäkel M, Schlimmer N, List F, Gensch C, Böhm M, Laufs U. Heart rate reduction by ivabradine reduces oxidative stress, improves endothelial function, and prevents atherosclerosis in apolipoprotein E-deficient mice. Circulation 2008; 117: 2377-87. [ Links ]
44. Thorin E, Drouin A, Gendron ME, et al. Chronic heart rate reduction by ivabradine prevents endothelial dysfunction in dyslipidemic mice. Eur Heart J 2007; 28: 482 (abstr). [ Links ]
45. De Ferrari GM, Mazzuero A, Agnesina L, Bertoletti A, Lettino M, Campana C, Schwartz PJ, Tavazzi L. Favourable effects of heart rate reduction with intravenous administration of ivabradine in patients with advanced heart failure. Eur J Heart Fail 2008; 10: 550-5. [ Links ]
46. Current Controlled Trials. Current Controlled Trials Ltd Web site. Disponible en: www.controlled-trials.com. [ Links ]
47. Doesch AO, Celik S, Ehlermann P, Frankenstein L, Zehelein J, Koch A, Katus HA, Dengler TJ. Heart rate reduction after heart transplantation with beta-blocker versus the selective If channel antagonist ivabradine. Transplantation 2007; 84: 988-96. [ Links ]
48. Graham I, Atar Dan, Borch-Johnsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts) Eur Heart J 2007; 28: 2375-2414. [ Links ]














