Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.5 Bogota Sep./Oct. 2009
Departamento de Medicina Interna. Departamento de Epidemiología Clínica y Bioestadística. Facultad de Medicina. Pontificia Universidad Javeriana, Bogotá, DC., Colombia.
Correspondencia: Dr. Álvaro Ruiz. Departamento de Medicina Interna. Departamento de Epidemiología Clínica y Bioestadística. Facultad de Medicina. Pontificia Universidad Javeriana, Bogotá, DC., Colombia. Correo electrónico: aruiz@javeriana.edu.co
Recibido: 11/05/2009. Aceptado: 01/09/2009.
La enfermedad coronaria es una entidad con causas múltiples, la primera causa de mortalidad en el mundo actual y, para el año 2025, la primera causa de morbilidad mundial. Dado su origen multicausal, el enfoque debe ser también múltiple; con revisión a todos los factores.
Uno de los factores de riesgo, la dislipidemia, tiene varios aspectos que necesitan atención y control, aunque ésta se haya centrado tradicionalmente en el c-LDL, sin prestar mayor cuidado a las otras subfracciones.
Los estudios clásicos en lípidos, principalmente con estatinas, han dirigido su atención, al c-LDL y se encuentran estudios en los que hay reducción en c-LDL sin cambios (o con muy pocos) en c-HDL. Aunque hay disminución en el riesgo de eventos y mortalidad, pueden apreciarse riesgos residuales significativos. Un estudio con fibratos tuvo los resultados opuestos, un aumento significativo en el c-HDL sin cambio en el c-LDL, y se observó una reducción interesante en el riesgo, pero con un riesgo similar al observado en los estudios con estatinas.
Los estudios con intervenciones múltiples que impactan todas las subfracciones lipídicas, han mostrado cambios significativamente mejores en riesgo. La adición de niacina de liberación extendida al armamentario terapéutico ha permitido, en combinación con estatinas, obtener un mejor control de todas las subfracciones lipídicas, así como reducciones significativas en riesgo y en crecimiento de placa.
Los efectos de la niacida de liberación extendida son reducción de c-LDL y triglicéridos, aumento en c-HDL y también reducción en LP(a), así como cambios benéficos en apoA y apoB. Las reacciones adversas, como el enrojecimiento, pueden controlarse y en muchos casos evitarse, y han mostrado ser pasajeras y disminuir hasta desaparecer con el tiempo.
Palabras clave: enfermedad arterial coronaria, dislipidemia, c-hdl, niacina liberación extendida.
Coronary artery disease is an entity with multiple causes. It is the first cause of mortality in the world, and for the year 2025, will be the first cause of morbidity. Given its multi-causal origin, the approach must also be multiple and all factors should be controlled.
Dyslipidemia, one of the main risk factors, has several aspects that need attention and control, although the attention has traditionally been focused on LDL-c, disregarding other lipidic subfractions.
Classical lipid studies mainly those with statins, have directed their attention to LDL-c, and there are studies in which there is a LDL-c reduction without little or no change in HDL-C. Even though events and mortality risks decrease, significant residual risks can be appreciated. A study with fibrates had the opposite results, showing significant increase in HDL-c without any change in LDL-c, and an interesting decrease in risk but also with a similar risk to that found in previous studies with statins was observed.
Studies with multiple interventions that impact all lipidic sub-fractions have shown better significant changes in risk. Addition of niacin extended release to the pool of drugs in combination witn statins, has allowed to achieve a better control of all the lipidic subfractions as well as significant reductions in risk and plaque growth.
The effects of the niacin extended release are reduction of LDL-c and triglycerides, increase in HDL-c and also LP(a) reduction, as well as beneficial changes in ApoA and ApoB. Adverse reactions, such as flushing, can be controlled and in many cases avoided, and have shown to be transient and to decrease and even disappear with time.
Key Words: coronary artery disease, dyslipidemia, HDL-c, niacin extended release.
La enfermedad coronaria, primera causa de muerte global en el mundo, será en pocos años también la primera causa de morbilidad, principalmente a expensas de los países en desarrollo, en los que aún continúa el aumento en la incidencia de la enfermedad (1).
En Colombia los datos muestran que las enfermedades cardiovasculares, primera causa de mortalidad, siguen en aumento, y que la enfermedad vascular cerebral también continúa la tendencia. En 1990 hubo 25.312 muertes por enfermedad coronaria y 24.033 por agresiones (homicidios). Las cifras de 2003 muestran un incremento de enfermedad coronaria a 37.481 y un ligero aumento en agresiones, a 25.612 (2).
Varios factores facilitaron estos cambios: envejecimiento de la población (la esperanza de vida al nacer proyectada para 2005-2010 es de 73,27 años - 76,27 para mujeres y 70,34 para hombres), aumento de la población mayor de 60 años (como resultado del aumento en la expectativa de vida y también por la reducción de la población de 15 a 35 por migración; 10% de la población ha abandonado el país en los últimos años) y violencia (3).
Adicionalmente, ha habido efectos deletéreos por los cambios en estilo de vida, que incluyen migración a las ciudades (más de 80% de la población colombiana vive en ciudades según el Censo DANE 2005) (4), aumento en la frecuencia de los factores de riesgo y cambios en los patrones de alimentación hacia alimentos procesados, menos frutas y verduras, y más grasas y azúcares refinados, además de la reducción en ejercicio y actividad física.
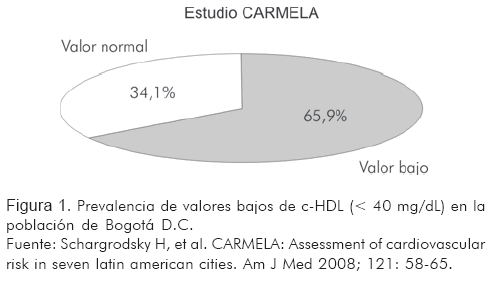
Se ha mostrado que la población colombiana tiene alteraciones lipídicas que pueden no coincidir con lo descrito principalmente para la población norteamericana, ya que hay alta frecuencia de hipertrigliceridemia (5) y altas tasas de personas con valores bajos de c-HDL (6). El Estudio CARMELA, que evaluó la prevalencia de factores de riesgo para enfermedad coronaria en siete ciudades de América Latina, encontró una prevalencia de valores bajos de c-HDL (<40 mg/dL) de 65,9% para la población de Bogotá (Figura 1).
Lípidos y aterogénesis
La aterosclerosis es una enfermedad compleja, de múltiples causas, que tiene factores de riesgo claramente identificados. Entre los principales factores modificables, y en buena parte prevenibles, están las dislipidemias. Éstas se relacionan íntimamente con procesos inflamatorios en la placa aterosclerótica, por lo que siempre se las debe considerar en conjunto.
Las lipoproteínas, estructuras de almacenamiento y transporte, pueden dividirse en dos grandes grupos:
-
Las potencialmente aterogénicas, entre las cuales se cuentan quilomicrones, VLDL, IDL, LDL, lipo(a) y remanentes de quilomicrones (7), todas ellas con apo B.
-
Las que tienen función protectora y las HDL (8), que tienen apo A.
Se ha demostrado que desde temprana edad se inician procesos de depósito de lípidos en la subíntima vascular, por ingreso de partículas lipídicas, en particular c-LDL. Una vez dentro del espacio subendotelial, ocurren una serie de transformaciones, como oxidación de lípidos y de ApoB, hidrólisis de fosfatidilcolina a liso-fosfatidilcolina, agregación y otras modificaciones que producen el c-LDL modificado, que es claramente anti-inflamatorio (9).
El c-LDL modificado produce estímulos inflamatorios al activar monocitos, que una vez convertidos en macrófagos inician la producción activa de sustancias promigratorias y proadhesivas, como la proteína quemotáctica de monocitos (MPC-1) y citoquinas como interleuquina 1 (IL-1) y factor de necrosis tumoral alfa (TNF-a), que al actuar sobre la célula endotelial estimulan la producción de moléculas de adhesión celular (CAM) (10).
Estas últimas son proteínas que expresa la superficie celular y que tienen como objetivo la unión con otras células o con la matriz extracelular. Característicamente, las CAM son receptores transmembrana como la selectina endotelial (selectina E), las moléculas de adhesión intercelular (iCAM-1) y las moléculas de adhesión vascular (VCAM-1).
Estas CAM facilitan la entrada, junto con la MPC-1, de monocitos y células inflamatorias al espacio subendotelial, permitiendo un proceso circular de inflamación que se auto-estimula por factores promigratorios. Las CAM disminuyen la velocidad de traslación de los monocitos en el espacio vascular y hacen que inicien movimientos de rotación sobre sí mismos, lo que les hace perder velocidad de traslación, y que el monocito se acerque más al endotelio, donde hace transmigración.
Estos procesos pueden comenzarse por la entrada de lípidos al espacio subendotelial, e inicialmente se conforma una estría grasa que irá creciendo por procesos inflamatorios posteriores. Los macrófagos inician la incorporación de colesterol y se convierten en células espumosas muy activas, que tienen como misión el control de lípidos en el espacio subendotelial, pero que ante el exceso de colesterol crecen y llenan el espacio, dando origen a la placa aterosclerótica y promoviendo la expresión de metaloproteinasas de la matriz (MMP) (11).
Las MMP son endopeptidasas con un núcleo de cinc (de allí el nombre de metaloproteinasas) que pueden degradar toda clase de proteínas de la matriz extracelular y que son responsables de la ruptura de los receptores de la membrana celular y de la liberación de ligandos apoptóticos. Además de los efectos sobre la producción y estabilidad de la colágena, que hace la placa frágil y la cápsula fibrosa más fácil de romper, se ha demostrado que participan en procesos de migración celular, proliferación y diferenciación celular, angiogénesis y apoptosis (12).
También se ha demostrado que las MMP pueden producir factor de crecimiento (GF) que estimula el crecimiento, la proliferación y la diferenciación celular, y que promueve el crecimiento de la placa (13).
Los estímulos producidos por el c-LDL oxidado y por la producción de citoquinas llevan también a la inhibición de producción de colágena y a la producción de interferón gamma, que no sólo promueve la migración de células inflamatorias sino que interfiere con la síntesis de colágena. Así mismo, aumentan la actividad protrombótica y antitrombolítica, por alteración en niveles de PAI-1 y de actividad plaquetaria (14).
Estos cambios inflamatorios, proaterogénicos y protrombóticos pueden ser estimulados por las fracciones lipídicas agrupadas como colesterol no-HDL, por lo que todos los lípidos deben ser controlados (15, 16).
Fracciones protectoras
A través del transporte reverso, las HDL controlan el cúmulo de colesterol en el endotelio, ya que recuperan el colesterol que esté en macrófagos o en el espacio subendotelial; mediante las apoA (I y II) le quita la oxidación y lo entrega al hígado para su excreción (17).
Adicionalmente, las HDL tienen efectos anti-inflamatorios, ya que pueden evitar la oxidación del colesterol con las paraoxonasas (18), evitar la conversión de macrófagos en células espumosas (19) y disminuir la expresión de moléculas de adhesión por interferencia en la producción del factor de transcripción nuclear kappa B (NF-kB) (20, 21).
Se ha mostrado que las HDL también pueden regular las células endoteliales progenitoras por aumento de la eNOS y prevención de apoptosis, reducción de MMP-9 y disminución de actividad de la caspasa-3 (22).
Control de los lípidos
Los efectos proaterotrombóticos del colesterol no-HDL y los protectores del c-HDL, hacen que sea indispensable controlar por completo las fracciones lipídicas, así como los procesos inflamatorios involucrados.
Enfoque tradicional
El c-LDL, que es claramente la partícula más responsable del daño, ha sido el blanco terapéutico en los últimos años y su reducción, particularmente con estatinas, ha demostrado lograr control fisiopatológico, menor producción de radicales libres, factor tisular e inhibidor de activador de plasminógeno (PAI-1), menor actividad plaquetaria y como resultado menos actividad trombogénica y mayor trombólisis; más expresión de sintasa de óxido nítrico (eNOS) y por lo tanto más vasodilatación y menor producción de citoquinas proadhesivas y promigratorias, lo que limita la cantidad y actividad de las células inflamatorias (14).
Por efecto de las estatinas se ha demostrado reducción de interferón gamma, que limita la producción de colágena, así como la expresión de MMP. Como efectos globales se ha mostrado la reducción en la producción de proteína C reactiva ultrasensible, un potente marcador que predice inflamación (23).
Las estatinas también han demostrado detener el progreso de lesiones medidas a través del espesor íntima media (IMT) y no sólo detener el progreso de placas ateroscleróticas formadas (24, 25) sino reducir las placas avanzadas (26).
Adicionalmente, se ha mostrado que hay impacto en desenlaces clínicos, que se reduce el número de infartos fatales y no fatales, así como el número de eventos vasculares cerebrales fatales y no fatales, el de episodios de angina e insuficiencia cardíaca, la necesidad de revascularización y la mortalidad global (27).
El estudio JUPITER mostró que el tratamiento con rosuvastatina en pacientes con lípidos normales pero PCR-us elevada, logra reducciones muy significativas en morbilidad cardio y cerebrovascular, en enfermedad tromboembólica y en mortalidad cardiovascular y global (28).
Evidencia en estudios clínicos
Los estudios, sin embargo, han utilizado estrategias monodireccionales que permiten reducciones de c-LDL superiores a 40%, pero que tienen poco efecto en el c-HDL y los triglicéridos. El estudio PROVE-IT (Pravastatin or Atorvastatin Evaluation and Infection Therapy), que comparó atorvastatina de 80 mg contra pravastatina de 40 mg, mostró mejor disminución en c-LDL para atorvastatina y una reducción de 16% en la tasa de eventos cardiovasculares en ese grupo. No obstante, como puede verse en la figura 2, hubo un riesgo residual de 22,4% (29).
En el estudio TNT (Treatment to New Target) se logró una reducción significativamente mayor de c-LDL en el grupo (con enfermedad coronaria) que recibió atorvastatina de 80 mg que en el grupo que recibió tan sólo 10 mg, pero no hubo diferencias significativas en c-HDL entre los dos grupos. Se logró una reducción de riesgo significativa (22% reducción relativa de riesgo), pero también hubo un porcentaje de riesgo residual (8,7%) (30).
En un enfoque no tradicional, pero también monodireccional, el estudio VA-HIT (Veterans Affairs High Density Lipoprotein Intervention Trial) (31) se comparó la terapia de gemfibrozil con placebo en pacientes con enfermedad coronaria. Si bien hubo un aumento significativo en c-HDL en el grupo activo (6%), no se observaron diferencias en c-LDL entre los grupos. Hubo una reducción de 22% en el riesgo relativo entre los grupos, a favor de gemfibrozil, pero un riesgo residual de 17,3%.
Enfoques múltiples
El control no sólo de una de las fracciones sino de todo el perfil lipídico, que tiene más sustento fisiopatológico (reducción de fracciones aterotrombóticas, colesterol no-HDL y aumento de las protectoras, c-HDL), ha mostrado resultados significativamente mejores.
El FATS (Familial Atherosclerosis Treatment Study) consideró la hipótesis que tanto la reducción de c-LDL como el aumento de c-HDL tuvieran impacto potencial en eventos cardiovasculares. Se comparó una terapia combinada de niacina, lovastatina y colestipol con el tratamiento convencional, en pacientes con enfermedad coronaria, con la que se logró una reducción de 90 mg/dL de c-LDL (comparado con -20 mg/dL) y un aumento de 30% en c-HDL. Los resultados indicaron un riesgo relativo de 0,27 (0,10-0,77) (32, 33) y riesgos residuales en los desenlaces primarios más pequeños que en el enfoque monodirigido.
En el ARBITER-2 (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol) (34) se evaluó la adición de niacina de liberación extendida (niacin ER) al tratamiento de base con estatinas en pacientes con enfermedad coronaria y que tuvieran valores bajos de c-HDL, en los valores de espesor íntima media (IMT). Después de un año de seguimiento, con un aumento de 21% en c-HDL en el grupo combinado (p=0,002), el IMT siguió aumentando en los pacientes que recibieron sólo estatina, pero dejó de crecer en los que recibieron la terapia combinada (p=0,08). En una fase posterior (ARBITER-3) (35) se continuó la niacina en quienes la habían recibido y se la agregó a los que estaban solamente con estatina. En esta fase abierta del estudio se mostró una regresión significativa del IMT de 0,095 ± 0,019 mm (p < 0,001).
El control adicional de c-HDL, que tiene base fisiopatológica, ha demostrado producir resultados intermedios y clínicos relevantes, y obliga a la consideración del control más amplio de las fracciones lipídicas.
Niacina de liberación extendida (niacina ER)
La niacina ER es una opción diferente del ácido nicotínico que estuvo en uso antes de la aparición de las estatinas, aunque mantiene la capacidad de modificación de los lípidos. La principal diferencia estriba en la tolerabilidad, para la cual se han hecho modificaciones que han mejorado sustancialmente el perfil del medicamento. Es la mejor opción farmacológica disponible para la elevación del c-HDL y tiene efectos en el c-LDL, los triglicéridos y la lipo(a).
Mecanismo de acción
La niacina ER reduce la movilización de ácidos grasos a partir del tejido adiposo periférico, inhibe la aciltransferasa de diacilglicerol hepática, por lo que disminuye la síntesis de triglicéridos; aumenta la degradación intracelular de apoproteínas B y disminuye centralmente la producción de VLDL por parte del hígado, lo que mengua la conversión de éstas en LDL.
Adicionalmente, disminuye la tasa catabólica de apo A-1 (la apoproteína de las HDL) sin que se vea afectada su tasa de biosíntesis; además disminuye el catabolismo de HDL. Como efecto de la niacina ER se aumentan selectivamente los niveles plasmáticos de Lp-AI (que es la subfracción de la HDL sin la apo-AII), subfracción que ha mostrado efecto protector cardiaco. También inhibe selectivamente la remoción y recaptura de apo A-I por los hepatocitos, de manera que se aumenta la capacidad para facilitar el transporte reverso de colesterol (36).
Se ha mostrado que puede reducir el c-LDL de 15% a 25%, los triglicéridos de 20% a 50%, las apo B en 16% y la lipo(a) en 27% (es el único medicamento que ha mostrado capacidad para modificar significativamente esta pequeña fracción aterogénica (37). Estas modificaciones se traducen también en un aumento en el tamaño de las partículas de LDL, que pasan de pequeñas y densas a más grandes y flotantes. Adicionalmente pueden lograrse aumentos de c-HDL hasta de 15% a 35% y la subfracción HDL2 hasta en 137%, en pacientes con dislipidemias IIa, IIb o IV (38).
Tolerabilidad de la niacina ER
La forma de liberación extendida (ER) es una forma de presentación reciente, que tiene como ventajas sobre las formas de la molécula previamente disponibles una frecuencia significativamente menor de episodios de enrojecimiento (flushing) (39) a la vez que produce una menor elevación en los niveles de ácido úrico y no ha sido asociada con hepatotoxicidad. Puesto que la forma de liberación inmediata (ácido nicotínico cristalino) estaba muy asociada con el efecto de enrojecimiento, que limitaba su aceptación por parte de los pacientes, se desarrolló una forma de liberación sostenida que disminuía significativamente este efecto pero aumentaba el riesgo de toxicidad hepática, por lo que se llegó a la actual forma, de liberación extendida (ER), que es significativamente más segura y mejor tolerada.
Aunque puede producir un aumento leve en los niveles de glucemia, los estudios realizados han mostrado que no son significativos, que no producen cambios en la HbA1c y que reducen de manera efectiva los triglicéridos y aumentan el c-HDL en pacientes diabéticos, sin causar un impacto adverso significativo en el control de la glucemia (40).
El efecto adverso más conocido, además de las molestias gastrointestinales, es el enrojecimiento con calor, que simula la sensación de quemadura solar, que ha estimulado la producción de diversas formas de presentación hasta la actual y más tolerada, de liberación extendida.
El enrojecimiento, que puede manifestarse no sólo como eritema cutáneo sino como prurito, es un efecto adverso controlable en un alto porcentaje de pacientes y evitable en muchos. Dados los beneficios múltiples en las fracciones lipídicas, se justifican las medidas para prevenirlo, controlarlo y ayudar al paciente a tolerarlo. En un estudio (Tabla 1) (41) sobre la forma de liberación extendida (ER), se encontró que la frecuencia de efecto era alta, pero que tanto el número de pacientes que sufría de episodios de enrojecimiento como el número de episodios por mes, disminuían consistente y significativamente con el tiempo de tratamiento.
En este estudio se evaluaron 517 pacientes entre 21 y 75 años y se evidenció que la frecuencia de pacientes que referían enrojecimiento fue de 75%, pero había bajado a 50% a las cuatro semanas, a 40% en las veinticuatro semanas y a 20% a las noventa y seis semanas. El número de episodios a las cuatro semanas, era de 1,9 por paciente por mes, con lo que se observa una clara tendencia de reducción: 1,2 episodios a las doce semanas, 0,6 a las veinticuatro semanas y 0,19 a las noventa y seis semanas (Tabla 2).

Control del enrojecimiento
Las ventajas terapéuticas de la niacina ER son suficientes para que el balance de beneficio-riesgo sea positivo. Hay varias estrategias que se siguen para ayudar al paciente a entender el enrojecimiento, prevenirlo, disminuir su intensidad y tolerarlo, más aún si se sabe que va disminuyendo con el tiempo. Estas recomendaciones (Tabla 2), se refieren a advertir al paciente sobre el efecto, igual que se hace con los efectos de otros medicamentos (aspirina, metronidazol, antibióticos, calcio…) y evitar aquello que pueda generar la reacción, así como utilizar mecanismos de prevención.
Conclusiones
La aterosclerosis, una enfermedad de múltiples causas y un gran componente inflamatorio, debe tener múltiples enfoques que busquen el mejor control de los factores de riesgo y de la inflamación. En particular en las fracciones lipídicas debe buscarse el mejor control de cada uno de los componentes del perfil lipídico: c-LDL, triglicéridos, remanentes de quilomicrones y c-HDL.
Las estrategias combinadas ofrecen mayor probabilidad de control de los lípidos y de la inflamación. La forma de liberación extendida de niacina ofrece la opción de control de todas las fracciones lipídicas, lo que la hace una clara opción para el tratamiento combinado (en algunos casos aislado) y tiene buena tolerabilidad, que puede mejorarse si médico y paciente conocen y previenen el enrojecimiento.
Bibliografía
1. Nadar S, Lip GYH. Secular trends in cardiovascular disease. J Human Hypertens 2002; 16: 663-666. [ Links ]
2. http://www.paho.org/HIA/archivosvol2/paisesesp/Colombia%20Spanish.pdf [ Links ]
3. http://www.dane.gov.co/index.php?option=com_content&task=section&id =16&Itemid=39 [ Links ]
4. http://190.25.231.242/cgibin/RpWebEngine.exe/PortalAction?& MODE=MAIN&BASE =CG2005AMPLIADO &MAIN=WebServerMain.inl [ Links ]
5. Lanas F, Avezum A, Bautista LE, Diaz R, Luna M, Islam S, et al. INTERHEART Investigators in Latin America. Risk factors for acute myocardial infarction in Latin America: the INTERHEART Latin American study. Circulation 2007; 115 (9): 1067-74. [ Links ]
6. Schargrodsky H, Hernández-Hernández R, Champagne BM, Silva H, Vinueza R, Silva Ayçaguer LC, et al. CARMELA Study Investigators. CARMELA: Assessment of Cardiovascular Risk in Seven Latin American Cities. Am J Med 2008; 121: 58-65. [ Links ]
7. Campos H, Khoo C, Sacks FM. Diurnal and acute patterns of postprandial apolipoprotein B-48 in VLDL, IDL, and LDL from normolipidemic humans. Atherosclerosis 2005; 181 (2): 345-51. [ Links ]
8. SnidermanAD, Furberg CD, Keech A, et al. Apolipoproteins versus lipids as indices of coronary risk and as targets for statin treatment. Lancet 2003; 361 (9359): 777-80. [ Links ]
9. Steinberg D et al. Beyond cholesterol: modifications of low-density lipoprotein that increase its atherogenicity. N Engl J Med 1989: 320: 915-924. [ Links ]
10. Yuhanna IS, Zhu Y, Cox BE et al. High-density lipoprotein binding to scavenger receptor-BI activates endothelial nitric oxide synthase. Nat Med 2001 (7): 853-857. [ Links ]
11. Marchesi LS Lombardini R et al, Mechanisms of high-density lipoprotein cholesterol effects on the endothelial function in hyperlipidemia. Metabolism 2003; 1191-1195. [ Links ]
12. Birkedal-Hansen H, Moore WGI, Bodden MK, Windsor LJ, Birkedal-Hansen B, DeCarlo A, et al. Matrix metalloproteinases: a review. Crit Rev Oral Biol Med 1993; 4; 197-250. [ Links ]
13. Backes JM, Gibson CA. effect of lipid-lowering drug therapy on small-dense low-density lipoprotein. Ann Pharmacother 2005; 39: 523-526. [ Links ]
14. Festa A, D'Agostino AJr, Mykkanen L, Tracy R, Howard BV, Haffner SM. Low-density lipoprotein particle size is inversely related to plasminogen activator inhibitor-1 levels: The Insulin Resistance Atherosclerosis Study. Arterioscler Thromb Vasc Biol 1999; 19 (3): 605-610. [ Links ]
15. Ross R. Atherosclerosis: an inflammatory disease. N Eng J Med 1999; 340: 115-126. [ Links ]
16. Pischon T, Girman CJ, Sacks FM, et al. Non-high-density lipoprotein cholesterol and apolipoprotein B in the prediction of coronary heart disease in men. Circulation 2005; 112 (22): 3375-83. [ Links ]
17. Franceschini G, Werba JP, Calabresi L. Drug control of reverse cholesterol transport. Pharmacol Ther 1994; 61: 289-324. [ Links ]
18. Matsuda Y, Hirata K, Inoue N, Suematsu M, Kawashima S, Akita H, et al. High density lipoprotein reverses inhibitory effect of oxidized low density lipoprotein on endothelium-dependent arterial relaxation. Circ Res 1993; 72: 1103-1109. [ Links ]
19. Navab M, Imes SS, Hama SY, Hough GP, Ross LA, Bork RW, et al. Monocyte transmigration induced by modification of low density lipoprotein in cocultures of human aortic wall cells is due to induction of monocyte chemotactic protein 1 synthesis and is abolished by high density lipoprotein. J Clin Invest 1991; 88: 2039-2046. [ Links ]
20. Calabresi L, Gomaraschi M, Villa B, Omoboni L, Dmitrieff C, Franceschini G. Elevated soluble cellular adhesion molecules in subjects with low HDL-cholesterol. Arterioscler Thromb Vasc Biol 2002; 22: 656. [ Links ]
21. Cockerill GW, Rye KA, Gamble JR, Vadas MA, Barter PJ. High-density lipoproteins inhibit cytokine-induced expression of endothelial cell adhesion molecules. Arterioscler Thromb Vasc Biol 1995; 15: 1987-1994. [ Links ]
22. Noora R, Shuaib U, Wang CX, Todd K, Ghani U, Schwindt B, Shuaib A. High-density lipoprotein cholesterol regulates endothelial progenitor cells by increasing eNOS and preventing apoptosis. Atherosclerosis 2007; 192: 92-99. [ Links ]
23. Ridker PM, Hennekens CH, Buring JE, Rifai N. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women. N Engl J Med 2000; 342: 836-843. [ Links ]
24. Nissen SE, Tuzcu EM, Schoenhagen P, Crowe T, Sasiela WJ, Tsai J, et al. For the Reversal of Atherosclerosis with Aggressive Lipid Lowering (REVERSAL) Investigators. Statin therapy, LDL cholesterol, C-reactive protein, and coronary artery disease. N Engl J Med 2005; 352: 29-38. [ Links ]
25. Crouse JR, Raichlen JS, Riley WA, Evans GW, Palmer MK, O'Leary DH, et al. METEOR Study Group. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA 2007; 297: 1344-1353. [ Links ]
26. Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, et al. ASTEROID Investigators. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295: 1556-65. [ Links ]
27. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, et al. National Heart, Lung, and Blood Institute; American College of Cardiology Foundation; American Heart Association. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110: 227-39. [ Links ]
28. Ridker PM, Danielson E, Fonseca FAH, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359: 2195-207. [ Links ]
29. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004; 350: 1495-1504. [ Links ]
30. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al. Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352: 1425-350. [ Links ]
31. Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, Elam MB, et al. For the Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N Engl J Med 1999; 341: 410-418. [ Links ]
32. Brown BG, Albers JJ, Fisher LD et al. Regression of coronary artery disease as a result of intensive lipid-lowering therapy in men with high levels of apolipoprotein B (FATS). N Engl J Med 1990; 323: 1289-1298. [ Links ]
33. Brown BG, Brockenbrough A, Zhao XQ, Dowdy AA, Monick EA, Huss Frechette et al. Very intensive lipid therapy with lovastatin, niacin, and colestipol for prevention of death and myocardial infarction: a 10-year Familial Atherosclerosis Treatment Study (FATS) follow-up. Circulation 1998; 98 ( suppl): I-635. [ Links ]
34. Taylor AJ, Sullenberger LE, Lee HJ, et al. Arterial biology for the investigation of the treatment effects of reducing cholesterol (ARBITER) 2. Circulation 2004; 110: 3512-17. [ Links ]
35. Taylor AJ, Lee HJ, Sullenberger LE. The effect of 24 months of combination statin and extended-release niacin on carotid intima-media thickness: ARBITER 3. Curr Med Res Opin 2006; 22 (11): 2243-50. [ Links ]
36. Shobha H, Kamanna VS, Kashyap ML. Niacin and cholesterol: role in cardiovascular disease (review). Atherosclerosis Research Center, Department of Veterans Affairs Healthcare System, Long Beach, CA, USA. J Nutr Biochem 2003; 14 (6): 298-305. [ Links ]
37. Morgan JM, Capuzzi DM, Guyton JR, Centor RM, Goldberg R, Robbins DC. Treatment effect of niaspan, a controlled-release niacin, in patients with hypercholesterolemia: a placebo-controlled trial. J Cardiovasc Pharmacol Ther 1996; 3: 195-202. [ Links ]
38. Wahlberg G, Walldius G, Olsson AG, Kirstein P. Effects of nicotinic acid on serum cholesterol concentrations of high density subfractions HDL2 and HDL3 in hyperlipoproteinaemia. J Intern Med 1990; 228 (2): 151-7. [ Links ]
39. Goldberg A, et al. Multiple-dose efficacy and safety of an extended-release form of niacin in the management of hyperlipidemia. Am J Cardiol 2000; 85: 1100-5. [ Links ]
40. Grundy, A. Cholesterol-lowering Clinical Trials: a Historial Perspective. En: Grundy SM. Cholesterol-lowering therapy: evaluation of clinical trial evidence. New York: Marcel Dekker; 2000. p. 1-44. [ Links ]
41. Capuzzi DM, Guyton JR, Morgan JM, Goldberg AC, Kreisberg RA, Brusco OA, et al. Efficacy and safety of an extended-release niacin (Niaspan): a long-term study. Am J Cardiol 1998; 82: 74U-81U. [ Links ]














