Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.16 no.5 Bogota Sep./Oct. 2009
(1) Hospital Universitario San Vicente de Paúl. Medellín, Colombia.
(2) Clínica Cardiovascular Santa María. Medellín, Colombia.
(3) Universidad de Antioquia. Medellín, Colombia.
Correspondencia: Dra. Carolina Gómez López de Mesa, Cra. 80ª No. 34-36 Apto. 506. Tel.: (4) 2504742; Cel.: 313-6789933, Medellín, Colombia. Correo electrónico: carogldm@hotmail.com.
Recibido: 26/11/2008. Aceptado: 22/07/2009.
Los rabdomiomas cardiacos son tumores benignos dependientes de las fibras musculares miocárdicas, los cuales usualmente son múltiples, pero tienden a disminuir tanto en número como en tamaño con el crecimiento, con una regresión espontánea en 90% de los casos. Hacen parte de los tumores cardiacos primarios, los cuales son poco frecuentes, con una incidencia que varía entre 0,0017% y 0,28%. El más frecuente de los tumores cardiacos primarios es el rabdomioma. Se describe asociación con esclerosis tuberosa hasta en 72% de los casos, razón por la cual ésta debe buscarse ante el hallazgo de rabdomioma cardiaco.
Palabras clave: rabdomioma, esclerosis tuberosa, tumores cardiacos, ecocardiografía.
Cardiac rhabdomyomas are benign tumors derived from cardiac muscle fibers. They are usually multiple, but tend to decrease both in number and size with growth, with spontaneous regression in 90% of cases. These lesions are part of the primary cardiac tumors, which are uncommon, and have a variable incidence between 0.0017 and 0.28%. The most common primary cardiac tumor is the rhabdomyoma. An association between rhabdomyoma and tuberous sclerosis has been described in up to 72% of cases. For this reason, a patient with cardiac rhabdomyoma should be investigated for tuberous sclerosis.
Keywords: rhabdomyoma, tuberous sclerosis, cardiac tumors, echocardiography.
Introducción
Los rabdomiomas cardiacos son tumores benignos dependientes de las fibras musculares miocárdicas. Usualmente son múltiples, pero con el crecimiento tienden a disminuir tanto en número como en tamaño, con una regresión espontánea en 90% de los casos (1). Hacen parte de los tumores cardiacos primarios, los cuales son poco frecuentes en todas las edades (2), con una incidencia que varía entre 0,0017% y 0,28% (3). Entre los años 1980 y 1998, una base de datos de ecocardiografía del hospital de niños de Boston, reveló una incidencia de tumores cardiacos de 0,17% en niños referidos para evaluación cardiaca (4), donde el más frecuente de los tumores cardiacos primarios fue el rabdomioma (63%), seguido por fibroma (6%), mixoma (6%) y teratoma pericárdico (4,5%) y misceláneo (20,5%).
Los rabdomiomas son masas intramurales múltiples y bien circunscritas que pueden presentarse en cualquier lugar dentro del corazón (5), donde comprometen comúnmente los ventrículos. Los fibromas son únicos, no encapsulados e intramurales y complican la pared libre ventricular izquierda o el septo interventricular (1-5).
El rabdomioma puede manifestarse de tres formas, dentro del complejo esclerosis tuberosa (en 50%), como una lesión esporádica, o más raras veces asociado a enfermedades cardiacas congénitas (1).
A pesar de que por mucho tiempo la angiografía fue el patrón de oro para realizar el diagnóstico de los tumores cardiacos, desde hace varios años el ultrasonido cardiaco, la tomografía computarizada y la resonancia magnética, se consideran como herramientas más útiles y han reemplazado a las antiguas técnicas invasivas (3).
Aunque su expresión clínica es amplia, la mayoría de los casos son asintomáticos, y las manifestaciones clínicas dependerán del tamaño y la localización de la lesión intracardiaca. El compromiso del sistema de conducción eléctrica puede llevar a bloqueos cardiacos, taquicardia atrial ectópica, y arritmias ventriculares intratables. Las manifestaciones de la obstrucción mecánica dependen de la cavidad cardiaca implicada; 70% se localizan en el ventrículo izquierdo, fundamentalmente en la zona septal o apical (6).
Se describe asociación con esclerosis tuberosa hasta en 72% de los casos (5). El complejo esclerosis tuberosa es una facomatosis que implica un trastorno en la diferenciación y proliferación celular, que se caracteriza por la aparición de hamartomas en múltiples sistemas. Sus principales manifestaciones clínicas incluyen: angiofibromas faciales, máculas hipomelanóticas, nevus del tejido conectivo, lesiones en confeti (piel y anexos), túberes corticales, nódulos sub-ependimales, astrocitomas de células gigantes, líneas de migración radial en la sustancia blanca (cerebro), hamartoma nodular múltiple (ojos), angiomiolipoma y quistes renales (riñón), agujeros en esmalte dental, fibromas gingivales (boca) y los rabdomiomas descritos (corazón) (7). Las manifestaciones clínicas usualmente no aparecen desde el nacimiento y se van observando con el trascurrir de los años. Esta enfermedad tiene un patrón de herencia autosómico dominante con alta penetrancia, por mutaciones en el gen TSC1, hamartina en el locus 9q34 y TSC2, tuberina en el locus 16p13.3 (8), aunque también en menor proporción, se han descrito mutaciones de novo (9). A continuación se presenta el caso clínico de dos pacientes con rabdomioma cardiaco en el período neonatal y su posible asociación con esclerosis tuberosa.
Caso 1
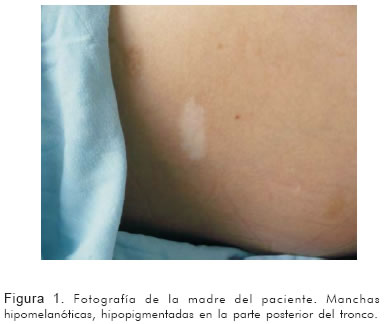
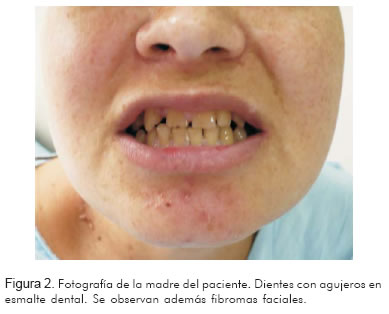
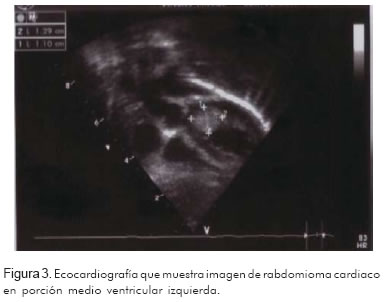
Madre de veinticuatro años, con veintiséis semanas de gestación, quien ingresó al servicio de urgencias por síndrome convulsivo, y además tenía antecedente de epilepsia de difícil control desde la infancia. Se realizó ecografía gestacional de III nivel que mostró en el feto imagen hiperecoica de 8 mm en el ventrículo izquierdo, no obstructiva, compatible con rabdomioma cardiaco. Por la alta asociación de los rabdomiomas con esclerosis tuberosa, se inició estudio en la madre. La resonancia magnética nuclear evidenció múltiples hamartomas corticales y nódulos subependimarios. En el examen físico se encontraron diversas manchas hipocrómicas en cuello, extremidades y tronco (Figura 1), angiofibroma en cara, agujeros en esmalte dental (Figura 2) y manchas retinianas. En la ecografía renal había múltiples calcificaciones renales. Todos estos hallazgos confirmaron el diagnóstico de esclerosis tuberosa. Nació paciente a término, de género masculino, con peso adecuado para su edad gestacional. Su ecocardiografía confirmó la presencia de masa hiperdensa de gran tamaño en la porción medio ventricular izquierda, compatible con rabdomioma cardiaco (Figura 3). Hasta ahora ésta ha sido la única manifestación de la esclerosis tuberosa en este paciente.
Caso 2
Niño recién nacido a término, quien dos días luego de un parto sin complicaciones y buena adaptación neonatal, presentó convulsión tónica generalizada. Se encontró además flutter auricular, por lo que se realizó ecocardiografía transtorácica que mostró rabdomioma no obstructivo de 3,4 cm de diámetro en el ventrículo derecho. Por sospecha de esclerosis tuberosa se inició estudio imaginológico del cerebro, y mediante tomografía axial computarizada se halló trombosis de seno venoso y sangrado parietal bilateral. En la resonancia magnética nuclear se observó hemorragia en la región parieto-occipital y temporal derechas; sin túberes corticales. Tampoco presentó lesiones en piel, retina o riñón, ni se evidenciaron características en los padres que fueran compatibles con esclerosis tuberosa. El niño tuvo deterioro neurológico progresivo y murió a los cuatro días de nacido.
Discusión
Los tumores cardiacos primarios son raros en la edad pediátrica. Dentro de éstos el rabdomioma cardiaco es el más frecuente y tiene una alta asociación con la esclerosis tuberosa.
En este artículo se presentan dos casos de recién nacidos con rabdomioma cardiaco que hacen pertinente el diagnóstico de esclerosis tuberosa; uno de ellos con un evidente componente genético, en el que la madre cumplía con criterios clínicos mayores y menores para el diagnóstico de esta entidad clínica y presentaba la clásica tríada de Vogt, convulsiones, retardo mental y angiofibromas faciales, la cual ocurre sólo en 50% de los casos.
Estos hallazgos deben ser una señal de alarma para el seguimiento clínico del paciente, pues hasta 65% manifiesta su enfermedad como epilepsia, la cual en muchos de los casos es de difícil control y los hallazgos radiológicos pueden ser sólo evidentes hasta después de dieciséis a dieciocho meses de edad, siendo más sensibles en la resonancia magnética nuclear (10).
En el otro caso, en el que a causa del hallazgo ecocardiográfico de rabdomioma se realizó la búsqueda de esclerosis tuberosa tanto en el niño como en sus padres y fue negativa, la mutación genética para adquirir la esclerosis tuberosa correspondería a una mutación de novo, la cual es menos frecuente.
Es importante resaltar que no todos los rasgos de la esclerosis tuberosa están presentes en el momento del nacimiento y por el contrario comienzan a manifestarse en diferentes etapas de la vida; por lo tanto, el seguimiento clínico de los pacientes con manifestaciones que sugieren esta condición, como el rabdomioma cardiaco, o con componente genético asociado, son indispensables para tomar las conductas apropiadas en el momento indicado.
En el caso específico del rabdomioma cardiaco, el diagnóstico puede hacerse mediante ecografía prenatal, y de esta forma se facilita el tratamiento precoz, si es indicado, con resultados favorables (11). Mientras la obstrucción severa del flujo sanguíneo cardiaco necesita resección quirúrgica urgente, la mayoría de estos tumores involucionan de manera espontánea y su localización anatómica se convertirá en el factor que predecirá el desarrollo de arritmias cardiacas (12).
Las manifestaciones de la obstrucción mecánica dependen de la cavidad cardiaca implicada. En las lesiones del lado izquierdo, grandes masas intraventriculares pueden limitar el volumen de fin de diástole y por lo tanto alterar el gasto cardiaco; además, la obstrucción a la salida ventricular izquierda puede llevar a la estenosis aórtica crítica funcional, o incluso al síndrome del corazón izquierdo hipoplásico funcional. Estas lesiones requieren un conducto arterioso permeable para mantener el flujo de sangre sistémico. En ausencia de diagnóstico prenatal, estos recién nacidos presentarán un estado de choque con el cierre ductal. La obstrucción de la afluencia de la válvula mitral puede manifestarse también como síndrome de corazón izquierdo hipoplásico. En estos casos se requiere un septo interatrial sin restricción y un conducto arterioso permeable para mantener el gasto cardiaco y la perfusión sistémica. En el lado derecho del corazón, las grandes masas intraventriculares pueden limitar el volumen de fin de diástole ventricular llevando a signos de insuficiencia cardiaca del lado derecho. La obstrucción de la salida ventricular derecha puede llevar a estenosis pulmonar funcional severa o a atresia pulmonar funcional. Estas lesiones requieren un conducto arterioso permeable para mantener el flujo de sangre pulmonar. En ausencia de diagnóstico prenatal, estos recién nacidos presentarán cianosis extrema después del cierre ductal. La obstrucción de la afluencia de la válvula tricúspide puede llevar a atresia tricúspide funcional que requiere un conducto permeable y un septo interatrial sin restricción para mantener el volumen cardiaco y el flujo de sangre pulmonar.
La indicación para la hospitalización de pacientes pediátricos con los tumores cardiacos primarios, varía entre los diversos grupos. Los tumores intracardiacos diagnosticados en el útero requieren seguimiento por cardiólogo pediatra a través del embarazo, preferiblemente en un hospital de tercer nivel. Los hallazgos ecocardiográficos que sugieren compromiso hemodinámico debido al tamaño, incluyen el aumento progresivo en el cociente del porcentaje de la superficie transversal del tumor al área biventricular no ocupada en diástole en la ventana ecocardiográfica de cuatro-cámaras, incremento en las velocidades Doppler a través de cualquier zona de la salida ventricular, hipertensión venosa sistémica debido al incremento en la impedancia al vaciamiento atrial dando como resultado aumento del cociente de velocidad del flujo reverso durante la sístole atrial y flujo anterógrado durante la diástole atrial en la vena cava inferior e índice elevado de pulsatilidad de la vena cava inferior. Esta constelación de hallazgos indica la necesidad de atender el parto en un centro de tercer nivel, con la atención inmediata del equipo de cardiología pediátrica. El diagnóstico diferencial de un neonato con síndrome de dificultad respiratoria, cianosis y choque debe incluir siempre una lesión cardiaca ductus-dependiente junto con sepsis, neumonía y enfermedad metabólica. Si se presume que es posible un problema cardiaco, se realiza un ecocardiograma pediátrico en forma temprana. El diagnóstico de una masa cardiaca asociada a la presentación mencionada, implica obstrucción a la entrada/salida o bajo gasto cardiaco; esto, por supuesto, es una indicación absoluta para la admisión hospitalaria y requiere la intervención temprana para restablecer la perfusión sistémica o pulmonar.
Durante la infancia a la edad adulta temprana, los pacientes manifiestan la presencia de soplo cardiaco, o llegan a formar parte de una investigación para esclerosis tuberosa. Los pacientes con mixomas cardiacos y teratomas intrapericárdicos requieren hospitalización. Los mixomas cardiacos se extirpan en el momento del diagnóstico (1-13). La cirugía en los pacientes mayores asintomáticos con teratomas intrapericárdicos, se indica debido a su asociación con muerte súbita (14).
En los neonatos con diagnóstico en útero de tumores significativos desde el punto de vista hemodinámico, así como en los neonatos que presentan signos de compromiso hemodinámico causados por un tumor cardiaco de reciente diagnóstico, se requiere tratamiento farmacológico. Cuando existe obstrucción severa del tracto de salida asociada con compromiso del flujo sanguíneo sistémico o pulmonar, la prostaglandina E1 (PGE1) se inicia en forma emergente para abrir de nuevo el conducto arterioso. De igual forma, el transporte inmediato de estos neonatos a un centro médico de tercer nivel, con diagnóstico e intervenciones tempranas es crítico para el pronóstico. El retraso en la iniciación de la PGE1 da lugar a hipoperfusión sistémica o pulmonar prolongada, hipoperfusión coronaria y choque cardiogénico, lo cual conduce a paro cardiaco. Los neonatos en choque cardiogénico pueden requerir inotrópicos mientras se inicia la PGE1. Se ha demostrado que esta última abre el conducto arterioso (15), y dependiendo de la localización de la masa tumoral, aumenta el flujo sanguíneo pulmonar o el flujo sanguíneo sistémico. El establecimiento de flujo ductal en el caso de la obstrucción a la salida ventricular derecha, mejorará las saturaciones de oxígeno a medida que el flujo pulmonar aumenta. En el caso de la obstrucción a la salida ventricular izquierda (13), el flujo ductal permitirá la perfusión sistémica y la resolución de la acidosis metabólica. No existe contraindicación absoluta para la iniciación de PGE1 en el paciente con compromiso hemodinámico significativo debido a un tumor cardiaco primario. El deterioro clínico después de la iniciación de PGE1 indica obstrucción del flujo de sangre venosa pulmonar o un defecto septal interatrial restrictivo en el caso de la obstrucción atrioventricular. Estas situaciones requieren intervención de emergencia para restablecer el flujo venoso. Los procedimientos intervencionistas se indican en niños con tumores cardiacos primarios y obstrucción de la válvula atrioventricular asociada a un defecto septal interatrial restrictivo, en niños con bloqueo atrioventricular completo causado por la infiltración del tumor, y en niños con lesión hipóxico-isquémica asociada a disfunción miocárdica severa que no responde a tratamiento farmacológico. La septostomía atrial se realiza preferentemente de forma percutánea con balón, a través de la vena femoral o umbilical, en el laboratorio de cateterismo cardiaco usando fluoroscopia, o en la unidad de cuidados intensivos bajo dirección de la ecocardiografía. Se avanza un catéter desinflado hasta el atrio derecho, y allí, a través del agujero del foramen ovale, se pasa al atrio izquierdo, en donde se infla el balón. Éste debe estar totalmente libre dentro del atrio izquierdo antes de la septostomía, para evitar lacerar o separar las venas pulmonares del atrio izquierdo. Con un movimiento rápido se hace tracción del balón a través del septo interauricular. Esta maniobra se efectúa una a cuatro veces hasta que no se sienta resistencia al retirar el balón completamente inflado.
Las contraindicaciones relativas para la realización de septostomía atrial con balón incluyen: pacientes de más de un mes de vida, ya que el septo interatrial es más grueso y puede hacer ineficaz el procedimiento, y pacientes con el atrio izquierdo muy pequeño, pues están en riesgo de perforación o laceración de la orejuela atrial o de las venas pulmonares. Las complicaciones incluyen: ruptura del balón durante el procedimiento, inadecuada guía ecocardiográfica del catéter debajo del diafragma que puede llevar a perforación vascular subdiafragmática, desplazamiento de un trombo pre-existente en el conducto venoso con la manipulación del catéter bajo guía ecocardiográfica, y laceración del atrio izquierdo o aun avulsión de las venas pulmonares.
Debido a la historia natural de la regresión espontánea de los rabdomiomas, éstos deben tratarse de forma expectante. La terapia quirúrgica sólo se indica para los síntomas secundarios a una masa específica. La presencia de obstrucción a la salida ventricular, obstrucción a la afluencia de la válvula atrioventricular, o las arritmias intratables son indicaciones para resecar estos tumores. La meta de la terapia quirúrgica es resecar únicamente la masa o porción de masa responsable de la obstrucción y causante de la sintomatología adversa. Es importante no dañar las estructuras a las cuales está adherido el tumor. La resección completa no es necesaria. Típicamente, el tejido rabdomiomatoso restante regresará de manera espontánea y no causará ninguna otra secuela.
Durante el seguimiento de los niños se espera que los rabdomiomas tengan una regresión espontánea y por ello debe hacerse una evaluación periódica con ecocardiografía que la certifique y que además permita detectar complicaciones a tiempo (16).
Bibliografía
1. Freedom RM, Lee KJ, Mac Donald C, Taylor G. Selected aspects of cardiac tumours in infancy and childhood. Pediatr Cardiol 2000; 21: 299-316. [ Links ]
2. Fyler DC. Report of the New England Regional Infant Cardiac Program. Pediatrics 1980; 65: 375-461. [ Links ]
3. Sallee D, Spector ML, Van Heeckeren DW, Patel CR. Primary pediatric cardiac tumors: A 17 year experience. Cardiol Young 1999; 9: 155-62. [ Links ]
4. Marx GR, Moran AM. Cardiac tumors. In: Edited by Allen HD, et al. Moss and Adams' Heart Disease in Infants, Children, and Adolescents Including the Fetus and Young Adult, 6th. ed. Philadelphia: Lippincott, Williams & Wilkins; 2001. p. 1432-1445. [ Links ]
5. Becker AE. Primary heart tumors in the pediatric age group: a review of salient pathologic features relevant for clinicians. Pediatr Cardiol 2000; 21: 317-323. [ Links ]
6. Black MD, Kadletz M, Smallhorn JF, Freedom RM. Cardiac rhabdomyoma and obstructive left heart disease; histologically but not functionally benign. Ann Thorac Surg 1998; 65: 1388-90. [ Links ]
7. Crino P, Nathanson K, Petri E. The tuberous sclerosis complex. N Eng J Med 2007; 356: 92-94. [ Links ]
8. Au KS, Williams AT, Gambello MJ, Northrup H. Molecular genetic basis of tuberous sclerosis complex: from bench to bedside. J Child Neurol 2004; 19: 699-709. [ Links ]
9. Leung A, Robson W.L. Tuberous sclerosis complex. A review. J Pediatric Health Care 2007; 21 (2): 108-114. [ Links ]
10. Evans JC, Curtis J. The radiological appearances of tuberous sclerosis. Br J Radiol 2000; 73 (865): 91-98. [ Links ]
11. Erdmenger J, Vásquez C, Ortega J. Valor de la ecocardiografía en el diagnóstico contemporáneo de tumores cardiacos en Pediatría. Archivos de Cardiología de México 2005; 75 (2): 154-158. [ Links ]
12. Ba-Cohen Y, Silka MJ, Sklansky MS. Neonatal tuberous sclerosis and multiple cardiac arrhythmias. Circulation 2007; 115: e395-e397. [ Links ]
13. Elderkin RA, Radford DJ. Primary cardiac tumours in a paediatric population. J Paediatr Child Health 2002: 38; 173-177. [ Links ]
14. Burke A, Virmani R. Tumors of the heart and great vessels. In: Atlas of Tumor Pathology. Armed Forces Institute of Pathology. Washington DC; 1996: series 3, fascicle 16. [ Links ]
15. Heymann MA. Pharmacologic use of prostaglandin E1 in infants with congenital heart disease. Am Heart J 1981; 101: 837-843. [ Links ]
16. Arnaiz P, Toledo I, Borzutzky A, Urcelay G, Heusser F, Garay F, et al. Comportamiento clínico de los tumores cardiacos desde el feto hasta el adulto: serie multicéntrica de 38 pacientes. Rev Méd Chile 2006; 134: 1135-1145. [ Links ]














