Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.17 no.2 Bogota Mar./Apr. 2010
Servicio de Hemodinamia e Intervencionismo Cardiovascular. Laboratorio de Investigación en Función Vascular. Fundación Cardioinfantil- Instituto de Cardiología, Bogotá, Colombia.
Correspondencia: Dr. Darío Echeverri. Servicio de Hemodinamia e Intervencionismo Cardiovascular. Laboratorio de Investigación en Función Vascular. Fundación Cardioinfantil- Instituto de Cardiología, Calle 163 A No. 13B - 60. Primer Piso. Bogotá - Colombia. Teléfono: (57-1) 679 1192- (57-1) 667 2727 Ext.: 1114. Fax: (57-1) 669 0382. Correo electrónico: decheverri@cardioinfantil.org
Recibido: 30/09/2009. Aceptado: 21/10/2009.
Los stents medicados ofrecen la mejor alternativa disponible no quirúrgica para el tratamiento de la enfermedad coronaria gracias a su demostrada eficacia. Sin embargo, estos excelentes resultados han sido opacados en términos de seguridad, principalmente por la presencia de trombosis de stents de manera tardía o muy tardía. La comprensión de los efectos biológicos que ejercen a nivel de la arteria coronaria luego de su implante, se debe al efecto de la plataforma utilizada, el polímero y la droga que liberan. Los trastornos de reparación vascular inducidos favorecen la trombosis de stents y sus consecuencias clínicas. Se hace una revisión de los diferentes efectos biológicos de los stents medicados en las arterias coronarias, que permite comprender como han surgido rápidamente nuevas versiones en materiales, diseños, polímeros y medicamentos que reducen los efectos adversos a nivel coronario, mejorando su eficacia y seguridad.
PALABRAS CLAVE: stents, trombosis, endotelio, inflamación, enfermedad coronaria.
Drug-eluting stents offer the best available non-surgical alternative for the treatment of coronary disease, thanks to its demonstrated efficacy. However, in terms of security, these excellent results have been overshadowed by the late or very late appearance of stent thromboses.The biological effects they have in the coronary artery after its implantation are due to the effect of the platform used, the polymer and the medication released. The vascular healing disorders induced by drug-eluting stents favor stent thrombosis and its clinical consequences. This is a review of the different biological effects of drug-eluting stents in coronary arteries that allows to understand how the rapid onset of new versions of materials, designs, polymers and medications diminish adverse coronary effects and improve its efficacy and safety.
KEY WORDS: stents, thrombosis, endothelium, inflammation, coronary heart disease.
Introducción
El uso de stents para el tratamiento percutáneo de la enfermedad coronaria severa en casos seleccionados, ha sido uno de los avances más importantes en la medicina moderna. Con el ingreso de los stents convencionales (bare metal stents, BMS) a la terapia de revascularización miocárdica percutánea, se logró reducir el fenómeno del retroceso elástico y la remodelación vascular negativa luego del trauma vascular, con la consecuente reducción de la re-estenosis coronaria en comparación con la angioplastia con balón (1, 2). El riesgo de re-estenosis coronaria con BMS permanecía entre 20% a ± 25% en BMS. Los stents medicados (SM, drug-eluting stents, DES) se diseñaron para ofrecer, además de la acción mecánica del stent, un efecto biológico local a partir del medicamento que se libera en el segmento arterial intervenido. A pesar de los avances, la re-estenosis intra-stent, permanece como el principal problema por resolver, con un estimativo de frecuencia promedio de ±12% con stents medicados.
Los stents medicados de primera generación con rapamicina/sirolimus (SES) (Cypher® stents. Cordis Johnson & Johnson) o paclitaxel (PES) (Taxus® stents. Boston Scientific. Corp.) (Tabla 1), reducen la re-estenosis intra-stent y la revascularización del vaso intervenido a menos de 10% (3). A pesar de estos importantes resultados, la incidencia de trombosis a causa de los stents medicados no se ha reducido en comparación con los BMS (4); aún se reportan varios cientos de casos de trombosis de stents (5).
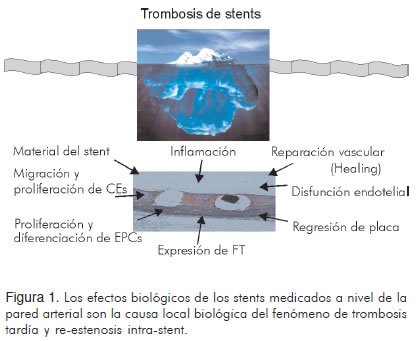
Hoy en día es claro que el implante de stents coronarios causa un trauma significativo en la pared del vaso. El proceso de re-estenosis coronaria y trombosis se relaciona estrechamente con la historia natural de reparación de heridas (vascular healing), el cual típicamente ocurre en varias semanas a meses. La interacción dinámica entre la superficie del stent con la pared del vaso es motivo de gran interés en la actualidad (Figura 1). Esta información indujo al desarrollo de nuevas generaciones de stents que ofrecen mayor eficacia y seguridad.
Fármacos en stents medicados de primera generación
Los primeros stents medicados usados son el SES (Cypher®) y el PES (Taxus®). Han reducido de manera importante la formación de hiperplasia neointimal por inhibir el ciclo celular en células activas en fase de proliferación (6). No es sorprendente que estos fármacos anti-proliferativos liberados a partir del stent, también tengan efectos adversos sobre otras células.
La rapamicina (sirolimus) es un macrólido-lactona natural, una prodroga con efecto inmunosupresor y propiedades anti-proliferativas. Se une al receptor intracelular de p27kip1, FKBP12 (FK506-unido a proteínas), que se encuentra up-regulated en células de músculo liso vascular de neoíntimas humanas. El complejo FKBP12/rapamicina se une e inactiva mTOR (mammalian target of rapamycin), un miembro de la fosfoinositol-3-kinasa (PI3K) de la familia de las proteinkinasas (PIKK). Estas PIKK están involucradas en pasos críticos del ciclo celular, incluyendo la fase de transición G1/S (7).
El paclitaxel es un diterpenoide extraído de varias especies Taxus (Taxus brevifolia y Taxus media) (8). Su mecanismo de acción es promover una interferencia con la formación de microtúbulos al unirse a la subunidad b-tubulina, estabilizándolos y reduciendo la transferencia de material genético durante la mitosis e induciendo paro mitótico y muerte celular.
El paclitaxel inhibe las células de músculo liso vascular y la migración de células endoteliales a concentraciones bajas nanomolares (nM) induciendo apoptosis en ambos tipos de células. El sirolimus produce paro de células del músculo liso vascular y de células endoteliales en las fases G0/G1 sin inducir apoptosis, lo que permite sugerir que el paclitaxel tiene efecto antiproliferativo a través de la muerte celular apoptótica y que el sirolimus lo tiene a través de un mecanismo citostático (9).
Efectos del material del stent en la circulación coronaria
Algunos materiales de las plataformas de los stents parecen promover el desarrollo de trombosis. Recientemente se ha demostrado la incidencia creciente de respuesta alérgica al níquel (10). Los stents en acero inoxidable (316L) exponen una carga de níquel en contacto con las células, induciendo una respuesta a cuerpo extraño local. Los stents diseñados con celdas abiertas produjeron mayor activación de plaquetas a treinta días en comparación con aquellos de celdas cerradas (11). El grosor de los struts así como el tipo de polímero utilizado, también desempeñan un papel muy importante al asociarse con mayor trauma, respuesta inflamatoria, depósitos de fibrina, retardo en la endotelización y trombosis.
La infiltración eosinofílica crónica en la pared arterial, sugiere una reacción de hipersensibilidad y probablemente se debe a la presencia de polímeros no-erodables de los stents medicados. Estas reacciones se observan de manera creciente luego de cuatro meses del implante (12). Mientras que el polímero puede tener un efecto en las arterias coronarias después del implante del stent, la relación causal entre inflamación inducida por el polímero y la incidencia de trombosis, solamente se ha observado en una minoría de pacientes.
Inflamación inducida por stents medicados
Los efectos vasculares de los stents medicados fueron descritos en modelos animales en los cuales se demostró necrosis de la túnica media e infiltrado inflamatorio (13). Fueron vistos con dosis muy altas de paclitaxel y en todas las dosis de actinomicina D, y se asociaron con fuerza a remodelación arterial positiva, mala aposición de struts y trombosis de stents. Se observaron hallazgos similares en un estudio clínico que utilizó stents con actinomicina D, reportando alta re-estenosis intra-stent y trombosis tardía.
Los leucocitos locales favorecen la adhesión a través de integrinas de la clase Mac-1 (CD11b/CD18), y también se unen a plaquetas vía receptores GP1b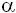 y a través de los receptores GPIIb/IIIa al fibrinógeno (14). Bajo la influencia de quimoquinas (MCP-1, IL-6 y IL-8) liberadas a partir de células de músculo liso vascular y macrófagos residentes, se forma un infiltrado leucocitario local. Factores de crecimiento tales como FGF (fibroblast growth factor), PDGF (platelet-derived growth factor), IGF (insulin-like growth factor), TGF-
y a través de los receptores GPIIb/IIIa al fibrinógeno (14). Bajo la influencia de quimoquinas (MCP-1, IL-6 y IL-8) liberadas a partir de células de músculo liso vascular y macrófagos residentes, se forma un infiltrado leucocitario local. Factores de crecimiento tales como FGF (fibroblast growth factor), PDGF (platelet-derived growth factor), IGF (insulin-like growth factor), TGF-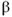 (transforming growth factor-
(transforming growth factor-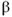 ) y VEGF (vascular endothelial growth factor) que son liberados a partir de plaquetas, leucocitos y células de músculo liso vascular, estimulan la proliferación y migración de éstas desde la media hacia la íntima. La presencia de esta clase de células, la infiltración de macrófagos y la producción de matriz extracelular (MEC) ayudan a formar la neoíntima de la re-estenosis intra-stent.
) y VEGF (vascular endothelial growth factor) que son liberados a partir de plaquetas, leucocitos y células de músculo liso vascular, estimulan la proliferación y migración de éstas desde la media hacia la íntima. La presencia de esta clase de células, la infiltración de macrófagos y la producción de matriz extracelular (MEC) ayudan a formar la neoíntima de la re-estenosis intra-stent.
La respuesta inflamatoria local es uno de los factores más críticos del trauma vascular inducido por stents medicados. Las reacciones de hipersensibilidad han sido descritas con SES e involucran grandes segmentos del stent; éstas consisten en infiltrados de eosinófilos y linfocitos T alrededor de los struts, comprometiendo zonas a través de la lámina elástica interna y la túnica media, y favoreciendo la remodelación positiva (15). Además, la utilización de polímeros no-bioabsorbibles (polyethilene-co-vynil acetate (PEVA) y poly n-butyl methacrylate (PBMA) en stents medicados, contribuye en gran parte a esta reacción de hipersensibilidad y de cuerpo extraño a nivel local (16).
Los stents medicados inhiben la migración y proliferación de células endoteliales
La restauración de un endotelio intacto, desde el punto de vista morfológico y funcional luego del trauma vascular con stents, representa un proceso crucial en el restablecimiento de una superficie arterial anti-trombótica. Por tradición, se ha pensado que la re-endotelización ocurre porque las células endoteliales proliferan y migran a partir de segmentos arteriales vecinos intactos, llevando a una reparación endotelial del segmento intervenido.
La toxicidad local de los fármacos utilizados en stents medicados, tiene un efecto adverso tóxico sobre las células endoteliales, que compromete su replicación, función y regeneración, dado que las proteínas reguladoras del ciclo celular pueden inhibirse a partir de fármacos de los stents medicados no sólo en células de músculo liso vascular sino también en células endoteliales.
En humanos, la re-endotelización casi completa se observa tres a cuatro meses después del implante de BMS (17). En estudios de autopsia, en los que se comparan segmentos arteriales coronarios después del implante de BMS y stents medicados, existe retardo en la reparación vascular («healing») y pobre re-endotelización documentada en segmentos con stents medicados. En el estudio de Parry y colaboradores (18) muestran que solamente el paclitaxel inhibe las células de músculo liso vascular y la migración de células endoteliales a concentraciones bajas (nM). El sirolimus frena las células de músculo liso vascular y las células endoteliales en fase G0/G1 del ciclo celular sin inducir apoptosis, mientras que el paclitaxel induce apoptosis en ambas células a bajas concentraciones. Los resultados de este estudio sugieren que sirolimus tiene un efecto citostático y que paclitaxel uno apoptótico y muerte celular.
Los stents medicados inhiben la proliferación y diferenciación de células progenitoras endoteliales
Siempre se ha pensado que las células endoteliales proliferan y migran a partir de células madre en los segmentos coronarios intervenidos llevando a la re-endotelización. Estas células progenitoras endoteliales, son células inmaduras derivadas de la médula ósea, con capacidad de migrar, proliferar y diferenciarse en células endoteliales bajo la influencia de factores de crecimiento angiotrópicos, incluyendo el factor de crecimiento de endotelio vascular, interacciones célula-célula e interacciones con la matriz extraceluar (19).
En 1997, Asahara y colaboradores (20), sugirieron el papel benéfico de estas células progenitoras de endotelio en neoangiogénesis y reparación vascular. Las drogas de los stents medicados también suprimen las células progenitoras de endotelio (21) impidiendo una potencial re-endotelización. Por su parte, la rapamicina inhibe la proliferación, migración y diferenciación de células progenitoras de endotelio in-vitro a través de la interacción con mTOR y en parte por inducción de apoptosis. Se estima que estas células contribuyen a la re-endotelización de la neoíntima hasta en 25%.
Los stents medicados inducen disfunción endotelial en la circulación coronaria distal
La disfunción endotelial, manifestada como un efecto de vasoconstricción no deseado, ha sido demostrada inmediatamente después de intervención coronaria percutánea (PCI) con normalización en tres a cinco meses.
La disfunción endotelial por largo plazo se ha documentado en segmentos arteriales intervenidos con SES, pero no con BMS, y se manifiesta como una vasoconstricción paradójica a la acetilcolina. De manera similar, el implante de PES se asocia con vasoconstricción inducida con ejercicio en segmentos arteriales proximales y distales al stent, mientras que se documentó vasodilatación con el uso de BMS (22). Estos sucesos podrían ayudar a explicar fenómenos de vasoespasmo y «no-reflujo» después del implante.
Los stents medicados inducen expresión de factor tisular
Tal vez, el factor tisular es la sustancia más trombogénica que posee el árbol coronario. Consistentemente, la inhibición de mTOR incrementa la expresión y actividad del factor tisular endotelial inducido por trombina y TNFa (23). Este efecto ocurre en presencia de concentraciones farmacológicas de rapamicina utilizadas después del implante de stents in-vivo. Sin embargo, el efecto de la rapamicina sobre la expresión del factor tisular en células de músculo liso vascular es controvertido; algunos no han demostrado algún efecto luego de cinco horas de exposición, otros han demostrado que la exposición prolongada por más de veinticuatro horas, tiene un ligero incremento de la expresión de factor tisular de células de músculo liso vascular. El paclitaxel también activa señales de transducción de moléculas tales como JNK, un importante mediador de la inducción de factor tisular endotelial (24).
De tal manera que la inducción de factor tisular en respuesta a rapamicina y paclitaxel, podría promover un ambiente pro-trombótico después del implante de stents medicados. Las implicaciones clínicas de este efecto no son claras y se requieren más estudios para aclarar este aspecto.
Retardo en la reparación vascular (healing)
El depósito de fibrina y plaquetas se observa alrededor de los struts de los stents con gran acumulación de células inflamatorias luego del implante de stents medicados en el primer mes. Sin embargo, luego de este periodo se empiezan a observar las diferencias: la proliferación de células de músculo liso vascular es profundamente suprimida, rara vez vista entre los tres a seis meses y más prominente en SES que en PES; esta diferencia persiste hasta el primer año. Los depósitos de fibrina son más intensos y difusos en PES, y es mayor que cuando se compara con BMS. La pobre cobertura endotelial es un hallazgo consistente en stents medicados aún hasta dos a tres años de seguimiento, en contraste con una re-endotelización completa a tres o cuatro meses en BMS.
Recientemente, se publicaron los resultados de un estudio diseñado para evaluar la reparación vascular arterial luego del implante de un BMS, y stents medicados con beta-estradiol (BES) y everolimus (EES) en un modelo animal de conejos con aterosclerosis avanzada (25). Los BES inducen índices mayores de inflamación y depósitos de fibrina con bajo índice de re-endotelización. El EES indujo mayor inflamación, fibrina y signos de hemorragia. Ambos inducen similar grado de transtornos de reparación vascular. De otra parte, el porcentaje de colágeno tipo I fue similar. El porcentaje de colágeno tipo III fue más alto en BMS cuando se comparó con stents medicados o stents recubiertos solamente con polímero (Figuras 2 y 3). La presencia de struts descubiertos, sin re-endotelización, es un factor importante para trombosis tardía, el cual se ha demostrado con mayor frecuencia en pacientes in-vivo a través de angioscopia, al comparar SES con BMS (26).
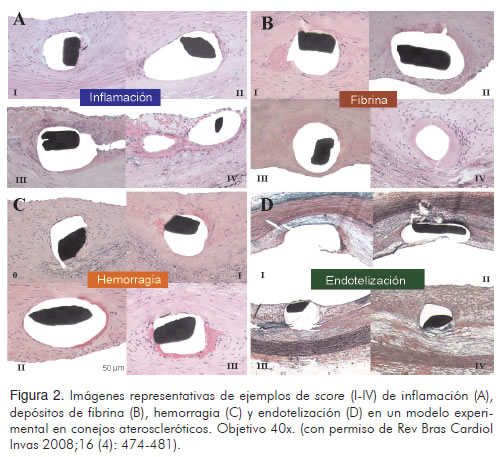
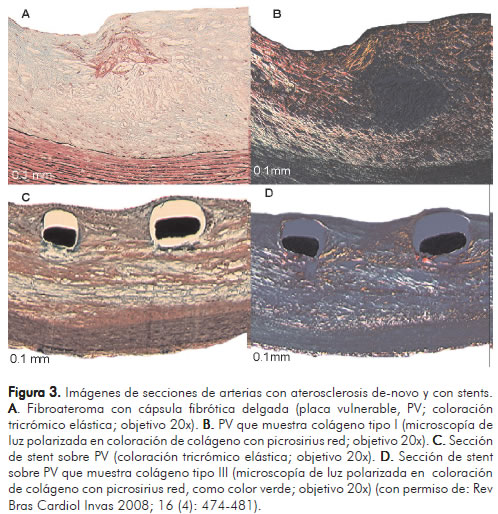
Stents medicados y trombosis coronaria
Pese a que los stents medicados reducen la re-estenosis coronaria de manera significativa en comparación con todas las técnicas de revascularización coronaria utilizadas, la frecuencia de trombosis intra-stent no ha disminuido en comparación con BMS. Los stents medicados se asocian con trombosis tardía, en especial cuando se usan en condiciones «off label». En la literatura médica se reporta un número no despreciable de trombosis de stents. Esta cifra puede ser aun mayor en el contexto del «mundo real» más que en los estudios clínicos (27).
Para aclarar este fenómeno se desarrollaron varios meta-análisis. Algunos de estos no revelaron un incremento de riesgo de trombosis en stents medicados en comparación con BMS entre ocho y doce meses. Posteriormente, tres meta-análisis atrajeron especialmente la atención ya que en éstos se demostró que la trombosis de stents medicados tenía una incidencia acumulada de 1,3 a 2,9/100 pacientes año. En otros estudios se demostró que los stents medicados tienen mayor incidencia de trombosis tardía que los BMS (28). Aunque la interpretación de los meta-análisis tiene limitaciones inherentes, que incluyen uso selectivo de puntos finales, recolección de datos incompletos y una naturaleza retrospectiva de los análisis, es llamativa la descripción de trombosis en stents medicados incluso luego de varios años de implante.
Aunque la trombosis de stents permanece como un evento raro, se considera como una complicación severa con alta morbimortalidad. A ello se asocian varios factores incluyendo características del procedimiento por sí mismo (mala aposición del stent, subexpansión, número de stents implantados, longitud, flujo sanguíneo lento y persistente, disección residual), características del paciente y de la lesión, diseño del stent, y cese prematuro del consumo de terapia antiagregante entre otros (ejemplo: resistencia a la aspirina y al clopidogrel).
El efecto biológico local de los stents medicados en las arterias coronarias, desempeña un papel importante que no debe subestimarse, para ser considerado como un factor importante en la génesis de la trombosis. La activación de señales de transducción celular, la inhibición en la proliferación celular y el compromiso de la re-endotelización ayudan al retardo de la reparación vascular, e incluso el ambiente pro-trombogénico asociado al aumento en la expresión de factor tisular favorecen la presencia de mayor riesgo de trombosis local.
A pesar de que la relación causal entre inflamación inducida por el polímero y la incidencia de trombosis de stents sólo se ha probado en una minoría de pacientes que poseen condiciones especiales pro-inflamatorias, análisis detallados de los cambios morfológicos muestran una respuesta inmune celular localizada, con predominio de linfocitos CD45+ y eosinófilos.
Stents medicados de segunda generación
En respuesta a las limitaciones en seguridad de los stents medicados de primera generación, han surgido nuevas alternativas que ofrecen diferentes plataformas, polímeros y medicamentos (Tabla 1).
El everolimus, un compuesto activo de la familia del sirolimus, se usa en la actualidad en stents medicados de segunda generación (Xience V® stent, Abbott Vascular y Promus® stent, Boston Scientific); ha demostrado un gran efecto anti-proliferativo, inmunosupresor y citostático. Posee una plataforma en cromo-cobalto con struts de bajo perfil con 0,0032" ó 0,0813 mm de grosor, un fluoropolímero altamente biocompatible, durable y no adhesivo, con alta capacidad de carga de droga, gran adhesión al metal, así como buena ductibilidad y flexibilidad. Este stent medicado ha demostrado importantes resultados angiográficos y clínicos cuando se compara con BMS y Taxus® stent (29).
El zotarolimus también es un análogo del sirolimus altamente lipofílico, con propiedades anti-proliferativas y anti-inflamatorias. El stent medicado con zotarolimus (ZES) (Endeavor® stent; Medtronic Vascular), utiliza una plataforma de cromo-cobalto y un polímero de fosforilcolina también altamente biocompatible. Los componentes del Endeavor Resolute® comprenden la plataforma y un sistema de polímero Biolinx® que posee la característica de tener propiedades hidrofílicas (biocompatible, menos pro-inflamatorio y menos pro-trombótico) e hidrofóbicas (mayor retención y mejor distribución uniforme de la droga), lo cual podría tener impacto en una mejor reparación vascular luego del implante. De la misma manera, el zotarolimus inhibe la migración y proliferación de células de músculo liso vascular y reduce la formación de neoíntima en modelos animales porcinos y estudios clínicos (30).
El biolimus A9T (BA9 eluting stent) es un polímero bioabsorbible. El pimecrolimus es un derivado de la ascomicina y posee actividad anti-inflamatoria e inmuno-modulatoria conocida al bloquear la activación de células T (31). Esta inmunofilina, se une específicamente al receptor citosólico inmunofilina-macrofilina-12. Este complejo pimecrolimus-macrophilina inhibe efectivamente la proteína calcineurin-fosfatasa en las células T. El resultado de este bloqueo de señales es la inhibición de la síntesis de citokinas inflamatorias, específicamente Th1 (IL-2, interferón- ), y Th2 (IL-4, IL-10). El pimecrolimus también ha demostrado prevenir la liberación de citokinas y mediadores pro-inflamatorios de las células mastocíticas. Los resultados revelan permeabilidad arterial con baja oclusión (± 29% vs. 41%) y con menor índice de inflamación (0,78-0,97 vs. 1,08). Se demostraron resultados angiográficos similares con un mayor diámetro luminal para los stents con pimecrolimus en comparación con stents con PLLA, lo cual refleja una adecuada reparación vascular similar a los BMS y una reducción de la respuesta neointimal.
), y Th2 (IL-4, IL-10). El pimecrolimus también ha demostrado prevenir la liberación de citokinas y mediadores pro-inflamatorios de las células mastocíticas. Los resultados revelan permeabilidad arterial con baja oclusión (± 29% vs. 41%) y con menor índice de inflamación (0,78-0,97 vs. 1,08). Se demostraron resultados angiográficos similares con un mayor diámetro luminal para los stents con pimecrolimus en comparación con stents con PLLA, lo cual refleja una adecuada reparación vascular similar a los BMS y una reducción de la respuesta neointimal.
Diseño de futuros stents medicados
Los stents medicados ideales deberían inhibir la formación neointimal sin interferir con la reparación vascular y la re-endotelización, sobre la base de un medicamento con adecuadas propiedades farmacológicas locales y un polímero biodegradable y biológicamente inerte. Los nuevos stents con agentes biológicos que faciliten la re-endotelización después del implante del stent representan un objetivo claro en la tecnología para optimizar la eficacia y la seguridad (Tabla 1).
En la actualidad se han diseñado varias combinaciones que están disponibles en la práctica clínica. Probablemente se aproximen nuevas mezclas de materiales como titanium con óxido nítrico, que disminuyan la adhesión de plaquetas y el depósito de fibrinógeno (32).
En vista de que recientes reportes sugieren que las células progenitoras de endotelio guardan estrecha relación con las plaquetas, la modificación de la superficie del stent podría obtenerse por diferentes vías:
a. Optimizando las propiedades electromecánicas.
b. Modificando la estructura de la topografía.
c. Adhiriendo moléculas biomiméticas en la superficie del stent (33).
En respuesta a estos conceptos se desarrollaron varias estrategias; por ejemplo la reciente creación de una nano-estructura de titanio favorece la re-endotelización cuatro veces (34). En modelos animales en los cuales se utilizaron arterias coronarias de porcinos, se han implantado stents con péptido cyclic Arg-Gly-Asp, induciendo una endotelización acelerada que atrae células progenitoras de endotelio (35). El dimetthyl sulfóxido (DMSO) puede prevenir la proliferación y migración de células de músculo liso vascular y, al mismo tiempo, reducir la up-regulation de factor tisular en células endoteliales, células de músculo liso vascular y macrófagos, y disminuir la posibilidad de oclusión trombótica in-vivo en modelos de arterias carótidas en ratones (36).
Algunas nuevas versiones de stents medicados en desarrollo, intentan omitir el uso del polímero controlando la liberación de la droga, usando microporos o diseños de stents basados en pequeños reservorios que liberan la droga, tales como nonpolymer-SES (37), PES y tacrolimus-eluting stent (38). Se describen hallazgos preliminares con stents medicados biodegradables, que procuran una plataforma ideal con biocompatibilidad óptima y propiedades mecánicas adecuadas que les permitan ser incorporados de manera correcta (39).
Recientemente, se consideró la combinación de tecnología de stents bioabsorbibles (Tabla 2) con la capacidad de liberación de drogas, permitiendo que la plataforma desaparezca una vez haya cumplido con el objetivo de evitar el retroceso elástico y la remodelación vascular negativa. El stent bioabsorbible liberador de everolimus, tiene una plataforma en poly-D,L-lactic acid (PLLA) y permite la liberación controlada del medicamento. Este stent está en evaluación en el ABSORB Trial (40), en el cual ha demostrado LL aceptable, formación neointimal intrastent mínima y área de obstrucción baja.
Conclusión
Una vez se implantan los stents medicados en la arteria, ejercen diferentes efectos biológicos locales en la circulación coronaria que deben tenerse en cuenta y comprenderse. Su acción no está confinada a la inhibición de la migración y proliferación de células de músculo liso vascular. Los stents medicados se asocian con reacciones de hipersensibilidad local que pueden ser un factor importante en el retardo de la reparación vascular (vascular healing) con el consecuente riesgo de trombosis.
Esto ha generado gran interés en desarrollar mejores plataformas, polímeros y medicamentos en dispositivos de segunda y tercera generación, que permitan mantener la eficacia mejorando la seguridad, para así sostener la tecnología de los stents como la terapia de elección para el tratamiento de la enfermedad coronaria oclusiva.
Bibliografía
1. Fischman DL, Leon MB, Baim DS, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med 1994; 331: 496-501. [ Links ]
2. Serruys PW, de Jaegere P, Kiemeneij F, et al. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. BENESTENT Study Group. N Engl J Med 1994; 331: 489-495. [ Links ]
3. Moses JW, Leon MB, Popma JJ, et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med 2003; 349: 1315-1323. [ Links ]
4. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents: a cause for concern. Circulation 2007; 115: 1440-1455. [ Links ]
5. Luscher TF, Steffel J, Eberli FR, et al. Drug-eluting stent and coronary thrombosis: biological mechanisms and clinical implications. Circulation 2007; 115: 1051-1058. [ Links ]
6. Marx SO, Jayaraman T, Go LO, Marks AR. Rapamycin-FKBP inhibits cell cycle regulators of proliferation in vascular smooth muscle cells. Circ Res 1995; 76: 412-417. [ Links ]
7. Wang TH, Wang HS, Ichijo H, Giannakakou P, Foster JS, Fojo T, Wimalasena J. Microtubule-interfering agents activate c-Jun N-terminal kinase/stress-activated protein kinase through both Ras and apoptosis signal-regulating kinase pathways. J Biol Chem 1998; 273: 4928-4936. [ Links ]
8. Kamath KR, Barry JJ, Miller KM. The Taxus drug-eluting stent: a new paradigm in controlled drug delivery. Advances in drugs delivery 2006; 58: 412-436. [ Links ]
9. Parry TJ, Brosius R, Thyagarajan R, Carter D, Argentieri D, Falotico R, Siekierka J. Drug-eluting stents: sirolimus and paclitaxel differentially affect cultured cells and injured arteries. Eur J Pharmacol 2005; 524 (1-3): 19-29. [ Links ]
10. Mc Lucas E, Rochev Y, Carroll WM, Smith TJ. Analysis of the effects of surface treatments on nickel release from nitinol wires and their impact on candidate gene expression in endothelial cells. J Mater Sci Mater Med 2008; 19: 975-980. [ Links ]
11. Gurbel PA, Callahan KP, Malinin AI, et al. Could stent design affect platelet activation? Results of the Platelet Activation in STenting (PAST) study. J Invasive Cardiol 2002; 14: 584-589. [ Links ]
12. Farb A, Burke AP, Kolodgie FD, et al. Pathological mechanisms of fatal late coronary stent thrombosis in humans. Circulation 2003; 108: 1701-1706. [ Links ]
13. Virmani R, Farb A, Guagliumi G, Kolodgie FD. Drug-eluting stents: caution and concerns for long-term outcome. Coron Artery Dis 2004; 15 (6): 313-318. [ Links ]
14. Watt J, Wadsworth R, Kennedy S, Oldroyd KG. Pro-healing drug-eluting stents: a role for antioxidants? Clinical Science 2008; 114: 265-273. [ Links ]
15. Nakasawa G, Ladich H, Finn A, Virmani R. Pathophysiology of vascular healing and stent mediated arterial injury. Eurointervention 2008; 4 (Suppl C): C7-C10. [ Links ]
16. Ahmed DD, Sobczak SC, Yunginger JW. Occupational allergies caused by latex. Immunol Allergy Clin North Am 2003; 23 (2): 205-219. [ Links ]
17. Farb A, Burke AP, Kolodgie FD, et al. Pathological mechanisms of fatal late coronary stent thrombosis in humans. Circulation 2003; 108: 1701-1706. [ Links ]
18. Parry TJ, Brosius R, Thyagarajan R, Carter D, Argentieri D, Falotico R, et al. Drug-eluting stents: sirolimus and paclitaxel differentially affect cultured cells and injured arteries. Eur J Pharmacol 2005; 524: 19-29. [ Links ]
19. Butzal M, Loges S, Schweizer M, Fischer U, Gehling UM, Hossfeld DK, et al. Rapamycin inhibits proliferation and differentiation of human endothelial progenitor cells in vitro. Exp Cell Res 2004; 300: 65-71. [ Links ]
20. Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science; 275 (5302): 964-967. [ Links ]
21. Steffel J, Latini RA, Akhmedov A, Zimmermann D, Zimmerling P, Luscher TF, et al. Rapamycin, but not FK-506, increases endothelial tissue factor expression: implications for drug-eluting stent design. Circulation 2005; 112: 2002-2011. [ Links ]
22. Togni M, Räber L, Cocchia R, et al. Local vascular dysfunction after coronary paclitaxel-eluting stent implantation. Int J Cardiol 2007; 120 (2): 212-220. [ Links ]
23. Steffel J, Latini RA, Akhmedov A, et al. Rapamycin, but not FK-506, increases endothelial tissue factor expression: implications for drug-eluting stent design. Circulation 2005; 112: 2002-2011. [ Links ]
24. Steffel J, Luscher TF, Tanner FC. Tissue factor in cardiovascular diseases: molecular mechanisms and clinical implications. Circulation 2006; 113: 722-731. [ Links ]
25. Echeverri D, Purushothaman KR, Moreno PR. Reparação vascular após implante de stents não-farmacológicos e farmacológicos em modelo experimental de fibroateroma de capa fina em coelhos. Rev Bras Cardiol Invas 2008; 16 (4): 474-481. [ Links ]
26. Awata M, Kotani J, Uematsu M, et al. Serial angioscopic evidence of incomplete neointimal coverage after sirolimus-eluting stent implantation: comparison with bare-metal stents. Circulation 2007; 116 (8): 910-916. [ Links ]
27. Ong AT, McFadden EP, Regar E, de Jaegere PP, van Domburg RT, Serruys PW. Late angiographic stent thrombosis (LAST) events with drug-eluting stents. J Am Coll Cardiol 2005; 45: 2088-2092. [ Links ]
28. Bavry AA, Kumbhani DJ, Helton TJ, Borek PP, Mood GR, Bhatt DL. Late thrombosis of drug-eluting stents: a meta-analysis of randomized clinical trials. Am J Med 2006; 119: 1056-1061. [ Links ]
29. Stone GW, for the SPIRIT III Investigators. Clinical, angiographic, and IVUS results from the pivotal U.S. randomized SPIRIT III Trial of the XIENCE V Everolimus Eluting Coronary Stent System. Paper presented at: ACC 56th Annual Scientific Session; March 24-27, 2007; New Orleans, LA. [ Links ]
30. García-Touchard A, Burke SE, Toner JL, et al. Zotarolimus-eluting stents reduce experimental coronary artery neointimal hyperplasia after 4 weeks. Eur Heart J 2006; 27: 988-993. [ Links ]
31. Grassberger M, Baumruker T, Enz A, Hiestand P, Hultsch T, Kalthoff F, et al. Novel anti-inflammatory drug, SDZ ASM 981, for the treatment of skin diseases: in vitro pharmacology. Br J Dermatol 1999; 141: 264-273. [ Links ]
32. Windecker S, Simon R, Lins M, et al. Randomized comparison of a titanium-nitride-oxide-coated stent with a stainless steel stent for coronary revascularization: the TiNOX trial. Circulation 2005; 111: 2617-2622. [ Links ]
33. Sprague EA, Pomeranz ML, Odess I, Furnish SM, Granada JF. Surface material, surface treatment and nanotechnology in cardiovascular stent development. Eurointervention 2008; 4 (Suppl C): C60-C62. [ Links ]
34. Choudhary S, Haberstroh KM, Webster TJ. Enhanced functions of vascular cells on nanostructured Ti for improved stent applications. Tissue Eng 2007; 13 (7): 1421-1430. [ Links ]
35. Aoki J, Serruys PW, van Beusekom H, et al. Endothelial progenitor cell capture by stents coated with antibody against CD34: the HEALING-FIM (Healthy Endothelial Accelerated Lining Inhibits Neointimal Growth-First In Man) Registry. J Am Coll Cardiol 2005; 45: 1574-1579. [ Links ]
36. Camici GG, Steffel J, Akhmedov A, et al. Dimethyl sulfoxide inhibits tissue factor expression, thrombus formation, and vascular smooth muscle cell activation: a potential treatment strategy for drug-eluting stents. Circulation 2006; 114: 1512-1521. [ Links ]
37. Mehilli J, Kastrati A, Wessely R, et al. Randomized trial of a nonpolymer-based rapamycin-eluting stent versus a polymer-based paclitaxel-eluting stent for the reduction of late lumen loss. Circulation 2006; 113: 273-279. [ Links ]
38. Morice MC, Bestehorn HP, Carrie D. et al. Direct stenting of de novo coronary stenoses with tacrolimus-eluting versus carbon-coated carbostents. The randomised JUPITER II trial. Eurointervention 2006; 2: 45-52. [ Links ]
39. Lafont A. Bioresorbable stents: the next horizon after drug eluting stents? Eurointervention 2007; 3: 21-23. [ Links ]
40. Ormiston JA, Serruys PW, Regar E, et al. A bioabsorbable everolimus-eluting coronary stent system for patients with single de-novo coronary artery lesions (ABSORB): a prospective open-label trial. Lancet 2008; 371: 899-907. [ Links ]














