Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cardiología
versão impressa ISSN 0120-5633
Rev. Colom. Cardiol. v.17 n.3 Bogota maio/jun. 2010
Descripción de un caso clínico y revisión de tema
Description of a clinical case and literature review
(1) Fundación Santa Fe de Bogotá, Bogotá, Colombia.
Correspondencia: Dr. Julio César Rodríguez Goyes. Fundación Santa Fe de Bogotá. Departamento de Medicina Interna. Calle 119 No. 7-75. Bogotá DC., Colombia. Teléfonos: (571) 603 0303 Fax: (571) 6575714, AA. 220246. Correo electrónico: julliusc@yahoo.com.mx
Recibido: 28/08/2009. Aceptado: 07/05/2010.
El aneurisma arterial coronario constituye una entidad rara en la población; su incidencia varía entre 1,5% y 5%, siendo más frecuente en hombres. Existe escasa bibliografía acerca de esta patología a pesar de que su estudio se remonta a finales del siglo XVIII. La arteria que se afecta con mayor frecuencia es la coronaria derecha, aproximadamente en 40% de los casos. La dificultad al momento del diagnóstico clínico radica en que inicialmente el enfoque está dirigido a confirmar y tratar de manera oportuna el síndrome coronario agudo que con insistencia constituye la manifestación inicial con que cursan este tipo de pacientes; por ello el diagnóstico necesariamente requiere ayudas imaginológicas e intervencionistas, o ambas. Hay muchas causas que puedan producir aneurismas en la circulación coronaria, la más común de ellas es la aterosclerosisseguida por trastornos congénitos, enfermedades del tejido conectivo, vasculitis y consumo de cocaína entre otros. Recientemente se han publicado innovadores estudios respecto a la fisiopatología y los avances en terapéutica farmacológica e intervencionista, aunque el tratamiento debe enfocarse en los factores de riesgo, las patologías y las manifestaciones clínicas que presente el paciente.
PALABRAS CLAVE: aneurisma arterial coronario, aneurisma sacular, aneurisma fusiforme, ectasia coronaria, isquemia miocárdica, cocaína, enfermedad de Kawasaki, síndrome coronario agudo, arterioesclerosis.
Coronary artery aneurysm is a rare entity in the population. Its incidence rates vary between 1.5% - 5%, and is more frequent in males. There is limited literature on this disease, although its study goes back to the late eighteenth century. The most frequently affected artery is the right coronary artery, in approximately 40% of cases. The initial diagnostic difficulty lies in the fact that the initial approach is focused in confirming and treating properly the coronary acute syndrome, which is the most frequent initial presentation in these patients. Therefore, its diagnosis requires necessarily imaging or interventionist aid, or both. Many causes account for coronary aneurysms, being the most common atherosclerosis followed by congenital abnormalities, connective tissue diseases, vasculitis and cocaine consumption. Novel studies regarding the physiopathology and advances in pharmacological and interventionist therapy have been published, although treatment must focus on risk factors, associated pathologies and clinical manifestations.
KEY WORDS: coronary artery aneurysm, sacular aneurysm, fusiform aneurysm, coronary ectasia, myocardial ischemia, cocaine, Kawasaki disease, acute coronary syndrome, atherosclerosis.
Caso clínico
Paciente masculino de 54 años, originario de Girardot y procedente de Bogotá, químico desde hace veinticinco años, con factores de riesgo cardiovasculares dados por edad, género, sedentarismo, obesidad, dislipidemia y hábito de fumar de 90 paquetes/año durante veinte años hasta hace diez años, quien asistió el 13 de marzo de 2008 a consulta externa con Medicina Interna en la Fundación Santa Fe de Bogotá, por cuadro de dolor torácico precordial de cinco días de evolución, opresivo, con intensidad 6/10, sin irradiación, desencadenado con medianos esfuerzos y disnea paroxística nocturna. En dicha consulta sus signos vitales fueron: TA 130/80 FC 70 FR 18 T 36,5 Peso 103 Talla 178 IMC 32, sin alteraciones al examen físico. La conducta a seguir fue estudio ambulatorio mediante ecocardiograma estrés con dobutamina y nuevo control por consulta externa. Asistió con resultados de paraclínicos el 3 de abril de 2009 en los que se encontró ecocardiograma con estrés farmacológico con fracción de eyección de 67%, positivo para isquemia miocárdica inducida por el fármaco al 82% de la frecuencia cardiaca máxima esperada. Con el estímulo farmacológico se presentó incremento en la contractilidad en todos los segmentos examinados excepto en el tercio proximal de la pared anterior. La prueba fue suspendida por dolor y alteraciones de la contractilidad.
Ante estos hallazgos, el Internista que le valoró decidió su traslado a urgencias, pues en ese momento cursaba con cuadro de dolor torácico aproximadamente de cuarenta minutos de evolución, opresivo, de intensidad 6/10, sin irradiación asociada a disnea de mínimos esfuerzos. Desde su último control (un mes) había presentado deterioro de la clase funcional de I/IV a IV/IV, con mayor intensidad de los síntomas en la última semana, cursando además en esos últimos días con dolor torácico precordial opresivo, desencadenado por estrés y esfuerzo pero no en reposo, sin irradiación, de intensidad 6/10, y duración máxima de veinte minutos. En los paraclínicos solicitados se encontró electrocardiograma normal, troponina I negativa al ingreso y a las seis horas, y radiografía sin alteraciones significativas (Figura 1). Se diagnosticó síndrome coronario agudo sin elevación del segmento ST (angina inestable clasificación de Braunwald IB) y se inició manejo anti-isquémico (enoxaparina 1 mg/kg SC BID, ácido acetilsalicílico, clopidogrel), nitroglicerina y metoprolol, y se observó mejoría de los síntomas. Por los resultados positivos en el ecocardiograma de estrés con dobutamina, se decidió hacer arteriografía coronaria por cateterismo (Figura 2), en la que se halló FE 70%, dilatación de la raíz aórtica 4 cm, tronco de la coronaria izquierda dilatado con aneurisma de 10 mm en su tercio distal con compromiso en el origen de sus ramas, descendente anterior con ectasia en sus tercios proximal y medio, circunfleja con ectasia en su tercio proximal, ramus intermedio con ectasia en sus tercios proximal y medio, coronaria derecha con ectasia en tercios proximal y medio, y flujos lentos en toda la circulación coronaria.
El caso se presentó en junta Médico Quirúrgica de Cardiología y se concluyó que se debía continuar con manejo médico y control estricto de factores de riesgo cardiovasculares y que en ese momento no era candidato para manejo quirúrgico. Se ordenaron cambios de estilo de vida y tratamiento farmacológico con diltiazem 60 mg PO TID, ácido acetilsalicílico 100 mg PO QID y ezetimibe + simvastatina 10/20 mg PO QPM. El paciente continuó asintomático, pero sin adherencia a las recomendaciones indicadas.
En septiembre de 2008 por decisión propia suspendió el tratamiento instaurado, luego de lo cual desarrolló progresivamente ortopnea y angina con patrón estable hasta el 20 de enero de 2009 cuando al controlarlo en consulta externa de Cardiología se evidenció deterioro de los síntomas de aproximadamente cuatro días de evolución, con dolor torácico precordial opresivo, sin irradiación ni disautonomías, intensidad 8/10, constante, duración mínima de veinte minutos y máxima de tres horas, se presentaba a diferentes horas del día, ocurría en reposo, alteraba el sueño o era desencadenado por estrés emocional, por lo que se remitió al servicio de urgencias.
A su ingreso a urgencias se encontró paciente con TA 120/80 FC 80 FR 20 T 37, aceptable estado general, con dolor torácico de las características antes descritas, intensidad 5/10, sin dificultad respiratoria ni alteraciones de la auscultación cardiopulmonar, sin otras anomalías al examen físico.
Se realizó electrocardiograma en el que no se evidenciaron alteraciones que sugirieran isquemia miocárdica aguda (Figura 3) y troponina I negativa al ingreso y a las seis horas; la radiografía de tórax no mostró anomalías (Figura 4). Se diagnosticó nuevamente síndrome coronario agudo pero esta vez teniendo en cuenta la ocurrencia de la sintomatología en reposo, y se reclasificó la angina inestable a tipo IIIB en la clasificación de Braunwald. Se inició manejo anti-isquémico (enoxaparina 1 mg/kg subcutánea cada doce horas, ácido acetilsalicílico, clopidogrel), nitroglicerina, metoprolol, diltiazem y simvastatina, y se hospitalizó en la unidad de cuidado intermedio médico. Con el tratamiento instaurado el paciente mejoró su sintomatología y fue trasladado a pisos de hospitalización.
Aunque el deterioro de los síntomas coincidía con la suspensión del tratamiento, se decidió realizar perfusión miocárdica con dipiradamol-isonitrilos (Figura 5) la cual fue positiva para insuficiencia coronaria, encontrando en las imágenes con estrés farmacológico defecto moderado de la concentración del trazador con compromiso de la región anteroseptal en su tercio apical y otro defecto de localización inferior igualmente apical. Las alteraciones descritas se revertían completamente en reposo y cuantitativamente se representaban con un índice de severidad de 7 (moderado), para una extensión total del defecto reversible de 10% del ventrículo izquierdo. Volumen de fin de diástole 137 mL, volumen de fin de sístole 46 mL y fracción de eyección post-estrés 67%.
Con el resultado positivo de la perfusión miocárdica con isonitrilos-dipiridamol se procedió a efectuar nueva arteriografía coronaria por cateterismo (Figura 6) en la que se observó que el aneurisma había incrementado de tamaño 12 x 14 mm con compromiso del origen (tercio proximal) de la descendente anterior y circunfleja, diagonal alta de gran calibre, ectasia difusa de los vasos principales y flujos lentos.
Se presentó nuevamente el caso en la junta de decisiones Médico-Quirúrgicas de Cardiología con la conclusión de que se requería un procedimiento quirúrgico teniendo en cuenta el crecimiento del tamaño del aneurisma, pero el paciente se negó a cualquier tipo de procedimiento invasivo y solicitó alta voluntaria. Se dio salida con el esquema farmacológico previamente propuesto adicionando clopidogrel 75 mg PO QID. Se insistió en recomendaciones generales, estilos de vida saludables, adherencia al tratamiento y modificación de factores de riesgo prevenibles. Se citó a control ambulatorio por consulta externa con cardiología con angio-TAC de vasos coronarios con reconstrucción 3D para valorar de forma más objetiva el tamaño y las características del aneurisma (Figuras 7 y 8).
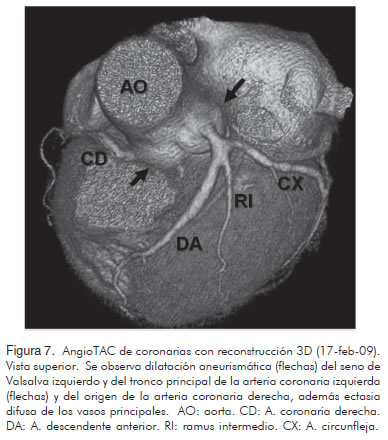
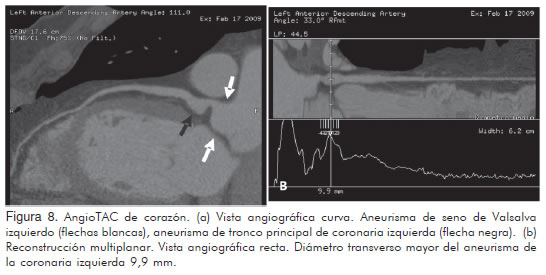
Asistió a control con Cardiología con resultado de angio-TAC de coronarias con reconstrucción tridimensional en el cual se evidenció:
- Dilatación aneurismática del seno de valsalva izquierdo (19,6 x 22,9 mm).
- Dilatación aneurismática del tronco principal de la coronaria izquierda con diámetro transverso de 9,4 mm.
- Dilatación de descendente anterior desde su origen, donde alcanzó un diámetro mayor de 6 mm; en su segmento distal el diámetro es de 1,8 mm.
- Moderada dilatación de circunfleja desde su origen alcanzando un diámetro transverso de 4,4 mm a ese nivel, y distalmente un diámetro de 2,8 mm.
- Ectasia difusa de los vasos principales.
- Pequeña placa excéntrica ateromatosa calcificada en el tercio proximal de la descendente anterior sin producir obstrucciones significativas al flujo sanguíneo.
Una semana después de la angiografía coronaria por TAC-3D el paciente asistió a control por consulta externa de Cardiología, asintomático, tomando en forma adecuada el tratamiento ordenado y sin voluntad de ser sometido a procedimientos invasivos.
Marco teórico
Definición
El aneurisma arterial coronario se define como la dilatación segmentaria que excede en más o igual 1,5 veces (150%) el diámetro de los segmentos inmediatamente adyacentes del vaso, o el diámetro mayor del vaso comprometido. Un aneurisma arterial verdadero puede ser fusiforme cuando compromete la circunferencia total del vaso o sacular, en cuyo caso tan sólo complica una porción de la circunferencia; los primeros son más frecuentes que los segundos. Un falso aneurisma o pseudoaneurisma, se define como la ruptura de la pared de un vaso arterial contenido por la túnica adventicia o por un coágulo (1, 2). A su vez, la ectasia coronaria se conoce como la dilatación difusa de un vaso arterial coronario que compromete como mínimo 50% de la longitud total del mismo (3). En 1761, Morgagni (4) reportó el primer caso de aneurisma coronario; más tarde, en 1958 Munker y colaboradores reportaron el primer caso mediante angiografía coronaria (5).
Epidemiología y topografía
La incidencia de aneurisma arterial coronario varía entre 1,5% y 5%, y es más frecuente en hombres que en mujeres. La incidencia puede variar entre distintas poblaciones; es así como un estudio realizado en India reporta tal vez la más alta incidencia de 10% y 12%, sugiriendo la participación de factores ambientales o genéticos (6). Es más frecuente el compromiso de la coronaria derecha, seguida por la descendente anterior o la circunfleja, y son raros los compromisos del tronco principal de la coronaria izquierda o el de tres vasos (Tabla 1).
Causas
El 50% de los aneurismas arteriales coronarios se produce por arteriosclerosis, siendo ésta la causa más frecuente. En su orden continúan la enfermedad de Kawasaki y los aneurismas congénitos (20%-30%). Otro tipo de causas son los trastornos inflamatorios, las enfermedades del tejido conectivo, las enfermedades infecciosas, los casos relacionados con fármacos o tóxicos, las traumáticas, las metástasis tumorales, las endocrinológicas y las que ocurren luego de angioplastia coronaria. Existe una incidencia de 30% de formación de aneurisma coronario en los consumidores de cocaína. Las causas de aneurisma arterial coronario se citan en la tabla 2.

Histopatología
Todos los aneurismas coronarios tienen destrucción de la túnica media, la cual es delgada, en ocasiones tanto que no se logra visualizar entre las túnicas íntima y adventicia. Las células musculares lisas y las fibras elásticas son reemplazadas por tejido conectivo hialinizado. A veces existe destrucción de la lámina elástica interna, por lo que es difícil establecer el límite entre las capas íntima (aterosclerótica) y media. En la pared aneurismática se observan depósitos lipídicos y de colesterol, células espumosas, detritus eosinofílicos, calcificaciones, neovascularización, reacción inflamatoria y, en algunos casos, hemorragia, que pueden presentarse en la túnica íntima y en la media, o en ambas. La reacción inflamatoria está compuesta por linfocitos, macrófagos, neutrófilos, eosinófilos, células gigantes y células plasmáticas. El compromiso puede estar limitado a una o dos capas del vaso o incluso ser transmural (1).
Fisiopatología
La fisiopatología de la formación del aneurisma coronario es similar a la implicada en la génesis de aquellos que comprometen los grandes vasos, con destrucción de la capa media e incremento del estrés de la pared vascular y dilatación progresiva del diámetro del vaso (20-22). Daoud y colaboradores, en su serie de casos, resaltaba como mecanismo requerido para la formación de un aneurisma en una arteria coronaria, la existencia de un segmento estenótico en el vaso, de forma tal que el flujo sanguíneo, luego de atravesar dicho punto estrecho, genere turbulencia sanguínea y permita la transformación de la energía cinética a energía potencial con incremento de la presión lateral con mayor estrés en la pared; hoy se sabe que no se requiere necesariamente la presencia de una estenosis del vaso para la formación de un aneurisma (23). Varios autores han intentado explicar la fisiopatología de la formación de los aneurismas coronarios, y aunque con detalles distintos, todos basan sus teorías en la causa más frecuente de la producción de éstos: la aterosclerosis. Por ejemplo, Berkoff y Rowe así como Befeler y colaboradores postularon la teoría de que debe existir una capa media alterada y delgada en el vaso, que se encuentre adyacente a una placa aterosclerótica en la íntima; por estrés físico dicha placa es propensa a romperse y constituir el sitio de la formación del aneurisma (24, 25). A su vez, Markis y colaboradores sugirieron que es necesario que exista una pared vascular que tenga una menor resistencia al estrés físico, debido a anomalías en la capa media del vaso (26). Otra teoría es la que se relaciona con el papel del óxido nítrico (NO) en la formación de aneurismas; esta sustancia induce vasodilatación por relajación del músculo liso a través de la vía de la guanilato ciclasa. La sobre-estimulación crónica de la pared del vaso sanguíneo por el NO puede llevar a la formación de aneurismas. Dos ejemplos llamativos para resaltar esta teoría son la mayor incidencia de aneurisma coronario en las personas con empleos relacionados con la producción de municiones, quienes se encuentran expuestas a nitritos, y aquellos con exposición crónica a herbicidas, quienes tienen mayores concentraciones de NO debido a la estimulación de la producción de esta sustancia por niveles incrementados de acetilcolina en su organismo (27, 28). Si bien, en la formación de los aneurismas aórticos se han demostrado mayores concentraciones de metaloproteinasas de matriz (metalloproteinase, MMP) capaces de degradar todos los componentes de la matriz intersticial de la pared arterial, entre ellas: matrix metalloproteinase 1 MMP-1 (colagenasa Intersticial), MMP-2 (gelatinasa A), MMP-3 (stromelesyn 1), MMP-9 (gelatinasa-B), MMP-12 (metaloelastasa de macrófagos) asociado con un déficit de los factores inhibidores de las MMP, en la patogénesis de la formación de los aneurismas coronarios sólo se ha logrado establecer relación con el alelo mutante 5A de la metaloproteinasa 3 (stromelesyn 1), el cual se relaciona con una actividad promotora incrementada que estimula la transcripción del gen y por ende la mayor formación de la metaloproteinasa, con mayor degradación tisular (29). El polimorfismo que afecta al gen de la inositol 1,4,5-trifosfato 3-cinasa C, se relaciona con mayor predisposición a padecer la enfermedad de Kawasaki y la formación de aneurismas coronarios. Esta molécula actúa como un regulador negativo de la activación de los linfocitos T; por lo tanto, en caso de polimorfismo existe una híper-reactividad inmune que se ha relacionado con la formación de los aneurismas (30). En la enfermedad de Kawasaki existen mayores concentraciones de MMP-3 y de MMP-9 (31). Las vasculitis pueden llevar a la formación de aneurismas sin que necesariamente exista arteriosclerosis, premisa que se expone en la enfermedad de Kawasaki y en la poliarteritis nodosa -en la cual 9% de los afectados puede desarrolar aneurismas coronarios-, lupus eritematoso sistémico y arteritis de Takayasu. La arteritis de células gigantes no se ha asociado con la formación de aneurismas coronarios; ésta es una enfermedad que afecta principalmente a personas de edad avanzada y con mayor frecuencia a mujeres de raza blanca. Dichos pacientes en general tienen compromiso arteriosclerótico coronario por sus características etáreas, por lo cual el hecho de que cursen con un aneurisma coronario debido a aterosclerosispuede malinterpretarse como debido a la arteritis en sí (32). Los aneurismas coronarios pueden formarse luego de procedimientos de angioplastia con balón o con la instalación de stents, debido al trauma mecánico que implican. Algunos autores defienden la teoría de que los stents medicados tienen mayor riesgo de formación de aneurismas coronarios en comparación con los no medicados, sobre la base de que se puede producir una vasculitis de hipersensibilidad (la cual se manifiesta desde el punto de vista histopatológico como un infiltrado eosinófilo) debida a los polímeros en los que se encuentran disueltos los fármacos que dichos dispositivos liberan. Vale aclarar que los fármacos que se liberan a partir del stent, como sirolimus o paclitaxel, inhiben la inflamación, y el segundo además por ser quimioterápico inhibe la proliferación celular. Este tipo de aneurismas se presentan generalmente luego de meses o años de instalado el stent, debido a que inicialmente se libera el medicamento y posteriormente los polímeros. Stone y colaboradores, en su estudio multicéntrico, controlado, aleatorizado, demostraron que no existe diferencia estadísticamente significativa entre el desarrollo de aneurisma coronario luego del implante de un stent medicado liberador de paclitaxel vs. el metálico no medicado (1,4% vs. 0,2%; p=0,07) (33). Las enfermedades del tejido conectivo pueden no precisar la participación de la aterosclerosis para la formación de aneurismas coronarios. Varios de estos trastornos se agrupan bajo el nombre de síndromes aneurismáticos causados por mutaciones en el receptor del TGF-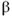 (transforming growth factor
(transforming growth factor 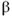 ) produciendo concentraciones incrementadas de TGF-
) produciendo concentraciones incrementadas de TGF-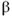 , como ocurre en los síndromes de Marfan, Loeys-Dietz y Ehlers-Danlos (34, 35). El consumo de cocaína produce la formación de aneurismas coronarios, entre otros mecanismos por el incremento de la concentración de TGF-
, como ocurre en los síndromes de Marfan, Loeys-Dietz y Ehlers-Danlos (34, 35). El consumo de cocaína produce la formación de aneurismas coronarios, entre otros mecanismos por el incremento de la concentración de TGF-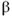 (transforming growth factor
(transforming growth factor 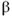 ) (36).
) (36).
Diagnóstico
No existen características clínicas definidas que se asocien con los aneurismas arteriales coronarios, aunque la presentación clínica usual se caracteriza por síntomas anginosos o de evento coronario agudo, teniendo en cuenta que puede haber formación de trombos al interior del aneurisma (70% de aneurismas en autopsia) y embolización distal, así como vasoespamo y/o ruptura de la pared debilitada (48). En ocasiones puede auscultarse un soplo sistólico a nivel mesocárdico, aunque Zoneraich describió un caso de aneurisma coronario asociado a soplo diástolico (49). En algunos casos puede asociarse con hipertensión arterial y aneurismas aórticos abdominales. La presencia de síntomas de isquemia miocárdica en pacientes jóvenes y con antecedentes de enfermedades del tejido conectivo o vasculitis, puede sugerir el diagnóstico (22).
No obstante, el diactamen definitivo del aneurisma arterial coronario se hace mediante imágenes diagnósticas. El estándar de oro con el cual se evidencia la presencia de estas anomalías vasculares es la angiografía coronaria ya que suministra información acerca del tamaño, la forma, la topografía y el número, y además determina la presencia de estenosis asociada. Algunos métodos son menos invasivos, pero tienen menor agudeza para detectar la presencia de aneurismas coronarios, entre ellos la ecocardiografía transtorácica bidimensional y la transesofágica, que se usan en el estudio de este tipo de pacientes, si bien la segunda tiene mayor sensibilidad que la primera. Capanneri y colaboradores en su estudio de setenta pacientes con enfermedad de Kawasaki, demostraron que la sensibilidad de la ecocardiografía transtorácica es cercana a 100% en la detección de aneurismas coronarios de los troncos principales, seleccionando de esta forma los pacientes que irían a arteriografía coronaria (50). Los aneurismas coronarios también pueden observarse en estudios de tomografía computarizada y resonancia magnética torácicos, aunque la angiografía coronaria con reconstrucción 3D por escanografía ha revolucionado el estudio de esta patología (51). Así mismo se usa el ultrasonido intravascular, con lo cual se logra una mejor caracterización del aneurisma y mayor diferenciación entre aneurismas verdaderos y falsos (52).
Complicaciones
Las que comúnmente se asocian con los aneurismas arteriales coronarios son la trombosis y la embolización distal, las cuales se relacionan con la producción de los síntomas de isquemia miocárdica. Dadoud y colaboradores encontraron en su serie post mortem de casos, una incidencia de esta complicación de 70%. Otra de las complicaciones es la ruptura del aneurisma, aunque en los primeros estudios se reportaban incidencias de ruptura cercanas a 12% de los casos (19). En series más recientes y con mayor número de casos se ha demostrado que la incidencia de esta complicación es muy baja; por ejemplo Swaye y colaboradores no encontraron ningún caso entre 978 pacientes (53). Por último, el vasoespasmo es otra complicación asociada con los aneurismas coronarios, aunque la túnica media del vaso sanguíneo comprometido está alterada y por tanto, en teoría, es difícil que ocurra una contracción fuerte y sostenida necesaria para producir vasoespasmo; no obstante, en reportes de casos se han descrito pacientes que han tenido vasoespasmo coronario a nivel del aneurisma o en sitios adyacentes al mismo, de ocurrencia espontánea en unos, y por estímulo mecánico luego de angioplastia o inserción de stents en otros. Se cree que el estímulo requerido para producir vasoespasmo es más mecánico que neurohumoral (54-57).
Tratamiento
Los aspectos patogénicos que se resaltaron en el apartado anterior, tienen implicaciones terapéuticas. Así, el TGF-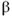 puede inhibirse por los bloqueadores de los receptores tipo 1 de angiotensina II, como losartán, el cual puede prevenir la formación de aneurismas aórticos en ratones modelo con síndrome de Marfan (37). La secreción de las MMP-1, 2, 3 y 9 a partir de los macrófagos y las células del músculo liso vascular, puede inhibirse con el uso de estatinas (inhibidores de la hidroximetilglutaril coenzima A reductasa) como simvastatina, lovastatina y cerivastatina, las cuales pueden inhibir la destrucción de la túnica media (38). Dada la alta frecuencia de trombosis en los aneurismas arteriales coronarios, puede requerirse tratamiento antiplaquetario (aspirina o clopidogrel) o anticoagulante (warfarina) para evitarlo (39, 40). Otra estrategia es el uso de medicamentos vasodilatadores como calcioantagonistas o nitratos, en los raros casos que cursen con vasoespasmo. La implantación de stents y la embolización del aneurisma han sido algunas de las estrategias no quirúrgicas en el tratamiento de esta patología (41, 42). Se han obtenido mejores resultados con los stents que tienen membrana de politetrafluoroetileno también conocidos como stent-grafts, ya que ocluyen la boca de apertura del aneurisma y disminuyen la probabilidad de embolia distal. Independiente del tipo de stent utilizado, el tiempo mínimo de terapia antiplaquetaria que debe administrarse luego de su implantación son seis meses (43). Se recomienda tratamiento quirúrgico en aquellos casos que representan riesgo de trombosis o ruptura, especialmente los aneurismas saculares (44-46). Algunos cirujanos consideran que el tratamiento quirúrgico de los aneurismas coronarios, debe realizarse cuando el diámetro de éstos es superior a tres veces el diámetro normal mayor del vaso. Éste consiste en la realización de bypass coronario con ligadura o resección del aneurisma; se han obtenido los mejores resultados cuando el aneurisma no queda incluido en la anastomosis (47). Debido a la baja incidencia de esta patología, no existen estudios adecuados con los cuales se logre concluir el mejor tratamiento para la misma. Las recomendaciones existentes en la literatura se basan en experiencias personales derivadas de estudios de un solo paciente o en el mejor de los casos con muy pocos individuos.
puede inhibirse por los bloqueadores de los receptores tipo 1 de angiotensina II, como losartán, el cual puede prevenir la formación de aneurismas aórticos en ratones modelo con síndrome de Marfan (37). La secreción de las MMP-1, 2, 3 y 9 a partir de los macrófagos y las células del músculo liso vascular, puede inhibirse con el uso de estatinas (inhibidores de la hidroximetilglutaril coenzima A reductasa) como simvastatina, lovastatina y cerivastatina, las cuales pueden inhibir la destrucción de la túnica media (38). Dada la alta frecuencia de trombosis en los aneurismas arteriales coronarios, puede requerirse tratamiento antiplaquetario (aspirina o clopidogrel) o anticoagulante (warfarina) para evitarlo (39, 40). Otra estrategia es el uso de medicamentos vasodilatadores como calcioantagonistas o nitratos, en los raros casos que cursen con vasoespasmo. La implantación de stents y la embolización del aneurisma han sido algunas de las estrategias no quirúrgicas en el tratamiento de esta patología (41, 42). Se han obtenido mejores resultados con los stents que tienen membrana de politetrafluoroetileno también conocidos como stent-grafts, ya que ocluyen la boca de apertura del aneurisma y disminuyen la probabilidad de embolia distal. Independiente del tipo de stent utilizado, el tiempo mínimo de terapia antiplaquetaria que debe administrarse luego de su implantación son seis meses (43). Se recomienda tratamiento quirúrgico en aquellos casos que representan riesgo de trombosis o ruptura, especialmente los aneurismas saculares (44-46). Algunos cirujanos consideran que el tratamiento quirúrgico de los aneurismas coronarios, debe realizarse cuando el diámetro de éstos es superior a tres veces el diámetro normal mayor del vaso. Éste consiste en la realización de bypass coronario con ligadura o resección del aneurisma; se han obtenido los mejores resultados cuando el aneurisma no queda incluido en la anastomosis (47). Debido a la baja incidencia de esta patología, no existen estudios adecuados con los cuales se logre concluir el mejor tratamiento para la misma. Las recomendaciones existentes en la literatura se basan en experiencias personales derivadas de estudios de un solo paciente o en el mejor de los casos con muy pocos individuos.
Bibliografía
1. Nichols L, Lagana S, Parwani A. Coronary artery aneurysm a review and hypothesis regarding etiology. Arch Pathol Lab Med 2008; 132: 823-828. [ Links ]
2. Syed M, Lesch M. Coronary artery aneurysm: a review. Progress in Cardiovascular Diseases 1997; 40: 77-84. [ Links ]
3. Markis JE, Joffe CD, Cohn PF. Clinical significance of coronary arterial ectasia. Am J Cardiol 1976; 37: 217-222. [ Links ]
4. Morgagni JB. De sedibus et causis morborum. Venectus Tom I, Epis 27, Art 28, 1761. [ Links ]
5. Munker TM, Peterson O, Vesterdal J. Congenital aneurysm of the coronary artery with an arteriovenous fistula. Acta Radiol 1958; 50: 333-336. [ Links ]
6. Sharma SN, Kaul U, Sharma S, et al. Coronary arteriographic profile in young and old Indian patients with ischemic heart disease: a comparation study. Indian Heart J 1990; 42: 365-369. [ Links ]
7. Swaye PS, Fisher LD, Litwin P, et al. Aneurysmal coronary artery disease. Circulation 1983; 67: 134-138. [ Links ]
8. Robertson T, Fisher L. Prognostic significance of coronary artery aneurysm and ectasia in the coronary artery surgery study (CASS) registry, in Shulman ST (ed): Kawasaki disease: proceedings of the Second International Kawasaki Symposium. New York, NY,A.R. Liss; 1987. p. 325-339.
9. Tunick PA, Slater J, Kronzon I, et al. Discrete atherosclerotic coronary artery aneurysms: a study of 20 patients. J Am Coll Cardiol 1990; 15: 279-282. [ Links ]
10. Hartnell GG, Parnell BM, Pride RB. Coronary artery ectasia. Its prevalence and clinical significance in 4993 patients. Br Heart J 1985; 54: 392-395. [ Links ]
11. Markis JE, Joffe CD, Cohn PF. Clinical significance of coronary arterial ectasia. Am J Cardiol 1976; 37: 217-222. [ Links ]
12. Aintablian A, Hamby RI, Hoffman I, et al. Coronary ectasia: incidence and results of coronary bypass surgery. Am Heart J 1978; 96: 309-315. [ Links ]
13. Oliveros RA, Falsetti HL, Carroll R J, et al. Atherosclerotic coronary artery aneurysm. Arch intern Med 1974; 134: 1072-1076. [ Links ]
14. Berkoff HA, Rowe GG. Atherosclerotic ulcerative disease and associated aneurysms of the coronary arteries. Am Heart J 1975; 90: 153-158. [ Links ]
15. Befeler B, Aranda JM, Embi A, et al. Coronary artery aneurysms: study of their etiology, clinical course and effect on left ventricular function and prognosis. Am J Med 1977; 62: 597-607. [ Links ]
16. Rath S, Har-Zahav Y, Battler AE, et al. Fate of non-obstructive aneurysmatic coronary artery disease: Angiographic and clinical follow-up report. Am Heart J 1985; 109: 785-791. [ Links ]
17. Swanton HR, Thomas ML, Coltart D J, et al. Coronary artery ectasia, a variant of occlusive coronary arteriosclerosis. British Heart J 1978; 40: 393-400. [ Links ]
18. Falsetti HL, Carroll RJ. Coronary artery aneurysm. A review of the literature with a report of 11 new cases. Chest 1976; 69: 630-636. [ Links ]
19. Daoud A, Pankin D, Tulgan H, Florentin R. Aneurysms of the coronary artery. Report of ten cases and review of literature. Am J Cardio 1963; 111: 228-237. [ Links ]
20. Cohen P, O'Gara P. Coronary artery aneurysms: a review of the natural history, pathophysiology, and management. Cardiol Rev 2008; 16: 301-304. [ Links ]
21. Syed M, Lesch M. Coronary artery aneurysm: a review. Prog Cardiovasc Dis 1997; 40 (1): 77-84. [ Links ]
22. Aneta I, Gziut, Robert J, et al. Coronary aneurysms. Polskie Archiwum Medycyny Wewnetrznej 2008; 118 (12): 741-745. [ Links ]
23. Daoud A, Pankin D, Tulgan H, et al. Aneurysms of the coronary artery. Report of ten cases and review of literature. Am J Cardio 1963; 111: 228-237. [ Links ]
24. Berkoff HA, Rowe GG. Atherosclerotic ulcerative disease and associated aneurysms of the coronary arteries. Am Heart J 1975; 90: 153-158. [ Links ]
25. Befeler B, Aranda JM, Embi A, et al. Coronary artery aneurysms: study of their etiology, clinical course and effect on left ventricular function and prognosis. Am J Med 1977; 62: 597-607. [ Links ]
26. Markis JE, Joffe CD, Cohn PF. Clinical significance of coronary arterial ectasia. Am J Cardiol 1976; 37: 217-222. [ Links ]
27. England JF. Herbicides and coronary artery ectasia. Med J Aust 1981; II: 140. [ Links ]
28. Lange RL, Reid MS, Tresch DD, et al. Nonatheromatous ischemic heart disease following withdrawal from chronic industrial nitroglycerine exposure. Circulation 1972; 46: 666-678. [ Links ]
29. Lamblin N, Bauters C, Hermant X, et al. Polymorphisms in the promoter regions of MMP-2, MMP-3, MMP-9, and MMP-12 genes as determinants of aneurismal coronary artery disease. J Am Coll Cardiol 2002; 40: 43-48. [ Links ]
30. Onouchi Y, Gunji T, Burns JC, et al. ITPKC functional polymorphism associated with Kawasaki disease susceptibility and formation of coronary artery aneurysms. Nat Genet 2008; 40: 35-42. [ Links ]
31. Senzaki H, Masutani S, Kobayashi J, et al. Circulating matrix metalloproteinases and their inhibitors in patients with Kawasaki disease. Circulation 2001; 104: 860-863. [ Links ]
32. Senzaki H, Masutani S, Kobayashi J, et al. Circulating matrix metalloproteinases and their inhibitors in patients with Kawasaki disease. Circulation 2001; 104: 860-863. [ Links ]
33. Stone GW, Ellis SG, Cannon L, et al. Comparison of a polymer-based paclitaxel-eluting stent with a bare metal stent in patients with complex coronary artery disease: a randomized controlled trial. JAMA 2005; 294: 1215-1223. [ Links ]
34. Gelb BD. Marfan's syndrome and related disorders: more tightly connected than we thought. N Engl J Med 2006; 355: 841-844. [ Links ]
35. Loeys BL, Schwarze U, Holm T, et al. Aneurysm syndromes caused by mutations in the TGF-beta receptor. N Engl J Med 2006; 355: 788-798. [ Links ]
36. Peterson PK, Gekker G, Chao CC, et al. Cocaine potentiates HIV-1 replication in human peripheral blood mononuclear cell cocultures: involvement of transforming growth factor-beta. J Immunol 1991; 146: 81-84. [ Links ]
37. Habashi JP, Judge DP, Holm TM, et al. Losartan, an AT1 antagonist, prevents aortic aneurysm in a mouse model of Marfan syndrome. Science 2006; 312: 117-121. [ Links ]
38. Luan Z, Chase AJ, Newby AC. Statins inhibit secretion of metalloproteinases 1, 2, 3, and 9 from vascular smooth muscle cells and macrophages. Arterioscler Thromb Vasc Biol 2003; 23: 769-775. [ Links ]
39. Khan IA, Dogan OM, Vasavada BC, et al. Nonatherosclerotic aneurysm of the left circumflex coronary artery presenting with accelerated angina pectoris: response to medical management: a case report. Angiology 2000; 51: 595-598. [ Links ]
40. Lima B, Varma SK, Lowe JE. Nonsurgical management of left main coronary artery aneurysms. Tex Heart Inst J 2006; 33: 376-379. [ Links ]
41. Schussler JM, Jones WH, Vallabhan RC. Management of a single coronary artery aneurysm by use of a stent. Proc (Bayl Univ Med Cent) 2002; 15: 255-256. [ Links ]
42. Kereiakes DJ, Long DE, Ivey TD. Coil embolization of a circumflex coronary aneurysm at the time of percutaneous coronary stenting. Cathet Cardiovasc Intervent 2006; 67: 607-610. [ Links ]
43. Antonellis I, Patsilianakos S, Pamboukas C. Sealing of coronary artery aneurysm by using a new stent graft. Catheter Cardiovasc Interv 1999; 48: 96-99. [ Links ]
44. Anabtawi IN, de Leon JA. Coronary ectasia: incidence and results of coronary bypass surgery. Am Heart J 1978; 96: 309-315. [ Links ]
45. Ebert PA, Peter RH, Gunnels JC. Resecting and grafting of coronary artery aneurysm. Circulation 1971; 43: 593-598. [ Links ]
46. Alford WJ, Stoney WS, Burrus GT, et al. Recognition and operative management of patients with arteriosclerotic coronary artery aneurysms. Ann Thorac Surg 1976; 22: 317-321. [ Links ]
47. Mariscalco G, Mantovani V, Ferrarese S, et al. Coronary artery aneurysm: management and association with abdominal aortic aneurysm. Cardiovasc Pathol 2006; 15: 100-104. [ Links ]
48. Daoud A, Pankin D, Tuigan H, et al. Aneurysms of the coronary artery. Report of ten cases and review of literature. Am J Cardiol 1983; 11: 228-237. [ Links ]
49. Zoneraich S, Zoneraich O. Giant coronary artery aneurysm. The case of mid-diastolic murmur and bulging of the left cardiac border. JAMA 1975; 231: 179. [ Links ]
50. Cappanari TE, Daniels SR, Meyer RA, et al. Sensitivity, specificity and predictive value of two-dimensional echocardiography in detecting coronary artery aneurysms in patients with Kawasaki disease. J Am Coll Cardiol 1986; 7: 355-360. [ Links ]
51. Pucillo AL, Schechter AG, Moggio RA, et al. MR imaging in the definition of coronary artery anomalies. J Comput Assist Tomogr 1990; 14: 171-174. [ Links ]
52. Jumbo Ge, Liu F, Kearney P, et al. Intravascular ultrasound approach to the diagnosis of coronary artery aneurysms. Am Heart J 1995; 130: 765-761. [ Links ]
53. Swaye PS, Fisher LD, Litwin P, et al. Aneurysmal coronary artery disease. Circulation 1983; 67: 134-138. [ Links ]
54. Maseri A, Pesola A, Marzilli M, et al. Coronary vasospasm in angina pectoris. Lancet 1977; 1: 713-717. [ Links ]
55. Freedman SB, Richmond DR, Kelly DT. Clinical studies of patients with coronary spasm. Am J Cardiol 1983; 52: 67A-71A. [ Links ]
56. Bove AA, Vlietstra RE. Spasm in ectatic coronary arteries. Mayo Clin Proc 1985; 60: 822-826. [ Links ]
57. Gutowski T, Tannenbaum AK, Moreyra AE. Vasospasm in a coronary artery aneurysm. Cathet Cardiovas Diagn 1991; 22: 127-129. [ Links ]














