Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.17 no.4 Bogota July/Aug. 2010
(1) Laboratorio de Fisiología Celular e Inmunología. Facultad Ciencias de la Salud. Universidad Tecnológica de Pereira. Pereira, Risaralda, Colombia.
Correspondencia: Dr. Julio César Sánchez Naranjo. AA 097. Departamento de Ciencias Básicas, Facultad Ciencias de la Salud. Universidad Tecnológica de Pereira. La Julita, Pereira, Risaralda, Colombia. Teléfono: (096) 313 71 27, Fax: (096) 313 71 25. Correo electrónico: jcsanchez@utp.edu.co
Recibido: 31/07/2009. Aceptado: 08/06/2010.
Debido a la alta morbimortalidad de las enfermedades cardiovasculares y a su relación con trastornos de base como la obesidad y el síndrome metabólico, es crucial entender cuáles son los mecanismos y procesos que desencadenan la alteración del metabolismo y a su vez la generación de dichas enfermedades. En tal sentido, el tejido adiposo y el adipocito tienen un papel fundamental en este proceso, mediante la producción de múltiples adipocinas, algunas clásicas y otras de reciente descripción, pero que hasta ahora empieza a dilucidarse en medio del complejo panorama de interacciones fisiopatológicas conducentes al desarrollo de resistencia a la insulina y del complejo desequilibrio metabólico que conlleva un sinnúmero de complicaciones clínicas. Un grupo de estas adipocinas tiene claros efectos proinflamatorios, mientras que otras pueden clasificarse como anti-inflamatorias, las cuales contrarrestan en cierta medida y hasta cierto punto las acciones de las otras. Cuando esta homeostasis se rompe, la cascada de inflamación crónica allí originada desencadena resistencia a la insulina y se inicia el desarrollo del síndrome metabólico a partir de la obesidad, que a su vez genera alteraciones de la respuesta del adipocito a diferentes estímulos. Esto, sumado a los efectos de otros elementos, configura un complejo cuadro de factores que es necesario tener en cuenta para el abordaje correcto de la obesidad y sus patologías asociadas.
PALABRAS CLAVE: adipocinas, adipocito, síndrome metabólico, obesidad, inflamación.
Due to the high morbidity and mortality of cardiovascular diseases and their relationship with basic disorders such as obesity and metabolic syndrome, the understanding of the mechanisms and processes that trigger metabolic alterations and generate such diseases, is a crucial matter. In this regard, adipose tissue and adipocytes have a crucial role in this process through the production of multiple adipokines, some of them classical and others recently described; however, until now their role is beginning to be elucidated in the middle of the complex picture of pathophysiological interactions leading to insulin resistance and the metabolic imbalance that leads to a large number of clinic complications. A group of these adipokines has clear pro-inflammatory effects, while others can be classified as anti-inflammatory, which counteract in some extent the effects of the others. When this homeostasis is broken, the originated cascade of chronic inflammation triggers insulin resistance and the metabolic syndrome is developed from obesity, which in turn generates changes in adipocyte response to different stimuli. This, together with the effects of other elements, forms a complex picture of factors that need to be considered for the correct management of obesity and its comorbidities.
KEY WORDS: adipokines, adipocyte, metabolic syndrome, obesity, inflammation.
Introducción
La obesidad y el síndrome metabólico son protagonistas de una epidemia mundial que cobra gran cantidad de vidas a causa de sus complicaciones y de enfermedades asociadas tales como las patologías cardiovasculares, las mayores causas de mortalidad en todos los países del mundo (1). Su creciente prevalencia y la morbilidad asociada generan un elevado impacto en los sistemas de salud y en la calidad de vida de las personas que las padecen (2).
Lamentablemente, la fisiopatología de estas enfermedades no se ha comprendido con claridad puesto que los procesos biológicos implicados son muy complejos e involucran gran cantidad de mensajeros químicos y receptores, así como una complicada interacción entre diferentes tipos celulares. Sin embargo, el indiscutible protagonista en este proceso fisiopatológico es el tejido adiposo (3) y en particular el adipocito (4), célula extremadamente activa, cuyo rol fisiológico es importantísimo no sólo en la regulación metabólica general, sino en el crecimiento celular, la respuesta inmunológica, la termogénesis y las funciones reproductiva y cardiovascular (3, 5). Las alteraciones en esta célula inducidas por la sobrealimentación y el sedentarismo y agravadas por todos los factores relacionados desde el punto de vista epidemiológico con el incremento del riesgo metabólico y cardiovascular, son el punto de partida para una cascada de eventos que llevan al desequilibrio metabólico, causante primario de todas las complicaciones que ocasionan la elevada morbilidad y mortalidad derivadas del síndrome metabólico (6). Múltiples estudios demuestran que el adipocito produce gran cantidad de mensajeros químicos con acciones locales y sistémicas denominados genéricamente adipocinas, que involucran diversidad de receptores y de cascadas intracelulares de señalización que actúan en una gran variedad de células, incluyendo al adipocito, a través de señales autocrinas bien definidas, y en muchas células vecinas habitantes del mismo tejido adiposo, estableciendo comunicaciones paracrinas muy complejas (7), panorama que difiere mucho del concepto que se tenía del tejido adiposo hasta hace apenas una década.
Biología del adipocito
El adipocito maduro se caracteriza por poseer una gran vacuola grasa que ocupa 90% de su volumen y que lo hace morfológicamente único y plenamente distinguible de cualquier otra célula; tiene forma esférica y su diámetro puede ser muy variable. Esta célula deriva de una célula madre mesenquimal que es compartida por osteoblastos y fibroblastos y cuya diferenciación es determinada por múltiples factores (8). La primera célula del linaje identificada es el preadipocito, célula pequeña que se encuentra en grandes cantidades en el tejido adiposo y a partir de la que se desarrollan las células grasas nuevas según el estímulo al cual esté sometido el organismo; pueden madurar hacia adipocitos blancos o pardos, aunque la población de estos últimos es extremadamente escasa en el adulto (5). Sin embargo, aún no son claros los factores exactos que determinan esta maduración, así como tampoco se comprenden a cabalidad los mecanismos regulatorios de la producción de adipocinas y las interacciones entre éstas. El número de adipocinas descubiertas ha ido creciendo y la lista se ha engrosado también a causa de que el adipocito puede, además, producir muchas de las llamadas citocinas (adipocitocinas), generadas por diferentes tipos celulares, cuya función fundamental es mediar reacciones inflamatorias e inmunológicas en el organismo.
Adipocinas "clásicas"
La leptina, hormona de 16 kDa, producto del gen ob, es tal vez la adipocina más estudiada hasta el momento; fue descrita inicialmente como la hormona de la obesidad porque sus niveles se correlacionan estrechamente con la cantidad de grasa corporal del individuo (9) y con la circunferencia abdominal (10); sin embargo, con el paso del tiempo, la investigación en torno a esta hormona ha definido su participación en gran diversidad de procesos, desde la regulación de la inmunidad hasta la modulación del eje hormonal reproductivo (11). El receptor de la leptina es producto del gen db y existen al menos seis isoformas nombradas LRa-f, producto de múltiples combinaciones de diferentes segmentos del gen, siendo el LRb el único que se asocia con respuestas intracelulares. LRb activa preferentemente JAK2 (Janus kinase 2), la cual induce autofosforilación del complejo LRb-JAK2 iniciando una cascada de fosforilación que involucra diferentes sistemas enzimáticos (12). Como todas las tirosina kinasas, JAK2 fosforila proteínas que contienen dominios SH2, en este caso las proteínas ERK (extracellular-signal regulated kinase), las proteínas STAT3 (signal transducers and activators of transcription 3) y las proteínas IRS (insulin receptor substrate), grupo de moléculas que también es regulado por la insulina. Esta confluencia de las señales susceptibles de ser activadas por leptina y por insulina, plantea un interesante caso de señalización cruzada (cross-talk), que puede tener implicaciones metabólicas importantes en el contexto de la obesidad, en la que hay una hiperleptinemia por el incremento de tejido adiposo, asociada con una resistencia a la leptina, lo cual la inhabilita para ejercer su efecto inhibidor del apetito a nivel hipotalámico. LRb parece ser expresado en todos los tejidos (13), lo cual es evidencia de la importancia de la leptina como hormona reguladora de diversos procesos fisiológicos, muchos de ellos aún no comprendidos en su totalidad.
La leptina regula la liberación de la mayor parte de las adipocinas (14); inhibe la producción de adiponectina, otro de los mensajeros que más atención ha recibido en la última década por su aparente papel protector contra los efectos nocivos de la obesidad, y estimula la producción de resistina, la cual induce resistencia a la insulina y a la misma leptina.
La adiponectina es una proteína de 30 kDa, con homología estructural con el colágeno VIII y IX y el factor del complemento C1q (15), sintetizada principalmente por el adipocito (16) y con acciones metabólicas muy notorias en los tejidos, que consisten en incremento de la oxidación de ácidos grasos y reducción de la gluconeogénesis (17). Sus acciones se realizan a través de dos receptores denominados adipoR1 y adipoR2, el primero de expresión general y el segundo primordialmente de expresión hepática (18). Sus efectos están mediados por el incremento de la actividad de la PKA (proteína kinasa dependiente de AMP cíclico) (17). La activación de la PKA induce la expresión de PPARg (peroxisome proliferator-activated receptor g) (19), así como de las enzimas de la cascada de la oxidación de ácidos grasos y de otras proteínas involucradas en la captación de glucosa, lo cual explica el incremento de la actividad de insulina inducido por esta hormona (20). Por el mismo mecanismo se produce inhibición de las enzimas de la vía de la gluconeogénesis (21). Sus niveles en plasma son inversamente proporcionales a la masa de tejido adiposo y están reducidos en los pacientes con síndrome metabólico que presentan resistencia a la insulina y a la diabetes mellitus 2 franca (22); más aún, sus niveles aumentan con el ejercicio, la pérdida de peso y la terapia con tiazolidinedionas (23). Su secreción es reducida por efectos de insulina, leptina y citocinas proinflamatorias, lo cual podría explicar su relación con la obesidad en la cual hay hiperinsulinemia, hiperleptinemia y un estado de inflamación crónica inducida por el incremento de la masa de tejido adiposo (21). A su vez, la adiponectina modula la producción de citocinas por parte del tejido adiposo y otras células (24).
La expresión de los receptores para adiponectina también está reducida en la obesidad. La hipoadiponectinemia también es un factor de riesgo para el desarrollo de enfermedades asociadas con el síndrome metabólico, tales como hipertensión, enfermedad coronaria y otras complicaciones micro y macrovasculares (25). Diversos estudios demuestran que la adiponectina frena el proceso inflamatorio desencadenado en la aterosclerosis, disminuyendo la migración y proliferación de células inmunes y la secreción de citocinas, así como la adhesión plaquetaria y la formación de placas ateroscleróticas (26).
Los complejos efectos de la adiponectina se oponen a los de la resistina, péptido dimérico de 12.5 kDa, rico en residuos de cisteína (27) y producido en ratones principalmente en el tejido adiposo, pero también en otras células como macrófagos y monocitos, siendo estos últimos su principal fuente en humanos (28). Su receptor aún no ha sido identificado con claridad. En adipocitos y miocitos esqueléticos murinos inhibe la fosforilación del receptor de insulina e IRS-1, además de inhibir la activación de IP3K (inositol triphosphate kinase) y PKB (proteinkinase B), mecanismos que explican la disminución de la respuesta a la insulina, por lo cual se ha asociado con el desarrollo de resistencia a esta hormona en modelos murinos aunque la evidencia bien establecida en éstos no ha sido plenamente confirmada en humanos (29). Sin embargo, sus niveles se elevan en forma proporcional a la masa de tejido adiposo (30) y al desarrollo de resistencia a la insulina y diabetes (27), así como se ha implicado en la patogénesis de la aterosclerosis (31). Esta hormona tiene además claros efectos proinflamatorios (32) y a su vez, su producción se incrementa en estados inflamatorios crónicos (33). No obstante, los estudios en humanos son controversiales y algunos de ellos, contradictorios (34).
El TNFa (en inglés tumor necrosis factor a), es una citocina proinflamatoria liberada principalmente por macrófagos y linfocitos y, aunque puede también ser liberada por el adipocito, estudios recientes demuestran que los macrófagos son los que producen la mayor parte del TNFa liberado en el tejido adiposo (34, 35). El TNFa cumple sus funciones a través de dos receptores, ambos pertenecientes a la familia de receptores tipo citocina (36). El TNFa está aumentado en la obesidad y se asocia con la resistencia a la insulina que se observa en ésta (37); por otra parte, sus niveles disminuyen con la pérdida de peso (38). Uno de los mecanismos por los que produce sus efectos es la fosforilación inhibitoria de IRS-1, por lo cual se impide la producción y la traslocación del transportador GLUT-4 (39). El TNFa impide también la diferenciación de los adipocitos y bloquea la absorción y el almacenamiento de ácidos grasos al disminuir la expresión y la actividad de la lipoproteínlipasa (LPL) (40). Asimismo, aumenta la producción de leptina, disminuye la producción de adiponectina en adipocitos (41) y aumenta la producción de resistina en leucocitos de sangre periférica (42). A su vez, la adiponectina disminuye la producción de TNFa en adipocitos y macrófagos al inhibir el factor de transcripción NF-kB (del inglés nuclear factor kB) a través del PPARg, lo cual podría hacer parte de sus efectos protectores contra el desarrollo del síndrome metabólico (24). De igual forma, el TNFa promueve la infiltración de células inflamatorias en el tejido adiposo y es un factor de riesgo para aterosclerosis al aumentar la expresión de factores promotores del depósito de placa (34).
Adipocinas "nuevas"
Recientemente se han descrito otras adipocinas cuya caracterización todavía es incompleta; entre éstas figuran la visfatina, la apelina, la vaspina y la omentina, entre otras.
La visfatina se propone como un marcador temprano de disfunción de los adipocitos, en la medida que aumenta en forma aguda con el deterioro metabólico, el aumento de peso y el incremento de la circunferencia abdominal (43). Tiene efectos hipoglicemiantes independientemente de los cambios de niveles de insulina y en general un efecto mimético de la acción de esta hormona, ejercidos a través del mismo receptor, pero uniéndose a éste en un sitio diferente al de la insulina (44). La visfatina también ejerce efectos vasodilatadores dependientes del endotelio y mediados por la vía del óxido nítrico (ON), pero independiente del receptor de insulina (45). Los niveles de visfatina están elevados en hipercolesterolemia total y LDL y son directamente proporcionales a los niveles de TNFa y resistina, pero están disminuidos en pacientes obesos e hiperleptinémicos (46), así como en el embarazo y la diabetes gestacional (47). Adicionalmente induce adhesión leucocitaria y posee un efecto angiogénico y proinflamatorio directo y por tanto un papel en la disfunción endotelial (48).
La apelina es otra de las adipocinas recientemente descritas, cuyo receptor parece pertenecer a la familia de aquellos acoplados a proteínas G (49); se produce principalmente en miocitos cardiacos, en los cuales se comporta como un agente antiapoptótico y protector contra la lesión que ocurre por isquemia/reperfusión en corazón de ratas, resistiendo la oxidación a través de la regulación positiva de la sintasa de óxido nítrico endotelial (49). Sin embargo, también se ha encontrado ARNm de apelina distribuido en otros tejidos, incluyendo el adiposo. El ayuno induce incrementos considerables de su ARNm en hipotálamo y telencéfalo, lo cual hace pensar en su papel como osmorregulador y regulador del apetito y de la homeostasis energética (50).
Se ha demostrado que la expresión del ARNm de la vaspina puede inducirse por fenómenos como la obesidad, la resistencia a la insulina y la intolerancia a la glucosa (51). En pacientes con estenosis carotídea se encontró correlación de bajos niveles de esta adipocina con la presentación reciente de eventos isquémicos, pero no parece desempeñar un papel en el proceso aterosclerótico ya que no se encontró expresión de esta proteína en las placas removidas (52). Existe diferencia de género en cuanto a los niveles séricos de vaspina (2,5 veces más elevados en mujeres que en hombres) en sujetos con tolerancia normal a la glucosa, pero ésta se pierde en pacientes con diabetes mellitus tipo 2. Los sujetos con peso normal tienen niveles más bajos de vaspina que aquellos con sobrepeso u obesos. Sin embargo, en individuos con tolerancia normal a la glucosa, intolerancia a la glucosa y diabetes mellitus tipo 2 la vaspina se incrementa después de ejercicio físico sostenido, lo cual no deja de ser paradójico (53).
La omentina se expresa principalmente en tejido adiposo visceral (54) y se han encontrado niveles más elevados en sujetos delgados en comparación con sujetos con sobrepeso u obesos independiente de la edad y el género; por otro lado, existe correlación negativa entre los niveles plasmáticos de omentina y la medición de la resistencia a la insulina (índice HOMA), índice de masa corporal, circunferencia abdominal y niveles de leptina e insulina. Los niveles plasmáticos de adiponectina y los de colesterol HDL, se correlacionan de manera positiva con los de omentina (55). Esta última mejora los efectos de la insulina sobre el metabolismo de la glucosa, aunque sin poseer efectos intrínsecos miméticos de la insulina, a diferencia de la visfatina (54).
Entre las adipocinas de más reciente descripción se destacan: la quemerina, la cual disminuye significativamente el transporte de glucosa estimulado por insulina en adipocitos y asimismo se modula mutuamente con IL-1ß (56, 57); la adrenomedulina, aumentada en la obesidad (58) e inhibida por TNFa, lo cual podría estar relacionada con la disfunción endotelial encontrada en sujetos obesos con hipertensión (59) y tiene un papel proangiogénico in vitro en células endoteliales humanas (60), y la adipsina, cuya producción es estimulada por insulina y está aumentada en obesidad (61, 62).
Adipocitocinas y mensajeros relacionados
El adipocito produce varias citocinas que intervienen en el proceso inflamatorio local y sistémico desencadenado por la obesidad y que guardan relación directa con el desarrollo del síndrome metabólico. Todas ellas se caracterizan por poseer receptores que se asocian con la activación del sistema de señalización JAK-STAT análogo al descrito para leptina (63).
La interleucina 6 (IL-6) es una citocina proinflamatoria liberada por diversos tejidos, entre ellos el tejido adiposo, principalmente el visceral, siendo este último responsable de la liberación de 15% a 30% de toda la IL-6 del organismo, lo cual podría ser otra de las razones por las cuales la obesidad abdominal es un factor de riesgo para síndrome metabólico. Se considera un factor de riesgo cardiovascular y sus niveles también se han encontrado elevados junto con IL-8 y TNFa en individuos resistentes a la insulina, sean o no obesos (64). Induce hipertrigliceridemia en la obesidad al aumentar las VLDL y está implicada en la inducción de resistencia hepática a la insulina (65, 66). Asimismo produce caquexia y disminuye la actividad de la LPL, inhibiendo de esta forma la adipogénesis (67). Paradójicamente, aumenta la producción de resistina (42), efecto que es inhibido por la rosiglitazona (68). Algunos autores reportan efectos contrarios a los descritos, que probablemente están mediados por mecanismos aún no comprendidos (41). El TNFa y las catecolaminas inducen la producción de IL-6, mientras que los glucocorticoides y la adiponectina inhiben su producción (24, 67).
La interleucina 1 (IL-1) es una citocina proinflamatoria cuya producción en adipocitos es estimulada por el TNFa y lipopolisacárido (LPS) (69). Posee efectos lipolíticos que pueden ser bloqueados al impedir la acción de la ciclooxigenasa (COX), lo cual indica que éstos son mediados por la producción intracelular de prostaglandinas (70). IL-1 puede disminuir la señal inducida por la insulina y, en concierto con otras citocinas, causar resistencia a la misma (66, 71). Induce además la producción de leptina (69) y resistina (42).
Otras citocinas con acciones proinflamatorias y anti-inflamatorias producidas por el adipocito y los macrófagos del tejido adiposo se relacionan en las tablas 1 y 2. Algunas de ellas se asocian con diversas patologías relacionadas con el síndrome metabólico tales como la IL-7, asociada con aterosclerosis y angina inestable y aumentada en la obesidad (72); la IL-8, también aumentada en la obesidad (64, 73); la IL-18, aumentada en obesidad, falla cardíaca, enfermedad coronaria, diabetes mellitus tipo 2 y aterosclerosis (74, 75); la IL-10, elevada en la obesidad (35, 76) y reducida en personas con resistencia a la insulina y síndrome metabólico y cuya menor producción se ha asociado con mayores niveles de glucosa y HBA1c en sangre y con diabetes mellitus tipo 2 y dislipidemia.
Otros factores implicados en el síndrome metabólico
La producción de óxido nítrico también es otro factor que ha sido implicado en este intrincado sistema de señalización en el adipocito. Es producido por acción de la óxido nítrico sintasa sobre la L-arginina y está implicado en mecanismos inmunológicos y vasomoduladores (77). La leptina induce la producción de óxido nítrico a través de la óxido nítrico sintasa inducible (iNOS) en los adipocitos (34). La iNOS puede producir grandes cantidades de óxido nítrico en prolongados períodos de tiempo, y aunque lo anterior es benéfico en las reacciones inmunitarias, en exceso o en ausencia de infección causa daño en los tejidos, situación que parece suceder en la obesidad. La inducción de iNOS en el tejido adiposo en respuesta al LPS ha sido reportada, tanto en adipocitos como en macrófagos, efecto estimulado por TNFa e IFN-g en conjunto (78). El aumento de óxido nítrico inhibe la adipogénesis, la captación de glucosa y la liberación de leptina, e incrementa la tasa de lipólisis en los adipocitos. La insulina aumenta la producción de óxido nítrico a través de la óxido nítrico sintasa endotelial (eNOS) por lo cual esta enzima tiene un papel fundamental en la regulación del metabolismo del adipocito, mientras la iNOS está implicada sobre todo en el proceso inflamatorio que lleva al desarrollo de síndrome metabólico (77).
Los ácidos grasos libres también tienen efectos en la homeostasis del adipocito y han sido implicados en la cascada de eventos que lleva al desarrollo de complicaciones de la obesidad. La exposición de los adipocitos a elevadas cantidades de ácidos grasos libres conduce a la fosforilación inhibitoria de IRS-1 y por ende a resistencia a la insulina (79), así como a daño endotelial e inflamación vascular. Los ácidos grasos libres también son moduladores de la inflamación produciendo activación de células NK, inducción de fagocitosis y producción de citocinas (80).
Gran parte de la producción de citocinas en el adipocito es secundaria a la activación de los TLR (toll-like receptors), los cuales son receptores que reconocen patrones moleculares de patógenos (PPR) como el LPS presente en las bacterias gram-negativas y el peptidoglicano de las bacterias gram-positivas, por lo cual, en la actualidad, al adipocito se lo cataloga como parte del sistema inmune innato. La transducción de la señal iniciada por el TLR involucra al factor NF-kB, entre otros (81). En obesidad el adipocito incrementa la expresión de TLR2, TLR4 y TLR 9. El TLR4, así como la expresión de TLR2, a su vez disminuyen la producción de adiponectina (82).
La procedencia del LPS está relacionada con la hiperinsulinemia presente en el síndrome metabólico, que produce deficiencias en el sistema inmune, razón por la cual el LPS producido por bacterias intestinales no puede ser eliminado por las células de Kupffer, permitiendo que entre a la circulación y llegue al tejido adiposo, donde produce inflamación crónica (83). Es importante aclarar que no solo el LPS y el peptidoglucano activan los TLR; los ácidos grasos libres y las proteínas del shock térmico HSP60, producidos en forma endógena y especialmente en la obesidad, pueden activar TLR2 Y TLR4, lo que explica cómo los ácidos grasos libres pueden causar los efectos antes descritos (84, 85).
Conclusiones
Las adipocinas poseen efectos diversos en el síndrome metabólico (Figura 1), los cuales se pueden dividir de manera arbitraria en efectos proinflamatorios y anti-inflamatorios, aunque dicha clasificación es inexacta para ciertas adipocinas que poseen acciones ambiguas o mal determinadas, como es el caso de vaspina, visfatina, omentina, IL-15 y TGF-b.
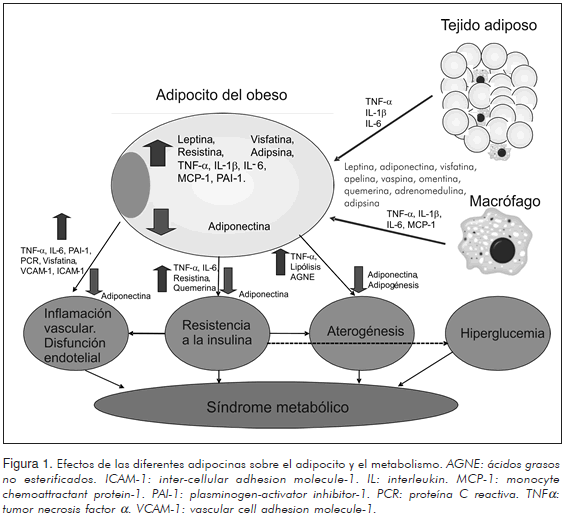
Leptina, resistina y adrenomedulina tienen efectos proinflamatorios claros al igual que las citocinas IL-1, IL-5, IL-6, IL-8, IL-15, IL-17, IL-18, IL-32, IL-33, TNFa, IFN-g, IFN-a, MCP-1 y MIF. Además, otras sustancias cuya producción se induce gracias a éstas también tienen efectos proinflamatorios adicionales; entre ellas se pueden destacar la trombina, la trombospondina y el PAI-1. Todas producen efectos tales como quimiotaxis, estimulación de macrófagos y linfocitos y disminución de la producción de sustancias anti-inflamatorias. Dichos efectos son crónicos y leves y como ya se mencionó son uno de los principales mecanismos fisiopatológicos que llevan al desarrollo del síndrome metabólico.
Por su parte, adiponectina, apelina, quemerina, IL-4, IL-10, IL-13, IL-1RA, IFN-b son todas adipocinas anti-inflamatorias, las cuales contrarrestan los efectos de las anteriores, usualmente al impedir la transcripción o expresión de las proteínas implicadas; aunque otras como la IL-1RA compiten con el receptor de las citocinas proinflamatorias, bloqueando de esa manera su acción.
Las adipocinas intervienen en diferentes eventos que pueden llevar al desarrollo de un síndrome metabólico. La resistencia a la insulina es, por ejemplo, una situación clave en la progresión de la enfermedad y diferentes adipocinas inducen dicha resistencia de manera directa como la leptina, la resistina, el TNFa y la IL-6, al evitar la transducción de la señal producida por la insulina, inhibiendo de ese modo la transcripción y translocación de los receptores de glucosa (83). La hiperglucemia resultante lleva al aumento del proceso inflamatorio debido a la producción de especies reactivas del oxígeno (86). Al mismo tiempo, la hiper-insulinemia secundaria a dicha resistencia causa defectos en las células fagocitarias aumentando la circulación de antígenos bacterianos, los cuales tienen la capacidad de activar leucocitos y adipocitos (a través de los TLRs) que liberan entonces citocinas proinflamatorias, siendo éste otro mecanismo causal de inflamación.
Adipocinas como la leptina que tienen un papel proinflamatorio, se liberan como mecanismo de regulación del metabolismo general, pero la falta de control en factores de riesgo como la obesidad, el sedentarismo y la dieta, generan resistencia al papel de esta hormona, mediada en parte por la hiperproducción de resistina, por lo que se produce en mayor cantidad y se aumentan de ese modo los efectos causantes del síndrome metabólico. Lo mismo es cierto para otras adipocinas como el TNFa y la IL-6.
En particular, la adiponectina parece tener un papel protector para el desarrollo de síndrome metabólico, ayudada en parte por la visfatina, aunque la primera disminuye en la obesidad y la segunda aumenta en ésta. La apelina ha mostrado también algunos efectos protectores sobre todo a nivel cardiaco. En contraste, la vaspina y la omentina, otras dos adipocinas escasamente caracterizadas, han mostrado efectos contradictorios, que la investigación debe aclarar.
La liberación de adipocinas anti-inflamatorias aumenta inicialmente en forma directamente proporcional a la liberación de adipocinas proinflamatorias y el incremento de peso, pero a medida que la patología avanza los niveles de las adipocinas anti-inflamatorias son incapaces de contrarrestar los efectos inflamatorios ocasionados por el coctel de adipocinas inflamatorias, y la homeostasis se rompe.
El aumento de la lipólisis y la disminución de la captación de ácidos grasos libres por parte de los adipocitos, efecto mediado por adipocinas como IL-6 y TNFa, incrementa los niveles de dichos ácidos grasos libres en sangre, los cuales producen también la activación de macrófagos y adipocitos. Los ácidos grasos libres ocasionan además la formación de una placa ateromatosa ya que inducen la liberación de quimiocinas y factores de adhesión en las células endoteliales, provocando un proceso inflamatorio en los vasos sanguíneos y la formación de trombos (85).
Muchos de los medicamentos utilizados en la actualidad en la terapéutica de la diabetes mellitus tipo 2, el síndrome metabólico y sus complicaciones cardiovasculares, además de otros usados en contextos clínicos comunes, poseen efectos sobre varios de los mecanismos mencionados, pero es necesario explorar con más detalle estas relaciones farmacológicas para utilizar estos medicamentos en forma más racional y poder contribuir a un manejo integral de los pacientes. Además, una mejor comprensión de los procesos fisiopatológicos en la obesidad, el desarrollo de resistencia a la insulina y la reacción inflamatoria crónica responsable de la perpetuación de estas alteraciones conducirá a una visión más integral y fundamentada de los pacientes que padecen estas condiciones para que la ciencia médica pueda ser más asertiva en la ayuda que les presta. Ésta es, además, una excelente oportunidad para trabajar por la integración efectiva de la investigación básica con la práctica clínica en beneficio de los pacientes.
Bibliografía
1. Zimmermann-Belsing T, Feldt-Rasmussen U. Obesity: the new worldwide epidemic threat to general health and our complete lack of effective treatment. Endocrinology 2004;145 (4):1501-2. [ Links ]
2. World Health Organization. Obesity: preventing and managing the global epidemic. Report of a WHO consultation. Geneva, 1997. WHO document WHO/NUT/NCD/98.1. [ Links ]
3. Prins JB. Adipose tissue as an endocrine organ. Best Pract Res Clin Endocrinol Metab 2002;16 (4): 639-51. [ Links ]
4. Arner P. The adipocyte in insulin resistance: key molecules and the impact of the thiazolidinediones. Trends Endocrinol Metab 2003;14 (3): 137-45. [ Links ]
5. Spiegelman BM, Enerback S. «The adipocyte: a multifunctional cell». Cell Metab 2006; 4 (6): 425-7. [ Links ]
6. Sjoholm A, Nystrom T. Inflammation and the etiology of type 2 diabetes. Diabetes Metab Res Rev 2006; 22 (1): 4-10. [ Links ]
7. Fruhbeck G, Gomez-Ambrosi J, Muruzabal FJ, Burrell MA. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation. Am J Physiol Endocrinol Metab 2001; 280 (6): E827-47. [ Links ]
8. Feve B. Adipogenesis: cellular and molecular aspects. Best Pract Res Clin Endocrinol Metab 2005;19 (4): 483-99. [ Links ]
9. Considine RV, Caro JF. Leptin and the regulation of body weight. Int J Biochem Cell Biol1997; 29 (11): 1255-72. [ Links ]
10. Rueda-Clausen CF, Lahera V, Calderón J, Bolívar IC, Castillo VR, Gutiérrez M, et al. The presence of abdominal obesity is associated with changes in vascular function independently of other cardiovascular risk factors. Int J Cardiol 2008; 139 (1): 32-41. [ Links ]
11. Ahima RS, Flier JS. Leptin. Annu Rev Physiol 2000; 62: 413-37. [ Links ]
12. Ghilardi N, Skoda RC. The leptin receptor activates janus kinase 2 and signals for proliferation in a factor-dependent cell line. Mol Endocrinol1997; 11 (4): 393-9. [ Links ]
13. Fei H, Okano HJ, Li C, Lee GH, Zhao C, Darnell R, et al. Anatomic localization of alternatively spliced leptin receptors (Ob-R) in mouse brain and other tissues. Proc Natl Acad Sci U S A1997; 94 (13): 7001-5. [ Links ]
14. Elimam A, Kamel A, Marcus C. In vitro effects of leptin on human adipocyte metabolism. Horm Res 2002; 58 (2): 88-93. [ Links ]
15. Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem 1995; 270 (45): 26746-9. [ Links ]
16. Berg AH, Combs TP, Scherer PE. ACRP30/adiponectin: an adipokine regulating glucose and lipid metabolism. Trends Endocrinol Metab2002; 13 (2): 84-9. [ Links ]
17. Yamauchi T, Kamon J, Minokoshi Y, Ito Y, Waki H, Uchida S, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase. Nat Med 2002; 8 (11): 1288-95. [ Links ]
18. Vasseur F. Adiponectin and its receptors: partners contributing to the «vicious circle» leading to the metabolic syndrome? Pharmacol Res 2006; 53 (6): 478-81. [ Links ]
19. Yamauchi T, Nio Y, Maki T, Kobayashi M, Takazawa T, Iwabu M, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med 2007;13 (3): 332-9. [ Links ]
20. Yoon MJ, Lee GY, Chung JJ, Ahn YH, Hong SH, Kim JB. Adiponectin increases fatty acid oxidation in skeletal muscle cells by sequential activation of AMP-activated protein kinase, p38 mitogen-activated protein kinase, and peroxisome proliferator-activated receptor alpha. Diabetes 2006; 55 (9): 2562-70. [ Links ]
21. Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocr Rev 2005; 26 (3): 439-51. [ Links ]
22. Shand BI, Scott RS, Elder PA, George PM. Plasma adiponectin in overweight, nondiabetic individuals with or without insulin resistance. Diabetes Obes Metab 2003; 5 (5): 349-53. [ Links ]
23. Gualillo O, González-Juanatey JR, Lago F. The emerging role of adipokines as mediators of cardiovascular function: physiologic and clinical perspectives. Trends Cardiovasc Med 2007; 17 (8): 275-83. [ Links ]
24. Ajuwon KM, Spurlock ME. Adiponectin inhibits LPS-induced NF-kappaB activation and IL-6 production and increases PPARgamma2 expression in adipocytes. Am J Physiol Regul Integr Comp Physiol 2005; 288 (5): R1220-5. [ Links ]
25. Spranger J, Kroke A, Mohlig M, Bergmann MM, Ristow M, Boeing H, et al. Adiponectin and protection against type 2 diabetes mellitus. Lancet 2003; 361 (9353): 226-8. [ Links ]
26. Lago F, Dieguez C, Goóez-Reino J, Gualillo O. The emerging role of adipokines as mediators of inflammation and immune responses. Cytokine Growth Factor Rev 2007; 18 (3-4): 313-25. [ Links ]
27. Steppan CM, Lazar MA. The current biology of resistin. J Intern Med 2004; 255 (4): 439-47. [ Links ]
28. Fain JN. Release of interleukins and other inflammatory cytokines by human adipose tissue is enhanced in obesity and primarily due to the nonfat cells. Vitam Horm 2006; 74: 443-77. [ Links ]
29. Niederwanger A, Kranebitter M, Ciardi C, Tatarczyk T, Patsch JR, Pedrini MT. Resistin impairs basal and insulin-induced glycogen synthesis by different mechanisms. Mol Cell Endocrinol2007; 263 (1-2): 112-9. [ Links ]
30. Conneely KN, Silander K, Scott LJ, Mohlke KL, Lazaridis KN, Valle TT, et al. Variation in the resistin gene is associated with obesity and insulin-related phenotypes in Finnish subjects. Diabetologia 2004; 47 (10): 1782-8. [ Links ]
31. Verma S, Li SH, Wang CH, Fedak PW, Li RK, Weisel RD, et al. Resistin promotes endothelial cell activation: further evidence of adipokine-endothelial interaction. Circulation 2003; 108 (6): 736-40. [ Links ]
32. Bo S, Gambino R, Pagani A, Guidi S, Gentile L, Cassader M, et al. Relationships between human serum resistin, inflammatory markers and insulin resistance. Int J Obes (Lond) 2005; 29 (11): 1315-20. [ Links ]
33. Dandona P, Aljada A, Bandyopadhyay A. Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol 2004; 25 (1): 4-7. [ Links ]
34. Antuna-Puente B, Feve B, Fellahi S, Bastard JP. Adipokines: the missing link between insulin resistance and obesity. Diabetes Metab 2008; 34 (1): 2-11. [ Links ]
35. Fain JN, Madan AK, Hiler ML, Cheema P, Bahouth SW. Comparison of the release of adipokines by adipose tissue, adipose tissue matrix, and adipocytes from visceral and subcutaneous abdominal adipose tissues of obese humans. Endocrinology 2004; 145 (5): 2273-82. [ Links ]
36. Hube F, Hauner H. The two tumor necrosis factor receptors mediate opposite effects on differentiation and glucose metabolism in human adipocytes in primary culture. Endocrinology 2000; 141 (7): 2582-8. [ Links ]
37. Spiegelman BM, Hotamisligil GS. Through thick and thin: wasting, obesity, and TNF alpha. Cell 1993; 73 (4): 625-7. [ Links ]
38. Bruun JM, Pedersen SB, Kristensen K, Richelsen B. Opposite regulation of interleukin-8 and tumor necrosis factor-alpha by weight loss. Obes Res 2002; 10 (6): 499-506. [ Links ]
39. Ito Y, Daitoku H, Fukamizu A. Foxo1 increases pro-inflammatory gene expression by inducing C/EBPbeta in TNF-alpha-treated adipocytes. Biochem Biophys Res Commun 2009; 378 (2): 290-5. [ Links ]
40. Li L, Renier G. Adipocyte-derived lipoprotein lipase induces macrophage activation and monocyte adhesion: role of fatty acids. Obesity (Silver Spring) 2007; 15 (11): 2595-604. [ Links ]
41. Simons PJ, van den Pangaart PS, van Roomen CP, Aerts JM, Boon L. Cytokine-mediated modulation of leptin and adiponectin secretion during in vitro adipogenesis: evidence that tumor necrosis factor-alpha- and interleukin-1beta-treated human preadipocytes are potent leptin producers. Cytokine 2005; 32 (2): 94-103. [ Links ]
42. Kaser S, Kaser A, Sandhofer A, Ebenbichler CF, Tilg H, Patsch JR. Resistin messenger-RNA expression is increased by proinflammatory cytokines in vitro. Biochem Biophys Res Commun 2003; 309 (2): 286-90. [ Links ]
43. Bo S, Ciccone G, Baldi I, Gambino R, Mandrile C, Durazzo M, et al. Plasma visfatin concentrations after a lifestyle intervention were directly associated with inflammatory markers. Nutr Metab Cardiovasc Dis 2009; 19 (6): 423-30. [ Links ]
44. Fukuhara A, Matsuda M, Nishizawa M, Segawa K, Tanaka M, Kishimoto K, et al. Visfatin: a protein secreted by visceral fat that mimics the effects of insulin. Science 2005; 307 (5708): 426-30. [ Links ]
45. Yamawaki H, Hara N, Okada M, Hara Y. Visfatin causes endothelium-dependent relaxation in isolated blood vessels. Biochem Biophys Res Commun 2009 ;383 (4): 503-8. [ Links ]
46. de Luis DA, Sagrado MG, Aller R, Conde R, Izaola O. Circulating visfatin in obese non-diabetic patients in relation to cardiovascular risk factors, insulin resistance, and adipocytokines: A contradictory piece of the puzzle. Nutrition. En prensa. DOI 10.1016/j.nut.2008.11.019. [ Links ]
47. Telejko B, Kuzmicki M, Zonenberg A, Szamatowicz J, Wawrusiewicz-Kurylonek N, Nikolajuk A, et al. Visfatin in gestational diabetes: serum level and mRNA expression in fat and placental tissue. Diabetes Res Clin Pract 2009; 84 (1): 68-75. [ Links ]
48. Adya R, Tan BK, Chen J, Randeva HS. Pre-B cell colony enhancing factor (PBEF)/visfatin induces secretion of MCP-1 in human endothelial cells: role in visfatin-induced angiogenesis. Atherosclerosis 2009; 205 (1): 113-9. [ Links ]
49. Zeng XJ, Zhang LK, Wang HX, Lu LQ, Ma LQ, Tang CS. Apelin protects heart against ischemia/reperfusion injury in rat. Peptides 2009; 30 (6): 1144-52. [ Links ]
50. Volkoff H, Wyatt JL. Apelin in goldfish (Carassius auratus): cloning, distribution and role in appetite regulation. Peptides 2009; 30(8): 1434-40. [ Links ]
51. Kloting N, Berndt J, Kralisch S, Kovacs P, Fasshauer M, Schon MR, et al. Vaspin gene expression in human adipose tissue: association with obesity and type 2 diabetes. Biochem Biophys Res Commun 2006; 339 (1): 430-6. [ Links ]
52. Aust G, Richter O, Rohm S, Kerner C, Hauss J, Kloting N, et al. Vaspin serum concentrations in patients with carotid stenosis. Atherosclerosis 2009; 204 (1): 262-6. [ Links ]
53. Suleymanoglu S, Tascilar E, Pirgon O, Tapan S, Meral C, Abaci A. Vaspin and its correlation with insulin sensitivity indices in obese children. Diabetes Res Clin Pract 2009; 84 (3): 325-8. [ Links ]
54. Yang RZ, Lee MJ, Hu H, Pray J, Wu HB, Hansen BC, et al. Identification of omentin as a novel depot-specific adipokine in human adipose tissue: possible role in modulating insulin action. Am J Physiol Endocrinol Metab 2006; 290 (6): E1253-61. [ Links ]
55. de Souza Batista CM, Yang RZ, Lee MJ, Glynn NM, Yu DZ, Pray J, et al. Omentin plasma levels and gene expression are decreased in obesity. Diabetes 2007; 56 (6): 1655-61. [ Links ]
56. Kralisch S, Weise S, Sommer G, Lipfert J, Lossner U, Bluher M, et al. Interleukin-1beta induces the novel adipokine chemerin in adipocytes in vitro. Regul Pept 2009; 154 (1-3): 102-6. [ Links ]
57. Takahashi M, Takahashi Y, Takahashi K, Zolotaryov FN, Hong KS, Kitazawa R, et al. Chemerin enhances insulin signaling and potentiates insulin-stimulated glucose uptake in 3T3-L1 adipocytes. FEBS Lett 2008; 582 (5): 573-8. [ Links ]
58. Nambu T, Arai H, Komatsu Y, Yasoda A, Moriyama K, Kanamoto N, et al. Expression of the adrenomedullin gene in adipose tissue. Regul Pept 2005; 132 (1-3): 17-22. [ Links ]
59. Takahashi K, Totsune K, Sone M, Kikuchi K, Murakami O. Effects of adipokines on expression of adrenomedullin and endothelin-1 in cultured vascular endothelial cells. Peptides 2005; 26 (5): 845-51. [ Links ]
60. Guidolin D, Albertin G, Spinazzi R, Sorato E, Mascarin A, Cavallo D, et al. Adrenomedullin stimulates angiogenic response in cultured human vascular endothelial cells: involvement of the vascular endothelial growth factor receptor 2. Peptides 2008; 29 (11): 2013-23. [ Links ]
61. Kitagawa K, Rosen BS, Spiegelman BM, Lienhard GE, Tanner LI. Insulin stimulates the acute release of adipsin from 3T3-L1 adipocytes. Biochim Biophys Acta1989; 1014 (1): 83-9. [ Links ]
62. White RT, Damm D, Hancock N, Rosen BS, Lowell BB, Usher P, et al. Human adipsin is identical to complement factor D and is expressed at high levels in adipose tissue. J Biol Chem1992; 267 (13): 9210-3. [ Links ]
63. Wood IS, Wang B, Trayhurn P. IL-33, a recently identified interleukin-1 gene family member, is expressed in human adipocytes. Biochem Biophys Res Commun 2009; 384 (1): 105-9. [ Links ]
64. Bruun JM, Lihn AS, Madan AK, Pedersen SB, Schiott KM, Fain JN, et al. Higher production of IL-8 in visceral vs. subcutaneous adipose tissue. Implication of nonadipose cells in adipose tissue. Am J Physiol Endocrinol Metab 2004; 286 (1): E8-13. [ Links ]
65. Rotter V, Nagaev I, Smith U. Interleukin-6 (IL-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin-resistant subjects. J Biol Chem2003; 278 (46): 45777-84. [ Links ]
66. Tilg H, Moschen AR. Insulin resistance, inflammation, and non-alcoholic fatty liver disease. Trends Endocrinol Metab 2008; 19 (10): 371-9. [ Links ]
67. Path G, Bornstein SR, Gurniak M, Chrousos GP, Scherbaum WA, Hauner H. Human breast adipocytes express interleukin-6 (IL-6) and its receptor system: increased IL-6 production by beta-adrenergic activation and effects of IL-6 on adipocyte function. J Clin Endocrinol Metab 2001; 86 (5): 2281-8. [ Links ]
68. Lehrke M, Broedl UC, Biller-Friedmann IM, Vogeser M, Henschel V, Nassau K, et al. Serum concentrations of cortisol, interleukin 6, leptin and adiponectin predict stress induced insulin resistance in acute inflammatory reactions. Crit Care 2008; 12 (6): R157. [ Links ]
69. Luheshi GN, Gardner JD, Rushforth DA, Loudon AS, Rothwell NJ. Leptin actions on food intake and body temperature are mediated by IL-1. Proc Natl Acad Sci U S A1999; 96 (12): 7047-52. [ Links ]
70. Shin JH, Shin DW, Noh M. Interleukin-17A inhibits adipocyte differentiation in human mesenchymal stem cells and regulates pro-inflammatory responses in adipocytes. Biochem Pharmacol2009; 77 (12): 1835-44. [ Links ]
71. Tilg H, Moschen AR. Inflammatory mechanisms in the regulation of insulin resistance. Mol Med 2008; 14 (3-4): 222-31. [ Links ]
72. Maury E, Ehala-Aleksejev K, Guiot Y, Detry R, Vandenhooft A, Brichard SM. Adipokines oversecreted by omental adipose tissue in human obesity. Am J Physiol Endocrinol Metab 2007; 293 (3): E656-65. [ Links ]
73. Bruun JM, Pedersen SB, Richelsen B. Regulation of interleukin 8 production and gene expression in human adipose tissue in vitro. J Clin Endocrinol Metab 2001; 86 (3): 1267-73. [ Links ]
74. Skurk T, Kolb H, Muller-Scholze S, Rohrig K, Hauner H, Herder C. The proatherogenic cytokine interleukin-18 is secreted by human adipocytes. Eur J Endocrinol 2005; 152 (6): 863-8. [ Links ]
75. Wood IS, Wang B, Jenkins JR, Trayhurn P. The pro-inflammatory cytokine IL-18 is expressed in human adipose tissue and strongly upregulated by TNFalpha in human adipocytes. Biochem Biophys Res Commun 2005; 337 (2): 422-9. [ Links ]
76. Kang K, Reilly SM, Karabacak V, Gangl MR, Fitzgerald K, Hatano B, et al. Adipocyte-derived Th2 cytokines and myeloid PPARdelta regulate macrophage polarization and insulin sensitivity. Cell Metab 2008; 7 (6): 485-95. [ Links ]
77. Unno Y, Akuta T, Sakamoto Y, Horiuchi S, Akaike T. Nitric oxide-induced downregulation of leptin production by 3T3-L1 adipocytes. Nitric Oxide 2006; 15 (2): 125-32. [ Links ]
78. Kapur S, Marcotte B, Marette A. Mechanism of adipose tissue iNOS induction in endotoxemia. Am J Physiol1999; 276 (4 Pt 1): E635-41. [ Links ]
79. Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 links innate immunity and fatty acid-induced insulin resistance. J Clin Invest 2006; 116 (11): 3015-25. [ Links ]
80. Bradley RL, Fisher FF, Maratos-Flier E. Dietary fatty acids differentially regulate production of TNF-alpha and IL-10 by murine 3T3-L1 adipocytes. Obesity (Silver Spring) 2008;16 (5): 938-44. [ Links ]
81. Chung S, Lapoint K, Martinez K, Kennedy A, Boysen Sandberg M, McIntosh MK. Preadipocytes mediate lipopolysaccharide-induced inflammation and insulin resistance in primary cultures of newly differentiated human adipocytes. Endocrinology 2006; 147 (11): 5340-51. [ Links ]
82. Ajuwon KM, Banz W, Winters TA. Stimulation with Peptidoglycan induces interleukin 6 and TLR2 expression and a concomitant downregulation of expression of adiponectin receptors 1 and 2 in 3T3-L1 adipocytes. J Inflamm (Lond) 2009; 6: 8. [ Links ]
83. Creely SJ, McTernan PG, Kusminski CM, Fisher M, Da Silva NF, Khanolkar M, et al. Lipopolysaccharide activates an innate immune system response in human adipose tissue in obesity and type 2 diabetes. Am J Physiol Endocrinol Metab 2007; 292 (3): E740-7. [ Links ]
84. Gulden E, Mollerus S, Bruggemann J, Burkart V, Habich C. Heat shock protein 60 induces inflammatory mediators in mouse adipocytes. FEBS Lett 2008 6; 582 (18): 2731-6. [ Links ]
85. Suganami T, Tanimoto-Koyama K, Nishida J, Itoh M, Yuan X, Mizuarai S, et al. Role of the Toll-like receptor 4/NF-kappaB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages. Arterioscler Thromb Vasc Biol 2007; 27 (1): 84-91. [ Links ]
86. Skurk T, Alberti-Huber C, Herder C, Hauner H. Relationship between adipocyte size and adipokine expression and secretion. J Clin Endocrinol Metab 2007; 92 (3): 1023-33. [ Links ]
87. Waite KJ, Floyd ZE, Arbour-Reily P, Stephens JM. Interferon-gamma-induced regulation of peroxisome proliferator-activated receptor gamma and STATs in adipocytes. J Biol Chem 2001; 276 (10): 7062-8. [ Links ]
88. Birk RZ, Rubinstein M. IFN-alpha induces apoptosis of adipose tissue cells. Biochem Biophys Res Commun 2006 J; 345 (2): 669-74. [ Links ]
89. Ajuwon KM, Jacobi SK, Kuske JL, Spurlock ME. Interleukin-6 and interleukin-15 are selectively regulated by lipopolysaccharide and interferon-gamma in primary pig adipocytes. Am J Physiol Regul Integr Comp Physiol 2004; 286 (3): R547-53. [ Links ]
90. Vassaux G, Gaillard D, Ailhaud G, Negrel R. Prostacyclin is a specific effector of adipose cell differentiation. Its dual role as a cAMP- and Ca(2+)-elevating agent. J Biol Chem1992; 267 (16): 11092-7. [ Links ]
91. Rocha VZ, Folco EJ, Sukhova G, Shimizu K, Gotsman I, Vernon AH, et al. Interferon-gamma, a Th1 cytokine, regulates fat inflammation: a role for adaptive immunity in obesity. Circ Res 2008; 103 (5): 467-76. [ Links ]
92. Skurk T, Herder C, Kraft I, Muller-Scholze S, Hauner H, Kolb H. Production and release of macrophage migration inhibitory factor from human adipocytes. Endocrinology 2005; 146 (3): 1006-11. [ Links ]
93. Herder C, Hauner H, Kempf K, Kolb H, Skurk T. Constitutive and regulated expression and secretion of interferon-gamma-inducible protein 10 (IP-10/CXCL10) in human adipocytes. Int J Obes (Lond) 2007; 31 (3): 403-10. [ Links ]
94. Dahlman I, Kaaman M, Olsson T, Tan GD, Bickerton AS, Wahlen K, et al. A unique role of monocyte chemoattractant protein 1 among chemokines in adipose tissue of obese subjects. J Clin Endocrinol Metab 2005; 90 (10): 5834-40. [ Links ]
95. Wu H, Ghosh S, Perrard XD, Feng L, García GE, Perrard JL, et al. T-cell accumulation and regulated on activation, normal T cell expressed and secreted upregulation in adipose tissue in obesity. Circulation2007; 115 (8): 1029-38. [ Links ]
96. Hoo RL, Chow WS, Yau MH, Xu A, Tso AW, Tse HF, et al. Adiponectin mediates the suppressive effect of rosiglitazone on plasminogen activator inhibitor-1 production. Arterioscler Thromb Vasc Biol 2007; 27 (12): 2777-82. [ Links ]
97. Varma V, Yao-Borengasser A, Bodles AM, Rasouli N, Phanavanh B, Nolen GT, et al. Thrombospondin-1 is an adipokine associated with obesity, adipose inflammation, and insulin resistance. Diabetes 2008; 57 (2): 432-9. [ Links ]
98. Ditiatkovski M, Toh BH, Bobik A. GM-CSF deficiency reduces macrophage PPAR-gamma expression and aggravates atherosclerosis in ApoE-deficient mice. Arterioscler Thromb Vasc Biol 2006; 26 (10): 2337-44. [ Links ]
99. Cao Y. Angiogenesis modulates adipogenesis and obesity. J Clin Invest 2007; 117 (9): 2362-8. [ Links ]
100. Wheatcroft SB, Kearney MT, Shah AM, Ezzat VA, Miell JR, Modo M, et al. IGF-binding protein-2 protects against the development of obesity and insulin resistance. Diabetes 2007; 56 (2): 285-94. [ Links ]
101. Chan SS, Twigg SM, Firth SM, Baxter RC. Insulin-like growth factor binding protein-3 leads to insulin resistance in adipocytes. J Clin Endocrinol Metab 2005; 90 (12): 6588-95. [ Links ]
102. van Exel E, Gussekloo J, de Craen AJ, Frolich M, Bootsma-Van Der Wiel A, Westendorp RG. Low production capacity of interleukin-10 associates with the metabolic syndrome and type 2 diabetes : the Leiden 85-Plus Study. Diabetes 2002; 51 (4): 1088-92. [ Links ]
103. Bertola A, Bonnafous S, Cormont M, Anty R, Tanti JF, Tran A, et al. Hepatocyte growth factor induces glucose uptake in 3T3-L1 adipocytes through A Gab1/phosphatidylinositol 3-kinase/Glut4 pathway. J Biol Chem 2007; 282 (14): 10325-32. [ Links ]
104. Juge-Aubry CE, Somm E, Chicheportiche R, Burger D, Pernin A, Cuenod-Pittet B, et al. Regulatory effects of interleukin (IL)-1, interferon-beta, and IL-4 on the production of IL-1 receptor antagonist by human adipose tissue. J Clin Endocrinol Metab 2004; 89 (6): 2652-8. [ Links ]
105. Álvarez B, Carbo N, López-Soriano J, Drivdahl RH, Busquets S, López-Soriano FJ, et al. Effects of interleukin-15 (IL-15) on adipose tissue mass in rodent obesity models: evidence for direct IL-15 action on adipose tissue. Biochim Biophys Acta 2002; 1570 (1): 33-7. [ Links ]
106. Rehman J, Considine RV, Bovenkerk JE, Li J, Slavens CA, Jones RM, et al. Obesity is associated with increased levels of circulating hepatocyte growth factor. J Am Coll Cardiol 2003; 41 (8): 1408-13. [ Links ]
107. Peeraully MR, Jenkins JR, Trayhurn P. NGF gene expression and secretion in white adipose tissue: regulation in 3T3-L1 adipocytes by hormones and inflammatory cytokines. Am J Physiol Endocrinol Metab 2004; 287 (2): E331-9. [ Links ]














