Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.17 no.4 Bogota July/Aug. 2010
Síndrome de Brugada en un paciente con síncope.
Presentación de un caso y revisión de la literatura
Presentación de un caso y revisión de la literatura
Brugada syndrome in a patient with syncope.
A case report and literature review
A case report and literature review
(1) Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
Correspondencia: Gabriel Arcenio Londoño Zapata. Calle 50 B sur No. 42 C - 21 Unidad la Hojarasca, Casa 414. Medellín, Colombia. Tel.: 378 18 58 - Cel.: 300 266 73 49. Correo electrónico: thegabo10@gmail.com
Recibido: 30/07/2009. Aceptado: 24/02/2010.
El síndrome de Brugada es una enfermedad autosómica dominante esporádica que afecta los canales de sodio de los miocardiocitos. Clínicamente se caracteriza por síncopes recurrentes y/o muerte súbita, que en el electrocardiograma simula un bloqueo de rama derecha, acompañado de elevación peculiar del segmento ST en las derivaciones precordiales derechas (V1, V2 y V3) sin alteración cardiaca estructural. Afecta principalmente a hombres en la cuarta década de la vida y tiene mayor prevalencia en el suroeste asiático. El caso que se describe corresponde a un paciente con antecedentes personales de síncopes, a quien se le encuentra un patrón electrocardiográfico tipo-2 de Brugada y quien además tiene un hermano con historia de síncopes. Con una prueba de mesa basculantes positivo para síncope mediado neuralmente se deja este diagnóstico, pero no se descarta la sospecha inicial de síndrome de Brugada.
PALABRAS CLAVE: síndrome de Brugada, síncope, muerte súbita, arritmias, patrones electrocardiográficos tipo Brugada, canales de sodio cardiacos, bloqueadores de canales de sodio.
Brugada syndrome is a sporadic autosomal dominant genetic disease that affects cardiac sodium channels. It is clinically characterized by recurrent syncope and/or sudden death with electrocardiographic manifestations that simulate a right bundle branch block accompanied by ST-segment elevation in the right precordial leads (V1, V2 and V3) without structural cardiac changes. It mainly affects men in their fourth decade and is most prevalent in southwestern Asia. We present the case of a patient with history of syncope, type-2 Brugada electrocardiographic pattern and who has a brother also with history of syncope. The patient had a positive tilt test for neurocardiogenic syncope. He was diagnosed as neurocardiogenic syndrome, without discarding the initial suspicion of Brugada syndrome.
KEY WORDS: Brugada syndrome, syncope, sudden death, arrhythmias, Brugada-type electrocardiographic patterns, cardiac sodium channels, sodium channel blockers.
Descripción del caso
Hombre de 59 años de edad, ex-fumador de cigarrillo (treinta paquetes/año) desde su adolescencia hasta aproximadamente dieciocho meses con previa exposición en su infancia al humo de tabaco y quien es bebedor ocasional de licor desde temprana edad sin llegar a la embriaguez.
En la historia familiar se evidencia que su padre falleció por cáncer gástrico y su madre por carcinoma hepatocelular. Al parecer su hermano mayor tenía posible síndrome de Brugada, presentó cuadros sincopales, sin antecedentes de muerte súbita, patrón electrocardiográfico desconocido y murió a los 51 años a causa de cáncer de pulmón; además tiene una sobrina con disautonomía.
El paciente refiere episodios de síncopes desde la infancia, que aparecían en reposo y tras períodos de intensa actividad física o mental; éstos eran precedidos de síntomas autonómicos (vómito, sudoración profusa y cefalea con patrón migrañoso) de corta duración. No se acompañaban de dolor torácico ni pérdida del control de esfínteres. El primero de éstos fue en la edad escolar, y posteriormente se fueron presentando otros episodios con un intervalo de aparición cada vez menor. Algunos de estos cuadros ocasionalmente se asociaron con situaciones especiales en la adultez (al donar sangre, jornadas laborales extenuantes, entre otros).
En un electrocardiograma tomado en su juventud posterior a uno de los episodios descritos, el médico tratante en ese entonces observó una elevación del segmento ST que lo interpretó como un posible infarto agudo del miocardio, pero no se le realizaron estudios específicos para hacer un diagnóstico concluyente. Tras varios años sin presentar episodios sincopales, consultó nuevamente por reaparición y recurrencia de éstos, los cuales se presentaron con las mismas características iniciales. Al examen físico presentó: presión arterial 110/70 sentado y 100/86 en bipedestación; frecuencia cardiaca de 76 lpm, frecuencia respiratoria 17 rpm, y estado afebril. Ruidos cardiacos rítmicos sin S3 o S4, sin soplos, pulsos periféricos palpables de buena intensidad y amplitud, murmullo vesicular audible con buena ventilación sin otros ruidos sobre-agregados.
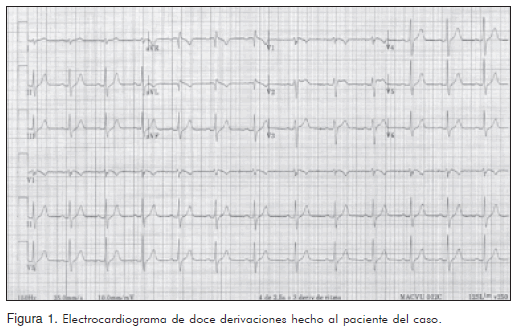
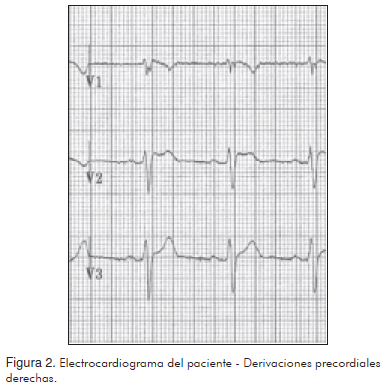
El 02 de octubre de 2008 se tomó un electrocardiograma (Figura 1) en el que se observó una elevación del ST en las derivaciones V1, V2 y V3, así como un remedo de bloqueo de rama derecha (Figura 2), frecuencia cardiaca 76 lpm, ritmo sinusal; intervalos y ejes dentro de los rangos normales y morfología de las demás ondas sin hallazgos significativos.
Se tomó un ecocardiograma, el cual fue normal, y una prueba de esfuerzo durante la que presentó excelente tolerancia al ejercicio, limitada por fatiga a un nivel de 13 MET; con ritmo sinusal durante toda la prueba y buena respuesta de la frecuencia cardiaca (148) y de la presión arterial (110/80) al ejercicio. En el periodo de recuperación hizo una bradicardia sinusal (frecuencia cardiaca 31 al min), sin presentar síntomas ni cambios adicionales en el electrocardiograma que pudieran sugerir isquemia miocárdica, lo cual lo clasificó en un estado funcional cIase I / IV.
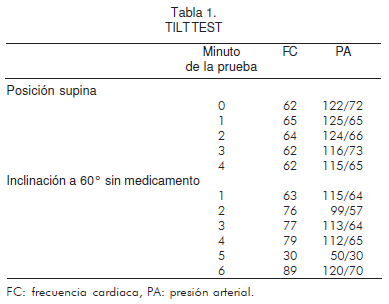
El 08 del mismo mes, se le realizó un tilt test (prueba de mesa basculante), con la aparición de síncope a los seis minutos de iniciada la prueba a una elevación de 60º, con presión arterial de 50/30 y frecuencia cardiaca de 31; respuesta tipo IIa con hipotensión y bradicardia menor de 40 lpm/minuto sin asistolia, que permitió diagnosticar síncope neurocardiogénico (Tabla 1).
Los electrocardiogramas de sus hijos fueron normales, sin evidencia de patrones similares a los del paciente. En la actualidad se encuentra estable, en manejo con terapia sintomática, recomendaciones acerca del estilo de vida y sin recurrencias de síncope a la fecha.
Síndrome de Brugada
Este síndrome fue descrito por primera vez en 1992 por Brugada y colaboradores (1), y se caracteriza por un patrón clínico electrocardiográfico similar al del bloqueo de rama derecha con elevación del segmento ST en las derivaciones precordiales derechas (V1 a V3) sin alteración cardiaca estructural de base, acompañado de síncopes recurrentes con o sin muerte súbita secundarios a taquicardias ventriculares polimórficas (Torsades de pointes) o fibrilación ventricular.
El síndrome de Brugada se ha convertido en una entidad de gran interés por su poco conocimiento en el campo médico (2) y por su prevalencia, que varía según la ubicación territorial (3-15), siendo ésta mayor en el suroeste asiático (7, 8, 12, 16). Tiene una incidencia mundial entre 5 y 66 casos por cada 10.000 personas (17); predomina en el género masculino en razón de 8:1 y tiene una edad promedio de presentación inicial de arritmias (fibrilación ventricular) a los cuarenta años, con un rango de 1 a 77 años de edad (18). Se estima que es responsable de por lo menos 4% de todas las muertes súbitas y de 20% de las muertes súbitas en pacientes sin alteración cardiaca estructural (19).
Criterios electrocardiográficos
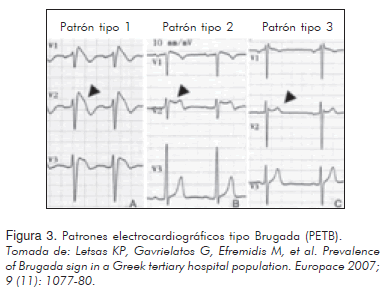
Principalmente se encuentra un trastorno en la despolarización que conlleva anormalidades en la repolarización sin que éstas se deban a una anormalidad estructural. Se reconocen tres tipos de patrones electrocardiográficos en este síndrome (18) (Tabla 2). El patrón tipo-1 (Figura 3), se caracteriza por una convexidad prominente del segmento ST que muestra elevación de la amplitud del punto J o elevación del segmento ST ³ 2 mm ó 0,2 mV en su pico, seguida por una onda T negativa con poca o ninguna separación de la línea isoeléctrica. El patrón tipo-2 (Figura 3), también presenta elevación del segmento ST con la característica que la amplitud del punto J (³ 2 mm) da lugar a un descenso gradual del segmento ST (permaneciendo a ³ 1 mm por encima de la línea de base), seguida por una onda T positiva o bifásica, lo cual da la configuración de una "silla de montar". Por último, el patrón tipo-3 (Figura 3), presenta una elevación del segmento ST < 1 mm con la configuración en "silla de montar", tipo convexo, o ambas.
Aunque los tres patrones pueden estar presentes en un paciente con síndrome de Brugada no todos son criterio diagnóstico del síndrome. Por consenso, el diagnóstico de Brugada está dado por una serie de criterios tanto clínicos como electrocardiográficos realizados por el Arrhythmia Working Group of the European Society of Cardiology (20): el Patrón electrocardiográfico tipo-1 en más de una derivación precordial derecha (V1-V3) con o sin la administración de bloqueadores de canales de sodio, sumado a uno o más de los siguientes criterios:
- Fibrilación ventricular documentada.
- Taquicardia ventricular polimórfica (Torsades de pointes).
- Arritmia ventricular inducida por estimulación eléctrica programada.
- Historia familiar de muerte súbita antes de los 45 años de edad.
- Presencia de patrón electrocardiográfico tipo-1 de Brugada en algún miembro de la familia.
- Historia personal de síncope.
- Respiraciones agónicas nocturnas (durante el sueño).
Fisiopatología
En 1998 se reportó por primera vez la asociación de fibrilación ventricular idiopática en pacientes con patrones electrocardiográficos característicos (los cuales se correlacionan con los hallazgos electrocardiográficos de Brugada) con alteraciones en la despolarización cardiaca que posteriormente fueron explicados por pérdida de la función de los canales de sodio cardiacos debido a una disminución cuantitativa y/o cualitativa, que conduce a dichos canales a entrar ya sea en un estadio intermediario de inactivación del cual se recuperan muy lentamente o en una inactivación acelerada, que finalmente se traduce en una pérdida funcional de la corriente iónica del canal de sodio (INa) (21).
Se cree que dichos cambios funcionales en los canales de sodio son los principales responsables de la patogénesis del síndrome de Brugada, al igual que lo han sido para el síndrome de Lenegre, el síndrome de QT largo (LQT3), el transtorno de conducción aislada, el paro auricular, el síndrome del nodo enfermo congénito y el síndrome de muerte súbita infantil (22). Estos canales de sodio son codificados por múltiples genes (nueve genes con 50% de similitud) en su mayoría ubicados en el brazo corto del cromosoma 3, que a nivel cardiaco y principal implicado en la patogenia de las enfermedades anteriormente mencionadas, es el gen SCN5A con 28 exones de 80 Kb ubicado en el locus p21-24 el cual codifica la subunidad a del canal iónico de sodio específico de la célula cardiaca (21), compuesto de cuatro dominios, cada uno de ellos con seis segmentos transmembrana, acoplados por enlazadores (linkers) internos y externos (Figura 4). La especificidad de estos canales por el sodio es dada por (23):
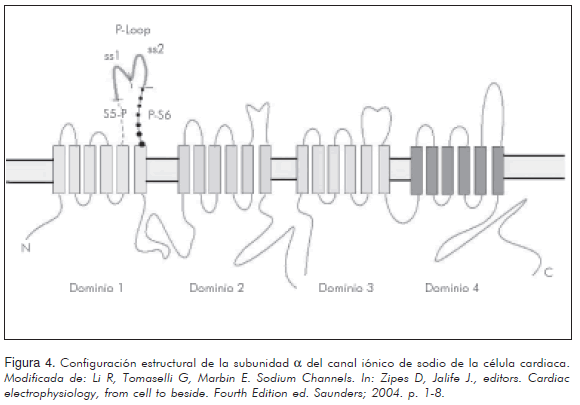
- La presencia de secuencias entre el dominio I y II de la subunidad alfa en el linker externo denominadas: S5-P, P-Loop (dividido a su vez en SS1 y SS2) y P-S6 que determinan mayor conductancia y por lo tanto mayor concentración de sodio efectiva al permitir una relación en el flujo iónico de 100:1 a favor del sodio con respecto a otros iones.
- La presencia de un aminoácido de lisina (lys) en el dominio III que es crítico para la discriminación entre sodio y calcio.
- La presencia de un "sensor" iónico específico para el sodio en el segmento S4 que regula el flujo y la expresión funcional de los canales de sodio.
En condiciones basales normales, estos canales permiten un flujo iónico relativamente constante, generando un potencial eléctrico entre la bicapa lipídica que a nivel intracelular es estimado en valores eléctricos de -85 mV; este potencial se rompe durante el inicio de la despolarización, aumentando hasta +20 mV gracias al INa donde se mantiene durante 0,2 segundos, lo que se traduce eléctricamente como una "meseta" en la curva del potencial de acción (diferencia fundamental con las células del músculo estriado no especializado). Esto se debe a la presencia de canales rápidos y lentos de Na, adicionado a una disminución en cinco veces el flujo de salida del potasio (Ito). Una vez cerrados los canales de Na y Ca, el Ito retorna a sus valores normales, lo que finalmente lleva a la repolarización. Terminado el estímulo, los miocardiocitos entran en un periodo refractario entre 0,15 - 0,3 ms, durante el cual, no ocurrirá un nuevo ciclo. Sin embargo, es de anotar que existe un periodo refractario relativo de 0,05 segundos durante el cual es posible generar una contracción prematura (24).
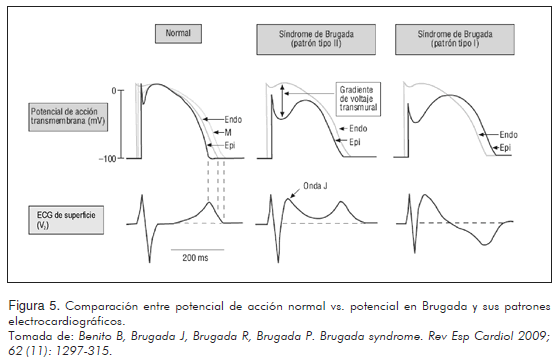
En la fisiopatogenia del síndrome de Brugada, debido a las alteraciones canaliculares que se comentaron previamente, ocurre una disminución en la INa, la cual es simultánea a la disminución de la corriente positiva de entrada del calcio (ICaL) y en consecuencia aumento del Ito de la célula cardiaca; estos cambios alteran el potencial de acción de membrana de la célula, y se traducen en una depresión o pérdida de la cúpula de dicho potencial en el epicardio ventricular (gráficamente se expresa mediante una pronunciación de la muesca del final de la fase 1) que con electrocardiografía se dilucida como una elevación del ST por la diferencia de potenciales que se genera entre las paredes del mismo ventrículo. La disminución de este potencial de acción es el principal promotor de las actividades arritmogénicas en la conductancia cardiaca y algunos estudios reportan un nivel de -30 mV como punto gatillo que permite la reentrada a nivel de la fase 2 de nuevos potenciales de acción. Sumado a esto, se genera un gradiente de voltaje transmural responsable del retraso de la fase 2 del epicardio ventricular que se traduce por la inversión de la onda T, como se observa en el PETB-1 (Figura 5) (25, 26).
A pesar de la asociación genotípica-fenotípica con el gen SCN5A como principal promotor de dicha entidad por estudios de análisis moleculares y ensayos clínicos, con la identificación de múltiples mutaciones en diferentes regiones de éste (21, 27-36) sólo se ha visto su relación con el síndrome en 18% a 30% de los casos ya reportados (20). De igual forma, en otros estudios se evidencia la relación del síndrome de Brugada con otras alteraciones, como es el caso del defecto del gen relacionado con la glicerol-3-fosfato deshidrogenasa tipo 1 (GPD1-L, por sus siglas en inglés) (37) y otras mutaciones relacionadas con los genes CACNA1c y CACNB2b que codifican para las subunidades de los canales de calcio cardiacos (38), abriendo un campo nuevo para investigaciones futuras.
Sin ser menor la información científica que no es afín con la patogenia desde el punto de vista genético, se han publicado reportes de casos y ensayos clínicos en pro de la asociación de niveles altos de testosterona en sangre con los patrones electrocardiográficos observados en este síndrome, lo que se ha relacionado principalmente en aquellos pacientes con cáncer de próstata (39), en quienes se reporta la desaparición de dicho fenotipo luego de la castración quirúrgica sin prostatectomía (40) y en otros de la castración hormonal, dando más fuerza a la posible asociación entre el cáncer de próstata y el síndrome de Brugada dados los altos niveles de testosterona que poseen estos pacientes. Este hecho ha sido analizado por otros investigadores quienes concluyen que la testosterona aumenta el Ito y disminuye el ICaL por acción directa sobre los canales de los miocardiocitos (41-43), que dan certeza de la información encontrada en los estudios clínicos. De igual forma, este hecho alude a una posible explicación de la mayor prevalencia de dicho síndrome entre la población masculina (44).
Cabe añadir que, en controversia con el paradigma que alude dicho síndrome como una patología no estructural, se reportan hallazgos histopatológicos en dieciocho pacientes con síndrome de Brugada, lo que permite pensar en posibles asociaciones estructurales de causas ambientales o inflamatorias como desencadenantes del mismo (45).
Manifestaciones clínicas
La mayoría de los pacientes con síndrome de Brugada permanecen asintomáticos; sin embargo, aquellos que manifiestan la enfermedad, lo hacen a través de síncopes y muerte súbita, o ambos, debidos a alteraciones arritmogénicas como taquicardia ventricular polimórfica y/o fibrilación ventricular que ocurren con mayor frecuencia en la cuarta década de la vida y en reposo o durante el sueño (16, 18, 20, 26). Se reporta mayor vulnerabilidad para desarrollar fibrilación auricular espontánea o inducida y arritmias supraventriculares asociadas con palpitaciones y mareo en 20% de los pacientes (47). Alrededor de 22% de los pacientes tienen antecedente de síncopes y/o muerte súbita (48). Otros síntomas de menor frecuencia incluyen ataques convulsivos con agitación y en raros casos puede haber pérdida del control urinario de la vejiga y pérdida anterógrada de la memoria (por la hipoxia cerebral) (49). Las respiraciones agónicas (principalmente durante el sueño por descarga vagal nocturna) (50), hacen referencia al término descrito en el suroeste asiático: "síndrome de la muerte súbita nocturna inexplicada" que luego de estudios clínicos, electrocardiográficos y genéticos, se incluyó dentro del síndrome de Brugada (51).
Varios estudios indican la asociación de ciertas entidades que pueden inducir la aparición de los cambios electrocardiográficos de un paciente con Brugada (Tabla 3). De éstos cabe resaltar que algunos medicamentos como los bloqueadores de los canales de sodio, entre los cuales se resaltan la procainamida, la flecainida o la ajmalina (con mejor evidencia para esta última), desenmascaran los síntomas y signos electrocardiográficos característicos de esta entidad, lo que convierte a estos fármacos en una herramienta importante para esclarecer el diagnóstico en pacientes cuyos hallazgos en el electrocardiograma no son contundentes (52-54).

Estratificación del riesgo
El riesgo de muerte súbita en los pacientes con síndrome de Brugada difiere según la presencia o no de factores de riesgo. Por tal razón es importante estratificar y conocer los factores de riesgo de manera individual en cada paciente, para conocer su pronóstico y ejecutar de manera individualizada un tratamiento adecuado. El segundo consenso sobre la conferencia acerca del síndrome de Brugada (20) reporta unos factores de riesgo según un estudio realizado en 2003 (55) por los hermanos Brugada, de lo que se concluye que:
- Todos los pacientes con síndrome de Brugada tienen alto riesgo relativo de muerte súbita por arritmias, incluso en ausencia de historia personal de paro cardiaco.
- Aquellos pacientes con patrón electrocardiográfico Brugada tipo-1 espontáneo, tienen 7,7 veces mayor riesgo de desarrollar un evento arrítmico durante su vida, en comparación con aquellos individuos en quienes el diagnóstico se hace por desenmascaramiento con bloqueadores de los canales de sodio.
- El género masculino tiene riesgo de 5,5 veces mayor para muerte súbita que el género femenino.
- La inducción de arritmia ventricular sostenida por medio de estimulación eléctrica programada, es un marcador de alto riesgo para muerte súbita, aumentando en ocho veces esta proporción.
Como nuevos aportes de la literatura, algunos estudios demuestran que la elevación de la onda J > 0,16 mV en -2 V2 (V2 en el segundo espacio intercostal) puede ser un predictor de la respuesta tipo Brugada al reto con bloqueadores de canales de sodio en quienes se sospecha tener el síndrome en el electrocardiograma de base (52, 56). De igual forma, el QRS-f (QRS fragmentado), comprendido como el resultado de anormalidades en la conducción ventricular que se manifiestan electrocardiográficamente como múltiples espigas dentro del complejo QRS, se ha postulado como un predictor de alto riesgo de arritmias ventriculares (especialmente la fibrilación ventricular) espontáneas y de síncope, en los pacientes con síndrome de Brugada (57).
Tratamiento
El manejo de elección es el implante de un cardiodesfibrilador (26). El ACC en asociación con la AHA publicaron en 2008 las indicaciones de la implantación de cardiodesfibrilador que se clasifican en tres categorías (58) de las cuales la clase 1 es la que explica el manejo de estos pacientes:
- Clase I: pacientes con muerte súbita debida a fibrilación ventricular o taquicardia ventricular polimórfica no consecuente a causa reversible o transitoria.
Adicionalmente, se sugiere el uso de anti-arrítmicos como prevención de la aparición de las arritmias típicas del síndrome de Brugada (taquicardia y fibrilación ventricular) (20), siempre y cuando la frecuencia e intensidad de aparición de éstas no se consideren como mortales para el paciente pues de lo contrario se optaría por implantársele un cardiodesfibrilador. En quienes no está indicada la implantación del cardiodesfribrilador (pacientes pediátricos), o en quienes es difícil el acceso a este tipo de dispositivos, se utiliza quinidina (59) (anti-arrítmico Clase Ia), b-agonistas (isoproterenol) y aun en discusión, inhibidores de la fosfodiesterasa III (cilostazol), pues algunos estudios muestran su eficacia (60) mientras que otros la refutan (61).
Discusión
Pese a que ya se han definido muchas de las características clínico-electrocardiográficas y genéticas del síndrome, aun persisten dificultades en su diagnóstico, ya sea por la gran variabilidad en su presentación clínica y electrocardiográfica, como por el gran desconocimiento en el ámbito médico.
Es necesario que el profesional de la salud tenga un conocimiento claro acerca de la fisiopatología y de las manifestaciones clínicas de esta entidad, ya que por su presentación, se convierte en diagnóstico diferencial de enfermedades de común aparición en la práctica médica, tales como infarto agudo del miocardio, síncopes mediados neuralmente, pericarditis, entre otros; que aunque son diagnósticos que se sospechan inicialmente y que deben ser descartados en primera instancia, no deben ser una máscara que oculte el diagnóstico del síndrome ya que se trata de una enfermedad potencialmente fatal por lo cual el paciente debe ser intervenido en un momento adecuado, y su incidencia viene en aumento desde su descripción inicial debido al mayor conocimiento de la enfermedad en el ámbito médico.
El caso que se presenta corresponde al de un paciente con patrón electrocardiográfico Brugada tipo-2 con diagnóstico de síncope neurocardiogénico y antecedentes familiares de posible síndrome de Brugada no confirmado, caso similar a los que se reportan en la literatura médica revisada, en la cual se encuentran casos de pacientes con síndrome de Brugada que previamente tenían diagnóstico de otras enfermedades como: hipersensibilidad del seno carotídeo (62), síndrome de Wolff-Parkinson-White (WPW) (63), síncope mediado neuralmente (64, 65), hipotermia (66) e infarto agudo del miocardio (67), entre otros. Estos hallazgos permiten plantear la posibilidad de co-existencia de otras patologías con el síndrome de Brugada, así como también es posible pensar que se podría estar diagnosticando de manera errónea o subdiagnosticando a algunos pacientes con éste y por lo tanto se debería considerar que en quienes se sospeche el síndrome sea pertinente realizar pruebas diagnósticas apropiadas y específicas.
En contraparte a lo anterior, existe evidencia de mayor soporte científico en un estudio de cohorte que involucró dieciocho personas con rasgos electrocardiográficos compatibles con Brugada a quienes se les hizo seguimiento entre 10 y 21 años con monitorización de aparición de taquicardia ventricular, fibrilación ventricular, episodios de síncope o muerte en el cual concluyen que pacientes asintomáticos, sin antecedentes familiares de muerte súbita, el patrón electrocardiográfico Brugada tipos-2 y 3 son una variación corriente y no representan ninguna anormalidad que amenace la vida del paciente (5). Proyectando esta información al caso presentado, se podría argumentar, que aunque es posible la coexistencia de alguna otra entidad, no es indispensable profundizar en la evaluación y/o manejo de un paciente con PETB-2 pues la evidencia científica demuestra que este hallazgo es benigno y por lo tanto cuenta con poco potencial de mortalidad.
Finalmente, la posición del médico tratante debe basarse en la clínica del paciente, lo que permitirá un mejor abordaje y manejo del paciente y contribuirá a mejorar su calidad de vida, haciendo énfasis en la decisión de realizar pruebas confirmatorias o asumir una conducta expectante e individualizada, en la que se sopesen el riesgo/beneficio que estas conductas conllevan para el paciente.
Agradecimientos
Al Doctor Carlos José Jaramillo por estimular nuestro espíritu investigativo para la generación de conocimiento a través de su apoyo imparcial. También al paciente y a su familia por su colaboración, la cual permitió la complementación del artículo.
Bibliografía
1. Brugada P, Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome. A multicenter report. J Am Coll Cardiol 1992; 20 (6): 1391-6. [ Links ]
2. Pérez Riera AR, Filho CF, Uchida AH, et al. Study of the extent of the information of cardiologists from São Paulo city, Brazil, regarding a low-prevalence entity: Brugada syndrome. Ann Noninvasive Electrocardiol 2008; 13 (4): 352-63. [ Links ]
3. Oe H, Tagaki M, Tanaka A, et al. Prevalence and clinical course of the juveniles with Brugada-type ECG in japanese population. Pacing Clin Electrophysiol 2005; 28 (6): 549-54. [ Links ]
4. Letsas KP, Gavrielatos G, Efremidis M, et al. Prevalence of Brugada sign in a Greek tertiary hospital population. Europace 2007; 9 (11): 1077-80. [ Links ]
5. Junttila MJ, Raatikainen MJ, Karjalainen J, Kauma H, Kesäniemi YA, Huikuri HV. Prevalence and prognosis of subjects with Brugada-type ECG pattern in a young and middle-aged Finnish population. Eur Heart J 2004; 25 (10): 874-8. [ Links ]
6. Gallagher MM, Forleo GB, Behr ER, et al. Prevalence and significance of Brugada-type ECG in 12,012 apparently healthy European subjects. Int J Cardiol 2008; 130 (1): 44-8. [ Links ]
7. Ito H, Yano K, Chen R, He Q, Curb JD. The prevalence and prognosis of a Brugada-type electrocardiogram in a population of middle-aged japanese-american men with follow-up of three decades. Am J Med Sci 2006; 331 (1): 25-9. [ Links ]
8. Miyasaka Y, Tsuji H, Yamada K, et al. Prevalence and mortality of the Brugada-type electrocardiogram in one city in japan. J Am Coll Cardiol 2001; 38 (3): 771-4. [ Links ]
9. Abrego HV, Suárez R, Sandoval AE. Prevalencia de patrones electrocardiográficos tipo Brugada en un centro de monitoreo cardíaco transtelefónico en El Salvador. Rev Costarr Cardio 2006; 8 (2): 13-17. [ Links ]
10. Donohue D, Tehrani F, Jamehdor R, Lam C, Movahed MR. The prevalence of Brugada ECG in adult patients in a large university hospital in the western United States. Am Heart Hop J 2008; 6 (1): 48-50. [ Links ]
11. Blangy H, Sadoul N, Coutelour JM, et al. Prevalence of Brugada syndrome among 35,309 inhabitants of Lorraine screened at a preventive medicine centre. Arch Mal Coeur Vaiss 2005; 98 (3): 175-80. [ Links ]
12. Yoshinaga M, Anan R, Nomura Y, et al. Prevalence and time of appearance of Brugada electrocardiographic pattern in young male adolescents from a three-year follow-up study. Am J Cardiol 2004; 94 (9): 1186-9. [ Links ]
13. Greer RW, Glancy DL. Prevalence of the Brugada electrocardiographic pattern at the Medical Center of Louisiana in New Orleans. State Med Soc 2003; 155 (5): 242-6. [ Links ]
14. Gervacio-Domingo G, Isidro J, Tirona J, et al. The Brugada type 1 electrocardiographic pattern is common among Filipinos. J Clin Epidemiol 2008; 61 (10): 1067-72. [ Links ]
15. Hermida JS, Lemoine JL, Aoun FB, Jarry G, Rey JL, Quiret JC. Prevalence of the Brugada syndrome in an apparently healthy population. Am J Cardiol 2000 1; 86 (1): 91-4. [ Links ]
16. Napolitano C, Priori SG. Brugada syndrome. Orphanet J Rare Dis 2006; 1 (35): 1-6. [ Links ]
17. Littmann L, Monroe MH. The Brugada numbers. Circulation 2003; 107 (18): e122. [ Links ]
18. Wilde AA, Antzelevitch C, Borggrefe M, et al. Proposed diagnostic criteria for the Brugada syndrome: consensus report. Circulation 2002; 106 (19): 2514-9. [ Links ]
19. Allocca G, Proclemer A, Nucifora G, Dall'Armellina E, Rebellato L. Monomorphic ventricular tachycardia in Brugada syndrome: clinical case and literature review. J Cardiovascu Med (Hagerstown) 2008; 9 (8): 842-6. [ Links ]
20. Antzelevitch C, Brugada P, Borggrefe M, et al. Brugada syndrome: report of the second consensus conference: endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation 2005; 11 (5): 659-70. [ Links ]
21. Chen Q, Kirsch GE, Zhang D, et al. Genetic basis and molecular mechanism for idiopathic ventricular fribrillation. Nature 1998; 392 (6673): 293-6. [ Links ]
22. George AL Jr. Inherited disorders of voltage-gated sodium channels. J Clin Invest 2005; 115: 1990-1999. [ Links ]
23. Li R, Tomaselli G, Marbin E. Sodium Channels. In: Zipes D, Jalife J., editors. Cardiac Electrophysiology, From Cell to beside. Fourth Edition ed. Saunders; 2004. p. 1-8. [ Links ]
24. Balser J. Biophysics of cardiac ion chanel function. In: Zipes D, Jalife J., editors. Cardiac Electrophysiology, From Cell to beside. Fourth Edition ed. Saunders; 2004. p. 77-83. [ Links ]
25. Ohkubo K, Watanabe I, Okumura Y, Ashino S, Kofune M, Ohta M, et al. Surface ECG characteristics of ventricular tachyarrhythmias before degenaration into ventricular fibrilation in patients with Brugada-type ECG. Int heart J 2009; 50: 477-487. [ Links ]
26. Benito B, Brugada J, Brugada R, Brugada P. Brugada syndrome. Rev Esp Cardiol 2009; 62 (11): 1297-315. [ Links ]
27. Itoh H, Sakaguchi T, Ashihara T, et al. A novel KCNH2 mutation as a modifier for short QT interval. Int J Cardiol 2009; 137 (1): 83-5. [ Links ]
28. Márquez MF, Cruz-Robles D, Inés-Real S, et al. A novel SCN5A deletion mutation in a child with ventricular tachycardia, recurrent aborted sudden death, and Brugada electrocardiographic pattern. Arch Cardiol Mex 2007; 77 (4): 284-7. [ Links ]
29. Makita N, Mochizuki N, Tsutsui H. Absence of a trafficking defect in R1232W/T1620M, a double SCN5A mutant responsible for Brugada syndrome. Circ J 2008; 72 (6): 1018-9. [ Links ]
30. Cordeiro JM, Barajas-Martinez H, Hong K, et al. Compound heterozygous mutations P336L and I1660V in the human cardiac sodium channel associated with the Brugada syndrome. Circulation 2006; 114 (19): 2026-33. [ Links ]
31. Vorobiof G, Kroening D, Hall B, Brugada R, Huang D. Brugada syndrome with marked conduction disease: dual implications of a SCN5A mutation. Pacing Clin Electrophysiol 2008; 31 (5): 630-4. [ Links ]
32. Frigo G, Rampazzo A, Bauce B, et al. Homozygous SCN5A mutation in Brugada syndrome with monomorphic ventricular tachycardia and structural heart abnormalities. Europace 2007; 9 (6): 391-7. [ Links ]
33. Mohler PJ, Rivolta I, Napolitano C, et al. Nav1.5 E1053K mutation causing Brugada syndrome blocks binding to ankyrin-G and expression of Nav1.5 on the surface of cardiomyocytes. Proc Natl Acad Sci U S A 2004; 101 (50): 17533-8. [ Links ]
34. Makita N, Sumitomo N, Watanabe I, Tsutsui H. Novel SCN5A mutation (Q55X) associated with age-dependent expression of Brugada syndrome presenting as neurally mediated syncope. Heart Rhythm 2007; 4 (4): 516-9. [ Links ]
35. Watanabe H, Koopmann TT, Le Scouarnec S, et al. Sodium channel beta1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest 2008; 118 (6): 2260-8. [ Links ]
36. Weiss R, Barmada MM, Nguyen T, et al. Clinical and molecular heterogeneity in the Brugada syndrome: a novel gene locus on chromosome 3. Circulation 2002; 105 (6): 707-13. [ Links ]
37. London B, Michalec M, Mehdi H, et al. Mutation in glycerol-3-phosphate dehydrogenase 1 like gene (GPD1-L) decreases cardiac Na+ current and causes inherited arrhythmias. Circulation 2007; 116 (20): 2260-8. [ Links ]
38. Antzelevitch C, Pollevick GD, Cordeiro JM, et al. Loss-of-function mutations in the cardiac calcium channel underlie a new clinical entity characterized by ST-segment elevation, short QT intervals, and sudden cardiac death. Circulation 2007; 115 (4): 442-9. [ Links ]
39. Haruta D, Matsuo K, Ichimaru S, Soda M, Hida A, Sera N, et al. Men with Brugada-like electrocardiogram have higher risk of prostate cancer. Circ J 2009; 73 (1): 63-8. [ Links ]
40. Matsuo K, Akahoshi M, Seto S, Yano K. Disappearance of the Brugada-type electrocardiogram after surgical castration: A role for testosterone and an explanation for the male preponderance. Pacing Clin Electrophysiol 2003; 26: 1551-3. [ Links ]
41. Shuba YM, Degtiar VE, Osipenko N, Naidenov VG, Woosley RL. Testosterone-mediated modulation of HERG blockage by proarrhythmic agents. Biochem Pharmacol 2001; 62: 41-9. [ Links ]
42. Liu XK, Katchman A, Whitfield BH, Wan G, Janowski EM, Woosley RL. In vivo androgen treatment shortens the QT interval and increases the densities of inward and delayed rectifier potassium current in orchiectomized male rabbits. Cardiovasc Res 2003; 57: 28-36. [ Links ]
43. Bai CX, Kurosawa J, Tamagawa M, Nakaya H, Fukukawa T. Nontranscriptional regulation of cardiac repolarization currents by testosterone. Circ J 2005; 112: 1701-10. [ Links ]
44. Shimizu W, Matsuo K, Kokubo Y, Satomi K, Kurita T, Noda T. Sex hormone and gender difference-role of testosterone on male predominance in Brugada syndrome. J Cardiovasc Electrophysiol 2007; 18: 415-21. [ Links ]
45. Frustaci A, Priori SG, Pieroni M, et al. Cardiac histological substrate in patients with clinical phenotype of Brugada syndrome. Circulation 2005; 112 (24): 3680-7. [ Links ]
46. Benito B, Brugada R, Brugada J, Brugada P. Brugada syndrome. Prog Cardiovasc Dis 2008; 51 (1): 1-22. [ Links ]
47. Eckardt L, Kirchhof P, Loh P, et al. Brugada syndrome and supraventricular tachyarrhythmias: a novel association? J Cardiovasc Electrophysiol 2001; 12 (6): 680-5. [ Links ]
48. Alings M, Wilde A. "Brugada" syndrome: clinical data and suggested pathophysiological mechanism. Circulation 1999; 99 (5): 666-73. [ Links ]
49. Brugada P, Brugada R, Antzelevitch C, Brugada J. The Brugada syndrome. Arch Mal Coeur Vaiss 2005; 98 (2): 115-22. [ Links ]
50. Mizumaki K, Fujiki A, Tsuneda T, et al. Vagal activity modulates spontaneous augmentation of ST elevation in the daily life of patients with Brugada syndrome. J Cardiovasc Electrophysiol 2004; 15 (6): 667-73. [ Links ]
51. Vatta M, Dumaine R, Varghese G, et al. Genetic and biophysical basis of sudden unexplained nocturnal death syndrome (SUNDS), a disease allelic to Brugada syndrome. Hum Mol Genet 2005; 11 (3): 337-45. [ Links ]
52. Abud A, Bagattin D, Lujan O, Birollo O, Lovecchio J. Detección de un síndrome de Brugada en las derivaciones precordiales altas del electrocardiograma de doce derivaciones. Rev Fed Arg Cardiol 2003; 32: 107-9. [ Links ]
53. Civetta MM, Moro SM, Chiale PA, Elizari MV, Escobar JR, Sicouri SJ. El efecto preferencial de la ajmalina sobre el epicardio ventricular derecho canino puede explicar las manifestaciones electrocardiográficas del síndrome de Brugada. Rev Fed Arg Cardiol 2002; 70: 118-25. [ Links ]
54. Katsuyuki T, Hidetaka O, Shinhiro T, Keiji T, Atsuhiro S. Unmasking of Brugada syndrome by an antiarrhythmic drug in a patient with septic shock. J Anesth Analg 2006; 102: 233-6. [ Links ]
55. Brugada J, Brugada R, Brugada P. Determinants of sudden cardiac death in individuals with the electrocardiographic pattern of Brugada syndrome and no previous cardiac arrest. Circulation 2003; 108 (25): 3092-6. [ Links ]
56. Hermida JS, Denjoy I, Jarry G, Jandaud S, Bertrand C, Delonca J. Electrocardiographic predictors of Brugada type response during Na channel blockade challenge. Europace 2005; 7: 447-53. [ Links ]
57. Morita H, Kusano KF, Miura D, Nagase S, Nakamura K, Morita ST, et al. Fragmented QRS as a marker of conduction abnormality and a predictor of prognosis of Brugada syndrome. Circ J 2008; 118: 1697-704. [ Links ]
58. Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices) developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 51 (21): e1-62. [ Links ]
59. Belhassen B, Glick A, Viskin S. Efficacy of quinidine in high-risk patients with Brugada syndrome. Circulation 2004; 110 (13): 1731-7. [ Links ]
60. Tsuchiya T, Ashikaga K, Honda T, Arita M. Prevention of ventricular fibrillation by cilostazol, an oral phosphodiesterase inhibitor, in a patient with Brugada syndrome. J Cardiovasc Electrophysiol 2002; 13 (7): 698-701. [ Links ]
61. Abud A, Bagattin D, Goyeneche R, Becker C. Failure of cilostazol in the prevention of ventricular fibrillation in a patient with Brugada syndrome. J Cardiovasc Electrophysiol 2006; 17 (2): 210-2.62. [ Links ]
62. Benito B, Brugada J. Recurrent syncope: an unusual presentation of Brugada syndrome. Nat Clin Pract Cardiovasc Med 2006; 3 (10): 573-7. [ Links ]
63. Bodegas AI, Arana JI, Vitoria Y, Arriandiaga JR, Barrenetxea JI. Brugada syndrome in a patient with accessory pathway. Europace 2002; 4 (1): 87-9. [ Links ]
64. Letsas KP, Efremidis M, Gavrielatos G, Filippatos GS, Sideris A, Kardaras F. Neurally mediated susceptibility in individuals with Brugada-Type ECG pattern. Pacing Clin Electrophysiol 2008; 31 (4): 418-21. [ Links ]
65. Nomura M, Nada T, Endo J, Kondo Y, Yukinaka M, Saito K, et al. Brugada syndrome associated with an autonomic disorder. Heart 1998; 80 (2): 194-6. [ Links ]
66. Ortega-Carnicer J, Benezet J, Calderón-Jiménez P, Yanes-Martín J. Hypothermia-induced Brugada-like electrocardiogram pattern. J Electrocardiol 2008; 41 (6): 690-2. [ Links ]
67. Gallahue FE, Uzgiris R, Burke R, Abrahams W. Brugada syndrome presenting as an "acute myocardial infarction". J Emerg Med 2009; 37(1): 15-20. [ Links ]














