Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colom. Cardiol. vol.17 no.4 Bogota July/Aug. 2010
Institución donde se reporta el caso clínico: Clínica Cardiovascular Santa María.
(1) Clínica Cardiovascular Santa María. Medellín - Colombia.
(2) Universidad Pontificia Bolivariana. Medellín - Colombia.
(3) Universidad de Antioquia. Medellín - Colombia.
Correspondencia: Carolina Gómez López de Mesa. Carrera 80a No. 34-36 interior 506, Medellín. UCI pediátrica. Medellín, Colombia. Teléfono: (57-4) 2504742. Celular: 3136789933. Correo electrónico: carogldm@hotmail.com
Recibido: 20/11/2008. Aceptado: 03/06/2010.
El quilopericardio constituye una complicación rara de la cirugía de defectos cardíacos congénitos. Es causada por la obstrucción mecánica del drenaje del conducto torácico o sus tributarios linfáticos en la vena subclavia o por daño quirúrgico.
Se reporta el caso de un paciente de dos meses de vida con diagnóstico de ventrículo izquierdo hipoplásico, en quien se encontró quilopericardio posterior a dos intervenciones quirúrgicas, y recibió tratamiento exitoso con drenaje pericárdico y sustitución de las grasas de la dieta por triglicéridos de cadena media.
PALABRAS CLAVE: quilopericardio, conducto torácico, cirugía cardiaca, triglicéridos de cadena media, taponamiento cardiaco.
Chylopericardium is a rare complication after congenital heart disease surgery. It is caused by mechanical obstruction of the thoracic duct drainage or its lymphatic tributaries to the subclavian vein or by direct surgical injury.
We report the case of a two month-old boy with hypoplastic left ventricle diagnosis who developed chylopericardium secondary to two cardiac surgeries and who underwent a successful pericardial drainage procedure. Dietary fats were substituted by medium chain triglycerides.
KEY WORDS: chylopericardium, thoracic duct, cardiac surgery, medium chain triglycerides, cardiac tamponade.
Introducción
La acumulación de quilo en el espacio pericárdico, denominada quilopericardio, constituye una complicación rara de la cirugía de defectos cardiacos congénitos en los niños. Fue descrita por primera vez in vivo en 1966 (1), aunque ya había sido reportada por Hasebrock en una autopsia realizada en 1888. Son pocos los casos que se describen en la literatura médica, y se reporta una incidencia entre 0,01% y 0,22% (2, 3).
Se cree que el quilopericardio primario, menos frecuente que el secundario, se debe a una conexión anómala entre el conducto torácico y los linfáticos pericárdicos, con consecuente hipertensión linfática e incremento de la permeabilidad linfática (4).
Se dice que el quilopericardio secundario se asocia con linfangioma congénito, neoplasias mediastinales, higroma quístico, trombosis de la vena subclavia, radiación, trauma y cirugía torácica; sin embargo, la principal asociación es con la cirugía cardiaca. El mecanismo principal corresponde a una obstrucción mecánica del drenaje del conducto torácico o sus tributarios linfáticos en la vena subclavia, por daño quirúrgico o traumático, o bloqueo por neoplasias, tuberculosis o linfangiomatosis congénita (5). La fisiopatología común a todas esas condiciones parece ser la obstrucción del conducto torácico sin el desarrollo de drenaje (6). Normalmente, el sistema linfático drena el quilo, el cual es filtrado por los capilares del espacio intersticial en el conducto torácico.
El sistema linfático
Está constituido por vasos, ganglios y tejido linfático. Cumple tres funciones básicas: mantener el equilibrio osmolar en el tercer espacio, contribuir a formar y activar el sistema inmunológico, y recolectar el quilo a partir del contenido intestinal (producto con alto contenido de grasas). El sistema linfático puede considerarse como colateral al sistema cardiovascular, dispuesto en forma paralela y que también transporta líquidos a través de una red vascular. La mayoría de los tejidos están en contacto con la linfa, a excepción del cerebro, que carece de vasos linfáticos.
Los capilares linfáticos se encuentran en contacto con las células, poseen paredes permeables para permitir el paso de moléculas que no serían reabsorbidas por el capilar venoso (como por ejemplo las proteínas), no poseen válvulas y es a través de ellos que la linfa entra en el sistema linfático. Alrededor de una décima parte del líquido penetra en los capilares linfáticos, en lugar de volver a la sangre a través de los capilares venosos.
La unión de múltiples capilares linfáticos da origen a estructuras de mayor diámetro, los vasos linfáticos. Su estructura es muy similar a las venas, a diferencia que poseen paredes más delgadas y numerosas válvulas que evitan el retroceso de la linfa. Los vasos linfáticos son los encargados de transportar la linfa desde el intersticio hacia la vena cava superior; éstos confluyen para terminar en dos grandes conductos: el torácico y el linfático derecho. El primero es el principal tronco colector del sistema linfático, se inicia en la cisterna de Pecket (cisterna del quilo), que se sitúa entre la aorta y la columna vertebral (décima-segunda vértebra torácica y la primera vértebra lumbar), se dirige hacia arriba, atraviesa el tórax y termina en la vena subclavia izquierda, cerca de la unión de dicho vaso con la vena yugular interna. El conducto linfático derecho es de menor tamaño y desemboca en la vena subclavia derecha (Figura 1).
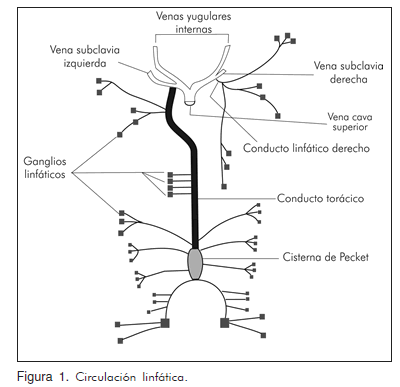
Los ganglios o nódulos linfáticos se intercalan en el recorrido de los vasos linfáticos. La linfa llega a los ganglios por los vasos aferentes, y sale del mismo por vasos eferentes. Éstos se localizan en cabeza, cuello, extremidades, tórax, abdomen y pelvis. Están rodeados por una cápsula externa de tejido conectivo. En su interior tienen una corteza con folículos linfoides primarios que se transforman en secundarios ante la presencia de cualquier agente invasor. Poseen un centro germinal que contiene abundantes linfocitos B, y la paracorteza que es rica en linfocitos T. En la zona central del ganglio se encuentra la médula a donde llega la linfa luego de atravesar las trabéculas; ésta contiene macrófagos y linfocitos T y B. La principal función de los ganglios linfáticos es la producción y maduración de linfocitos para la formación de anticuerpos. Esos linfocitos son incorporados a la linfa cuando ésta llega al ganglio por vía aferente. Otra función importante de los nódulos linfáticos es filtrar y destruir elementos extraños que llegan vía aferente, como partículas, células tumorales, restos de tejidos y micro-organismos.
El quilo es una sustancia heterogénea, de color amarillento, que circula por el interior de los vasos linfáticos. Puede considerarse como una mezcla de filtrado capilar y de líquido intersticial que ha penetrado en los capilares linfáticos. Está compuesta en 90% por agua, sales, glucosa, algunos glóbulos blancos, pocas proteínas, dióxido de carbono, bajas concentraciones de oxígeno y sustancias de desecho celulares.
El daño directo del conducto torácico resulta más frecuentemente en quilotórax que en quilopericardio, ya que éste se encuentra en la región de la aorta descendente; el trauma directo en un procedimiento intrapericárdico es inusual (7).
A continuación se reporta el caso de un paciente de dos meses de vida que presentó quilopericardio posterior a cirugía cardiovascular.
Caso clínico
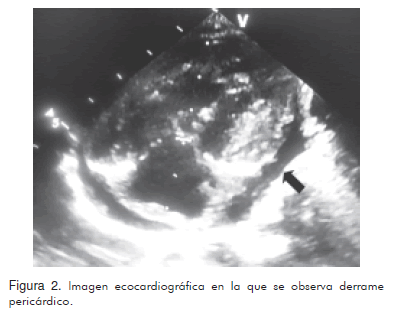
Recién nacido de término quien a los quince días de vida se tornó cianótico con quejido y taquipnea. Se encontró saturación de oxígeno de 66%, taquicardia, polipnea e hipotensión. No se auscultó soplo. Se inició prostaglandina E1 y se realizó ecocardiografía que reportó doble tracto de salida del ventrículo derecho con ventrículo izquierdo hipoplásico, atresia mitral, comunicación interventricular perimembranosa subaórtica y comunicación interauricular restrictiva. Presentó sepsis neonatal, con marcado deterioro clínico y desaturación, con lo cual requirió inicio de ventilación mecánica y atrioseptostomía con balón urgente. Los hemocultivos fueron positivos para Enterococo faecalis. Recibió piperacilina/tazobactam durante diez días y tuvo una adecuada respuesta clínica, por lo cual, siete días después se realizó exitosamente cerclaje pulmonar bilateral con implantación de stent por abordaje percutáneo. Fue dado de alta en condiciones aceptables y con tratamiento farmacológico. Al mes siguiente se le practicó ecocardiografía donde se encontró derrame pericárdico de 11,5 x 8 mm (Figura 2) que causaba colapso de la aurícula derecha con signos de taponamiento cardíaco.
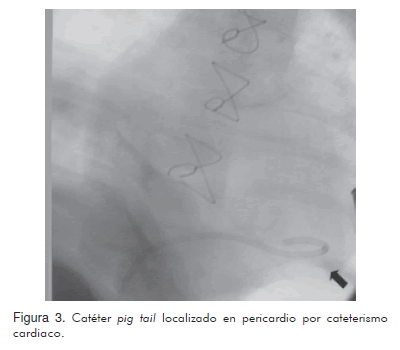
Se realizó pericardiocentesis guiada por ecocardiografía, obteniéndose líquido pericárdico lechoso con grasa, compatible con quilo, con triglicéridos de 1.858 mg/dL, leucocitos 6.320/mm3, linfocitos 98%, neutrófilos 2% y pH 7,5. Se inició tratamiento para quilopericardio con dieta rica en triglicéridos de cadena media (monogen). A las 48 horas se realizó control ecocardiográfico donde se evidenció aumento del derrame pericárdico (10 x 14 mm cardiaco y 26 mm retrocardiaco), por lo que fue necesario realizar nuevo drenaje con colocación de catéter pig tail (Figura 3), el cual drenó inicialmente 50 mL de quilo. Los días posteriores disminuyó progresivamente el volumen drenado, siendo 35 mL al segundo día, 26 mL en el tercero, 17 mL al cuarto y 12 mL al quinto. Así, se logró retirar el dren al sexto día luego de resolver el derrame. Se completaron seis semanas de dieta con triglicéridos de cadena media sin recurrencia del derrame ni complicación adicional.
Discusión
A pesar de que la la cirugía cardiaca es la causa principal de quilopericardio secundario, la presencia de éste como complicación de la cirugía cardiovascular es rara (8) y se relaciona con la manipulación quirúrgica de los linfáticos pericárdicos. Los linfáticos de los órganos intratorácicos tienen drenaje en el conducto torácico; el corazón lo hace a través de dos principales vías de drenaje: el tronco linfático derecho e izquierdo. El derecho drena la linfa del ventrículo derecho y pasa entre el tronco pulmonar y aórtico. No está clara la relación entre la hipertensión pulmonar y la obstrucción venosa pulmonar con el quilopericardio, sin embargo, datos experimentales sugieren que se debe a incremento del flujo linfático pulmonar y por el drenaje compartido en los nódulos linfáticos traqueobronquiales de la linfa del pericardio posterior y lateral con la linfa de los pulmones, presentándose una acumulación excesiva de quilo en dichos nódulos en la hipertensión pulmonar, que predispone a su ruptura durante la manipulación quirúrgica (7-9). La mayoría de los casos se atribuye finalmente a microperforaciones en el conducto torácico (10).
La forma más frecuente de presentación es la de un paciente asintomático, como el caso que se presenta, sin embargo puede manifestarse por tos, disnea y fatigabilidad. La radiografía de tórax es el paso inicial en el diagnóstico, ya que puede mostrar aumento del tamaño de la silueta cardiaca. La ultrasonografía cardiaca, dentro del estudio de la cardiomegalia, confirma la presencia de líquido pericárdico, y la tomografía sería útil para excluir una masa como causa de la obstrucción del conducto torácico, además de delinear el trayecto del conducto torácico con una posible comunicación anormal entre éste y la cavidad pericárdica al combinarse con la linfangiografía (4).
El tratamiento conservador del quilopericardio se realiza con dieta hipograsa, utilizando triglicéridos de cadena media, cuya absorción se lleva a cabo por vía de la vena porta y no por la vía de los vasos linfáticos, como sucede con los de cadena (11).
Generalmente, el quilopericardio puede manejarse con éxito mediante tratamiento nutricional (dieta a base de triglicéridos de cadena media) y pericardiocentesis percutánea. Los casos refractarios que requieran ligadura del conducto torácico son excepcionales; sin embargo, en pacientes con drenajes prolongados se han descrito derivaciones pericardio-peritoneales y reemplazo de la alimentación enteral por nutrición parenteral total como alternativa de tratamiento (2). Uno de los diagnósticos diferenciales principales es el síndrome post-pericardiotomía, el cual responde al tratamiento con ácido acetil salicílico a diferencia del quilopericardio.
En resumen, el quilopericardio es una patología rara en la población pediátrica, que, no obstante, debe incluirse dentro del diagnóstico diferencial de los pacientes con cardiomegalia. El paciente debe recibir evaluación oportuna a fin de prevenir complicaciones serias como taponamiento cardíaco o alteraciones metabólicas e inmunes, iniciando con medidas conservadoras como la restricción dietética y el drenaje percutáneo, llegando hasta el drenaje quirúrgico o la ligadura del conducto torácico en los casos de difícil control. Independientemente del tipo de drenaje usado, el tratamiento de esta entidad médica benigna debe acompañarse por tiempo prolongado, por lo menos seis semanas, de la dieta mencionada, bien sea enteral o parenteral.
Bibliografía
1. Louhimo I, Kekomaki M, Pasila M, Sulamaa H. Chylothorax and chylopericardium as a problem in pediatric surgery. Eur J Ped Surg 1966 (Suppl):19-28. [ Links ]
2. Campbell R, Benson LN, Williams WW, Adatia I. Chylopericardium after cardiac operations in children. Ann Thorac Surg 2001; 72: 193-196. [ Links ]
3. Nguyen DM, Shum-Tim D, Dobell AR, Tchervenkov CI. The management of chylothorax/chylopericardium following pediatric cardiac surgery: a 10-year experience. J Cardiac Surg 1995; 10: 302-308. [ Links ]
4. Ossiani MH, McCauley R, Patel HT. Primary idiopathic chylopericardium. Pediatr Radiol 2003; 33: 357-359. [ Links ]
5. Yoon YS, Shim WH, Chung TS, Lee YS. primary idiopathic chylopericardium: report of a case and literature review. Yonsei Med J 1993; 34: 98-108. [ Links ]
6. Furrer M, Holp M, Ris HB. Isolated primary chylopericardium: treatment by thorascoscopic thoracic duct ligation and pericardial fenestration. J Thorac Cardiovasc Surg 1996; 112 (4): 1120-1. [ Links ]
7. Kanemoto S, Abe M, Ikeda A, Gomi S. Recurrent symptomatic chylopericardium after cardiac surgery in a child. Pediatr Cardiol 2008; 29: 683-685. [ Links ]
8. Kan CD, Wang JN, Wu JM, Yang YJ. Isolated chylopericardium after intrapericardial procedures; possible role of inadvertent right efferent lymphatic trunk injury. Texas Heart Inst J 2007; 34: 82-87. [ Links ]
9. Minnear FL, Barie PS, Malik AB. Effects of transient pulmonary hypertension on pulmonary vascular permeability. J Appl Physiol 1983; 55: 983-989. [ Links ]
10. Revere DJ, Makaryus AN, Bonaros EP, Graver LM. Chylopericardium presenting as cardiac tamponade. Tex Heart Inst J 2007; 34: 379-382. [ Links ]
11. Moraes MA, Martins AS, Leite de Campos NL, Ramos de Andrade R, Massato L, Hueb JC. Quilopericardio idiopático primario - informe de caso clínico. Arq Bras Cardiol 2009; 92 (6): e40-e43. [ Links ]














