Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.18 no.4 Bogota July/Aug. 2011
(1) Universidad de Antioquia. Medellín, Colombia.
(2) Clínica Cardiovascular Congregación Mariana. Medellín, Colombia.
Correspondencia: Dra. Rosalba Vivas Tróchez. Calle 64 N°51 D -154. Medellín, Colombia. Fundación Hospital San Vicente de Paúl-Quinto piso del Hospital Infantil. Departamento de Pediatría - Universidad de Antioquia. Teléfono: (574) 2 63 78 85. Correo electrónico: rossyviv@hotmail.com
Recibido: 01/12/2010. Aceptado: 23/05/2011.
Los aneurismas de la arteria pulmonar son poco frecuentes en niños. Entre sus principales causas se encuentran procesos infecciosos como la endocarditis, que favorece el desarrollo de aneurismas micóticos, en especial en pacientes con defectos cardíacos congénitos y en aquellos con adicción a drogas de uso endovenoso (sobre todo en adultos), y lleva al desarrollo de aneurismas micóticos. Las opciones de tratamiento dependen de las características de la lesión y de la condición clínica del paciente.
Se presenta el caso de una paciente de siete años, quien fue referida para evaluación por endocarditis infecciosa de la válvula tricúspide debida a Staphylococcus aureus. Desarrolló aneurismas bilaterales en ramas lobulares de la arteria pulmonar secundarios a la infección valvular. El aneurisma del lado derecho era de gran tamaño y con alto riesgo de ruptura, razón de peso para que se le efectuara embolización con coils. El procedimiento fue exitoso y no se documentaron complicaciones. La lesión del lado izquierdo se trató de forma expectante teniendo en cuenta que era de menor tamaño. En la actualidad la paciente está en seguimiento ambulatorio con el fin de vigilar la evolución del aneurisma del lado izquierdo.
Palabras clave: aneurisma de la arteria pulmonar, aneurisma micótico, terapia endovascular.
Pulmonary artery aneurysms are infrequent in children. Among its main causes are infectious processes such as endocarditis which favors the development of mycotic aneurysms especially in patients with congenital heart defects and in those with endovenous drug addiction (mainly in adults) that develop mycotic aneurysms. Treatment options depend on the characteristics of the lesion and the clinical condition of the patient.
We present the case of a seven year old female patient who was referred for evaluation of infectious endocarditis of the tricuspid valve due to Staphylococcus aureus. She developed bilateral aneurysms in lobular branches of the pulmonary artery secondary to the valve infection. The right aneurysm was large and had a high risk of rupture, and for this reason an embolization with coils was performed. The procedure was successful and no complications were documented. Given that the left side lesion was smaller, it received an expectant management. At present, the patient has ambulatory follow-up in order to monitor the evolution of the left side aneurysm.
Keywords: pulmonary artery aneurysm, mycotic aneurysm, endovascular therapy.
Introducción
Los aneurismas del tronco de la arteria pulmonar y sus ramas (AAP) son lesiones vasculares poco frecuentes en pediatría y con una etiología muy diversa, lo que ha permitido clasificar sus causas en congénitas y adquiridas.
Debido a su baja prevalencia y al curso asintomático de muchos pacientes que presentan estas lesiones, son pocos los reportes de casos. Esto ha llevado a que no exista evidencia suficiente que permita establecer guías claras en lo referente a su manejo de ahí que las decisiones terapéuticas se basen en las características clínicas de cada paciente con respecto al tamaño de la lesión, su localización y el riesgo de ruptura.
Caso clínico
Se presenta el caso de un paciente de género femenino, de siete años de edad, con historia de dos meses de evolución de fiebre, malestar general y artralgias. Al examen físico se encuentra taquicárdica y con soplo compatible con insuficiencia tricúspide a la auscultación. Se solicitaron exámenes de laboratorio que evidenciaron elevación de reactantes de fase aguda y presencia de Staphylococcus aureus sensible a la meticilina en dos hemocultivos.
La paciente tenía antecedente quirúrgico de reparación de comunicación interauricular (CIA) y de comunicación interventricular (CIV) con parche de pericardio bovino a los nueve meses de vida, sin defectos residuales. No tenía antecedente de procesos infecciosos recientes ni había sido invadida con catéteres centrales ni otro tipo de dispositivos médicos. Su esquema de vacunación estaba completo para la edad y su estado nutricional era adecuado.
La ecocardiografía evidenció dilatación de la aurícula derecha, vegetación de gran tamaño (17 x 3 mm) en la valva septal de la tricúspide en su cara atrial adherida a la valva septal y al septum interatrial, ruptura de la valva septal de la tricúspide con insuficiencia tricúspide severa, sin defectos residuales y función ventricular conservada. Se diagnosticó endocarditis bacteriana y se inició tratamiento antibiótico.
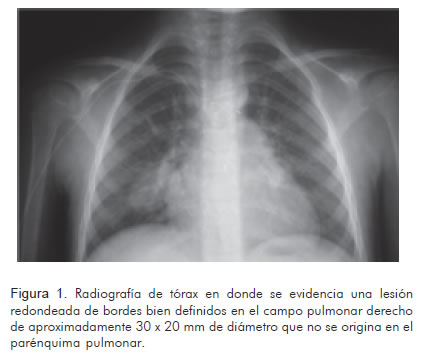
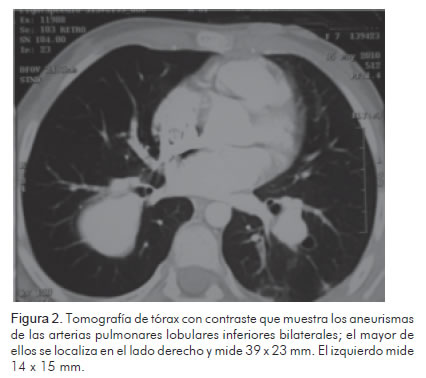
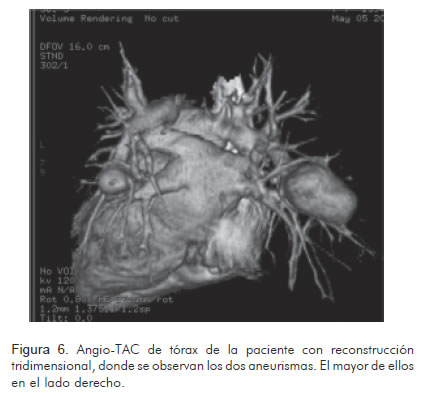
En una radiografía de tórax realizada como parte de los estudios prequirúrgicos, luego de dos semanas de tratamiento, se observó una lesión radio-lúcida redondeada, de bordes bien definidos, en el campo pulmonar derecho, de aproximadamente 30 x 20 mm de diámetro (Figura 1). Se solicitó tomografía de tórax simple y contrastada con reconstrucción tridimensional que reportó aneurismas de las arterias pulmonares lobulares inferiores bilaterales, uno en el lado derecho de 39 mm x 23 mm sin coágulos en su interior y otro en el lado izquierdo de 14 mm x 15 mm (Figuras 2 y 3). Se diagnosticaron aneurismas micóticos en las arterias pulmonares y se decidió llevar a manejo vía endovascular.
Se realizó cateterismo cardiaco en donde se observó un aneurisma micótico gigante localizado en el lóbulo medio del pulmón derecho el cual se embolizó con espirales GDC (Guglielmi detachable coils, 24 mm x 40 cm standard) y DCS (truFILL DCS detachable coil, complex standard 20 mm x 30 cm y truFILL DCS detachable coil complex fill 10 mm x 30 cm) los cuales se depositaron a través de dos microcatéteres (Excelsior 1018). También se observó un aneurisma de menor dimensión (10 x 10 mm) que no se embolizó por su tamaño y la proximidad con la língula. En la angiografía de control se observó oclusión completa del aneurisma embolizado (Figuras 3, 4 y 5).

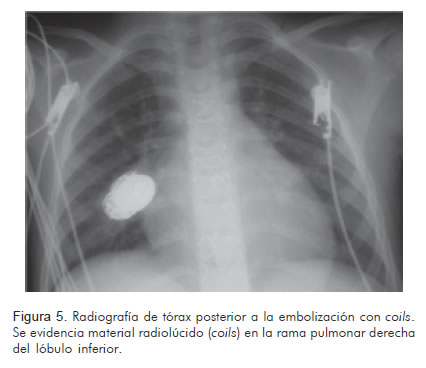
La paciente recibió seis semanas de tratamiento antibiótico venoso y se le realizó reparación de la válvula tricúspide, luego de lo cual mostró buena evolución. Fue dada de alta y se evaluó de forma ambulatoria en el servicio de cardiología pediátrica tres meses después, encontrándose asintomática desde el punto de vista cardiovascular y respiratorio, sin ninguna limitación de su actividad física.
Discusión
La definición de aneurisma hace referencia a la dilatación localizada de un vaso sanguíneo, que compromete las tres capas de su pared. Cuando no hay compromiso de todas las capas, sino que se produce un hematoma pulsátil extravascular, se denomina pseudoaneurisma, el cual es más susceptible de ruptura.
Los aneurismas ocurren con más frecuencia en la circulación sistémica, principalmente en la aorta y las arterias mesentéricas, femorales e intracraneales. Algunos reportes (1) mencionan que los AAP corresponden a menos del 1% de los aneurismas localizados en la cavidad torácica.
Su etiología es diversa y se agrupa en causas congénitas y adquiridas. Las primeras se relacionan con diferentes tipos de defectos cardíacos que incluyen, entre otros, persistencia del conducto arterioso, tetralogía de Fallot, estenosis valvular pulmonar y cortocircuitos de izquierda a derecha. Entre las causas adquiridas están procesos infecciosos como endocarditis y neumonía principalmente, enfermedades del tejido conectivo (lupus eritematoso sistémico, síndrome de Marfan), condiciones que cursan con vasculitis (enfermedad de Behçet - arteritis de Takayasu) y trauma que suele estar relacionado con el paso de catéteres de Swan-Ganz (2-4).
En la serie clásica descrita por Deterling y Clagget (5) se reportó una incidencia de AAP de 1 en 14.000 autopsias. En dicha serie la causa más común fue la que se asoció con defectos cardíacos, de los cuales el más frecuente fue el conducto arterioso persistente, seguido por causas infecciosas.
Los defectos cardíacos, tal como lo menciona Bartter en su revisión (6), desempeñan un papel importante como facilitadores del desarrollo de estos aneurismas. Esto se explica por dos mecanismos; primero, estos defectos favorecen el desarrollo de hipertensión arterial pulmonar, elemento clave en el desarrollo de los aneurismas, a través del incremento en la tensión de la pared de los vasos sanguíneos; segundo, predisponen al desarrollo de infecciones como endocarditis y neumonías, que pueden causar aneurismas micóticos.
Estos últimos se forman como resultado de la diseminación de la infección por varios mecanismos:
- Embolización de un foco séptico, como complicación de un cuadro de endocarditis infecciosa que produce arteritis o genera un émbolo séptico que obstruye el lumen del vaso y facilita la invasión de la pared vascular.
- Extensión de un proceso infeccioso del parénquima pulmonar adyacente, que erosiona la pared vascular como en la tuberculosis (aneurisma de Rasmussen) o en la neumonía necrosante.
- Bacteriemia que causa siembras en la pared del vaso con destrucción de la misma y consecuente dilatación (7-9).
La etiología de los aneurismas micóticos ha cambiado con el paso de los años y con la introducción de nuevos agentes antimicrobianos. Hoy, los principales microorganismos implicados incluyen: Staphylococcus aureus, especies de estreptococos, Salmonella spp, Escherichia coli, Micobacterias, y algunas especies de hongos como Candida albicans y Aspergillus flavus (6, 8).
En el caso que se describe no se pudo obtener diagnóstico histopatológico, pero las características imaginológicas y los hallazgos del cateterismo son típicos de los aneurismas micóticos.
En general, los AAP pueden cursar asintomáticos o con síntomas relacionados con la enfermedad de base con la que se asocian, como en el caso expuesto en donde las manifestaciones clínicas se relacionaban con la endocarditis de la válvula tricúspide. En la mayoría de los casos el hallazgo es incidental en una radiografía de tórax. Algunos pacientes pueden presentar tos, disnea y dolor torácico relacionado con compresión de estructuras locales. En la serie de Arom y colaboradores (10) en adultos, se describe disnea con el ejercicio en 69% de los pacientes con este tipo de lesiones. Un signo ominoso es la presencia de hemoptisis, que indica inestabilidad del aneurisma, asociándose con mayor riesgo de ruptura y una tasa de mortalidad hasta de 50% (11-13).
Con menos frecuencia, los pacientes con AAP pueden cursar con insuficiencia cardíaca derecha, principalmente aquellos con aneurismas del tronco de la arteria pulmonar que pueden desarrollar insuficiencia valvular pulmonar (14).
En cuanto a la evaluación diagnóstica de los AAP, la prueba de oro clásica es la angiografía pulmonar; no obstante, hoy se cuenta con métodos menos invasivos, entre ellos la angiotomografía de tórax (Figura 6). Este es el método diagnóstico de elección, ya que permite reconstruir la vasculatura pulmonar a través de una imagen tridimensional con el fin de planear el abordaje quirúrgico o endovascular y adicionalmente facilita la identificación de complicaciones asociadas (15, 16).
En algunas ocasiones, la radiografía simple de tórax permite tener una sospecha diagnóstica, al revelar anormalidades vasculares torácicas, tal como sucedió en el caso que se expone (Figura 1). La ecocardiografía doppler es una herramienta útil para el diagnóstico de aneurismas del tronco de la arteria pulmonar y de sus ramas principales, pero no en los casos de aneurismas de ramas distales (15, 16).
El uso de imágenes por resonancia magnética ha ganado espacio como herramienta diagnóstica en los casos de AAP. Algunas de sus desventajas como la duración prolongada del examen, la mayor susceptibilidad a artefactos por el movimiento, la menor resolución espacial y la menor cobertura de volumen, han ido superándose con los equipos de última generación, lo que la posiciona como un estudio importante; de hecho en algunos centros es la imagen diagnóstica de primera elección (15, 16).
Las opciones de tratamiento de los AAP dependen del número de aneurismas, de su tamaño y localización, de la condición clínica del paciente y de la experiencia del grupo tratante (6, 13, 17, 18). Sin embargo, no existen guías específicas ni evidencia suficiente que delimiten las opciones terapéuticas.
Para los aneurismas del tronco y de las ramas principales de la arteria pulmonar el tratamiento quirúrgico se puede realizar por medio de aneurismectomía o aneurismorrafia con colocación de injertos de dacrón u homoinjertos con pericardio autólogo. En caso de aneurismas más periféricos la resección en cuña o lobectomía es una opción quirúrgica, pero hoy en día se prefiere el manejo con terapia endovascular en estos casos (6, 13, 15-20).
Aún no se ha definido con exactitud cuál es el momento indicado para realizar la intervención quirúrgica. Veltdman y colaboradores (14) consideran que ello depende del tamaño del aneurisma y de la función del ventrículo derecho que puede estar afectada por lesión de la válvula pulmonar. Otros autores como Imazio y colaboradores (17) y Kuwaki y colegas (21), recomiendan una intervención temprana en las lesiones que comprometen el tronco de la arteria pulmonar por el riesgo de ruptura, principalmente, en casos de aneurismas micóticos.
En algunas series de casos recomiendan intervención temprana en las siguientes situaciones: paciente con hemoptisis, crecimiento rápido de un aneurisma o tamaño de la lesión mayor de 20 mm de diámetro, ya que en estos casos hay mayor riesgo de ruptura (6, 13, 17, 18). Otros autores consideran que los aneurismas idiopáticos del tronco de la arteria pulmonar menores de 6 cm tienen bajo riesgo de ruptura (22, 23).
La terapia endovascular es una alternativa terapéutica que permite conservar el tejido pulmonar normal y preservar la función pulmonar residual distal al aneurisma. Las técnicas incluyen: oclusión con balón, embolización con coils o con agentes líquidos, e implante de stents recubiertos. La elección de una u otra técnica, similar a lo que sucede con los procedimientos quirúrgicos, también depende de las características de la lesión y de la preferencia del grupo tratante (16, 24-27). La mayor experiencia al respecto se tiene en pacientes adultos (15, 16) con algunos reportes de casos en niños (24, 27, 28). Los casos descritos por Deshmukh y colaboradores (27) y Liddel y su equipo (24) son muy similares al caso que se presenta, ya que los pacientes tenían lesiones en las ramas periféricas de la arteria pulmonar, secundarias a procesos infecciosos, que fueron tratadas con embolización con coils.
Algunos pacientes pueden requerir más de una sesión de embolización para lograr la resolución de la lesión como sucedió en el caso descrito por Liddel y colaboradores (24).
En nuestros días se dispone de ayudas radiológicas y dispositivos que facilitan el acceso vascular a estas lesiones y hacen menos riesgoso el procedimiento (16). Entre las posibles complicaciones asociadas se describen aquellas que se relacionan con acceso vascular, infartos, persistencia de la perfusión en el aneurisma, migración y/o desplazamiento de coils y lesión de la pared del vaso (26). En el caso que se describe no hubo complicaciones.
Otra opción terapéutica es el manejo conservador que se describe en algunos reportes de casos en los que se indicó manejo médico en pacientes asintomáticos y sin condiciones de riesgo. Esto implica controlar los factores de predisposición y la hipertensión pulmonar, en caso de ser necesario, así como verificar que no haya cortocircuitos de izquierda a derecha y vigilar al paciente con periodicidad (13-15, 20, 22, 29). Esta posibilidad de manejo se describe principalmente en casos de pacientes con aneurismas idiopáticos del tronco de la arteria pulmonar. Sin embargo, hay reportes en pacientes con aneurismas micóticos quienes se manejaron con terapia antibiótica sin ningún otro tipo de intervención y tuvieron resolución espontánea de la lesión (13, 29).
El seguimiento radiológico es importante ya que si el aneurisma presenta fuga o aumenta de tamaño durante el tratamiento antibiótico, se requerirá una intervención inmediata dadas las altísimas probabilidades de ruptura y muerte.
En el caso que se muestra, se decidió optar por el manejo expectante para el aneurisma del lado izquierdo teniendo en cuenta su tamaño y el bajo riesgo de ruptura.
El pronóstico de los AAP no ha sido definido y puede ser variable, ya que su historia natural es difícil de determinar. En los pacientes no tratados las complicaciones que pueden darse son: ruptura, disección, erosión intrapulmonar, embolismo pulmonar y compresión de la tráquea o de los bronquios. De éstas las más peligrosas son la ruptura y la disección, o ambas, porque se asocian con altas tasas de mortalidad (1).
En los casos de aneurismas micóticos, una vez controlado el proceso infeccioso el riesgo de ruptura es bajo (17).
De otra parte, se ha descrito recurrencia tardía de aneurismas en pacientes sometidos a aneurismorrafia en quienes no se logró un adecuado control de las condiciones hemodinámicas que generan tensión sobre la pared de la arteria pulmonar (21).
En cuanto a la mortalidad, Benveniste y colaboradores (11) reportaron muerte en 14 de 23 pacientes con aneurismas de la arteria pulmonar. Butto y colaboradores (7) documentaron cerca de 30% de pacientes que murieron por ruptura del aneurisma.
En cuanto a los aneurismas idiopáticos del tronco de la arteria pulmonar, se considera que tienen un pronóstico benigno (15).
Para concluir, hasta el momento la paciente del caso permanece asintomática y está en seguimiento por consulta externa de cardiología pediátrica. Para su evaluación se ordenó angiotomografía de tórax con el fin de observar la evolución del aneurisma embolizado y vigilar el crecimiento del aneurisma del lado izquierdo para definir la necesidad de tratamiento con terapia endovascular.
Bibliografía
1. Kodikara S, Sivasubramanium M. Bilateral pulmonary artery aneurysms. Legal Medicine 2009; 11: S496-S497. [ Links ]
2. Boateng P, Anjum W, Wechsler AS. Vascular lesions of the mediastinum. Thorac Surg Clin 2009; 19: 91-105. [ Links ]
3. Caplin J, Dymond D, Barret D, Rees R, Rees G, Spurrel R. Pulmonary mycotic aneurysms secondary to infective endocarditis in a patient with a persistent ductus arteriosus and partial anomalous pulmonary venous drainage. Eur Heart J, 1985; 6: 985-88. [ Links ]
4. Mody G, Lau C, Bhalla S, Picus D, Ritter J, Mc Cardle T, et al. Mycotic pulmonary artery pseudoaneurysm. J Thorac Imaging 2005; 20: 310-12. [ Links ]
5. Deterling RA, Clagett T. Aneurysm of the pulmonary artery; review of the literature and report of a case. Am Heart J 1947; 34: 471-99. [ Links ]
6. Bartter T, Irwin RS, Nash G. Aneurysms of the pulmonary arteries. Chest 1988; 94: 1065-75. [ Links ]
7. Kumar V, Cotran R, Collins T. Aneurysms and dissection. En: Robbins and Cotran, Pathologic Basis of Disease. Professional Edition, 8th. ed. Saunders-Elsevier; 2009. p. 507-508. [ Links ]
8. Dransfield MT, Johnson JE. A mycotic pulmonary artery aneurysm presenting as an endobronchial mass. Chest 2003; 124: 1610-12. [ Links ]
9. Steven J. Lester, Wilansky S. Endocarditis and associated complications. Crit Care Med 2007; 35 (8): S387. [ Links ]
10. Arom K, Richardson J, Grover F, Ferris G, Trinkle K. Pulmonary artery aneurysm. Am Surgeon 1978; 44: 688-92. [ Links ]
11. Butto F, Russell V, Lucas RV, Edwards J. Pulmonary arterial aneurysm, a pathologic study of five cases. Chest 1987; 91: 237-41. [ Links ]
12. Benveniste O, Brunell F, Bedos J. Ruptured mycotic pulmonary artery aneurisms: an unusual complication of right-sided endocarditis. Scand J Infect Dis 1998; 6: 626-29. [ Links ]
13. Wilson T, Tew K, Taranath A. Multiple mycotic aneurysms of the pulmonary arteries resolving with conservative management. J Thorac Imaging 2008; 23: 197-201. [ Links ]
14. Veldtman G, Dearani J, Warnes C,. Low pressure giant pulmonary artery aneurysms in the adult: natural history and management strategies. Heart 2003; 89: 1067-70. [ Links ]
15. De Tomás L, Beltrán S, Molina S, Navarro F, Álvarez D, Pérez E, et al. Aneurisma idiopático de la arteria pulmonar. Presentación de un caso y revisión de la literatura. An Med Interna 2005; 22: 329-331. [ Links ]
16. Lee W, Mossop P, Little A, Fitt G, Vrazas J, Hoang J et al. Infected (Mycotic) aneurysm: espectrum of imaging appearances and management. Radiographics 2008; 28 (7): 1853-68. [ Links ]
17. Imazio M, Cecchi E, Giammaria M, Pomari F, Tabasso M, Ghisio A, et al. Main pulmonary artery aneurysm: a case report and review of the literature. Ital Heart J 2004; 5: 232-37. [ Links ]
18. Chung CW, Doherty JU, Kotler R, Finkelstein A, Dresdale A. Pulmonary artery aneurysm presenting as a lung mass. Chest 1995; 108: 1164-66. [ Links ]
19. Chen IM, Chang HH, Hsu CP, Lai ST, Shih CC. Ten-year experience with surgical repair of mycotic aortic aneurysms. J Chin Med Assoc 2005; 6: 265-71. [ Links ]
20. Shih H, Kang P, Lin Ch, Lin Y. Main pulmonary artery aneurysm. J Chin Med Assoc 2007; 70 (10): 453-55. [ Links ]
21. Kuwaki K, Morishita K, Sato H, Urita R, Abe T. Surgical repair of the pulmonary trunk aneurysm. Eur J Cardiothorac Surg 2000; 18: 535-9. [ Links ]
22. Fang C, Tsai C. Idiopathic pulmonary artery aneurysm. J Formosan Med Assoc 1996; 212: 615-36. [ Links ]
23. Deb S, Zehr K, Shields R. Idiopathic pulmonary artery aneurysm. Ann Thorac Surg 2005; 80: 1500-2. [ Links ]
24. Liddell R, Patel S, Neuwirth M, Hebert J, Arepally A, Hofmann L. Transcatheter coil embolization of large pulmonary artery seudoaneurysms in a child. J Vasc Interv Radiol 2003; 14: 923-27. [ Links ]
25. Block M, Lefkowitz T, Ravenelc J, Leon S, Hannegan C, Charleston SC. Endovascular coil embolization for acute management of traumatic pulmonary artery pseudoaneurysm. J Thorac Cardiovasc Surg 2004; 128: 784-5. [ Links ]
26. Ghaye B, Trotteur G, Dondelinger R. Multiple pulmonary artery pseudoaneurysms: intrasaccular embolization. Eur Radiol 1997; 7: 176-79. [ Links ]
27. Deshmukh h, Rathod k, Garg A, Sheth R. Ruptured mycotic pulmonary artery pseudoaneurism in an infant: Transcatheter embolization and CT Assessment. Cardiovasc Intervent Radiol 2003; 26: 485-487. [ Links ]
28. Domínguez G, Ramos B, Fuentes C, Novales J. Aneurisma de la arteria pulmonar derecha en un paciente con síndrome de Williams. Reporte de un caso. Rev Mex Pediatr 2003; 70 (6): 288-90. [ Links ]
29. Bozkurt K, Oztunc F, Akman C, Kurugoglu S, Eroglu A. Multiple pulmonary artery aneurysms due to infective endocarditis. Ann Thorac Surg 2003; 75: 593-96. [ Links ]














