Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.18 no.5 Bogota Sept./Oct. 2011
(2) Escuela de Medicina. Facultad de Salud. Universidad Industrial de Santander. Hospital Universitario de Santander. Bucaramanga, Santander.
(3) Grupo de Inmunología y Epidemiología Molecular, GIEM, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia.
Correspondencia: Dr. Julio César Mantilla Hernández. Departamento de Patología. Escuela de Medicina. Facultad de Salud. Universidad Industrial de Santander. Carrera 32 Nº. 29-31. Segundo piso-Edificio antiguo. Facultad de Salud. Bucaramanga, Colombia. Tel.: (57-7) 6 34 54 96. Correo electrónico: urielsuarezmd@gmail.com
Recibido: 02/05/2011. Aceptado: 09/08/2011.
La enfermedad de Chagas es un padecimiento que predomina en aquellas regiones del continente americano que combinan condiciones geográficas, climáticas y ecológicas para que el hombre, el Trypanosoma cruzi, sus reservorios y vectores, interactúen de manera ideal.
Objetivo: presentar nueve casos de enfermedad de Chagas diagnosticados mediante autopsia en el Departamento de Patología de la Universidad Industrial de Santander entre 2002 y 2009, correlacionar los hallazgos pos-mortem con las manifestaciones clínicas y comparar los datos obtenidos con la información referida en la literatura mundial.
Materiales y Métodos: estudio descriptivo, retrospectivo en casos de autopsias realizadas en el Departamento de Patología de la Universidad Industrial de Santander entre el primero de enero de 2002 y el 30 de junio de 2009.
Resultados: de un total de 756 autopsias, nueve (1,2%) correspondieron a pacientes con diagnóstico confirmado de enfermedad de Chagas: siete hombres y dos mujeres. El rango de edad osciló entre 14 meses y 56 años. De los casos analizados cinco correspondieron a la forma aguda, dos a la forma crónica y dos a un proceso de reactivación. Todos tenían compromiso cardíaco, uno compromiso del colon y uno compromiso encefálico. La causa de muerte se relacionó de manera directa con estas afecciones.
Conclusión: en zonas endémicas, ante la presencia de manifestaciones cardíacas, es necesario considerar la enfermedad de Chagas con el fin de realizar un diagnóstico precoz y oportuno que permita identificar casos y establecer medidas de manejo específico enfocado de acuerdo con su condición.
Palabras clave: enfermedad de Chagas, miocardiopatía chagásica, Trypanosoma cruzi, tripanosomiasis americana.
Chagas disease is a condition that prevails in those regions of the Americas that combine geographical, climatic and ecological conditions so that man,Trypanosoma cruzi, their reservoirs and vectors may ideally interact.
Objective: to present nine cases of Chagas disease diagnosed by autopsy at the Department of Pathology, Universidad Industrial de Santander between 2002 and 2009, correlating post-mortem findings with the clinical manifestations, and compare these data with the information referred in the world literature.
Materials and Methods: a descriptive, retrospective study of autopsy cases performed in the Department of Pathology, Universidad Industrial de Santander between January 2002 and June 30, 2009.
Results: of a total of 756 autopsies, nine (1.2%) were patients with confirmed diagnosis of Chagas disease: seven men and two women. The age range oscillated between 14 months and 56 years. Of the cases analyzed, five corresponded to the acute form, two to the chronic form, and two to a process of reactivation. All had cardiac involvement; one had colon involvement, and one brain involvement. The cause of death was directly related to these conditions.
Conclusion: in the presence of cardiac manifestations in endemic areas, is necessary to consider Chagas disease, in order to make an early and appropriate diagnosis, to identify cases and to establish specific management measures focused according to their condition.
Keywords: Chagas disease, Chagas cardiomyopathy, Trypanosoma cruzi, trypanosomiasis.
Introducción
La enfermedad de Chagas es producida por el Trypanosoma cruzi, (T. cruzi) un protozoo de la familia Trypanosomatidae, en cuyo ciclo biológico intervienen mamíferos y un insecto vector (1-3). La enfermedad constituye uno de los principales problemas de salud pública en Latinoamérica, y según datos de la Organización Mundial de la Salud, existen unos 16 a 18 millones de personas infectadas cuya tasa de infección anual de 300.000 y una mortalidad de 21.000 individuos por año, la convierten en la tercera infección parasitaria más común en todo el mundo después de la malaria y la esquistosomiasis (4, 5). En Colombia la prevalencia es de 5% y la población en riesgo asciende a 3,5 millones (6, 7).
El hombre puede infectarse con T. cruzi por las deyecciones de triatominios, que contienen tripanosomas, los cuales entran en el organismo por las excoriaciones de la piel en el sitio de la picadura o a través de las mucosas; por la placenta (8) y por las transfusiones sanguíneas (6-9). Aunque la trasmisión oral es poco conocida, constituye una ruta muy importante de trasmisión en algunas regiones geográficas (10-16). También se ha descrito la trasmisión a través de la leche materna y por accidentes de laboratorio por manipulación inadecuada de sangre, cultivos celulares y animales infectados (2, 6).
La enfermedad de Chagas se presenta en las formas aguda y crónica. La primera aparece después de un periodo de incubación de entre una y cuatro semanas y los síntomas son evidentes tan sólo en 5% de los infectados, con mayor frecuencia en niños; cursa con alta parasitemia, y en ausencia de tratamiento los síntomas persisten por dos a cuatro meses (17). En 90% de éstos hay compromiso cardíaco representado por miocarditis de intensidad variable con diversas alteraciones electrocardiográficas, y algunos desarrollan insuficiencia cardiaca cuya gravedad es inversamente proporcional a la edad del afectado (18).
Una vez superada la fase aguda, la sintomatología desaparece y el paciente entra en una fase crónica que se torna sintomática luego de varios años de la primoinfección y se caracteriza por daño irreversible del corazón. Los enfermos con afección severa del miocardio muestran grados extremos de cardiomegalia, insuficiencia cardiaca y fenómenos tromboembólicos. Un porcentaje no determinado de pacientes chagásicos, desarrolla trastornos del tubo digestivo, megaesófago y megacolon (2, 18-22).
El diagnóstico de la enfermedad de Chagas se fundamenta en los antecedentes epidemiológicos y en los hallazgos clínicos y de laboratorio (23). En quienes se sospecha la enfermedad, se realizan pruebas directas e indirectas que demuestren la existencia del T. cruzi. En la fase aguda los métodos de diagnóstico incluyen: examen microscópico directo en sangre fresca, examen de gota gruesa, centrifugación de sangre fresca y xenodiagnóstico (24). Durante la fase crónica de la enfermedad la cantidad de parásitos es muy baja e incluso ausente; por tanto, la detección de anticuerpos circulantes ha sido el método más utilizado para su diagnóstico y de éstas, los más comúnmente utilizados son la hemoaglutinación, la inmunofluorescencia, y ELISA, los cuales pueden dar lugar a tasas de sensibilidad y especificidad superiores a 90% (25-31).
Este trabajo tiene como objetivo mostrar nueve casos de enfermedad de Chagas diagnosticados mediante autopsia en el Departamento de Patología de la Universidad Industrial de Santander (UIS) entre los años 2002 y 2009, correlacionar los hallazgos pos-mortem con las manifestaciones clínicas y comparar los datos obtenidos con la información referida en la literatura mundial.
Materiales y métodosSe analizaron 1.398 protocolos de autopsias realizadas en el Departamento de Patología de la Universidad Industrial de Santander a individuos fallecidos en el Hospital Universitario de Santander o en otra institución hospitalaria del área metropolitana de Bucaramanga, cuyos familiares hubieran solicitado al hospital en mención la prestación de tal servicio entre el 1º. de enero de 2002 y el 30 de junio de 2009. De ellas se excluyeron 642 (45,9%) que correspondían a autopsias perinatales; de las restantes 756 (54,1%) se revisaron los protocolos de los fallecidos con diagnóstico de enfermedad de Chagas, y se encontraron nueve casos (1,2%).
Definición de caso
En el estudio se incluyeron los casos en los cuales, a partir de los tejidos examinados, se identificó T. cruzi en el corazón, en algún segmento del tubo digestivo o en el encéfalo, y se confirmó su presencia mediante estudios de biología molecular (PCR).
Diseño del estudio
Estudio de autopsias descriptivo retrospectivo, llevado a cabo entre el 1º. de enero de 2002 al 30 de junio de 2009 en un hospital público de tercer nivel.
Lugar del estudio
Departamento de Patología de la Universidad Industrial de Santander y el Hospital Universitario de Santander, de Bucaramanga, Colombia.
Consideraciones éticas
Todos los casos evaluados corresponden a pacientes fallecidos en los diversos servicios del Hospital Universitario de Santander o en instituciones hospitalarias del área metropolitana remitidos al mismo, a quienes se les practicó autopsia médico-científica, previa solicitud del médico tratante y autorización de algún miembro de la familia, según lo exige el Decreto 786 de 1990 (en Colombia), a excepción de uno en el cual la solicitud de autopsia fue expedida directamente por la Secretaría de Salud Departamental, en vista de que se trataba de un caso de salud pública y se requería diagnóstico de la causa de muerte.
El trabajo cuenta con la autorización del Director del Departamento de Patología de la Universidad Industrial de Santander para la revisión de los protocolos de autopsia, las preparaciones histológicas y las fotografías que se incluyeron en el estudio, y tiene en cuenta las normas vigentes sobre investigación en seres humanos, contempladas en la Declaración de Helsinki de la Asociación Médica Mundial y la Resolución 8430 de 1993 del Ministerio de Salud de Colombia.
Según la anterior documentación, la presente se cataloga como una investigación sin riesgo, ya que emplea técnicas y métodos retrospectivos de revisión de protocolos de autopsia, en los que no se realiza ninguna intervención o modificación intencionada de las variables biológicas, fisiológicas, psicológicas o sociales de los participantes (32, 33).
Presentación de casosDurante el período comprendido entre enero de 2002 y junio de 2009, en el Departamento de Patología de la Universidad Industrial de Santander, se identificaron nueve casos en los que se pudo establecer enfermedad de Chagas como diagnóstico final de muerte. De los nueve casos, siete (77,77%) eran de género masculino y dos (22,22%) femenino. El rango de edad osciló entre 1 y 59 años. De los casos analizados: cinco correspondían a formas agudas, dos a la forma crónica y dos a reactivación de formas crónicas asintomáticas (Tabla 1).
Caso 1
Hombre de 59 años, procedente de la zona rural de Rionegro, con clínica de dos meses de evolución de disnea y edema progresivo de miembros inferiores, por lo que consultó al hospital local. Al examen físico encontraron frecuencia cardiaca de 124 por minuto, frecuencia respiratoria de 22 por minuto, tensión arterial 125/80 mm Hg, ingurgitación yugular, estertores en ambos campos pulmonares y hepatomegalia. Se diagnosticó insuficiencia cardíaca congestiva y se remitió al Hospital Universitario de Santander, donde le iniciaron tratamiento, con mejoría inicial, aunque en el tercer día presentó episodio de disnea, dolor retroesternal y cianosis, seguidos de síncope, hipotensión sostenida y muerte. En la autopsia se halló cardiomegalia global con dilatación de cavidades, trombo-émbolos en ramas principales de arterias pulmonares, esófago con dilatación retrógrada moderada, estenosis en la unión cardio-esofágica e hígado aumentado de tamaño, cuya superficie de corte presentaba aspecto en nuez moscada. El estudio microscópico reveló, en corazón, fibrosis intersticial moderada, hipertrofia en las fibras remanentes, infiltrado linfohistiocitario escaso y pocos nidos de amastigotes en el interior de las fibras miocárdicas; y en esófago, fibrosis, infiltrado linfohistiocitario escaso y ocasionales amastigotes de T. cruzi entre las túnicas circular interna y longitudinal externa de su capa muscular. Los estudios complementarios de biología molecular permitieron identificar cepas de T. cruzi linaje I en el corazón y T. cruzi linaje II en el esófago (34).
Caso 2
Hombre de 35 años, procedente de Bucaramanga, con fiebre de dos semanas de evolución, malestar general, fatiga fácil y disnea, por lo que consultó al Hospital Universitario de Santander, donde diagnosticaron síndrome febril agudo y como primera posibilidad etiológica infección por virus Hanta. Su padre y un hermano habían fallecido en el último mes a consecuencia de enfermedad febril similar. En la autopsia se encontró edema de miembros inferiores, hidrotórax bilateral, hidropericardio y ascitis. El corazón mostró dilatación de sus cavidades y en las preparaciones histológicas denso infiltrado intersticial de linfocitos, plasmocitos e histiocitos, más notorio en torno a fibras miocárdicas, con quistes de amastigotes de T. cruzi; en el pericardio había infiltrado linfoplasmohistiocitario.
Caso 3
Paciente de género masculino, de 40 años de edad, natural del municipio de Mogotes, procedente y residente en Bucaramanga, con antecedente de insuficiencia renal crónica diagnosticada en 1997, a quien se le realizó trasplante renal en 1999, con rechazo crónico desde 2001 y se le trató con ciclosporina, micofenolato y prednisolona, con serología positiva desde 1997 para Chagas, Toxoplasma y Citomegalovirus. El 22 de julio de 2004 consultó por malestar general, fiebre, deposiciones diarreicas y elevación de las cifras de azoados. Se hizo diagnóstico de reactivación de infección por citomegalovirus y disfunción secundaria del injerto, y se inició terapia con valganciclovir. En las semanas posteriores presentó deterioro de su estado general, con picos febriles, y fue hospitalizado el 19 de agosto de 2004, con diagnóstico de insuficiencia renal crónica, viremia por Citomegalovirus y síndrome febril en paciente inmunosuprimido, donde, a pesar del tratamiento, falleció.
En la autopsia se encontró ascitis, edema, tromboembolismo pulmonar y cardiomegalia con manchas blanquecinas en la superficie del corazón que reflejaban episodios anteriores de pericarditis. Al corte, se observó dilatación de cavidades e hipertrofia concéntrica de la pared del ventrículo izquierdo; riñones de superficie externa irregular y riñón trasplantado en la fosa ilíaca derecha, de aspecto congestivo y edematoso (Figuras 1A, 1B). El examen histológico del corazón reveló fibrosis e infiltrado intersticial mononuclear de predominio linfocitario; en el interior de algunas fibras miocárdicas se identificaron quistes que contenían amastigotes de T. cruzi (Figura 1C). Se identificó T. cruzi linaje I en corazón mediante estudio de PCR.
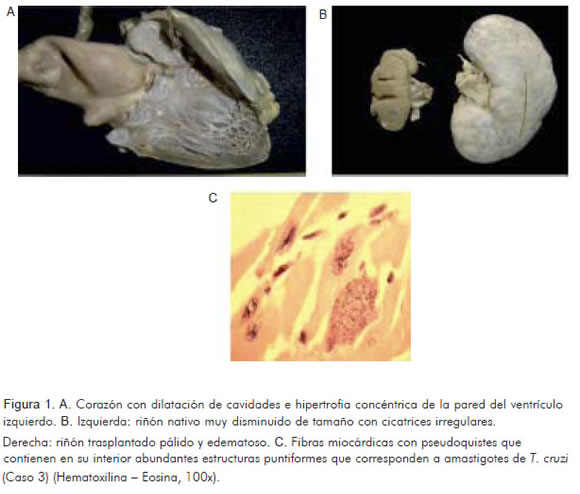
Caso 4
Mujer adulta de 56 años, procedente de San Vicente de Chucurí, con quince días de fiebre, debilidad progresiva y disnea, por lo que fue remitida del hospital local hacia el Hospital Universitario de Santander, donde ingresó en shock cardiogénico y falleció. En la autopsia se encontró edema de miembros inferiores, ascitis e hidrotórax bilateral, edema, tromboembolismo pulmonar e hígado grande, cuya superficie de corte mostró aspecto en nuez moscada y cardiomegalia con dilatación de cavidades. El examen microscópico del mismo mostró infiltrado linfohistiocitario denso y fibras miocárdicas con quistes que contenían amastigotes de T cruzi; había, además, focos de necrosis y hemorragia. Los estudios de PCR confirmaron la presencia de T. cruzi linaje I en el corazón.
Caso 5
Hombre de 28 años de edad, quien consultó al Hospital Universitario de Santander por cefalea prolongada de intensidad progresiva que no cedía a los analgésicos comunes. Se le ordenó tomografía axial computarizada de cráneo que mostró lesión encefálica gangliobasal derecha, compatible con toxoplasmosis cerebral. Se hizo prueba de ELISA para VIH, la cual fue positiva. Luego de iniciar tratamiento específico sin resultados satisfactorios, falleció.
En la autopsia se encontraron lesiones necróticas en encéfalo, una en la región ganglio basal anterior y otra en el hemisferio cerebeloso derecho, de 2,3 x 1,7 cm y de 1,8 x 1,5 cm respectivamente (Figura 2A). El estudio microscópico reveló extensa necrosis con algunos quistes que contenían amastigotes, y en la periferia había nódulos microgliales e infiltrado linfocitario. En el corazón se evidenció infiltrado linfohistiocitario y en el interior de las fibras miocárdicas quistes con amastigotes y amplias zonas de necrosis (Figura 2B). Los estudios de PCR permitieron determinar secuencias nucleares del T. cruzi en el corazón y el cerebro. Los estudios de PCR para Toxoplasma gondii fueron negativos (35, 36).
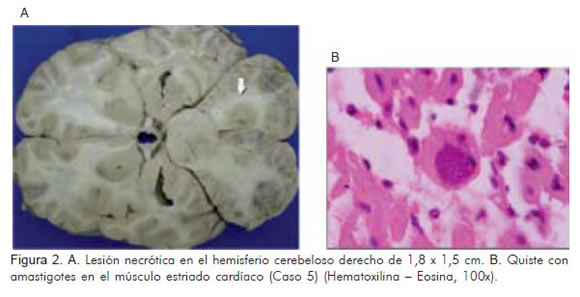
Caso 6
Hombre de 22 años, residente del área urbana de Lebrija, operario de un aeropuerto, con fiebre de cinco semanas de evolución, malestar general y debilidad, quien en diversas oportunidades fue valorado por médico; se le emitió diagnóstico de dengue y recibió tratamiento sintomático, sin mejoría. En la última semana presentó edema de miembros inferiores, dolor en el hipocondrio derecho y fatiga fácil, por lo que consultó a una clínica de la ciudad de Bucaramanga, donde fue hospitalizado; allí sufrió deterioro de su estado general e insuficiencia cardiaca congestiva severa complicada con taquiarritmias, y posterior shock cardiogénico, que hizo necesario el traslado a cuidado intensivo, donde falleció. Teniendo en consideración que no se cuenta con diagnóstico etiológico de la enfermedad y que dos compañeros de trabajo presentaron igual sintomatología, se solicitó autopsia médico-científica, cuyos hallazgos incluyeron: edema de tejidos blandos, hidrotórax bilateral, ascitis, edema pulmonar y cardiomegalia con dilatación de todas las cavidades. Así mismo, en los cortes histológicos del corazón había infiltrado linfoplasmohistiocitario denso que comprometía la totalidad del órgano, múltiples quistes que ocupaban la mayor parte las fibras miocárdicas, llenos de amastigotes de T. cruzi, amplias zonas de necrosis miocárdica y extensión del infiltrado a la grasa epicárdica y a los ganglios nerviosos del corazón (Figura 3). Por estudios de PCR se confirmó la presencia de T. cruzi linaje I en el corazón.
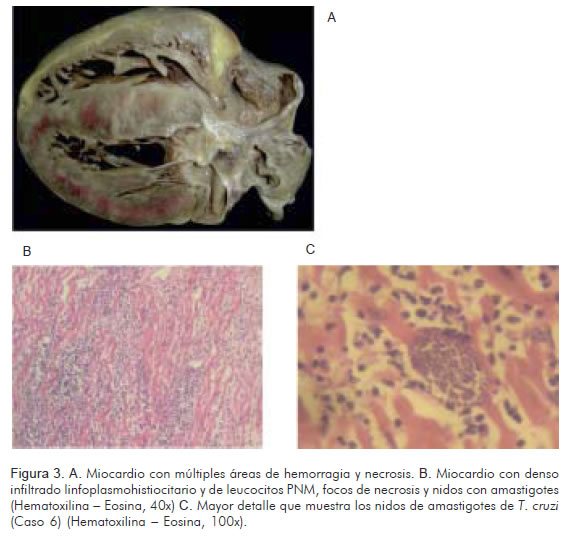
Caso 7
Hombre de 33 años de edad, residente en zona rural de San Vicente de Chucurí, quien consultó al hospital local por episodio convulsivo, con posterior afasia y hemiplejía derecha, por lo que fue remitido al Hospital Universitario de Santander, donde se le diagnosticó síndrome convulsivo tardío secundario a neoplasia del sistema nervioso central. Se practicó tomografía axial computarizada que reveló isquemia del hemisferio cerebral izquierdo y ecocardiografía transtorácica que mostró cardiomegalia y fracción de eyección del 10%. Tuvo deterioro hemodinámico progresivo y falleció.
En la autopsia se halló cardiomegalia con dilatación de cavidades, aneurisma a nivel de la punta, trombos murales en el ventrículo izquierdo, amplias zonas de fibrosis, y escasos amastigotes de T. cruzi en algunas fibras miocárdicas (Figuras 4A y 4B). De otro lado, en el colon se observó dilatación retrógrada desde el recto que alcanzó hasta 18 centímetros de diámetro, con adelgazamiento extremo de su pared, que en áreas apenas si alcanzó 1 mm de espesor. En el recto estenosis, engrosamiento difuso de su pared, fibrosis, infiltrado linfocitario y ausencia de células ganglionares en el plexo de Auerbach. Se identificaron anticuerpos anti-T. cruzi por método de ELISA indirecto. Además se encontró tromboembolismo e infartos pulmonares, y necrosis masiva del hemisferio cerebral izquierdo, por obstrucción tromboembólica de la arteria cerebral media (Figura 4C). Los estudios de PCR confirmaron T. cruzi linaje I en corazón y colon (37).
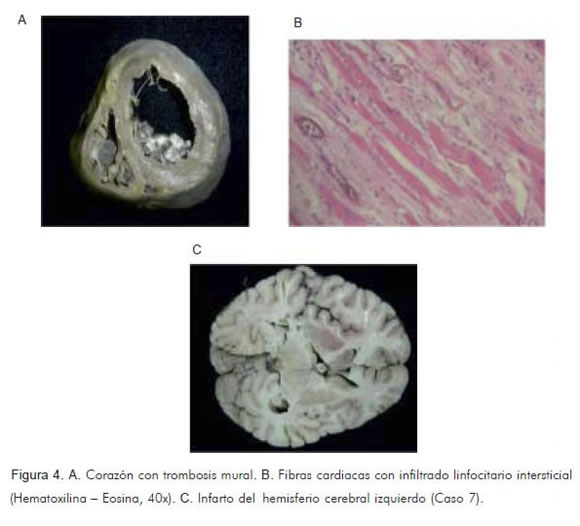
Caso 8
Hombre de 21 años de edad, trabajador de un aeropuerto, residente en zona rural de Lebrija, con cuadro clínico que inició en la segunda semana de noviembre de 2008 consistente en edema facial, malestar general, epigastralgia y deposiciones diarreicas. Tres semanas después fue hospitalizado con diagnóstico de miocarditis aguda, con bloqueo de rama derecha. En vista de que el 7 de diciembre falleció su compañero de trabajo, a quien se le diagnosticó enfermedad de Chagas, se le realizaron pruebas serológicas que confirmaron el diagnóstico y se le inició tratamiento con nifurtimox, con evolución satisfactoria, por lo que se dio salida. El 5 de enero consultó por disnea, ortopnea, tos, expectoración hemoptoica, sin fiebre ni dolor; al examen físico se evidenciaron ruidos cardiacos arrítmicos, ruidos respiratorios disminuidos y hepatomegalia. Se le realizó electrocardiograma, el cual mostró fibrilación auricular con respuesta ventricular alta, y radiografía de tórax que reveló derrame pleural derecho. Fue hospitalizado en la unidad de cuidado intensivo con diagnóstico de insuficiencia cardiaca congestiva, y allí, a pesar del tratamiento instalado, presentó shock cardiogénico, y falleció el 7 de enero de 2009.
En la autopsia se encontró epicardio con infiltrado linfocitario, que involucró filetes y ganglios nerviosos; en el miocardio había extensa lesión inflamatoria con infiltrado mononuclear denso de predominio linfocitario, que formó agregados irregulares; existían además zonas de necrosis que comprometían múltiples fibras miocárdicas. No se identificaron amastigotes. En estudios previos al fallecimiento se aisló T. cruzi en sangre.
Caso 9
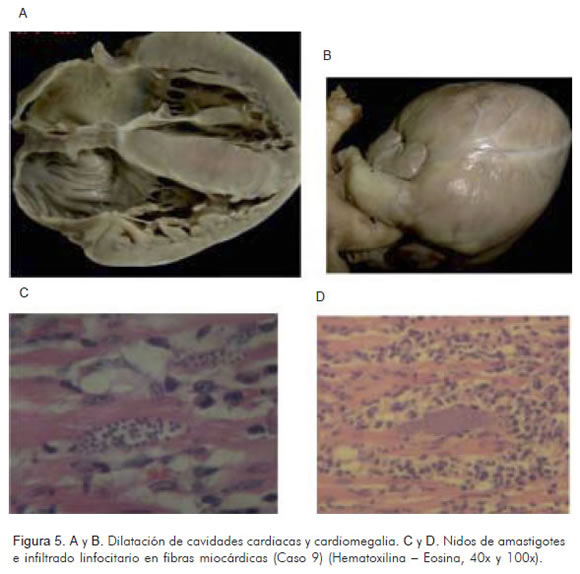
Paciente de doce meses de edad, residente en la zona urbana de Bucaramanga, quien fue llevada a consulta por dificultad respiratoria y fiebre de dos semanas de evolución. Se diagnosticó bronconeumonía, se hospitalizó y se inició tratamiento con antibióticos y broncodilatadores, con mejoría parcial, por lo que se dio de alta; regresó dos días después con mayor dificultad respiratoria y edema de miembros inferiores; en esta ocasión se diagnosticó miocarditis infecciosa vs. neumonía viral. La radiografía de tórax mostró cardiomegalia global e infiltrados alvéolo-intersticiales; el ecocardiograma reportó derrame pericárdico. Se hospitalizó en cuidados intensivos, se inició manejo con furosemida y metoprolol, tuvo deterioro de su función hemodinámica y falleció. Como antecedente de importancia, una tía y una hermana de la menor presentaban cuadro clínico similar pero de menor severidad. En la autopsia se encontró edema generalizado, derrames pericárdico y pleural bilateral, ascitis, cardiomegalia global con miocarditis linfoplasmohistiocitaria severa por T. cruzi, edema pulmonar, hepatoesplenomegalia y linfadenitis mesentérica generalizada (Figura 5). Por PCR se confirmó la presencia de T. cruzi linaje I en muestras de corazón. De acuerdo con los resultados de la autopsia, se tomaron muestras de sangre de los familiares de la paciente, logrando el aislamiento del parásito en la sangre de la hermana, y prueba serológica IgM positiva para T. cruzi en la tía.
Esta enfermedad, descrita por Carlos Chagas en 1909 en Minas Gerais, pero cuyos signos han sido hallados en momias sudamericanas de 9.000 años de antigüedad, sigue tan vigente como la pobreza en Latinoamérica (38). Se relaciona de manera directa con las dificultades socioeconómicas de las comunidades, sus condiciones de vivienda, el acceso a la educación y los movimientos migratorios (7, 39), lo cual hoy se evidencia como un problema de salud pública y en una más de las tantas enfermedades que afectan a las poblaciones pobres, donde el reduvio vive preferentemente, porque el tipo de vivienda se convierte en un hábitat ideal: grietas en las paredes construidas con ladrillos de barro o arcilla, agujeros en techos de paja, entre otros, en comunidades de zonas rurales o periurbanas.
Colombia no es ajena a este importante problema de salud pública, dado que existen 3´500.000 personas en riesgo, en un territorio que reúne las condiciones ambientales ideales para la interacción parásito-vector-huésped. Dentro del mismo se ubica el departamento de Santander, donde la seroprevalencia es superior al 40% en algunos de sus municipios (34, 35, 37, 40). Teniendo en cuenta lo anterior y según los datos aportados en cada uno de los casos, queda claro, en primer lugar, que en nuestro medio la enfermedad de Chagas es endémica. No obstante, ésta no se considera dentro del diagnóstico diferencial de pacientes con síndrome febril agudo ni con insuficiencia cardiaca, situación que impide el diagnóstico temprano y el tratamiento oportuno, y que se refleja en los resultados del trabajo que se expone, en el que sólo en uno de los casos se pudo establecer la enfermedad antes de la muerte del paciente, dado que éste hacia parte de un brote agudo de la enfermedad, y con anterioridad había fallecido el caso índice del mismo en el cual se había identificado el T. cruzi en el estudio de autopsia (Tabla 2).
La enfermedad de Chagas tiene dos formas clínicas, de las cuales la más frecuente es la crónica, que la mayoría de veces pasa inadvertida por tener un curso indolente asintomático o por presentarse como un cuadro de insuficiencia cardiaca congestiva de lenta evolución del cual no se investiga su etiología. Sin embargo, en la serie que se presenta, siete de nueve casos (77,77%) correspondían a la forma aguda, dentro de la cual cabe resaltar la variabilidad de sus manifestaciones como lo reportan otros autores (39, 41, 42).
Las manifestaciones clínicas de la fase aguda de la enfermedad pueden ser formas con puerta de entrada aparente (complejo oftalmoganglionar, chagoma de inoculación polimorfo) y formas sin puerta de entrada aparente (edema, fiebre, hepatomegalia, esplenomegalia, exantemas, entre otras), también llamados típicos o atípicos respectivamente. Cada uno de estos signos y/o síntomas generalmente tienen una presentación polimorfa y variable, como lo describieron otros autores. Añez y colaboradores (1999), en un estudio descriptivo de enfermedad de Chagas de 59 casos se presentaron 19 patrones de manifestaciones clínicas diferentes. El patrón de signos y/o síntomas que con mayor frecuencia se presentó al mismo tiempo en ese estudio estuvo constituido por fiebre, mialgias, cefalea y signo de Romaña; la mayoría de los pacientes (84,7%) mostró, además, un portal de entrada que se observó en 28 de los 59 casos en fase aguda. Así, fue claro el signo de Romaña en 27 (45,8%), y el chagoma en 1 (1,7%) (41).
De otra parte, según refieren Nicholls y colaboradores, el síntoma predominante en 90% de los casos fue la fiebre acompañada por otros síntomas importantes como cefalea, astenia y adinamia en 40%. Los signos de puerta de entrada no fueron frecuentes (39).
La variabilidad clínica de esta fase de la enfermedad es también visible en esta serie de casos, caracterizada por la ausencia de un patrón definido de signos y síntomas; sin embargo se resaltan, dada su frecuencia, la fiebre en más del 70% de los casos en fase aguda, al igual que la disnea, seguidas por el edema de miembros inferiores (48,85%) (Tabla 3). Varios autores consideran la fiebre como un signo y síntoma presente en todos o en la mayoría de los casos agudos; su intensidad va desde la simple febrícula, a veces vespertina, hasta las llamativas temperaturas de 39-40º, que generalmente se dan en los casos graves, a cualquier edad (41).
Dos pacientes presentaron diarrea, en un caso acompañada de fiebre y en el otro de disnea y hepatomegalia. Para otros autores el síntoma que debe sugerir enfermedad de Chagas aguda es la diarrea persistente, como síntoma atípico, y cuando es la única manifestación acompañada de fiebre se sugiere la forma digestiva de la enfermedad (41, 43).
En el estudio que nos concierne, en dos pacientes se determinó el compromiso neurológico secundario a la enfermedad. En uno de los casos (caso 5) se documentó la presencia de cefalea intensa progresiva, asociada a lesión ganglio basal derecha, en este caso de origen infeccioso, en la cual se identificó T. cruzi como agente causal, en un individuo inmunosuprimido, lo que corresponde a una reactivación de la enfermedad de Chagas. En el caso 7, la manifestación cardinal fue un episodio convulsivo asociado con un evento cerebral isquémico por cardioembolismo favorecido por la enfermedad, sin embargo en esta oportunidad, en fase crónica (34, 35).
En ninguno de los casos se reportaron signos clínicos relacionados con la puerta de entrada del parásito, como el chagoma de inoculación y el signo de Romaña, a diferencia de lo que evidencia la literatura en la fase aguda de esta enfermedad (2, 17, 41, 42).
Es importante anotar que en uno de los casos en que la enfermedad evolucionó como un síndrome febril agudo, se consideró como posible causa la infección por Hantavirus (Caso 2). El síndrome cardiopulmonar por hantavirus (SCPH), es una entidad poco prevalente, y sin reportes claros de casos en nuestro medio, por lo que se hace necesario el enfoque integral de los pacientes dentro de un contexto regional o geográfico e incluir dentro del diagnóstico diferencial las enfermedades endémicas de la zona, dentro de las cuales figuran la de Chagas.
En relación con la vía de trasmisión de los casos expuestos, dos (22,22%) correspondieron a reactivación de la enfermedad crónica favorecida por la inmunosupresión asociada a SIDA y por la terapia inmunosupresora por trasplante renal; éstos ilustran sobre la condición oportunista del T. cruzi en aquellos individuos con formas severas de inmunosupresión y dan muestra del mal pronóstico de la enfermedad en éstos por cuanto el sistema nervioso central se ve afectado con frecuencia (34, 36, 40, 44, 45). Otros dos casos (22,22%) correspondieron a la forma crónica de la enfermedad en los que se presume la vía clásica de trasmisión mediante la picadura del insecto vector, ya que estos enfermos eran residentes de zonas endémicas (Rionegro y San Vicente de Chucuri) (Tabla 2). En los otros cinco casos (55,55%), se presume, por los estudios epidemiológicos, que el T. cruzi utilizó la vía oral para ingresar al organismo; de éstos, dos residían en Bucaramanga, dos en Lebrija y uno en San Vicente de Chucurí, y todos correspondieron a la forma clínica aguda de la enfermedad.
La trasmisión oral del T. cruzi, es una vía casi desconocida, por lo que se la considera poco probable; sin embargo hay reportes que mencionan la trasmisión por esta vía desde hace largo tiempo. El primero de ellos se reportó hace cincuenta años, en Teutonia, Brasil, en el que 17 personas enfermaron y 5 de ellas fallecieron, atribuyéndose la trasmisión de la enfermedad a la ingestión de comida contaminada con el parásito (46); después de este primer brote agudo, se reportaron casos similares en Argentina, Venezuela y la Guyana francesa (47-49). En Colombia se han informado casos esporádicos de la forma aguda de la enfermedad, el primero en Guamal, Magdalena en 1999, con 13 casos de síndrome febril agudo y miocarditis, 5 de los cuales fallecieron. El estudio epidemiológico de este brote, concluyó que la enfermedad se trasmitió muy posiblemente por vía oral luego de la ingestión de vino de palma (48). El segundo brote se informó en Tibú, Norte de Santander, donde enfermaron 14 soldados, y el tercero se registró en Bucaramanga, en 2003, como un síndrome febril agudo en un grupo familiar y el fallecimiento de tres de sus miembros.
En ninguno de los brotes agudos descritos en Colombia se ha podido documentar, de manera fehaciente, la vía de entrada o la fuente de exposición, pero dada la aparición simultánea de formas agudas de la enfermedad en grupos cerrados que comparten alimentos, la vía oral se considera como la más probable. Uno de los últimos brotes reportados en Colombia ocurrió en diciembre de 2008 en el municipio de Lebrija, Santander; inicialmente se informó sobre una extraña enfermedad caracterizada por fiebre, dolor torácico y alteración de las transaminasas en tres funcionarios de un aeropuerto, al parecer por la manipulación de termos que contenían semen bovino. El 7 de diciembre falleció uno de los enfermos y luego del estudio de autopsia se diagnosticó miocarditis chagásica aguda como causa de muerte; a continuación se conformó un equipo investigativo con personal del Instituto Nacional de Salud, la Secretaría de Salud de Santander, el laboratorio departamental de salud pública y el laboratorio de inmunología de la Universidad Industrial de Santander, a fin de estudiar 83 contactos laborales y 50 contactos familiares, en donde se detectaron 7 nuevos casos de infección por T. cruzi. La investigación posterior pudo concluir que 9 de los 10 infectados habían consumido durante una visita a la finca de uno de los enfermos en octubre de 2008, jugo de mandarina, y por lo tanto se postula la vía oral como la más probable en este brote, al cual pertenecen dos de los casos del estudio que se expone (casos 6 y 8) (40).
En cuanto a los hallazgos morfológicos, es importante mencionar que si bien es cierto que en todos los casos hay cardiomegalia con grados diversos de pericarditis y de dilatación de las cavidades cardiacas, éstos no deben considerarse específicos de la enfermedad. Por el contrario, el cuadro histológico es mucho más preciso y específico, y en todos los casos revisados se observa miocarditis linfoplasmohistiocitaria de severidad variable, según la forma clínica y la evolución de la enfermedad. Así, en las formas agudas predomina la lesión necroinflamatoria severa con denso infiltrado de linfocitos, plasmocitos, histiocitos y algunos leucocitos PMN neutrófilos, abundantes nidos de amastigotes de tripanosoma en las fibras miocárdicas y gran cantidad de fibras miocárdicas necróticas; en algunas arteriolas hay infiltrado linfocitario en la pared formando además trombos plaquetarios en su luz. En la grasa epicárdica hay infiltrado inflamatorio que compromete fibras y ganglios nerviosos; mientras que en las formas crónicas, el daño miocárdico estuvo representado por fibrosis intersticial, más intensa en la zona subendocárdica de ambos ventrículos, leve a moderado infiltrado de células mononucleares con predominio de linfocitos, e hipertrofia de las fibras miocárdicas remanentes (Tablas 4 y 5).
En sólo uno de los casos analizados no se hallaron amastigotes en el estudio histológico del corazón, correspondiendo éste al único caso diagnosticado durante su hospitalización, y que además recibió tratamiento con nifurtimox. En este llama la atención la severa reacción necroinflamatoria, hallazgo que sugiere que el medicamento tiene muy buen efecto tripanocida en la fase aguda, pero que el organismo continúa desarrollando una respuesta inflamatoria contra los productos del parásito.
La enfermedad de Chagas fue descubierta hace un poco más de cien años, y los dos únicos fármacos disponibles para su tratamiento desde hace más de treinta años son el benznidazol y el nifurtimox (50), cuya eficacia varía en función tanto de la fase de la enfermedad, como de la dosis, la duración del tratamiento, la edad del paciente, el período de seguimiento después de la terapia y las pruebas utilizadas para evaluar la validez del tratamiento. Estos dos fármacos muestran actividad tripanocida significativa, con tasas de eliminación parasitológica hasta de 80% en la fase aguda; no obstante, en la fase crónica su utilidad es muy limitada, y aunque algunos estudios muestran que el benznidazol parece tener actividad curativa significativa en las formas crónicas de corta evolución, esto podría ser marginal (51-54). Existen otras posibles alternativas terapéuticas, como los inhibidores de la biosíntesis de ergosterol, entre los cuales están el posaconazol y el ravuconazol, cuyas posibles ventajas son la mayor potencia y selectividad tanto en infecciones agudas como en crónicas, la actividad contra cepas resistentes a benznidazol y nifurtimox, la mayor tolerabilidad y el perfil de seguridad. Estos compuestos son los candidatos más avanzados en la terapia tripanocida, pero todavía existen limitaciones por falta de estudios clínicos y por los costos que ello genera (55).
La fase aguda de la enfermedad de Chagas se ha convertido en una manifestación frecuente en nuestro medio, representando la mayoría de los casos que se exponen en esta serie, lo cual es desconcertante comparado con la prevalencia revisada en la literatura. El diagnóstico de enfermedad de Chagas en la fase aguda se establece en menos de 10% de los casos, hecho que en este estudio fue similar, probablemente porque los síntomas suelen ser variables y leves y pueden confundirse fácilmente con otras enfermedades infecciosas. La enfermedad de Chagas aguda produce un cuadro febril inespecífico que evoluciona hasta presentar signos y síntomas que apuntan a una lesión cardíaca, por lo cual es indispensable considerarla dentro de los diagnósticos diferenciales de síndrome febril teniendo en cuenta que el pronóstico y la respuesta al tratamiento mejoran con el diagnóstico oportuno.
ConclusionesLa enfermedad de Chagas constituye en nuestro medio una enfermedad de frecuente acaecimiento, con áreas dentro del departamento de Santander que tienen seroprevalencia superior al 40% entre sus pobladores. Sin embargo, al momento de enfrentar un paciente con síndrome febril agudo o con insuficiencia cardiaca congestiva, el médico poco tiene en cuenta la enfermedad de Chagas situación que se refleja en el presente estudio en el que se oberva un porcentaje muy bajo de certeza diagnóstica (uno de nueve casos, 11,11%) y una mortalidad muy elevada, especialmente en las formas agudas.
Se asume que la forma crónica de la enfermedad es frecuente pero que es ínfimo lo que se puede hacer contra ella una vez se ha producido el daño miocárdico. La enfermedad aguda se presenta en nuestro medio como un síndrome febril agudo con desenlace fatal habitual y a pesar del uso de piretroides y mosquiteros impregnados, que ha demostrado reducir su transmisión (56), estos resultan insuficientes para el control del insecto vector. De ahí la importancia de la implementación de campañas educativas con el objetivo de que la comunidad en general conozca sobre este padecimiento y aprenda a identificar el vector y los sitios donde éste se oculta, y así pueda combatirlo. Adicionalmente, y de mayor importancia, resulta ser la labor de sensibilización hacia los médicos y el personal encargado del cuidado de la salud de la comunidad para que piensen en esta entidad como lo que realmente es: una enfermedad endémica.
Finalmente y ante el surgimiento de brotes agudos de la enfermedad en los cuales se plantea como posible mecanismo de trasmisión del parásito la vía oral por la ingestión de alimentos contaminados con las heces del insecto vector, es necesario informar a la comunidad en general y al personal de salud sobre la importancia de la manipulación adecuada de los mismos, y en especial de las bebidas típicas y frutos silvestres en aquellas zonas que por sus condiciones ambientales correspondan al hábitat de los triatominios vectores.
En la fase aguda de la enfermedad, el compromiso cardíaco es la forma más común en nuestro medio. En zonas endémicas, ante la presencia de manifestaciones cardiacas, es imperioso considerar la enfermedad de Chagas con el fin de realizar un diagnóstico precoz y oportuno que permita identificar casos y establecer medidas de tratamiento específico enfocado de acuerdo con su condición.
AgradecimientosAl Doctor Fernando Rosas por su colaboración y apoyo en la edición de este trabajo, que esperamos sea un punto de referencia en cuanto a enfermedad de Chagas.
Bibliografía1. Brener Z. General review of Trypanosoma cruzi classification and taxonomy. Rev Soc Bras Med Trop 1985; 18: 1. [ Links ]
2. Apt W, Heitmann I, Jercic MI, et al. Guías clínicas de la enfermedad de Chagas. Parte I y II. Rev Chil Infect 2008; 25 (3-4): 199-189. [ Links ]
3. Jaramillo C, Montaña MF, Castro L, et al. Differentiation and genetic analysis of Rhodnius prolixus and Rhodnius colombiensis by rDNA and Random Amplified Polymorphic DNA. Mem Inst Oswaldo Cruz 2001; 96 (8): 1043-1048. [ Links ]
4. WHO Control of Chagas disease. WHO Technical Report Series. 902. Second report of the WHO Expert Committee, Geneva; 2002. [ Links ]
5. World Bank. World Development Report 1993: Investing in health. Oxford University Press; 1993. p. 12, 329. [ Links ]
6. Moncayo A. Chagas disease: current epidemiological trends after the interruption of vectorial and transfusional transmission in the Southern Cone countries. Mem Inst Oswaldo Cruz 2003; 98: 577-91. [ Links ]
7. Guhl F. Epidemiología de la enfermedad de Chagas en Latinoamérica y Colombia. En: Rosas F, Vanegas D, Cabrales M, eds. Enfermedad de Chagas. Bogotá: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular; 2007. p. 7-14. [ Links ]
8. Freilij H, Altcheh J. Chagas congénito. En: Storino R, Milei J, eds. Enfermedad de Chagas. Buenos Aires: Mosby Doyma; 1994. p. 267-78. [ Links ]
9. Apt W, Heitmann I, Jercic MI, et al. Guías clínicas de la enfermedad de Chagas: Parte IV. Enfermedad de Chagas en pacientes inmunocomprometidos. Rev Chil Infect 2008; 25 (4): 289-292. [ Links ]
10. Garrido M, Brunicelli S, Vera M, et al. Abordaje técnico administrativo de un brote de tripanosomiasis americana. Informe preliminar. Unidad educativa municipal Andrés Bello, Municipio Chacao, Caracas -Venezuela. Salud Chacao 2008. [ Links ]
11. Nobrega AA, García MH, Tatto E, et al. Oral transmission of Chagas disease by consumption of açai palm fruit, Brazil. Emerg Infect Dis 2009; 15 (4): 653-55. [ Links ]
12. Dias JC. Notes about of Trypanosoma cruzi and yours bio-ecology characteristics with agents of the transmission by meals. Rev Soc Bras Med Trop 2006; 39: 370. [ Links ]
13. Da Silva NN, Clausell DT, Nólibos H, et al. Epidemic outbreak of Chagas disease probably due to oral contamination. Rev Inst Med Trop Sao Paulo 1968; 10: 265. [ Links ]
14. Benchimol PR. The oral transmission of Chagas disease: an acute form of infection responsible for regional outbreaks. Int J Cardiol 2006; 112: 132-3. [ Links ]
15. Zambrano P, Cucunubá Z, Montilla M, et al. Investigación de brotes de Chagas de posible transmisión oral en Colombia. Biomédica 2009; 29 (Supl.): 310-41. [ Links ]
16. Staquicini DI, Martins RM, Macedo S, et al. Role of GP82 in the selective binding to gastric mucin during oral Infection with Trypanosoma cruzi. PLoS Negl Trop Dis 2010; 4 (3): e613. [ Links ]
17. Rassi A, Rassi Jr A, Rassi GG. Fase aguda. In: Brener Z, Andrade ZA, Barral Neto M, eds. Trypanosoma cruzi e doença de Chagas (2a. Edição). Rio de Janeiro: Guanabara-Koogan Editora; 2000. p. 231-45. [ Links ]
18. Dias JCP, Kloetzel K. The prognostic value of the electrocardiographic features of chronic Chagas' disease. Rev Inst Med Trop São Paulo 1968; 10: 158. [ Links ]
19. Quiroz F, Morillo C, Casas JP, et al. Clinical, electrocardiographic and echocardiographic characteristics of Chagas' cardiomyopathy in Santander's State (Colombia) population. Rev Col Cardiol 2006, 13 (3): 149-153. [ Links ]
20. Rosas F, Guhl F, Velasco V, et al. Morbilidad de la enfermedad de Chagas en fase crónica en Colombia. Detección de pacientes chagásicos con cardiopatía en un área endémica del departamento de Boyacá. Rev Col Cardiol 2002; 9: 349-359. [ Links ]
21. Marin-Neto JA, Simões MV, Maciel BC. Specific diseases: cardiomyopathies and pericardial diseases. Other cardiomyopathies. In: Yusuf S, Cairns JA, Camm AJ, Fallen EL, Gersh BJ, eds. Evidence-Based Cardiology, 2nd. edition. London: BMJ Books; 2003. p.718. [ Links ]
22. Rassi A Jr, Rassi SG, Rassi A. Sudden death in Chagas' disease. Arq Bras Cardiol 2001; 76: 75-96. [ Links ]
23. Luquetti, A. Diagnóstico de la enfermedad de Chagas. En: Rosas F, Vanegas D, Cabrales M, eds. Enfermedad de Chagas. Bogotá: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular; 2007. p. 25-31. [ Links ]
24. Schenone H. Xenodiagnosis. Mem Inst Oswaldo Cruz 1999; 94 (suppl.1): 289-294. [ Links ]
25. Alvarez M, Cerisola JA, Rohwedder RW. Test de inmunofluorescencia para el diagnóstico de la enfermedad de Chagas. Bol Chil Parasitol 1968; 23: 4-8. [ Links ]
26. Cura EN, Ruiz AM, Velázquez E, et al. Estandarización de un kit de confirmación (FATALAKIT) para el inmunodiagnóstico de la infección por el Trypanosoma cruzi. Medicina (Buenos Aires) 1993; 53: 82. [ Links ]
27. Cerisola JA, Alvarez M, Lugones H, ET al. Sensitivity of serological tests in the diagnosis of Chagas' disease. Bol Chil Parasitol 1969; 24: 2-8. [ Links ]
28. Rassi A, Luquetti AO. Therapy of Chagas disease. In: Wendel S, Brener Z, Camargo ME, Rassi A, eds. Chagas disease (American trypanosomiasis): its impact on transfusion and clinical medicine. São Paulo: Sociedade Brasileira de Hematologia e Hemoterápia; 1992. p. 237-247. [ Links ]
29. Villa L, Morote S, Bernal O, et al. Access to diagnosis and treatment of Chagas disease/infection in endemic and non-endemic countries in the XXI century. Mem Inst Oswaldo Cruz 2007; 102 (Suppl. I): 87-93. [ Links ]
30. Coura JR, de Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz 2002; 97: 3-24. [ Links ]
31. Luquetti A, Rassi A. Tratamiento etiológico de la enfermedad de Chagas. En: Rosas F, Vanegas D, Cabrales M, eds. Enfermedad de Chagas. Bogotá: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular; 2007. p. 145-148. [ Links ]
32. Asociación Médica Mundial. Declaración de Helsinki. Principios éticos para las investigaciones médicas en seres humanos. 52ª Asamblea General. Edimburgo, Escocia: Organización Mundial de la Salud; 2000. [ Links ]
33. República de Colombia. Ministerio de Salud. Normas Científicas, Técnicas y Administrativas para la Investigación en Salud. Resolución 008430. 1993. [ Links ]
34. Zafra G, Mantilla JC, Valadares HM, et al. Evidence of Trypanosoma cruzi II infection in Colombian chagasic patients. Parasitol Res 2008; 103 (3): 731-4. [ Links ]
35. Mantilla JC, Vega Vera A. Correlación clínico patológica. Ponencia de un caso del Hospital Universitario de Santander en el año 2008. Revista Médica Universidad Industrial de Santander 2008; 22 (1): 91-109. [ Links ]
36. Ramírez CB, Jaramillo A, Becerra A, et al. Lesión cerebral como presentación de la enfermedad de Chagas. Primer caso reportado en Colombia. Acta Neurol Colomb 2007; 23: 15-18. [ Links ]
37. Flórez O, Esper J, Higuera S, et al. Chagasic megacolon asociated with Trypanozoma cruzi I in a colombian patient. Parasitology Research 2010; 107 (2): 439-442. [ Links ]
38. Aufderheide A, Salo W, Madden M, et al. A 9,000-year record of Chagas' disease. Proc Natl Acad Sci U S A. 2004;101(7): 2034-9. [ Links ]
39. Nicholls RS, Cucunubá Z, Knudson A, et al. Enfermedad de Chagas aguda en Colombia, una entidad poco sospechada. Informe de diez casos presentados en el periodo 2002 a 2005. Biomédica 2007; 27 (supl. 1): 8-17. [ Links ]
40. Hernández LM, Ramírez AN, Cucunubá Z, et al. Brote de Chagas agudo en Lebrija, Santander 2008. Gobernación de Santander. Secretaría de Salud Departamental. Artículo institucional. [ Links ]
41. Consenso de enfermedad de Chagas. Sociedad Argentina de Cardiología. Rev Argent Cardiol 2002; 70 (Suppl. 1): 13-39. [ Links ]
42. Añez N, Carrasco H, Parada H, et al. Acute Chagas' disease in western Venezuela: a clinical, seroparasitologic, and epidemiologic study. Am J Trop Med Hyg 1999; 60: 215-22. [ Links ]
43. Lugones H, Ledesma O, Storino R, et al. Chagas agudo. En: Storino R, Milei J, eds. Enfermedad de Chagas. Buenos Aires: Mosby Doyma; 1994. p. 209-234. [ Links ]
44. Ferreira MS, Nishioka AS, Rocha A, ET al. La enfermedad de Chagas y la inmunosupresión. En: Dias JCP, Coura JR, eds. Clínica y Tratamiento de la Enfermedad de Chagas. Río de Janeiro: Fundación Oswaldo Cruz; 1997. p.365-379. [ Links ]
45. Cordova E, Boschi A, Ambrosioni J, et al. Reactivation of Chagas disease with central nervous system involvement in HIV-infected pacients in Argentina, 1992-2007. Int J Infect Dis 2008; 12: 587-592. [ Links ]
46. Coura JR. Report on an outbreak of acute Chagas disease in Teutônia, Municipio de Estrela, Rio Grande do Sul. Rio de Janeiro: Instituto Nacional de Endemias Rurais, Ministério da Saúde; 1966. [ Links ]
47. Barrett TV, Hoff RH, Mott KE, et al. An outbreak of acute Chagas's disease in the São Francisco Valley region of Bahia, Brazil: triatomine vectors and animal reservoirs of Trypanosoma cruzi. Transactions of the Royal Society of Tropical and Medicine Hygiene 1979; 73: 703-09.11. [ Links ]
48. Maguire JH, Hoff R, Sleigh AC, Mott KE, et al. An outbreak of Chagas' disease in southwestern Bahia, Brazil. Am J Trop Med Hyg 1986; 35: 931-36. [ Links ]
49. Cáceres D, Nicholls RS, Corredor A, et al. Investigación de un brote de síndrome febril con miocarditis aguda en Guamal, Magdalena, 7 a 11 de junio de 1999. Inf Quinc Epidemiol Nac 1999; 4: 170-8. [ Links ]
50. Villa L, Morote S, Bernal O, et al. Access to diagnosis and treatment of Chagas disease/infection in endemic and non-endemic countries in the XXI century. Mem Inst Oswaldo Cruz 2007; 102 (Suppl. I): 87-93. [ Links ]
51. Britto C. Usefulness of PCR-based assays to assess drug efficacy in Chagas disease chemotherapy: value and limitations. Mem Inst Oswaldo Cruz 2009; 104 (Suppl. I): 122-135. [ Links ]
52. Andrade SG, Rassi A, Magalhaes JB, et al. Specific chemotherapy of Chagas disease: a comparison between the response in patients and experimental animals inoculated with the same strains. Trans R Soc Trop Med Hyg 1992; 86: 624-626. [ Links ]
53. Cançado JR 1999. Criteria of Chagas disease cure. Mem Inst Oswaldo Cruz 1999; 94 (Suppl. I): 331-335. [ Links ]
54. Viotti R, Vigliano C, Lococo B, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med 2006; 144: 72-34. [ Links ]
55. Urbina J. Ergosterol biosynthesis and drug development for Chagas disease. Mem Inst Oswaldo Cruz 2009; 104 (Suppl. I): 311-318. [ Links ]
56. Kroeger A, Villegas E, Ordoñez-Gonzalez J, et al. Prevention of the transmission of Chagas' disease with pyrethroid-impregnated materials. Am J Trop Med Hyg 2003; 68: 307. [ Links ]














