Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.18 no.5 Bogota Sept./Oct. 2011
(1) Nucleodiagnóstico Ltda., Cartagena, Colombia.
(2) Facultad de Medicina, Universidad de Cartagena. Cartagena, Colombia.
(3) Nuevo Hospital de Bocagrande. Cartagena, Colombia.
Correspondencia: Drs. Igor Iván Bonnet y/o Aiken Betancourt Piñeres. Bocagrande, Edificio Seguros Bolívar, local 11. Cartagena, Colombia. Correos electrónicos: igorbonnet@live.com, aikenbet@hotmail.com
Recibido: 22/09/2010. Aceptado: 28/01/2011.
Se presenta un caso clínico poco frecuente de feocromocitoma bilateral, en el cual los estudios de diagnóstico por imagen, tanto de información estructural como funcional, constituyeron una fuente fundamental para su detección y seguimiento.
Palabras clave: hipertensión arterial, feocromocitoma.
We report a rare case of bilateral pheochromocytoma, in which imaging studies, both of structural and functional information, were a major source for its detection and follow-up.
Keywords: hypertension, pheochromocytoma.
Caso clínico
Paciente de género femenino, de 31 años de edad, quien refirió episodios de cefalea, palpitaciones y diaforesis, relacionados con situaciones de estrés, de varios años de evolución, acompañados de hipertensión arterial, síncope (en dos ocasiones), pérdida de peso (15 kilogramos en los dos últimos años) y temblor distal, que se exacerba en las situaciones de carga emocional.
Al examen físico se encuentra presión arterial de 140/100 sentada, y 140/90 en bipedestación, frecuencia cardíaca de 100 pulsaciones por minuto, 65 kilogramos de peso, 1,70 cm de altura, diaforesis profunda en manos y temblor distal en reposo.
Debido al último episodio de síncope se realizó tomografía axial computarizada de cerebro y electroencefalograma, los cuales no mostraron anormalidades; de otra parte, se hizo ecocardiograma que reveló prolapso de válvula mitral leve; monitorización de presión arterial, que indicó hipertensión arterial sisto-diastólica diurna y nocturna no controlada con la medicación, y test de mesa basculante cuyo resultado fue negativo para síncope de origen vasovagal.
Los niveles séricos de ACTH, renina, noradrenalina, calcio, sodio, potasio y cortisol matutino y vespertino, fueron normales, así como los niveles de ácido vanililmandélico y cortisol, tomados en orina; la aldosterona sérica (colectada en bipedestación, que se presenta en 507,9 pg/mL, con valor normal entre 38,1-313 pg/mL), y las metanefrinas (en orina 1,7 mg/24 horas, con volumen de orina de 1.430 mL, con valor normal hasta de 1 mg/24 horas), se encontraron elevadas.
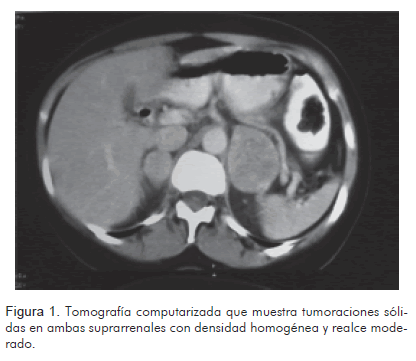
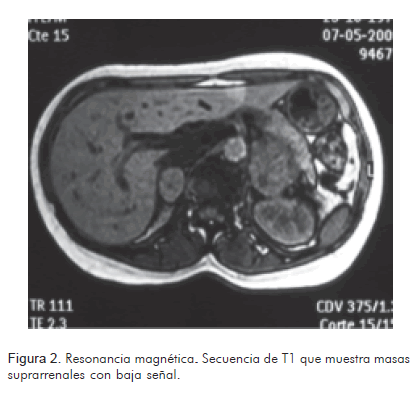
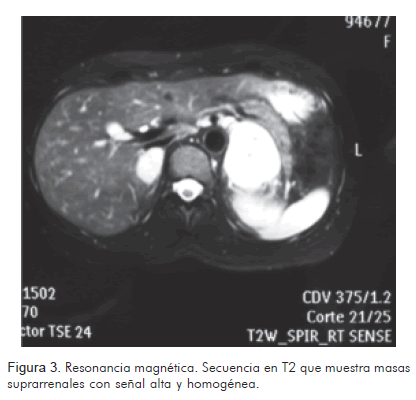
El estudio ecográfico mostró tumoración hipoecoica, redondeada, de 27 mm de diámetro mayor, de aspecto sólido, en el polo superior del riñón derecho, en topografía de la glándula suprarrenal. La tomografía abdominopélvica con contraste, reportó aumento de tamaño de las glándulas suprarrenales por presencia de masas de aproximadamente 22 x 25 mm (derecha) y 43 x 52 mm (izquierda), de naturaleza indeterminada (Figura 1). La resonancia magnética nuclear, reportó aumento del tamaño de ambas glándulas suprarrenales, por masas, siendo la izquierda de mayor volumen, con diámetros de 39,86 x 47,52 mm y la derecha de 20,96 x 26,94 mm. Estas tumoraciones son hipointensas en secuencias de T1 (Figura 2) e hiperintensas en secuencias de T2 (Figura 3).
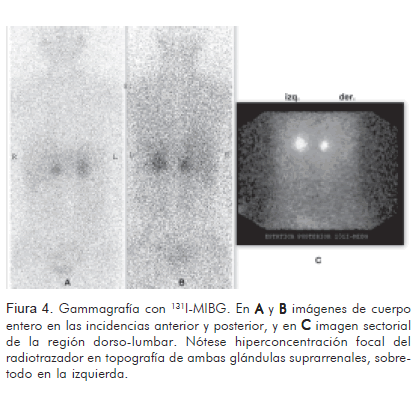
El estudio radioisotópico, de cuerpo entero, en las proyecciones anterior y posterior, realizado 24 y 48 horas después de la administración endovenosa de 1 mCi de metayodobencilguanidina marcada con yodo 131, previa administración de lugol, vía oral, para bloquear la captación del radioelemento por la glándula tiroides, reveló área focal anómala de hiperconcentración del radiofármaco, por encima de los polos superiores de ambos riñones, en topografía de las glándulas suprarrenales, más prominente a la izquierda, con biodistribución preservada del radioelemento en el resto de la economía corporal, compatible con feocromocitoma bilateral (Figura 4).
En virtud de los hallazgos descritos, se realizó ecografía de tiroides que reportó nódulo hipoecoico de 13 mm, de diámetro mayor en el lóbulo derecho, del cual se obtuvo muestra con aguja fina, que reveló bocio coloide sin evidencia de malignidad; así mismo se ralizó resonancia magnética nuclear cerebral que fue normal.
Con base en la información obtenida se hizo adrenalectomía bilateral por laparoscopia, cuya patología reportó feocromocitoma bilateral, bien delimitado, encapsulado, sin necrosis y sin invasión a la cápsula, donde se reconoció parénquima suprarrenal residual no tumoral.
En la actualidad la paciente está en seguimiento ambulatorio y tratamiento con prednisona, y no ha sufrido nuevos episodios de descarga adrenérgica.
DiscusiónEl feocromocitoma, tumor derivado de las células cromafines de la médula adrenal, que secreta adrenalina y noradrenalina, y rara vez dopamina, es una patología poco frecuente, cuya prevalencia se encuentra en torno del 0,2% al 0,6% en pacientes hipertensos (1, 2); si bien la variedad bilateral se halla en apenas 10% a 20% de los casos descritos (3), se resalta que en la paciente del caso es aparentemente esporádico, dada la ausencia de signos clínicos que sugieran neoplasia endocrina múltiple o síndrome neuroectodérmico.
Una vez se tiene sospecha clínica, se establece la confirmación bioquímica del feocromocitoma para realizar estudios anatómicos de diagnóstico por imagen, que muestran alta sensibilidad para su detección (tomografía computarizada y resonancia magnética nuclear) y seguidamente se hacen estudios funcionales de medicina nuclear, la cual tiene alta especificidad para su confirmación (4, 5). En el escenario del feocromocitoma bilateral, a juicio de los autores de este artículo, sólo los estudios de diagnóstico por imagen permiten constatar su existencia.
Papel de la tomografía computarizadaLas glándulas suprarrenales se sitúan en el retroperitoneo, más exactamente en el espacio perirrenal, rodeadas por grasa, lo cual permite su clara identificación en la tomografía computarizada. La glándula derecha se sitúa por detrás de la vena cava inferior y por fuera de la crura diafragmática derecha. La izquierda es antero-medial al polo superior del riñón izquierdo y posterior al páncreas y la vena esplénica. En cuanto a los estudios sin contraste endovenoso las glándulas muestran densidad de tejidos blandos similar al hígado; posterior a la inyección de contraste las glándulas se realzan en forma moderada (6, 7).
El papel de la tomografía computarizada es detectar y localizar el tumor una vez el estudio bioquímico ha hecho el diagnóstico. El 90% de los feocromocitomas se localizan en la glándula suprarrenal y 10% son extra-adrenales. De éstos, 7% se originan en el retroperitoneo, en el órgano de Zuckerkandl (8). También se describen localizaciones en la pared de la vejiga y el mediastino.
En el estudio tomográfico los feocromocitomas usualmente aparecen como masas mayores de 3 cm de diámetro. Cuando sufren necrosis central pueden asemejarse a lesiones quísticas. La calcificación es rara y cuando sucede toman la forma de «cáscara de huevo». Este tumor adopta tal cantidad de formas que algunos autores lo han denominado «el camaleón» (9). La mayoría de feocromocitomas muestra valores de atenuación mayores de 10 unidades Hounsfield (UH). Los adenomas, por el contrario, debido a su contenido graso suelen mostrar densidad inferior a 10 UH.
Los feocromocitomas suelen captar ávidamente el medio de contraste endovenoso y eliminarlo relativamente rápido. El tiempo que tarda una masa en captar y eliminar el contraste se denomina «lavado», el cual, sin embargo es muy variable en este tumor por lo que a veces puede comportarse como un adenoma y en otras ocasiones como metástasis. En consecuencia, es virtualmente imposible diferenciarlo si sólo se tiene en cuenta este detalle.
En el caso en cuestión las lesiones en tomografía computarizada eran sólidas, homogéneas, sin áreas de necrosis ni calcificación, con densidad mayor de 10 UH en fase simple y con captación intensa y homogénea en fase contrastada; es decir, tenían el comportamiento que más comúnmente se describe en los feocromocitomas.
Papel de la resonancia magnéticaA través de este medio, la forma más común del feocromocitoma corresponde a la de una masa con baja señal en secuencias de T1 y alta en secuencias de T2. Se realzan de manera significativa en secuencias de T1 posterior a la inyección de gadolinio endovenoso (10). Son hiperintensos en secuencias de T2 con supresión grasa. Sin embargo, existe un número importante de feocromocitomas que tienen un comportamiento inusual que conduce al radiólogo a un diagnóstico erróneo. Aproximadamente 35% de los feocromocitomas se interpretan como lesiones malignas o adenomas benignos; esto último cuando existe atípicamente, baja señal en secuencias de T2 (11).
En el caso, ambos tumores mostraron baja señal en secuencias de T1 y alta en secuencias de T2.
Papel del ultrasonidoÉste no se considera como una herramienta de primera línea en este contexto. Cuando, de manera incidental, se descubre un feocromocitoma en ultrasonido, suele tratarse de una masa sólida, grande, con bordes bien definidos y ecogenicidad intermedia. Son de ecogenicidad heterogénea cuando existen zonas de necrosis o hemorragia intratumoral (12).
Rol de la medicina nuclearLa metayodobencilguanidina (MIBG), molécula introducida en 1980, se asemeja al neurotransmisor norepinefrina, lo que permite su acumulación en los tejidos de origen simpático medular, donde se concentra a nivel de los gránulos de depósito de las catecolaminas. Esa característica permite que, cuando unida a trazadores radioactivos como el 131I y el 123I, se pueda rastrear el cuerpo entero en busca de tumores que se originan en la médula adrenal o en la cresta neural (13). Su sensibilidad y especificidad para el diagnóstico del feocromocitoma esporádico primario, cuando es marcado con 131I, es cercana al 79,5% y 98%, respectivamente (14). No obstante, se destaca que con el advenimiento del 123I, que ofrece imágenes con mejor resolución, la sensibilidad del procedimiento radioisotópico está cerca de 90% (15).
El patrón gammagráfico característico del estudio con MIBG radiomarcado en el feocromocitoma bilateral, consiste en la hiperconcentración del trazador en la topografía de las glándulas suprarrenales, siendo la hiperplasia de la médula adrenal bilateral en la neoplasia multiendocrina su diagnóstico diferencial esencial (16), en cuanto a que el bloqueo de la captación del radioelemento por el tumor debido a interferencia farmacológica (anfetaminas, anorexígenos, antihipertensivos simpaticomiméticos, descongestionantes nasales, fenotiazinas y antidepresivos tricíclicos, entre otros) puede contribuir a falsos negativos (17, 18). Otros aspectos relevantes, tales como el tamaño del tumor, la disminución en su capacidad de producción de epinefrina, la bilateralidad y la presencia de MEN 2A/2B pueden disminuir la sensibilidad del procedimiento (19), y la desdiferenciación celular del mismo puede ocasionar ausencia completa de captación del MIBG radiomarcado.
Cuando la clínica, la tomografía computarizada y la resonancia magnética sugieren la presencia de feocromocitoma uni o bilateral, y el estudio con MIBG radiomarcado es negativo, cobran importancia otros dos procedimientos radionucleares que expresan otras características metabólicas de esos tumores (5, 20, 21):
- Los estudios radioisotópicos para la detección de receptores de somatostatina (gammagrafías con 111In-Octreotride y con 99mTc-EDDA/HYNIC-octreotate, y la tomografía por emisión de positrones con 68Ga-DOTATOC), que rastrean la sobreexpresión de esos receptores, fundamentalmente del 2A y 3, común a la mayoría de los feocromocitomas.
- La tomografía por emisión de positrones con glucosa radiomarcada (FDG-PET), ya que por regla general, a mayor desdiferenciación celular, mayor consumo de glucosa, en este caso radiomarcada, y mayor probabilidad de malignización.
ConclusiónSe describe un caso de feocromoctioma bilateral en el cual los estudios de diagnóstico por imagen, estructurales y funcionales, no sólo demuestran su utilidad para localizar y confirmar esa patología, sino que permiten identificar su bilateralidad, información relevante que determina la terapéutica apropiada.
Bibliografía1. Ariton M, Juan CS, AvRuskin TW. Pheochromocytoma: clinical observations from Brooklyn tertiary hospital. Endocr Pract 2000; 6 (3): 249-52. [ Links ]
2. Omura M, Salto J, Yamaguchi K, et al. Prospective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan. Hypertens Res 2004; 27 (3): 193-202. [ Links ]
3. Werbel S, Ober P. Pheochromocytoma. Update on diagnosis, localization and management. Med Clin North Am 1995; 79: 131-53. [ Links ]
4. Bravo EL, Tagle R. Pheochromocytoma: state-of-the-art and future prospects. Endocr Rev 2003; 24 (4): 539-53. [ Links ]
5. Donckier JE, Michel L. Pheochromocytoma: state-of-the-art. Act Chir Belg 2010; 110 (2):140-8. [ Links ]
6. Montagne JP, Kressel HY, Korobkin M, et al. computed tomography of the normal adrenal gland. AJR Am J Roentgenol 1978; 130: 963-966. [ Links ]
7. Wilms G, Baert A, marchal G, et al. Computed tomography of the normal adrenal glands: correlative study with autopsy specimens. J Comput Assist Tomogr 1979; 3: 467-469. [ Links ]
8. Hayes WS, Davidson AJ, Grimley PM, et al. Extra adrenal retroperitoneal paraganglioma: cinical, pathologic, and CT findings. AJR Am J Roentgenol 1990; 155: 1247-1250. [ Links ]
9. Blake MA, Kalra MK, Maher MM, et al. Pheochromocitoma: an imaging chameleon. Radiographics 2004; 24: S87-9. [ Links ]
10. Mitchell DG, Crovello M, Matteucci T, Petersen RO, Miettinen MM. Benign adrenocortical masses: diagnosis with chemical shift MR imaging. Radiology 1992; 185: 345-351. [ Links ]
11. Varghese JC, Hahn PF, Papanicolau N, Mayo-Smith WW, Gaa JA, Lee MJ. MR differentiation or pheochromocytoma from other adrenal lesions based on qualitative analysis of T2 relaxation times. Clin Radiol 1997; 52: 603-606. [ Links ]
12. Bowerman RA, Silver TM, Jaffe MH, et al. Sonography of adrenal pheochromocytomas. AJR 1981; 137: 1227-1231. [ Links ]
13. Wieland DM, Wu J, Brown LE, et al. Radiolabeled adrenergic neuro-blocking agents: adrenomedulallary Imaging with [131I] iodobenziylguanidine. J Nucl Med 1980; 21 (4): 349-53. [ Links ]
14. Shapiro B, Copp J, Sisson J, Eyre P, Wallis J, Beierwaltes W. Iodine-131 metaiodobenzylguanidine for the locating of suspected pheochromocytoma: Experience in 400 cases. J Nucl Med 1985; 26 (6): 576-585. [ Links ]
15. Zapanti E, Ilias I. Pheochromocytoma: physiopathologic implications and diagnostic evaluation. Ann Ny Acad Sci 2006; 1068: 346-60. [ Links ]
16. Valk TW, Frager MS, Gross MD, et al. Spectrum of pheochromocytoma in multiple endocrine neoplasia: a scintigraphic portrayal using 131I-metaiodobenzylguanidine. Ann Intern Med 1981; 94: 762-767. [ Links ]
17. Solanki KK, Bomanji J, Moyes J, et al. A pharmacological guide to medicines wich interfere with biodistribution of radiolabeled meta-iodobenzylguanidine (MIBG). Nucl Med Commun 1992; 13: 513-521. [ Links ]
18. Nakajo M, Shapiro B, Copp J, et al. The normal and abnormal distribution of the adrenomedullary imaging agent m-(I-131)iodobenzylguanidine (I-131 MIBG) in man: evaluation by scintigraphy. J Nucl Med 1983; 24: 672-682. [ Links ]
19. van der Harst E, de Herder WW, Bruining HA, Bonjer HJ, de Krijger RR, Lamberts SW, et al. [(123)I]metaiodobenzylguanidine and [(111)In]octreotide uptake in benign and malignant pheochromocytomas. J Clin Endocrinol Metab 2001; 86 (2): 685-93. [ Links ]
20. Khan S, Win Z, Szysko T, Lloyd C, Dunn J, Alavi A, Nahhas A. Pet imaging of pheochromocytoma. PET Clin 2008; 2: 341-349. [ Links ]
21. Kikuchi F, Imachi H, Murao K, Ohyama T, Miyai Y, Kushida Y, et al. Positron emission tomography with 18f-fluorodeoxyglucose is a useful tool for the diagnosis of pheochromocytomas without distant metastasis, where malignancy is suspected on the basis of histopathologic analysis. Am J Med Sci 2010; 340 (2): 160-3. [ Links ]














