Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.19 no.1 Bogota Jan./Feb. 2012
(1) Grupo de Nutrición. Departamento de Ciencias Fisiológicas. Escuela de Ciencias Básicas. Facultad de Salud. Universidad del Valle. Cali, Colombia. Calle 4B No. 36-00, Sede San Fernando.
Correspondencia: Dr. Robinson Ramírez-Vélez. Correo electrónico: robin640@hotmail.com y/o Dr. Milton Fabián Suárez-Ortegón. Correo electrónico: fabian.suarezuv@gmail.com. Universidad del Valle. Calle 4B No. 36-00 Sede San Fernando. Departamento de Ciencias Fisiológicas. Edificio 116. Santiago de Cali, Valle del Cauca, Colombia. Teléfono: (+572) 5 18 56 03.
Recibido: 12/01/2011. Aceptado: 13/06/2011.
Objetivo: evaluar la correlación entre las concentraciones séricas de ferritina y los marcadores de riesgo cardiovascular con el tiempo de actividad física y sedentarismo auto-reportados en hombres aparentemente sanos.
Métodos: se incluyeron 69 hombres pertenecientes a tres empresas de servicio privado y público del área metropolitana de Cali, Colombia, con edades entre 25 y 64 años. Se aplicó la versión corta del International Physical Activity Questionnaire (IPAQ) y se agruparon cuatro categorías de actividad física:
1. Minutos actividad física intensa (AFI)/semana.
2. Minutos actividad física moderada (AFM)/semana.
3. Minutos caminata/semana.
4. Minutos sentado/día.
Los marcadores de riesgo cardiovascular se definieron con base en los criterios del ATP-III y la Federación Internacional de Diabetes.
Resultados: se encontraron correlaciones positivas en los sujetos que auto-reportaban mayor tiempo en actividades sedentarias según la categoría del IPAQ (minutos promedio sentado/día) en los indicadores antropométricos: porcentaje de grasa corporal (rho=0,249, p<0,05), índice de masa (rho=0,268, p<0,05) y circunferencia de cintura (rho=0,266, p<0,05). Este mismo comportamiento se observó en las variables bioquímicas: ferritina (rho=0,247, p<0,05), triglicéridos (rho=0,258, p<0,05), insulina (rho=0,284, p<0,05) e índice HOMA (rho=0,261). Asimismo, se evidenciaron menores niveles de c-HDL a menores niveles de actividad física (rho=-0,279; p<0,05).
Conclusiones: el tiempo sedentario (minutos sentado/semana) reportado por los sujetos, se correlacionó de manera positiva con los niveles de ferritina así como con la resistencia a la insulina y los marcadores de riesgo cardiovascular. Los depósitos de hierro corporales estimados como ferritina sérica, al relacionarse con parámetros de sedentarismo, se comportan como un potencial marcador de riesgo cardiovascular.
Palabras clave: actividad física, sedentarismo, riesgo cardiovascular, hombres, Colombia.
Objective: to evaluate the correlation between serum ferritin and cardiovascular risk markers with the time of self-reported physical activity and sedentary life style in apparently healthy men.
Methods: we included 69 men from three private and public companies in the metropolitan area of Cali, Colombia, aged between 25 and 64. The short version of the International Physical Activity Questionnaire (IPAQ) was applied, and were grouped in four categories of physical activity:
1. Minutes of intense physical activity (IFA)/week.
2. Minutes of moderate physical activity (MFA)/week.
3. Minutes of walk/week.
4. Minutes of sitting/day.
Cardiovascular risk markers were defined based on the criteria of the ATP-III and the International Diabetes Federation.
Results: positive correlations were found in subjects who self-reported more time in sedentary activities according to the IPAQ category (average minutes sitting/day) in anthropometric indicators: percentage of body fat (rho = 0.249, p <0.05), mass index (rho = 0.268, p <0.05) and waist circumference (rho = 0.266, p <0.05). This same behavior was observed in biochemical variables: ferritin (rho = 0.247, p <0.05), triglycerides (rho = 0.258, p <0.05), insulin (rho = 0.284, p <0.05) and HOMA index (rho = 0.261). Also, lower levels of HDL-C were evidenced with lower levels of physical activity (rho =- 0.279, P <0.05).
Conclusions: sedentary time (minutes sitting/week) reported by the subjects correlated positively with ferritin levels as well as with insulin resistance and cardiovascular risk markers. The body iron deposits estimated as serum ferritin, when related to sedentary lifestyle parameters, behave as a potential marker of cardiovascular risk.
Keywords: physical activity, sedentary lifestyle, cardiovascular risk, men, Colombia.
Introducción
En los últimos años se ha ampliado considerablemente el conocimiento del papel del hierro en la fisiología humana (1). De hecho, las concentraciones de ferritina sérica no sólo se consideran como un marcador de las reservas de hierro, sino también como un biomarcador elevado en individuos diabéticos, en particular en aquellos con diabetes mellitus tipo 2 (2) y síndrome metabólico (3). Salonen y colaboradores (2) demostraron que el aumento en las concentraciones de ferritina sérica predecía el desarrollo de diabetes mellitus tipo 2. Del mismo modo, en Estados Unidos, Ford y Cogswell (4), reportaron, en pacientes con diabetes mellitus tipo 2, riesgo de presentar concentraciones elevadas de ferritina sérica de 4,94 en varones y de 3,61 en mujeres. En sujetos sanos en esta población, 28% de los varones y 12,2% de las mujeres tenían depósitos elevados de hierro (5).
De la misma manera, se ha reportado un incremento de ferritina sérica con mayor índice de masa corporal (IMC), niveles elevados de triglicéridos y colesterol LDL (6), y mayores valores de presión arterial sistólica y diastólica (7, 8). Al parecer, el estrés oxidativo generado en reacciones intracelulares donde participa el hierro en estado ferroso, sería el mecanismo por el cual el exceso de hierro podría inducir disminución de la señalización de insulina y generar alteraciones metabólicas con la consecuente aparición de resistencia a la insulina (9).
No obstante, algunos autores describen a la ferritina más como un marcador de inflamación (debido a su carácter de reactante de fase aguda) que como un indicador de estado de hierro en relación con el riesgo de diabetes mellitus tipo 2 (10). Igualmente, la inflamación de tipo subclínico evaluada por niveles de proteína C reactiva de alta sensibilidad (PCR-AS), es un evento que se asocia con resistencia a la insulina y síndrome metabólico (11) . Por ende, la evaluación concomitante de ferritina y PCR-AS es importante tanto para establecer su relación con la resistencia a la insulina y el riesgo cardiovascular, como para estimar la inflamación como posible confusor en los valores de ferritina sérica.
Lakka y colaboradores (12) y Lui y colaboradores (13) informaron que la actividad física desempeña un papel importante en la reducción de la concentración de ferritina sérica. Una disminución en la concentración de ferritina sérica mostró ser dependiente tanto en la duración como en la frecuencia de la actividad física (10, 14). Por ejemplo, en estudios observacionales (15), sujetos que reportaban niveles de actividad física de moderada intensidad, definida como la actividad capaz de generar un gasto calórico de 3 a 5,9 equivalentes metabólicos (MET) o de 3,5 a 7 kcal/min, presentaban menores valores de las concentraciones de ferritina sérica, al compararlos con sus pares sedentarios. En Finlandia, Lakka y colaboradores (12) demostraron que la concentración media de ferritina sérica era 16,8% menor en los individuos en el cuartil más alto de actividad física (> 2,6 horas por semana) en comparación con aquellos en el cuartil más bajo de actividad física (< 0,4 horas por semana), aunque otros autores han demostrado escasa asociación entre el nivel de actividad física con la concentración de ferritina sérica (16-18). Por ejemplo, Delavar y colaboradores (19) y Dalacorte y su equipo (20) demostraron una discreta relación entre el auto-reporte de la actividad física con los cuestionarios validados para determinar esta variable, como el IPAQ (international physical activity questionnaire) con los biomarcadores asociados a riesgo cardiovascular y síndrome metabólico.
Teniendo en cuenta lo anterior, y ante el escaso reporte de trabajos en la región colombiana, el propósito de este estudio fue evaluar la correlación entre las concentraciones séricas de ferritina y los marcadores de riesgo cardiovascular con el tiempo de actividad física y de sedentarismo auto-reportados en hombres aparentemente sanos.
MétodosEstudio observacional transversal, en el que se incluyeron 69 hombres, con labores de oficina, pertenecientes a tres entidades del área metropolitana de Cali, Colombia (una del sector privado y dos del sector público), con edades entre los 25 y 64 años. La captación fue por contacto directo en el lugar de trabajo aplicando una encuesta de antecedentes de salud para detectar criterios de elegibilidad. Dos de los autores comprobaron de forma independiente la calidad de los datos registrados en los cuestionarios estandarizados como el IPAQ, la encuesta sociodemográfica y la encuesta de antecedentes de salud. Las muestras de sangre se tomaron poco después de la entrevista, previa firma del consentimiento informado y aprobación del comité de ética en humanos de la Universidad del Valle.
Se excluyeron aquellos con diagnóstico médico o clínico de enfermedad sistémica mayor (incluidos procesos malignos), diabetes, hipertensión arterial, hipo/hipertiroidismo, índice de masa corporal mayor o igual a 35,0 kg/m2, antecedentes de historia de abuso de drogas o alcohol, consumo de multivitamínicos, uso de estatinas y padecimiento de procesos inflamatorios (traumas, contusiones) o infecciosos, y tabaquismo (antiguo y actual).
Medición de los factores de riesgo cardiovascular
Se evaluaron marcadores de riesgo cardiovascular reportados en el Programa Nacional de Educación del Colesterol en los Estados Unidos de Norteamérica (NECP por sus sigla en inglés) (21) así como valores de PCR-AS, ferritina y sensibilidad a la insulina mediante el calculó del índice HOMA-RI (Homeostatic Model Assesment–Insulin Resistance) con la fórmula: [Insulina basal en mUI/L x glicemia basal en mmol/L)/22,5], como nuevos marcadores asociados al síndrome metabólico y a enfermedades cardiovasculares (22, 23). Se aplicaron también los criterios y la definición de la Federación Internacional de Diabetes (IDF por su sigla en inglés) (24), los cuales se han usado como puntos de corte en población colombiana (25). Para este propósito, era necesario evaluar la presencia de los componentes de síndrome metabólico: obesidad abdominal (circunferencia de cintura ≥ a 88 cm), triglicéridos (≥ 150 mg/dL), niveles bajos de colesterol c-HDL (< 40 mg/dL en hombres), presión arterial sistólica ≥ 130 mm Hg, presión arterial diastólica ≥ 85 mm Hg), y glucemia en ayunas ≥ a 100 mg/dL. Se definió individuo con síndrome metabólico aquel que presentara obesidad abdominal más al menos otros dos componentes.
Medición auto-reportada del nivel de actividad física
Se aplicó de manera auto-diligenciada la versión corta del IPAQ recomendado por la Organización Mundial de la Salud (www.ipaq.ki.se/questionnaires/ColombiaIQshtel.pdf), como medida válida para estimar la actividad física por un encuestador entrenado. Esta versión consta de siete preguntas que indagan la frecuencia, duración e intensidad de participación en actividades físicas como caminar o correr durante la semana inmediatamente previa a la inclusión en el estudio y en diferentes contextos de la vida cotidiana.
Para el análisis de correlación, se agruparon en las cuatro categorías internas del IPAQ así:
1. Minutos actividad física intensa (AFI)/semana.
2. Minutos actividad física moderada (AFM)/semana.
3. Minutos caminata/semana.
4. Minutos sentado/día.
Medición antropométrica y composición corporal
Se llevó a cabo un examen físico que incluyó antropometría aplicando el protocolo de López y colaboradores (26). Para el registro de la talla se usó un estadiómetro marca Kramer®, y para el peso corporal balanza de piso marca Tanita®. La circunferencia de cintura se midió con cinta métrica entre la costilla inferior y la cresta ilíaca, con el participante en posición de pie y ligero de ropa. La composición corporal se determinó mediante análisis de bioimpedancia utilizando el dispositivo (Bodystat®; Quadscan 4000, UK), para calcular de manera indirecta el porcentaje de grasa corporal a partir de la masa grasa total (kg) y el peso corporal.
Medición clínica
La presión arterial se midió con esfigmomanómetro digital (OMRON®) en el brazo derecho en dos ocasiones diferentes, con intervalos de cinco minutos entre sí, con los participantes sentados en posición confortable y después de diez minutos de reposo. Adicionalmente, los participantes diligenciaron una encuesta de antecedentes personales y familiares de salud.
Medición bioquímica
Por punción en la vena antecubital se extrajeron 10 mL de sangre en tubos vacutainer sin aditivo. Dichas muestras se transportaron al laboratorio en neveras entre 4°C y 8°C, y en un tiempo no mayor a una hora; luego se centrifugaron a 3.000 rpm para la obtención del suero hasta su procesamiento. Los marcadores bioquímicos se determinaron por las siguientes técnicas: PCR-AS y ferritina por métodos inmunoturbidimétricos en espectrofotómetro automatizado A-15 (Biosystems®, Spain); glucosa, colesterol total, triglicéridos (TAG), colesterol-HDL (método colorimétrico directo en espectrofotómetro automatizado por solubilización con detergente, Biosystems®, Spain) (27); mientras que el índice arterial se calculó con la fórmula: colesterol total/colesterol-HDL. Para el cálculo del c-VLDL y del c-LDL, se utilizaron las ecuaciones de Friedewald y colaboradores (28): c-VLDL=TAG/5 y c-LDL=colesterol total–(c-HDL)–c-VLDL (para los sujetos que tenían TAG < 400 mg/dL). De otra parte, los niveles de insulina se determinaron por ensayo de quimioluminiscencia (kit IMMULITE 1000®, San José, CA) (29).
Análisis de datos
En primer lugar se realizó un análisis exploratorio para determinar la frecuencia y distribución de cada una de las variables estudiadas. Para estimar la relación entre las cuatro categorías internas del cuestionario IPAQ y los marcadores de riesgo cardiovascular, se utilizaron los coeficientes de correlación de Spearman. Un valor p<0,05 se consideró como significativo y todos los análisis se realizaron en el paquete estadístico SPSS (Statistical Program Version 13 Chicago, IL.).
ResultadosEn la tabla 1 se describen las medias y desviaciones de las características clínicas, antropométricas y bioquímicas de la población estudiada. Todos los parámetros se encuentran dentro de los límites de normalidad.

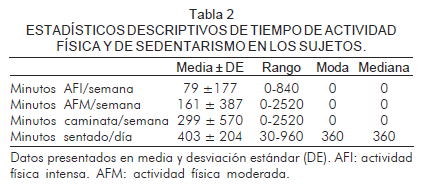
La caminata es el evento de actividad física que figura con más tiempo de práctica en los sujetos. La moda y la mediana para el tiempo de todas las actividades físicas es cero minutos, mientras el tiempo de permanencia sentado estimado al día más reportado por los sujetos, es 360 minutos (6 horas) (Tabla 2).
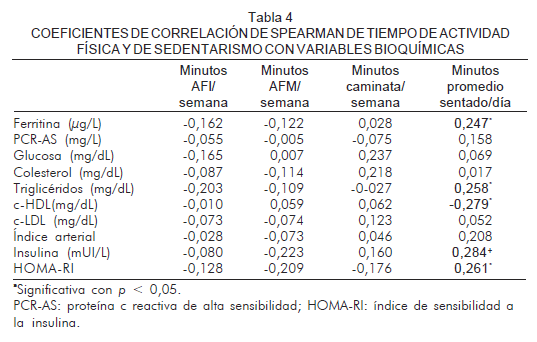
Se encontraron correlaciones positivas en los sujetos que auto-reportaban mayor tiempo sedentario según la categoría del IPAQ (minutos promedio sentado/día) en los indicadores antropométricos: porcentaje de grasa corporal (rho=0,249), IMC (rho =0,268) y circunferencia de cintura (rho =0,266) (Tabla 3). Este comportamiento se observó con las variables bioquímicas: ferritina (rho =0,247), triglicéridos (r=0,258), insulina (rho =0,284) e HOMA-RI (rho =0,261). También se observaron menores niveles de c-HDL cuanto mayor tiempo sentado se reportó (rho =-0,279) (Tabla 4).
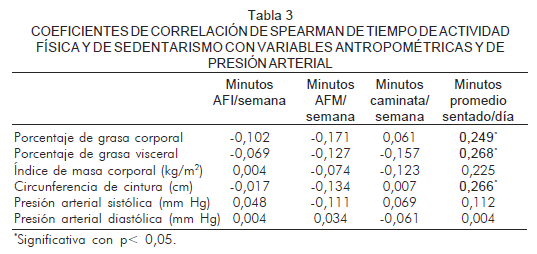
El objetivo de este estudio fue evaluar la correlación de las concentraciones séricas de ferritina y los marcadores de riesgo cardiovascular con el tiempo de actividad física y de sedentarismo auto-reportados en hombres aparentemente sanos. Los tiempos de actividad física intensa (AFI), actividad física moderada (AFM) y caminata no mostraron relación con los marcadores de riesgo cardiovascular, pese a que la moda y la mediana de actividad física muestran una población con altos niveles de sedentarismo. Es probable que las intensidades utilizadas en este trabajo (AFI y AFM), así como sus tiempos de ejecución (duración), no sean suficientes para demostrar una relación con estos biomarcadores. En contraste, los sujetos que auto-reportaban mayor tiempo de permanencia sentados se correlacionó con mayores valores de porcentaje de grasa corporal y visceral (rho=0,249 y rho=0,268 respectivamente), IMC (rho =0,268), circunferencia de cintura (r=0,266), niveles de ferritina sérica (rho =0,247), triglicéridos (rho =0,258), insulina (r=0,284) e HOMA-RI (r=0,261), y coinciden con los reportes de otros autores (6-11).
Como se mencionó anteriormente, se ha determinado la influencia del metabolismo del hierro en la etiopatogenia y la expresión de diferentes procesos relacionados con aterosclerosis e inflamación. El incremento del riesgo cardiovascular podría estar sustentado en un aumento de radicales libres generados en reacciones donde participa el hierro en estado ferroso, que podría alterar la sensibilidad a la insulina y la reactividad vascular (1).
Otra de las interacciones metabólicas que se describen es el aumento en los depósitos de hierro con el metabolismo de la glucosa que conduce a un estado de resistencia a la insulina y obesidad (1). La correlación positiva de ferritina sérica con la distribución central de la grasa corporal (rho=0,266, p<0,05) y otras medidas de obesidad como el porcentaje de grasa corporal (rho=0,249, p<0,05) y el IMC (rho=0,268, p<0,05), coinciden con lo reportado por Tuomainen y colaboradores (30). Otros factores de riesgo cardiovascular que se reportan están asociados con el incremento de la ferritina sérica son el colesterol total, el colesterol ligado a las lipoproteínas de alta densidad (c-HDL) y la relación HDL2/HDL3; estos dos últimos en correlación inversa (31). Los autores del artículo que aquí se presenta hallaron que los sujetos que auto-reportaban mayor tiempo de permanencia sentado tenían menores niveles de c-HDL (rho=-0,279, p<0,05).
Algunos autores sugieren que la ferritina sérica en relación con el riesgo de diabetes mellitus tipo 2 es un marcador de inflamación más que un marcador de sobrecarga de hierro, debido a su carácter de proteína de fase aguda (32). Es importante destacar la discrepancia de correlación con el tiempo de sedentarismo entre ferritina y PCR-AS, por lo que puede descartarse una confusión por inflamación en los valores de ferritina y sus relaciones con otras variables. Así mismo, estas dos variables no mostraron correlación significativa en los sujetos (datos no mostrados).
En el presente trabajo se registró la relación coherente entre el tiempo sentado con la resistencia a la insulina estimada mediante el índice HOMA-RI (rho=0,261, p<0,05), la cual se confirma con las otras variables antropométricas y bioquímicas, que guardan estrecha relación con el metabolismo en general. Al respecto de esta relación, el estudio de Esteghamati y colaboradores, desarrollado en Irán (33) en 3.101 sujetos, reveló la correlación significativa entre el tiempo de actividad física intensa y moderada con el índice HOMA-RI (rho=-0,28, p<0,05). En esa investigación los niveles de sedentarismo se relacionaron de manera positiva con mayores cifras de HOMA-RI, lo cual coincide con este reporte y fue confirmado, además, por Suija y colaboradores (34).
Sobre este particular, intervenciones descritas por McClung y colaboradores (35) y Le colaboradores (36) mostraron menores niveles de ferritina sérica en las personas que participaban de programas regulares de actividad física, cuando se comparaban con los sujetos no intervenidos. Del mismo modo, Lakka y su equipo de investigadores (10) en una cohorte de hombres finlandeses, demostraron que las personas que acusaban mayores niveles de actividad física auto-reportada presentaban menores niveles de ferritina sérica. Siguiendo con este último estudio y teniendo en cuenta que previamente la ferritina sérica había sido hallada como predictora de un primer infarto de agudo del miocardio en población masculina de Finlandia (37), los autores teorizaron un posible efecto benéfico de la actividad física en la disminución del riesgo de sufrir un infarto agudo del miocardio, mediado, en parte, por la reducción en los depósitos de hierro. De acuerdo con esta hipótesis, la evidencia ha demostrado un efecto inflamatorio de la actividad física a corto plazo y un efecto antiinflamatorio a largo plazo (38, 39). Sin embargo, esta relación no se identificó en este trabajo.
Por su parte, se pueden identificar dos limitaciones básicas en este estudio. La primera es la naturaleza transversal de las mediciones, la cual no permite establecer relaciones de causalidad en las correlaciones observadas; no obstante, los hallazgos son útiles para incrementar la evidencia acerca de la relación entre actividad física, concentraciones de ferritina sérica y algunos marcadores de riesgo cardiovascular. La segunda tiene que ver con que la información fue reportada en el IPAQ por los participantes, lo cual incrementa las posibilidades de sesgo de memoria. Esta limitación puede estar controlada por el corto período de referencia que utiliza el IPAQ. En cuanto a las fortalezas del estudio, los estrictos criterios de exclusión permitieron un análisis más cuidadoso debido a que el antecedente de enfermedades y el consumo de cigarrillo, medicamentos y multivitamínicos pueden afectar las variables de estudio.
En conclusión, el tiempo sedentario (minutos sentado/semana) reportado por los sujetos, se correlacionó de forma positiva con los niveles de ferritina así como con la resistencia a la insulina y los marcadores de riesgo cardiovascular. Los depósitos de hierro corporales estimados como ferritina sérica al relacionarse con parámetros de sedentarismo se comportan como un potencial marcador de riesgo cardiovascular.
AgradecimientosEste estudio es un sub-análisis derivado de un proyecto mayor financiado por COLCIENCIAS llamado: «Relación de niveles de hierro con resistencia a insulina y diabetes mellitus tipo 2», Contrato N° 1106-45921521.
Bibliografía1. Fernández-Real JM, Esteve E, Ricart W. Hierro, resistencia a la insulina y riesgo cardiovascular. Clin Invest Arterioscl 2004; 16: 114-21. [ Links ]
2. Salonen JT, Tuomainen T-P, Nyyssönen K, Lakka H-M, Punnonen K. Relation between iron stores and non-insulin-dependent diabetes in men: case-control study. BMJ 1999; 317: 727-30. [ Links ]
3. Oshaug A, Bugge KH, Bjonnes CH, Borch-Iohnsen B, Neslein IL. Prevalence of body iron excess in the metabolic syndrome. Diabetes Care 2005; 28: 2061-3. [ Links ]
4. Ford ES, Cogswell ME. Diabetes and serum ferritin concentration among U.S. adults. Diabetes Care 1999; 22: 1978-83. [ Links ]
5. Fleming DJ, Jacques PF, Tucker KL, Massaro JM, D'Agostino RB, Wilson PWF, et al. Iron status of the free-living, elderly Framingham Heart Study cohort: an iron-replete population with a high prevalence of elevated iron stores. Am J Clin Nutr 2001; 73: 638-46. [ Links ]
6. Ikeda Y, Suehiro T, Yamanaka S, Kumon Y, Takata H, Inada S, et al. Association between serum ferritin and circulating oxidized low-density lipoprotein levels in patients with type 2 diabetes. Endocr J 2006; 53: 665-70. [ Links ]
7. Milman N, Kirchhoff M. Relationship between serum ferritin and risk factors for ischaemic heart disease in 2235 danes aged 30-60 years. J Intern Med 1999; 245: 423-33. [ Links ]
8. Galan P, Noisette N, Estaquio C, Czernichow S, Mennen L, Renversez JC, et al. Serum ferritin, cardiovascular risk factors and ischaemic heart diseases: A prospective analysis in the SU.VI.MAX (Supplementation en Vitamines et mineraux AntioXydants) cohort. Public Health Nutr 2006; 9: 70-4. [ Links ]
9. Dongiovanni P, Valenti L, Ludovica Fracanzani A, Gatti S, Cairo G, Fargion S. Iron depletion by deferoxamine up-regulates glucose uptake and insulin signaling in hepatoma cells and in rat liver. Am J Pathol. 2008; 172: 738-47. [ Links ]
10. Chen J, Wildman RP, Hamm LL, Muntner P, Reynolds K, Whelton PK, et al. Association between inflammation and insulin resistance in U.S. nondiabetic adults: results from the Third National Health and Nutrition Examination Survey Diabetes Care 2004; 27: 2960-5. [ Links ]
11. Gelaye B, Revilla L, Lopez T, Suárez L, Sánchez SE, et al. Association between insulin resistance and C-reactive protein among Peruvian adults. Diabetol Metab Syndr. 2010; 18 (2): 30. [ Links ]
12. Lakka TA, Nyyssonen K, Salonen JT. Higher levels of conditioning leisure time physical activity are associated with reduced levels of stored iron in Finnish men. Am J Epidemiol 1994; 140: 148-60. [ Links ]
13. Liu JM, Hankinson SE, Stampfer MJ, Rifai N, Willett WC, Ma J. Body iron stores and their determinants in healthy postmenopausal US women. Am J Clin Nutr 2003; 78: 1160-7. [ Links ]
14. Naimark BJ, Ready AE, Sawatzky JA. et al. Serum ferritin and heart disease: The effect of moderate exercise on stored iron levels in postmenopausal women. Can J Cardiol 1996; 12: 1253-17. [ Links ]
15. CDC. General physical activities defined by level of intensity. 2006. [Consultado: enero 2 de 2010]. Disponible en: http://www.cdc.gov/physicalactivity/everyone/health/index.html#ReduceDiabetes [ Links ]
16. Peach HG, Barnett NE. Relationship between serum ferritin concentration and established risk factors among men in a population with a high mortality from cardiovascular disease. Nutrition & Dietetics 2002: 59; 97-112. [ Links ]
17. Bergstrom E, Hernell O, Persson LA. Endurance running performance in relation to cardiovascular risk indicators in adolescents. Int J Sports Med 1997; 18: 300-7. [ Links ]
18. Furqan M, Nafees M, Jilani T, Hijazi M. Relationship between physical activity and serum ferritin levels. Annals of Abbasi Shaheed Hospital and Karachi Medical and Dental College 2002; 7: 306-9. [ Links ]
19. Delavar MA, Sann LM, Hassan ST, Linn KG, Hannachi P. Physical activity and the metabolic syndrome in middle aged women, Babol, Mazandaran province, Iran. EJSR 2008; 22: 411-21. [ Links ]
20. Dalacorte RR, Reichert CL, Vieira JL. Metabolic syndrome and physical activity in outhern Brazilian community-dwelling elders: a population-based, cross-sectional study. BMC Public Health. 2009; 21: 9-25. [ Links ]
21. Executive Summary of the Third Report of National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-97. [ Links ]
22. Freeman DJ, Norrie J, Caslake MJ, Gaw A, Ford I, Lowe GD, et al. C-reactive protein is an independent predictor of risk for the development of diabetes in the West of Scotland Coronary Prevention Study. Diabetes. 2002; 51: 1596-1600. [ Links ]
23. Fernández-Real JM, Ricart-Engel W, Arroyo E, Balançá R, Casamitjana-Abella R, Cabrero D, et al. Serum ferritin as a component of the insulin resistance syndrome. Diabetes Care 1998; 21: 62-8. [ Links ]
24. International Diabetes Federation, Prevalence {sede Web}. Bruselas: International Diabetes Federation; 2005 {citado 2008 11 Dic}. Disponible en: http://www.eatlas.idf.org/Prevalence/index.cfm [ Links ]
25. Pérez M, Casas JP, Cubillos-Garzón LA, Serrano NC, Silva F, Morillo CA, et al. Using waist circumference as a screening tool to identify Colombian subjects at cardiovascular risk. Eur J Cardiovasc Prev Rehabil 2003; 10: 328-335. [ Links ]
26. López CA, Ramírez-Vélez R, Gallardo CEG, Marmolejo LC. Características morfofuncionales de individuos físicamente activos. Iatreia 2008; 21: 121-8. [ Links ]
27. Kishi K, Ochiai K, Ohta Y. Highly sensitive cholesterol assay with enzymatic cycling applied to measurement of remnant lipoprotein-cholesterol in serum. Clin Chem 2002; 48: 737-741. [ Links ]
28. Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of LDL in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972; 18: 499-502. [ Links ]
29. Grassi J, Pradelles P. Compounds labelled by the acetylcholinesterase of Electrophorus Electricus. Its preparation process and its use as a tracer or marquer in enzymo-immunological determinations. United States patent, N° 1,047,330. September 10, 1991. [ Links ]
30. Tuomainen TP, Nyysönen K, Salonen R, Tervahauta A, Korpela H, Lakka T. Body iron stores are associated with serum insulin and blood glucose concentrations. Diabetes Care 1997; 20: 426-8. [ Links ]
31. Fernández-Real JM, Ricart W, Arroyo E, Balança R, Casamitjana R, Cabrero D. Serum ferritin as a component of the insulin resistance syndrome. Diabetes Care 1998; 21: 62-8. [ Links ]
32. Hernández C, Lecube A, Carrear A, Simó R. Soluble transferrin receptors and ferritin in type 2 diabetic patients. Diabet Med 2005; 22: 97-101. [ Links ]
33. Esteghamati A, Khalilzadeh O, Rashidi A, Meysamie A, Haghazali M, Asgari F, Abbasi M, et al. Association between physical activity and insulin resistance in Iranian adults: National Surveillance of Risk Factors of Non-Communicable Diseases (SuRFNCD-2007). Prev Med. 2009; 49: 402-6. [ Links ]
34. Suija K, Pechter U, Maaroos J, Kalda R, Rätsep A, Oona M, Maaroos HI. Physical activity of Estonian family doctors and their counselling for a healthy lifestyle: a cross-sectional study. BMC Fam Pract. 2010; 11: 48. [ Links ]
35. McClung JP, Karl JP, Cable SJ, Williams KW, Nindl BC, Young AJ, et al. Randomized, double-blind, placebo-controlled trial of iron supplementation in female soldiers during military training: effects on iron status, physical performance, and mood. Am J Clin Nutr. 2009; 90: 124-31. [ Links ]
36. Le TD, Bae S, Ed Hsu C, Singh KP, Blair SN, Shang N. Effects of cardiorespiratory fitness on serum ferritin concentration and incidence of type 2 diabetes: Evidence from the Aerobics Center Longitudinal Study (ACLS). Rev Diabet Stud. 2008; 5: 245-52. [ Links ]
37. Salonen JT, Nyyssönen K, Korpela H, Tuomilehto J, Seppänen R, Salonen R. High stored iron levels are associated with excess risk of myocardial infarction in eastern Finnish men. Circulation 1992; 86: 803-11. [ Links ]
38. Kasapis C, Thompson PD. The effects of physical activity on serum C-reactive protein and inflammatory markers: a systematic review. J Am Coll Cardiol.2005; 45: 1563-9. [ Links ]
39. Rawson ES, Freedson PS, Osganian SK, Matthews CE, Reed G, Ockene IS. Body mass index, but not physical activity, is associated with C-reactive protein. Med Sci Sports Exerc. 2003; 35: 1160-6. [ Links ]














