Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cardiología
versão impressa ISSN 0120-5633
Rev. Colomb. Cardiol. vol.19 no.5 Bogota set./out. 2012
(1) CES Cardiología, Medellín.
(2) Universidad CES, Medellín.
Correspondencia: Dr. William Uribe Arango. Cra. 43 No. 36-02 consultorio 1102, teléfono: (574) 444 0566. Medellín, Colombia. Correo electrónico: wuribea@une.net.co
Recibido: 14/09/2011. Aceptado: 24/01/2012.
La fibrilación auricular es la arritmia más frecuente en la práctica clínica y conlleva implicaciones significativas en la morbilidad y mortalidad cardiovascular de la población, así como en los costos para los sistemas de salud. No obstante, el conocimiento de la fisiopatología de la arritmia y el surgimiento de nuevas alternativas terapéuticas han cambiado la perspectiva en el manejo de esta enfermedad. Se realiza una revisión del desarrollo reciente en conceptos etiológicos y fisiológicos de la arritmia, así como en los esquemas de clasificación y evaluación del riesgo trombohemorrágico, además de los nuevos avances en terapias farmacológicas e intervencionistas.
PALABRAS CLAVE: fibrilación auricular, anticoagulación, fisiopatología.
Atrial fibrillation is the most common arrhythmia in clinical practice and carries significant implications in the population's cardiovascular morbidity and mortality as well as in costs for the health systems. However, the knowledge of the pathophysiology of the arrhythmia and the emergence of new alternative therapies have changed the perspective in the management of this disease. We realize a review of recent developments in etiological and physiological concepts of the arrhythmia, as well as a review of the classification schemes and thrombohemorrhagic risk assessment in addition to the new advances in pharmacological and interventional therapies.
KEYWORDS: atrial fibrillation, anticoagulation, pathophysiology.
Introducción
La fibrilación auricular se define como una taquiarritmia caracterizada por la activación descoordinada de las aurículas con el consecuente deterioro de la función mecánica de las aurículas (1).
Es considerada por muchos un problema de salud pública que crece día a día y que, guardadas las proporciones, ha tomado la magnitud de una epidemia. La información disponible demuestra una clara asociación entre el aumento de edad y el incremento de la prevalencia de fibrilación auricular, así como también un preocupante aumento de la prevalencia en los últimos 20 años, de manera tal que, haciendo una proyección al año 2050 se prevé que solo en los Estados Unidos de América, habrá más de 10 millones de personas con este padecimiento. Adicionalmente, la fibrilación auricular se asocia con enfermedad cerebrovascular (ECV), insuficiencia cardiaca congestiva y muerte (2).
En Colombia no existe información específica sobre la incidencia de fibrilación auricular; sin embargo, la enfermedad cardiovascular es la primera causa de muerte. Al mismo tiempo, entre 1985 y 2005 se dio un aumento constante de la esperanza de vida al nacer, lo cual representó un incremento de 4,3 años en los hombres y 4,8 en las mujeres (3), y por ello es probable que el comportamiento epidemiológico del país sea similar a lo que se reporta en la literatura médica en relación con la incidencia de fibrilación auricular.
Lo anterior pone de manifiesto la necesidad de retomar la fibrilación auricular como una de las causas de morbimortalidad más importante en nuestro medio, sobre todo en adultos mayores, generar responsabilidad clínica en el manejo de la misma y propender por la disminución no solo de los síntomas, sino de los riesgos asociados a ésta y la calidad de vida de los pacientes que la sufren.
Definición y clasificación
La fibrilación atrial es una taquiarritmia auricular caracterizada por una activación desordenada de las aurículas con el subsiguiente deterioro de la función mecánica. En el electrocardiograma se caracteriza por la ausencia de ondas P claramente definidas las cuales son reemplazadas por oscilaciones rápidas (ondas fibrilatorias) que pueden variar en tamaño, forma y frecuencia que se asocian con una respuesta ventricular irregular cuando la conducción AV es normal (4) (Figura 1). La respuesta ventricular durante fibrilación auricular depende de las propiedades del nodo AV, el nivel del tono vagal y simpático y la presencia de medicaciones que afecten la conducción AV (betabloqueadores, calcioantagonistas no dihidropiridínicos y digitálicos).
La terminología abundante utilizada para caracterizar a los subgrupos de pacientes con fibrilación auricular y la ausencia de concordancia en las definiciones, hicieron que el Grupo de Trabajo de Arritmias de la Sociedad Europea de Cardiología (WGA-ESC) y la Sociedad Norteamericana de Estimulación y Electrofisiología (NASPE), crearan un grupo de estudio para lograr un consenso en cuanto a terminología y clasificación (4). Para el clínico, una clasificación es útil si se basa en la presentación clínica y tiene implicaciones terapéuticas inherentes. El término fibrilación atrial aislada describe a aquellos pacientes menores de 60 años con fibrilación atrial que no tienen otra enfermedad cardíaca asociada (4, 5) y el término fibrilación atrial idiopática corresponde a los pacientes con fibrilación atrial sin ninguna otra enfermedad (4). La fibrilación auricular aislada representa el 30% de los pacientes con fibrilación atrial. La terminología propuesta para la clasificación actual de la fibrilación auricular se aplica a episodios que duran más de 30 segundos. Es importante definir si se está ante el primer episodio detectado el cual recibirá el nombre de evento inicial, bien sea sintomático o no, o autolimitado o no. Si el paciente ha tenido dos o más episodios, se dice que la fibrilación auricular es recurrente, cuyos casos se clasifican a su vez en paroxísticos, persistentes o permanentes. La fibrilación atrial paroxística se refiere a que cede espontáneamente en los primeros 7 días, usualmente en las primeras 48 horas. La fibrilación atrial persistente es aquella que dura más de 7 días o requiere cardioversión bien sea química o eléctrica para restaurar el ritmo sinusal (4, 6).
En las recientes guías europeas para el manejo de la fibrilación auricular se incorporó un nuevo término para clasificar a los pacientes con fibrilación atrial cuya duración sea mayor a 1 año, en quienes se decide realizar una estrategia de control de ritmo; a este subgrupo se le conoce con el nombre de fibrilación auricular persistente de larga duración, mientra que el término fibrilación auricular permanente se utiliza cuando la arritmia es aceptada como permanente por el paciente y el médico (1) (Figura 2). En este caso no deberán realizarse estrategias para el control del ritmo y de intentarlas la fibrilación auricular se denominaría persistente de larga duración.
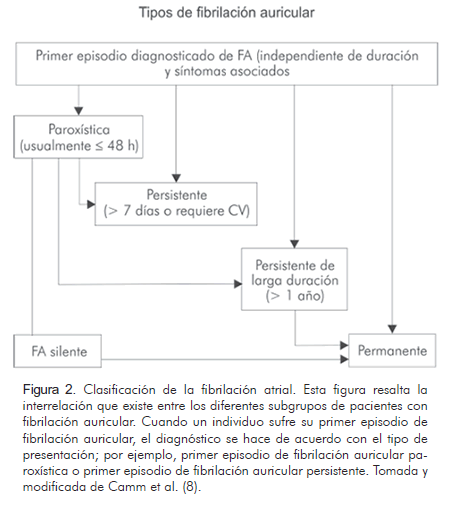
La forma persistente puede ser la primera presentación de la arritmia o estar precedida por episodios recurrentes de fibrilación auricular paroxística, y la forma permanente puede ser la primera presentación de una arritmia no autolimitada o ser precedida por episodios recurrentes autolimitados (4, 7) (Figura 2). Los individuos con enfermedad valvular se clasifican dentro de la categoría de pacientes con enfermedad cardíaca estructural. De acuerdo con lo anterior, la fibrilación atrial de los pacientes con enfermedad valvular, principalmente mitral, puede clasificarse como paroxística, persistente o permanente pero no aislada ni idiopática.
Esta clasificación ayuda al clínico a seleccionar las opciones terapéuticas correctas. El primer episodio detectado de fibrilación auricular puede ser sintomático o asintomático. Si es asintomático el control de la respuesta ventricular puede ser una opción terapéutica razonable; si es sintomático, la restauración del ritmo sinusal con anticoagulación apropiada de acuerdo a si la fibrilación auricular duró más de 48 horas, puede o no estar indicada. Sin embargo, la terapia antiarrítmica profiláctica no está recomendada para este primer episodio a menos que se presenten síntomas severos asociados con la fibrilación auricular; en ambas situaciones, la anticoagulación oral a largo plazo puede estar indicada si el paciente tiene alto riesgo de embolismo. Tanto la fibrilación auricular paroxística como la persistente tienen una marcada tendencia a la recurrencia. La estrategia terapéutica para ambos subgrupos es mantener el ritmo sinusal utilizando bloqueadores de los canales de sodio (antiarrítmicos Clase I) o bloqueadores de los canales de potasio (antiarrítmicos Clase III) o controlar la frecuencia cardíaca utilizando digitálicos, betabloqueadores o calcioantagonistas (Tabla 1) (4).
Epidemiología
La fibrilación atrial es la arritmia que más se asocia con un pronóstico adverso en la práctica clínica. Se ha estimado que 2,2 millones de americanos y 4,5 millones de europeos tienen fibrilación atrial paroxística o sostenida (9-12) con una prevalencia total de 0,4% en la población general, que aumenta a 2%-5% en mayores de 60 años y a 10% en mayores de 80 (13). Varios estudios estiman que la prevalencia de fibrilación auricular en Estados Unidos aumentará más de 2,5 veces y pasará de afectar a 2,2 millones a más de 10 millones de personas (2, 11).
La fibrilación atrial es un factor de riesgo independiente para enfermedad cerebrovascular, que conlleva aumento del riesgo de aproximadamente 3 a 5 veces, en pacientes que no reciben anticoagulación (14). Así mismo, el riesgo de enfermedad cerebrovascular crece con la edad, de 1,5% para individuos en sus 50 años a 23,5% para aquellos en sus 80.
De otra parte, la fibrilación auricular es la causa más común de embolismo cerebral y es la responsable del 15% de todos los accidentes cerebrovasculares trombóticos (15); en otras palabras, uno de cada seis accidentes cerebrovasculares trombóticos ocurre en pacientes con fibrilación atrial (16). Aproximadamente, 50% de todos los accidentes cerebrovasculares cardioembólicos se atribuyen a fibrilación auricular no valvular, 10% a enfermedad reumática cardíaca, usualmente acompañada de fibrilación auricular, y el 10% adicional a válvulas protésicas, las cuales también pueden estar acompañadas de fibrilación auricular (17). En 2003, la revista Circulation publicó un artículo que asociaba el accidente cerebrovascular trombótico en pacientes con fibrilación auricular, con el aumento de más del doble del riesgo de quedar postrados en cama en comparación con el accidente cerebrovascular trombótico por otras causas (18). Igualmente se identificó un incremento de demencia y una disminución de las capacidades cognitivas en pacientes con fibrilación auricular incluso sin que hubiesen presentado un accidente cerebrovascular trombótico (19).
En pacientes con enfermedad cardíaca reumática y fibrilación auricular, el riesgo de accidente cerebrovascular trombótico fue 17 veces mayor comparado con los individuos control en quienes la variable de edad había sido ajustada según se demostró en el estudio de Framingham, y es 5 veces mayor en relación con los pacientes que padecen fibrilación auricular no reumática (16). La fibrilación atrial tiene un impacto significativo sobre la longevidad, de hecho, aumenta la tasa de mortalidad por todas las causas, así como también la de origen cardiovascular (16, 20).
Adicionalmente, los pacientes con fibrilación auricular aumentaron 3,4 veces el riesgo de insuficiencia cardiaca, la cual a su vez es exacerbada por la fibrilación auricular debido a la reducción súbita del índice cardíaco que da lugar a un aumento de las presiones de llenado; de manera inversa la insuficiencia cardiaca promueve la aparición de fibrilación auricular ya que la sobrecarga de volumen produce fibrosis intersticial alterando así las propiedades de conducción y refractariedad de la aurícula izquierda (21).
Posiblemente, por todo lo anterior, las hospitalizaciones por fibrilación auricular también se han incrementado hasta en 60% en las últimas dos décadas lo cual convierte a esta condición en la primera causante de hospitalización en pacientes con arritmias cardiacas. Se sabe que los ingresos hospitalarios debidos a fibrilación auricular representan entre el 4% y 8% de todas las admisiones hospitalarias y de las cardiovasculares, respectivamente. Se calcula que el mayor costo directo de la fibrilación auricular es la hospitalización (19) llegando a representar hasta el 70% del costo total de la misma (22).
No menos importante es el impacto de la fibrilación auricular en la calidad de vida, ya que los pacientes con diagnóstico de fibrilación auricular tienen una disminución significativa en los diferentes indicadores de calidad de vida no solamente frente a los controles sanos, sino también frente a la población general y a pacientes con otras afecciones cardiacas como la enfermedad coronaria (23). Es frecuente que los pacientes cambien su rutina normal de vida por el temor a desencadenar un episodio de fibrilación auricular, lo cual está relacionado con el deterioro antes mencionado (19). Thrall y colaboradores llevaron a cabo un estudio para evaluar la asociación entre fibrilación auricular y las alteraciones del estado de ánimo, y encontraron que en la muestra de su estudio más del 30% de los pacientes presentaban cuadros severos de ansiedad y depresión, esta última asociada con la disminución de la calidad de vida (24).
Factores de riesgo
Los factores de riesgo clínicos para sufrir fibrilación atrial incluyen: edad, diabetes mellitus, hipertensión arterial, falla cardíaca congestiva, enfermedad valvular reumática y no reumática e infarto del miocardio (2). Los factores de riesgo para accidente cerebrovascular en fibrilación auricular tradicionalmente han incluido: enfermedad cardíaca reumática, edad mayor a 65 anos, hipertensión arterial, enfermedad cerebrovascular previa (incluida la isquemia cerebral transitoria), diabetes mellitus, falla cardíaca reciente y dilatación atrial o ventricular por ecocardiografía (25, 26). Más recientemente, la Sociedad Europea de Cardiología clasificó estos factores en: factores de riesgo mayores (accidente cerebrovascular trombótico previo, ataque isquémico transitorio, embolismo sistémico o edad > 75 años) o factores de riesgo clínicamente relevantes no mayores (falla cardiaca o disfunción ventricular izquierda moderada o severa [Ej. FEVI < 40%], hipertensión, diabetes mellitus, género femenino, edad entre 65–74 anos y enfermedad vascular) (8).
Mecanismos fisiopatológicos
Factores atriales
El incremento de la presión y el volumen auricular relacionado con la enfermedad valvular concluye en procesos que generan cambios ultraestructurales mediante la activación de fibroblastos, el aumento del depósito de colágeno y la remodelación estructural y eléctrica con heterogeneidad en la conducción, que facilitan el inicio y la perpetuación de la arritmia. Las aurículas de los pacientes con fibrilación auricular muestran anormalidades estructurales diferentes a los cambios causados por la enfermedad cardíaca de base. El análisis histológico ha evidenciado fibrosis en parches con yuxtaposición de fibras atriales normales y enfermas, que pueden ser las responsables de la dispersión de la refractariedad atrial. La fibrosis intersticial, la infiltración grasa y la hipertrofia de las fibras musculares son factores presentes en los estudios de patología de los pacientes con fibrilación auricular (27).
Mecanismos arritmogénicos
Las teorías de los mecanismos de producción de fibrilación auricular involucran dos procesos principales: automaticidad aumentada en uno o varios focos que se despolarizan rápidamente, y la reentrada, que involucra uno o más circuitos (hipótesis de las múltiples ondas de reentrada de Moe) (16) (Figura 3).
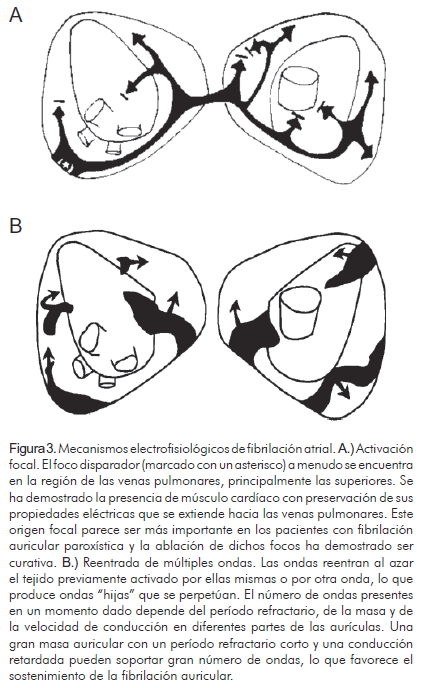
Remodelamiento eléctrico auricular
El reconocimiento de que la fibrilación auricular tiende a perpetuarse a sí misma (fibrilación atrial genera más fibrilación atrial) se basa en el hallazgo experimental de que con el aumento en la duración de los episodios se produce un acortamiento del potencial de acción atrial así como un acortamiento progresivo de los períodos refractarios efectivos, fenómeno que se conoce con el nombre de remodelamiento eléctrico. Este es un mecanismo de supervivencia celular que previene su muerte debido a la sobrecarga de calcio; sin embargo, este mecanismo favorece la reentrada. Además, la sobrecarga de calcio se ha involucrado como mecanismo potencial no solo del remodelamiento, sino también para el aumento de la actividad focal, la actividad desencadenada y múltiples mecanismos de reentrada que contribuyen al inicio y perpetuación de la arritmia mediante la alteración de mecanismos de transcripción genética, expresión de proteínas y regulación de las mismas. La disminución de la corriente de entrada de calcio a través de los canales L desempena un papel importante en el acortamiento del potencial de acción. La restauración de la refractariedad eléctrica mediante una pronta cardioversión de la fibrilación auricular podría explicar la mayor tasa de éxito de la intervención precoz. El bloqueo de los canales de calcio puede inhibir el remodelamiento atrial que ocurre durante la fibrilación auricular (16).
Otros factores electrofisiológicos
Los períodos refractarios y las velocidades de conducción no son homogéneos en los pacientes con fibrilación auricular y junto con la dispersión de la refractariedad están involucrados en la inducibilidad y persistencia de la fibrilación auricular. Otro factor involucrado en el sostenimiento de la fibrilación auricular es la presencia de una masa crítica de tejido atrial asociada con disminución de la conducción y el acortamiento de los períodos refractarios. Igualmente, los latidos atriales prematuros son eventos disparadores importantes en la mayoría de los pacientes con fibrilación auricular (16).
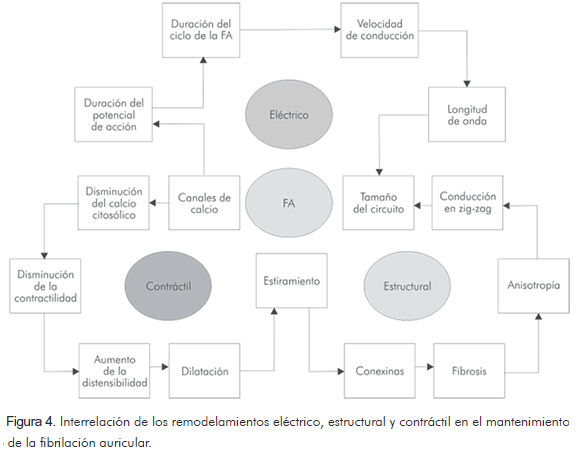
Allessie y colaboradores (27) proponen un mecanismo compuesto por múltiples factores que se retroalimentan de manera positiva, tal como se muestra en la figura 4.
Causas y patologías asociadas
Bien se sabe que la fibrilación auricular es una arritmia prevalente en pacientes con enfermedad cardiovascular, y que clásicamente, los factores de riesgo definidos para desarrollarla han sido hipertensión, cardiomiopatía isquémica, diabetes mellitus y enfermedad tiroidea. También se ha podido establecer, que existen otros factores que pueden desempenar un rol importante en su aparición; éstos son: obesidad, apnea del sueno, abuso del alcohol, práctica excesiva de deportes e inflamación, y las enfermedades valvulares que merecen una mención especial (28).
Enfermedad valvular y fibrilación atrial
Existe una clara relación entre la enfermedad valvular y la fibrilación auricular, establecida principalmente en los pacientes con enfermedad valvular reumática. Diker y colaboradores encontraron una prevalencia de fibrilación auricular del 70% en pacientes con estenosis mitral, insuficiencia mitral e insuficiencia tricuspídea, de 52% en pacientes con estenosis mitral e insuficiencia mitral, de 29% en estenosis mitral aislada y de 16% en insuficiencia mitral aislada (29). La enfermedad degenerativa de la válvula mitral, con prolapso mitral o con valvas disfuncionantes, se asocia con un riesgo de 5% por ano de presentar fibrilación auricular, siendo factores de riesgo determinantes la edad mayor a 65 anos y un diámetro de la aurícula izquierda mayor o igual a 50 mm.
Enfermedad valvular aórtica y fibrilación auricular
Estenosis aórtica
La fibrilación auricular se ha descrito en sólo 1% a 10% de pacientes con estenosis aórtica sin falla cardíaca concomitante debido a la presencia de dilatación atrial tan tardía, pero estos porcentajes aumentan considerablemente en aquellos que ya la desarrollaron. En la serie de pacientes sometidos a procedimiento de ablación quirúrgica de fibrilación auricular en el grupo de Dilker, 3% tenía estenosis aórtica, en cuyos casos siempre debe descartarse compromiso valvular mitral concomitante. La pérdida de la contracción atrial como consecuencia de la fibrilación auricular y la frecuencia ventricular rápida condicionan el llenado diastólico de un ventrículo pequeno y rígido, con un compromiso sintomático importante. Un episodio sincopal en un paciente con estenosis aórtica previamente asintomática puede ser consecuencia de un episodio de fibrilación auricular con respuesta ventricular rápida. En los pacientes que fueron llevados a reemplazo valvular aórtico se demostró que la presencia de fibrilación auricular es un predictor independiente de la mortalidad perioperatoria y de la mortalidad a 5 anos. Además, la presencia de falla cardíaca, ser mayor de 70 anos, el bajo índice de masa corporal, la fracción de eyección disminuida y el aumento del grosor ventricular de final de la sístole constituyen predictores de fibrilación auricular posoperatoria de pacientes con estenosis aórtica. El manejo de ésta en este grupo de pacientes se basa en los mismos conceptos del paciente sin enfermedad valvular, y se da prioridad a la cardioversión eléctrica cuando exista compromiso hemodinámico.
Insuficiencia aórtica
La fibrilación auricular es un predictor de mortalidad en pacientes con insuficiencia aórtica. En la serie de pacientes sometidos a ablación quirúrgica de fibrilación auricular, 10% tenía insuficiencia aórtica. La hipertensión arterial, la diabetes mellitus, la historia de falla cardíaca y la dilatación auricular son predictores de fibrilación auricular en el posoperatorio.
Enfermedad valvular tricuspídea y pulmonar y fibrilación auricular
Enfermedad tricuspídea
Se ha planteado que la remodelación atrial secundaria a fibrilación auricular es un factor causal en la insuficiencia tricuspídea idiopática. Así mismo, en la evolución de la enfermedad valvular primaria puede presentarse fibrilación auricular hasta en 45% de pacientes con enfermedad moderada a severa, incluso si es asintomática y condiciona el desarrollo posterior de síntomas y eventos embólicos. La intervención quirúrgica en un estadio avanzado de la enfermedad obviamente tiene poco impacto en una fibrilación auricular ya persistente.
Enfermedad valvular pulmonar
Es poco frecuente el compromiso pulmonar aislado y generalmente se relaciona con otras cardiopatías. En una serie japonesa se encontró una prevalencia cercana a 7% en pacientes que serían llevados a reemplazo de válvula pulmonar. En una serie de pacientes que fueron sometidos a reemplazo valvular pulmonar después de la corrección de tetralogía de Fallot, se encontró que la incidencia de fibrilación auricular disminuyó de 17% a 12% después de 4,7 anos de seguimiento. Las implicaciones pronósticas no son tan claras como en las otras enfermedades valvulares y están condicionadas por la gravedad de la cardiopatía concomitante.
Enfermedad valvular mitral y fibrilación atrial
Estenosis mitral
Claramente se identifican dos factores de riesgo como predictores para el desarrollo de fibrilación auricular en pacientes con estenosis mitral: la edad y el diámetro de la aurícula izquierda. La prevalencia de fibrilación auricular entre los pacientes con estenosis mitral aumenta con la edad, afectando a 17% de los pacientes entre los 21 y 30 anos, a 45% de aquellos entre los 31 y 40 anos, a 60% de aquellos entre los 41 y 50 anos y a 80% de los mayores de 51 anos. En una serie de pacientes mayores de 65 anos de edad sometidos a valvuloplastia mitral, la prevalencia de fibrilación auricular fue de 74%. Entre los pacientes con estenosis mitral e hipertensión pulmonar la prevalencia de fibrilación auricular es del 60%, y ésta aumenta también con la coexistencia de lesiones valvulares: 29% con estenosis mitral aislada, 52% con estenosis mitral e insuficiencia mitral y 70% con estenosis mitral, insuficiencia mitral e insuficiencia tricuspídea. En los pacientes con estenosis mitral, la fibrilación auricular se asocia con mayor prevalencia de eventos embólicos en comparación con los pacientes que permanecen en ritmo sinusal. La incidencia de embolismo sistémico en pacientes con estenosis mitral es de 32% en los mayores de 35 anos de edad con fibrilación auricular versus 11% en aquellos mayores de 35 anos en ritmo sinusal. El estudio Framingham estimó un aumento de 17 veces en el riesgo de accidente cerebrovascular para los pacientes con fibrilación auricular y estenosis mitral, comparado con un aumento de cinco veces en el riesgo para los pacientes con fibrilación auricular sin enfermedad valvular mitral. Además, la estenosis mitral con fibrilación auricular se relaciona con exceso de mortalidad. La tasa de sobrevida a cinco anos para los pacientes con estenosis mitral con fibrilación auricular es solamente de 64%, comparada con 85% en los pacientes con fibrilación auricular sin enfermedad valvular mitral (30).
El 30% al 40% de los pacientes con estenosis mitral sintomática desarrollan fibrilación atrial. Los cambios estructurales derivados de la presión y la sobrecarga de volumen alteran las propiedades electrofisiológicas de la aurícula izquierda y el proceso reumático por sí mismo puede conducir a fibrosis de los tractos internodales y danar el nodo sinoatrial. La pérdida de la contribución atrial al llenado ventricular izquierdo y la respuesta ventricular rápida que acorta el período de llenado diastólico y produce elevación de la presión auricular izquierda, son consecuencias hemodinámicas que resultan del desarrollo agudo de la fibrilación atrial. Se ha demostrado que ésta es un determinante fundamental del pronóstico en pacientes sometidos a reparación de la válvula mitral, lo cual afecta su morbilidad y mortalidad.
Insuficiencia mitral
La fibrilación atrial es una arritmia común y potencialmente mórbida cuando está asociada con insuficiencia mitral. La presencia de fibrilación atrial preoperatoria es un predictor independiente de disminución de la sobrevida a largo plazo después de cirugía de la válvula para insuficiencia mitral. La persistencia de fibrilación atrial después de cirugía de válvula mitral puede conducir a tromboembolismo y anula la ventaja de un reparo mitral porque requiere anticoagulación. Los predictores de persistencia de fibrilación atrial después de cirugía valvular son: presencia de fibrilación atrial mayor a 1 ano (en un estudio se demostró que es significativo desde más de 3 meses) y tamano de la aurícula izquierda mayor a 50 mm (31). De los pacientes sometidos a cirugía de válvula mitral solamente 5% en ritmo sinusal quedan en ritmo de fibrilación auricular en el posoperatorio, mientras que de los pacientes con fibrilación auricular preoperatoria, 80% quedan en ritmo de fibrilación auricular luego de cirugía (32). Aunque los pacientes que desarrollan fibrilación atrial usualmente manifiestan otros cambios funcionales o sintomáticos que indicarían el reparo o reemplazo de la válvula mitral, muchos clínicos consideran que el comienzo de fibrilación atrial paroxística o crónica sea una indicación por sí misma de cirugía (indicación Clase IIa, pacientes asintomáticos con función ventricular izquierda preservada y fibrilación atrial). La cirugía de válvula mitral combinada con la cirugía de MAZE (Cox) restablece el ritmo sinusal en más de 80% de los pacientes, aun cuando la fibrilación auricular ha estado presente por varios anos antes de la intervención quirúrgica. La conversión exitosa a ritmo sinusal en estos casos está relacionada con la edad, el tamano de la aurícula izquierda (menor a 40 mm) y el índice cardiotorácico (32).
Tratamiento médico
Aun cuando el tratamiento de la fibrilación auricular se ha enfocado tradicionalmente en tres objetivos no excluyentes entre sí, que son: restauración y mantenimiento del ritmo sinusal, control de la frecuencia ventricular y prevención de los eventos tromboembólicos, en los últimos anos este abordaje ha sido desafiado debido a que no incluye las variables de mortalidad, morbilidad, hospitalización, calidad de vida y costos, que son las que más afectan al paciente, al médico y a los sistemas de salud. Debido a que la fibrilación auricular aumenta el riesgo de morir aproximadamente 2 veces, el riesgo de desarrollar falla cardiaca aproximadamente 3,4 veces, el riesgo de hospitalización 3 veces y el riesgo de accidente cerebrovascular trombótico 5 veces, en la actualidad existe un gran compromiso entre las sociedades científicas, responsables de marcar la pauta en la fibrilación auricular, para promover que las metas terapéuticas en el tratamiento de la fibrilación auricular sean integrales y se enfoquen más en el paciente que en el electrocardiograma (Figura 5).

De acuerdo con las guías americanas de manejo de la fibrilación auricular, cuando se aborda inicialmente a un paciente con esta condición, la estrategia general deberá ser discutida con éste, teniendo en cuenta, entre otros factores, el tipo y la duración, la severidad y los síntomas, la enfermedad cardiovascular asociada, la edad del paciente, las condiciones médicas asociadas, los objetivos de tratamiento a corto y largo plazo y por último las opciones farmacológicas y no farmacológicas (1).
Restauración y mantenimiento del ritmo sinusal
Cardioversión
Cardioversión eléctrica
La cardioversión eléctrica de la fibrilación auricular es importante dentro de la estrategia del control del ritmo sinusal. Se reporta que la tasa de éxito primario de la cardioversión eléctrica externa está entre 70% y 90%. Después de una cardioversión eléctrica exitosa, la fibrilación atrial recurre sin tratamiento antiarrítmico en 44% a 85% (promedio 69%) en el seguimiento a seis meses. El tratamiento antiarrítmico mejora los resultados entre 17% y 89% (promedio 52%), pero la mayoría de los pacientes sufre una recaída seis a doce meses después de la cardioversión. La duración de la fibrilación auricular antes de la cardioversión eléctrica parece ser el mejor predictor de éxito y de mantenimiento del ritmo sinusal en la mayoría de los pacientes. La cardioversión eléctrica interna ha surgido como una opción complementaria en la consecución del ritmo sinusal. De otra parte, la tasa de éxito primario de la cardioversión eléctrica interna es aún mayor que la de la cardioversión eléctrica externa. La cardioversión eléctrica interna podría indicarse en quienes ha fallado la cardioversión eléctrica externa, principalmente pacientes obesos. En los pacientes con inestabilidad hemodinámica la cardioversión eléctrica debe realizarse en forma urgente, utilizando heparina no fraccionada intravenosa antes, durante y después del procedimiento.
Cardioversión farmacológica
Esta estrategia tiene un porcentaje de éxito menor al de la cardioversión eléctrica pero con la ventaja que no requiere que el paciente reciba sedación o anestesia. Se sugiere, después de haber hecho un adecuado control de la respuesta ventricular, y si el paciente continúa sintomático, o en quienes el control del ritmo es deseable, realizar una cardioversión farmacológica con la administración de un bolo de un medicamento antiarrítmico.
El estudio AVRO (33) demostró recientemente la mayor efectividad de vernakalant comparado con amiodarona para la cardioversión farmacológica en pacientes con fibrilación auricular de reciente inicio; sin embargo, esta indicación aún no se encuentra en las guías de manejo.
En la tabla 2 se revisan los agentes antiarrítmicos para uso intravenoso.
Los pacientes que han estado en fibrilación auricular por más de 48 horas sin anticoagulación tienen mayor riesgo de eventos embólicos después de la cardioversión. Sin embargo, es vital tener en cuenta que el embolismo puede ocurrir con menos de 24 horas de fibrilación auricular. Igualmente, la conversión de la fibrilación auricular se asocia con embolismo sistémico, el cual ocurre en 0,6% a 5,6% de los pacientes sometidos a cardioversión eléctrica o farmacológica.
Tratamiento de mantenimiento - largo plazo
Control del ritmo y la frecuencia
El tratamiento de los pacientes con fibrilación auricular debe, como mínimo, prevenir el riesgo de tromboembolia y corregir la alteración del ritmo o controlar la frecuencia cardiaca si es necesario. El primer tratamiento que se elige implica la aplicación de una estrategia de control del ritmo o de la frecuencia; sin embargo, según la evolución del paciente, la estrategia elegida inicialmente puede resultar ineficaz y se sigue entonces la estrategia alternativa, pero independientemente de la estrategia, es necesario un tratamiento antitrombótico para prevenir la tromboembolia de acuerdo con el riesgo del mismo. El objetivo del control del ritmo es restaurar el ritmo sinusal usando fármacos antiarrítmicos (fibrilación auricular) o cardioversión eléctrica, y luego mantenerlo usando fármacos antiarrítmicos. Así mismo, el objetivo del control de la frecuencia es controlar la frecuencia cardíaca sin que se intente específicamente restaurar y mantener el ritmo sinusal.
Varios estudios clínicos publicados (34-36) evalúan tanto la eficacia como la seguridad de estos tratamientos; no obstante, el impacto comparativo de los abordajes antes descritos sobre desenlaces clínicos duros tales como mortalidad por todas las causas o la incidencia de accidentes cerebrovasculares trombóticos no ha podido ser establecida ya que estos estudios no fueron disenados para tal fin. Por esta razón, contrario a la creencia que generó el estudio AFFIRM, está claramente establecido que el ritmo sinusal en pacientes con fibrilación auricular se asocia con una reducción del riesgo de muerte.
En la figura 6 puede observarse el flujograma general del tratamiento del paciente con fibrilación auricular.
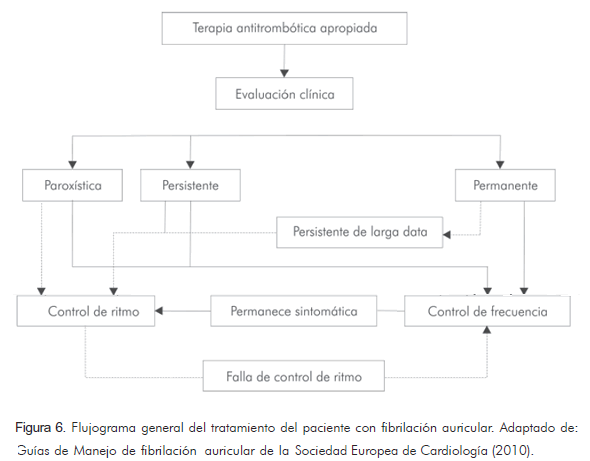
Las siguientes son las recomendaciones de las guías europeas de fibrilación auricular en relación con el control de la respuesta ventricular y la restauración y el mantenimiento del ritmo.
Usualmente, las opciones farmacológicas para el control de la respuesta ventricular son betabloqueadores, digoxina y calcioantagonistas. Por otra parte, en el mantenimiento del ritmo, en Colombia se utilizan la amiodarona y la propafenona y se considera que estos medicamentos están asociados con una eficacia moderada y una seguridad escasa ya sea por el potencial proarrítmico o por la toxicidad extracardíaca.
Nueva alternativa terapéutica en el mantenimiento del ritmo sinusal
Dronedarona
La dronedarona es un novedoso bloqueador multicanal (K+, Na+ y Ca++) que ha demostrado poseer las cuatro propiedades de la clasificación de Vaugahn Williams: actividad antiadrenérgica no competitiva, efecto vasodilatador coronario no dependiente del óxido nítrico y mayor efecto antihipertensivo en comparación con amiodarona.
Esta molécula es derivada del benzofurano y estructuralmente es similar a la amiodarona, pero con dos diferencias a nivel de su estructura química: la abolición de los radicales yodo en el anillo benceno y la adición de un grupo sulfonamida en el anillo benzofurano. Estas diferencias eliminan la toxicidad tiroidea asociada al yodo que ocurre con amiodarona, y disminuyen la lipofilicidad, lo que acortaría la vida media y reduciría la acumulación en los tejidos por lo cual no se ha observado toxicidad pulmonar u ocular, entre otras.
Su metabolismo se realiza extensamente por la vía CYP3A4, por lo cual se contraindica la utilización concomitante con inhibidores de CYP3A fuertes, tales como ketoconazol, itraconazol, voriconazol, ciclosporina, telitromicina, claritromicina, nefazodona y ritonavir, y éstos deberán suspenderse antes del inicio de dronedarona.
Varios estudios evalúan la eficacia y seguridad de dronedarona en el tratamiento de pacientes con fibrilación auricular. Así, EURIDIS y ADONIS (37) evaluaron su eficacia como antiarrítmico, demostrando una RRR de recurrencia versus placebo de 25% y un porcentaje de pacientes libre de recurrencia de síntomas a un ano de 62,3%. Al igual que ya se había demostrado en EURIDIS y ADONIS, el estudio ERATO (38) en pacientes con fibrilación auricular permanente con seguimiento a seis meses demostró una disminución de la frecuencia ventricular media de 11,7 lpm, disminución de la frecuencia ventricular durante ejercicio máximo de 24,5 lpm sin efecto sobre la capacidad del ejercicio y mantenimiento de este efecto a cuatro meses.
El estudio ATHENA (39), controlado, doble ciego, con distribución aleatoria, placebo controlado que incluyó 4.628 pacientes con fibrilación auricular paroxística o persistente, ?70 anos con uno o más factores de riesgo cardiovascular ó ? 75 anos, con o sin factores de riesgo, demostró, a través de los criterios de evaluación primarios y secundarios, RRR de 24% de hospitalización por causa cardiovascular o muerte por cualquiera causa, RRR de 29% de muerte de origen cardiovascular, RRR de 45% de muerte por arritmia cardiaca y RRR de 26% de sufrir una primera hospitalización por causa cardiovascular (reducción principalmente influida por RRR de 37% de ser hospitalizado por fibrilación auricular).
Aún cuando se declaran algunas limitaciones, se dice que ATHENA es un estudio sin precedentes, no sólo por el tamano de su muestra y sus criterios clínicos de evaluación de eficacia, sino también por sus resultados (que ningún otro antiarrítmico había logrado demostrar).
Con base en este estudio, la Administración de Drogas y Alimentos (FDA, su sigla en Inglés), aprobó en junio de 2009 la comercialización de dronedarona en los Estados Unidos ed América. Más recientemente en Colombia el INVIMA aprobó este medicamento con la siguiente indicación: «(...) está indicado para reducir el riesgo de hospitalización cardiovascular en pacientes con fibrilación auricular paroxística o persistente (fibrilación auricular) o flutter auricular, con un episodio reciente de fibrilación auricular o flutter auricular y que está asociado a factores de riesgo cardiovascular (por ejemplo, edad mayor a 70 anos, hipertensión, diabetes, accidente cerebrovascular previo, diámetro auricular izquierdo mayor o igual a 50 mm o fracción de eyección ventricular izquierda menor a 40%), quienes están en ritmo sinusal o puedan ser cardiovertidos».
Por la estrecha relación entre fibrilación auricular y falla cardiaca, se pensó que dronedarona podría tener un impacto positivo en pacientes con falla cardiaca congestiva de moderada a severa, por lo cual se disenó el estudio ANDROMEDA (40), en donde el criterio mayor de ingreso era falla cardiaca y no se requería que los pacientes tuvieran fibrilación auricular. Su criterio de evaluación compuesto fue muerte por cualquier causa u hospitalización por falla cardiaca. El estudio fue suspendido de forma temprana por un incremento en la mortalidad asociada a empeoramiento de la falla cardiaca. No se conocen las causas de este suceso, pero se ha postulado que pudo deberse a la descontinuación de los inhibidores de la enzima convertidora de angiotensina por una mala interpretación de neurotoxicidad. Por esta razón, en la actualidad dronedarona está contraindicado en pacientes con insuficiencia cardíaca Clase IV según la NYHA, o insuficiencia cardiaca Clases II – III según la NYHA con descompensación reciente (en el último mes) que hayan requerido hospitalización o derivación a una clínica especializada en insuficiencia cardiaca.
Durante los estudios clínicos de dronedarona, se observó que la creatinina sérica podía incrementarse 0,1 mg/dL en los primeros siete días en aproximadamente 10% de los sujetos que estaban siendo tratados, y que ello era el resultado de una inhibición en la secreción tubular de creatinina, sin ningún efecto nefrotóxico, de ahí que no se debe descontinuar la terapia en caso de que esto suceda.
Dentro de las precauciones más importantes para la adecuada utilización de este medicamento están las pruebas de función hepática antes del inicio del tratamiento y el monitoreo mensual durante los seis primeros meses, y luego en los meses 9 y 12. Si los niveles de alanino aminotransferasa (ALT) se encuentran elevados más de tres veces por encima del límite superior de lo normal, se deberá determinar de nuevo la ALT. Si se confirma este resultado, se deberá suspender el tratamiento. Se continuará haciendo un seguimiento estrecho hasta la normalización de la ALT.
En el estudio DYONISOS (41), dronedarona fue más segura en comparación con amiodarona al demostrar menos eventos adversos neurológicos o relacionados con toxicidad, cardiaca (menor incidencia de QT prolongado y de taquicardia ventricular de puntas torcidas), tiroidea, ocular, pulmonar, de piel, razón por la cual los pacientes toleraron mejor la medicación y se produjeron menores tasas de descontinuación. En eficacia medida con los parámetros antiguos de evaluación amiodarona presentó menos recurrencias vs. dronedarona (p? 0,05).
Debe tenerse en cuenta que la dronedarona no está indicada en pacientes con fibrilación auricular permanente y recientemente los reportes del estudio PALLAS (dronedarona vs. placebo en pacientes con fibrilación auricular permanente) sugieren un aumento en los eventos cardiovasculares en este grupo de pacientes.
Hoy, las guías de manejo europeas (Tabla 3 y figura 7) recomiendan la dronedarona como terapia de primera línea en pacientes con fibrilación auricular paroxística o persistente con corazón sano y en aquellos con corazón con enfermedad estructural (excepto en pacientes con falla cardiaca inestable).
Terapia no farmacológica de la fibrilación atrial
El estudio electrofisiológico con mapeo electroanatómico o electromagnético y ablación con energía de radiofrecuencia usando catéter irrigado, es razonable para aquellos pacientes sintomáticos con fibrilación auricular paroxística recurrente, refractaria a fármacos antirarrítmicos, con ausencia o incremento discreto del tamano de la aurícula izquierda. Esta recomendación, que viene siendo revalidada periódicamente según los resultados de nuevas investigaciones clínicas, ha sido recientemente (guías de la división de Electrofisiología de la Sociedad Europea de Cardiología, julio de 2010) calificada como recomendación clase IIa, nivel de evidencia A.
Así mismo, para la fibrilación auricular persistente refractaria a fármacos se ha establecido una recomendación clase IIa, nivel de evidencia B, mientras que para los pacientes con falla cardíaca que cursan con fibrilación auricular permanente sintomática y refractaria a fármacos (incluye la amiodarona), la estrategia de ablación por radiofrecuencia o aislamiento de las venas pulmonares ha sido considerada una recomendación clase IIb, nivel de evidencia B.
Prevención del cardioembolismo
Estratificación del riesgo
La incidencia de embolismo sistémico es de 1,3% en pacientes con fibrilación auricular aislada, de 3,2% en aquellos con fibrilación auricular recurrente y de 3,3% en pacientes con fibrilación auricular permanente; es decir, no existe diferencia entre el riesgo de embolismo en pacientes con fibrilación auricular paroxística con respecto a pacientes con fibrilación auricular persistente o permanente.
En quienes ya han sufrido eventos cerebrales embólicos transitorios, la incidencia de accidente cerebrovascular trombótico es cercana al 10% anual a pesar del uso de ASA. De igual forma, el embolismo previo, la falla cardíaca, la hipertensión arterial, el incremento de la edad, la diabetes mellitus, el género femenino y la disfunción ventricular izquierda son factores de riesgo independientes para eventos cerebrales embólicos en pacientes con fibrilación auricular no valvular.
A pesar del aumento en el riesgo de sangrado en los pacientes de mayor edad, estos son quienes más se benefician de la anticoagulación (42). Otros pacientes con riesgo aumentado de embolismo son los pacientes con hipertiroidismo, falla cardíaca y fibrilación auricular, razón por la cual se sugiere anticoagularlos. Un grupo adicional de riesgo lo conforma el paciente con cardiopatía hipertrófica, con una tasa de embolismo por ano de 2,4% a 7,1%. Así, los hallazgos ecocardiográficos que se asocian con riesgo aumentado de embolismo son: presencia de trombo en la auriculilla izquierda, disminución del flujo intracavitario, presencia de contraste espontáneo y enfermedad ateromatosa de la aorta.
Si hay trombos en la aurícula izquierda está contraindicada la cardioversión electiva, pero la ausencia de éstos no predice que no ocurra embolismo pos-cardioversión si no se anticoagula previamente.
Implicaciones terapéuticas
La eficacia y seguridad de la anticoagulación han sido objeto de múltiples estudios. La warfarina demostró una reducción de 62% en los accidentes cerebrovasculares en pacientes con fibrilación auricular (43). Por supuesto, también se relaciona con aumento en el riesgo de eventos hemorrágicos en todo el espectro de presentación. La búsqueda de un equilibrio entre eficacia terapéutica (que incluye disminución de accidentes cerebrovasculares y de mortalidad) y sangrado, ha permitido el surgimiento de nuevas moléculas anticoagulantes que plantean un nuevo escenario en la realidad del paciente con fibrilación auricular.
En la actualidad, la estratificación de riesgo embólico se realiza con base en el score CHADS2 (Tabla 4), y, según las guías europeas para el manejo de la fibrilación auricular, cuando el puntaje es menor de 2 debe utilizarse el CHA2DS2-VASc (Tabla 5) para una mejor estratificación del paciente de bajo riesgo. En resumen, si el puntaje es 0 con base en el esquema CHA2DS2-VASc, el paciente podrá recibir ácido acetil salicílico o no recibir terapia antitrombótica (preferible esto último); un paciente con puntaje de 1 deberá recibir ácido acetil salicílico o anticoagulantes orales (preferible esto último) y un paciente con puntaje de 2 ó más deberá recibir anticoagulantes orales.

Lógicamente el uso de anticoagulantes orales debe iniciarse después de un balance cuidadoso entre el riesgo de embolismo y el de sangrado. Este último puede estratificarse a través del score (Tabla 6) HAS-BLED [Hypertension, Abnormal liver o renal function, history of Stroke or bleeding, labile INR, Elderly age (>65 anos)] y el empleo concomitante de medicamentos que promuevan el sangrado o el uso excesivo de alcohol. El riesgo de sangrado mayor es de 1% para el puntaje menor o igual a 1% y de 12,5% para el puntaje de 5. Un puntaje de 3 ó más sugiere un alto riesgo de sangrado y debe hacer pensar en alternativas terapéuticas efectivas y que se relacionen con menor riesgo de sangrado.

El dabigatran es un inhibidor directo reversible de la trombina y fue el primero de estos nuevos medicamentos en recibir la aprobación para su uso en pacientes con fibrilación auricular no valvular.
Las guías europeas y canadienses lo recomiendan como alternativa a la warfarina en pacientes con indicación de anticoagulación por fibrilación auricular no valvular, con base en los resultados del estudio RE-LY (44). En el mismo, dabigatran etexilato 150 mg dos veces al días, redujo las tasa del resultado primario de accidentes cerebrovasculares (isquémicos y hemorrágicos) o embolismo sistémico anual (RR: 0,65; IC 95%: 0,52-0,81). Con esta dosis no se incrementó el sangrado mayor. A la dosis de 110 mg dos veces al día, la eficacia fue similar con disminución en la tasa de sangrado mayor en 20%. Ambas dosis utilizadas mostraron una reducción en la amenaza para la vida por sangrado intracraneal y total. En pacientes con falla renal severa (depuración de creatinina < 15 mL/min) o enfermedad hepática significativa, aún no se recomienda su uso.
Recientemente, se presentaron los resultados del estudio ROCKET-AF en el cual se comparó rivaroxaban (inhibidor selectivo del factor Xa) con warfarina y se demostró no inferioridad en disminución del riesgo embólico y tasas de sangrado, teniendo en cuenta que 90% de estos pacientes tenían puntaje CHADS2 de 3 o más.
Igualmente se publicó el estudio ARISTOTLE (45) en donde se comparó apixaban (inhibidor directo del factor Xa) con warfarina en pacientes con fibrilación auricular y al menos un factor de riesgo adicional para accidentes cerebrovasculares. En dosis de 5 mg dos veces al día, apixaban redujo el riesgo de accidente cerebrovascular o embolismo sistémico, el riesgo de sangrado mayor y la mortalidad, en 21%, 31% y 11%, respectivamente.
Estos datos sugieren un aumento en la efectividad de la terapia con disminución de los riesgos de la misma, por lo que su papel en este escenario será tema de discusión.
Conclusiones
La fibrilación auricular es la arritmia cardíaca sostenida más frecuente; afecta a 1 de cada 25 adultos mayores de 60 anos de edad y a 1 de cada 10 adultos mayores 80. Actualmente se calculan que 6,8 millones de pacientes sufren de fibrilación auricular en la Unión Europea y los Estados Unidos de América y se espera que la prevalencia aumente debido al envejecimiento de la población. La fibrilación auricular incrementa el riesgo de mortalidad, accidente cerebrovascular trombótico, falla cardiaca y hospitalización. Adicionalmente, afecta de manera significativa la calidad de vida y los costos en salud. Es así como el impacto descrito plantea la necesidad de revaluar la metas terapéuticas que se concentran en el electrocardiograma y buscan restaurar el ritmo sinusal, o controlar la frecuencia y progresar hacia un enfoque consecuente con el impacto de la enfermedad, cuyas metas terapéuticas sean integrales y logren impactar positivamente los desenlaces clínicos más importantes para el paciente: mortalidad, hospitalización y calidad de vida.
Bibliografía
1. Wann LS, Curtis AB, Ellenbogen KA, et al. 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (update on dabigatran). A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Heart Rhythm 2011; 8: e1-8. [ Links ]
2. Miyasaka Y, Barnes ME, Bailey KR, et al. Mortality trends in patients diagnosed with first atrial fibrillation: a 21-year community-based study. J Am Coll Cardiol 2007; 49: 986-92. [ Links ]
3. CANDANE. Proyecciones nacionales y departamentales de población 2005-2020. Centro Andino de Altos Estudios. [ Links ]
4. Levy S, Camm AJ, Saksena S, et al. International consensus on nomenclature and classification of atrial fibrillation: A collaborative project of the Working Group on Arrhythmias and the Working Group of Cardiac Pacing of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. J Cardiovasc Electrophysiol 2003; 14: 443-5. [ Links ]
5. Kopecky SL, Gersh BJ, McGoon MD, et al. The natural history of lone atrial fibrillation. A population-based study over three decades. N Engl J Med 1987; 317: 669-74. [ Links ]
6. Campbell RW. Atrial fibrillation. Eur Heart J 1998; 19 (Suppl E): E41-5, E60-3. [ Links ]
7. Fuster V, Ryden LE, Cannom DS, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: full text: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 guidelines for the management of patients with atrial fibrillation) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace 2006; 8: 651-745. [ Links ]
8. Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31: 2369-429. [ Links ]
9. Benjamin EJ, Levy D, Vaziri SM, D'Agostino RB, Belanger AJ, Wolf PA. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA 1994; 271: 840-4. [ Links ]
10. Granada J, Uribe W, Chyou PH, et al. Incidence and predictors of atrial flutter in the general population. J Am Coll Cardiol 2000; 36: 2242-6. [ Links ]
11. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285: 2370-5. [ Links ]
12. Fuster V, Ryden LE, Asinger RW, et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary. A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation): developed in Collaboration With the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 2001; 38: 1231-66. [ Links ]
13. Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74: 236-41. [ Links ]
14. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22: 983-8. [ Links ]
15. Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and stroke statistics--2011 update: a report from the American Heart Association. Circulation 2011; 123: e18-e209. [ Links ]
16. Fuster V, Ryden LE, Asinger RW, et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Eur Heart J 2001; 22: 1852-923. [ Links ]
17. Cardiogenic brain embolism. The second report of the Cerebral Embolism Task Force. Arch Neurol 1989; 46: 727-43. [ Links ]
18. Page RL, Tilsch TW, Connolly SJ, et al. Asymptomatic or "silent" atrial fibrillation: frequency in untreated patients and patients receiving azimilide. Circulation 2003; 107: 1141-5. [ Links ]
19. Prystowsky EN, Camm J, Lip GY, et al. The impact of new and emerging clinical data on treatment strategies for atrial fibrillation. J Cardiovasc Electrophysiol 2010; 21: 946-58. [ Links ]
20. Gajewski J, Singer RB. Mortality in an insured population with atrial fibrillation. JAMA 1981; 245: 1540-4. [ Links ]
21. Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003; 107: 2920-5. [ Links ]
22. Ringborg A, Nieuwlaat R, Lindgren P, et al. Costs of atrial fibrillation in five European countries: results from the Euro Heart Survey on atrial fibrillation. Europace 2008; 10: 403-11. [ Links ]
23. Camm AJ, Reiffel JA. Defining endpoints in clinical trials on atrial fibrillation. Eur Heart J 2008; 10 (suppl H): H55-H78. [ Links ]
24. Thrall G, Lip GY, Carroll D, Lane D. Depression, anxiety, and quality of life in patients with atrial fibrillation. Chest 2007; 132: 1259-64. [ Links ]
25. Predictors of thromboembolism in atrial fibrillation: I. Clinical features of patients at risk. The Stroke Prevention in Atrial Fibrillation Investigators. Ann Intern Med 1992; 116: 1-5. [ Links ]
26. Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic features of patients at risk. The Stroke Prevention in Atrial Fibrillation Investigators. Ann Intern Med 1992; 116: 6-12. [ Links ]
27. Allessie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002; 54: 230-46. [ Links ]
28. Schoonderwoerd BA, Smit MD, Pen L, Van Gelder IC. New risk factors for atrial fibrillation: causes of 'not-so-lone atrial fibrillation'. Europace 2008; 10: 668-73. [ Links ]
29. Diker E, Aydogdu S, Ozdemir M, et al. Prevalence and predictors of atrial fibrillation in rheumatic valvular heart disease. Am J Cardiol 1996; 77: 96-8. [ Links ]
30. Otto C. Mitral stenosis. Valvular Heart Disease. Philadelphia: WB Saunders; 1999. [ Links ]
31. Bonow RO, Carabello BA, Chatterjee K, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing Committee to Revise the 1998 guidelines for the management of patients with valvular heart disease) developed in collaboration with the Society of Cardiovascular Anesthesiologists endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. J Am Coll Cardiol 2006; 48: e1-148. [ Links ]
32. Otto C. Mitral Regurgitation. Valvular Heart Disease. Philadelphia: WB Saunders; 1999. p. 296-322. [ Links ]
33. Camm AJ, Capucci A, Hohnloser SH, et al. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodarone in recent-onset atrial fibrillation. J Am Coll Cardiol 2011; 57: 313-21. [ Links ]
34. Carlsson J, Miketic S, Windeler J, et al. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol 2003; 41: 1690-6. [ Links ]
35. Van Gelder IC, Hagens VE, Bosker HA, et al. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347: 1834-40. [ Links ]
36. Wyse DG, Waldo AL, DiMarco JP, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825-33. [ Links ]
37. Singh BN, Connolly SJ, Crijns HJ, et al. Dronedarone for maintenance of sinus rhythm in atrial fibrillation or flutter. N Engl J Med 2007; 357: 987-99. [ Links ]
38. Davy JM, Herold M, Hoglund C, et al. Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for the cOntrol of ventricular rate during atrial fibrillation (ERATO) study. Am Heart J 2008; 156: 527 e1-9. [ Links ]
39. Hohnloser SH, Crijns HJ, van Eickels M, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668-78. [ Links ]
40. Kober L, Torp-Pedersen C, McMurray JJ, et al. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008; 358: 2678-87. [ Links ]
41. Le Heuzey JY, De Ferrari GM, Radzik D, Santini M, Zhu J, Davy JM. A short-term, randomized, double-blind, parallel-group study to evaluate the efficacy and safety of dronedarone versus amiodarone in patients with persistent atrial fibrillation: the DIONYSOS study. J Cardiovasc Electrophysiol 2010; 21: 597-605. [ Links ]
42. Hart RG. Warfarin in atrial fibrillation: underused in the elderly, often inappropriately used in the young. Heart 1999; 82: 539-40. [ Links ]
43. Hart RG, Benavente O, McBride R, Pearce LA. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann Intern Med 1999; 131: 492-501. [ Links ]
44. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139-51. [ Links ]
45. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011. [ Links ]













