Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.19 no.6 Bogota Nov./Dec. 2012
(1) Universidad de Cartagena. Cartagena, Colombia.
(2) Nuevo Hospital Bocagrande. Cartagena, Colombia.
(3) Hospital General de Valencia. Valencia, España.
Correspondencia: Dr. Eduardo Fernández, correo electrónico: efernandezdaza@gmail.com Dr. Carlos García, correo electrónico: cargaries@yahoo.es
Recibido: 04/04/2011. Aceptado: 21/07/2012.
En la actualidad, las enfermedades cardiovasculares se consideran la pandemia más significativa del siglo XXI. Dentro de ellas, la enfermedad coronaria es la más prevalente y la que más morbi-mortalidad genera; en el caso particular de Colombia, es la principal causa de muerte en individuos mayores de 45 años. La característica silenciosa de esta enfermedad ha impulsado la investigación de moléculas que permitan su diagnóstico precoz y sirvan como predictores pronóstico tanto en la fase crónica como en la aguda.
Fruto de estas investigaciones, en los últimos treinta años se ha producido un avance importante en el desarrollo de biomarcadores cardiacos. Entre ellos están los recién desarrollados ensayos de troponinas ultrasensibles para diagnóstico temprano, la medición de la albúmina modificada por isquemia que cuenta con alto valor predictivo negativo para la detección de isquemia miocárdica, el ligando de CD40 soluble para la clasificación e individualización del tratamiento, la utilidad de la proteína C reactiva como marcador de riesgo de enfermedad coronaria y las diversas técnicas de alto rendimiento como la proteómica, que permite la detección de múltiples biomarcadores potenciales. A pesar de ello, aún no se dispone de evidencia suficiente para sustituir los marcadores que recomiendan las asociaciones científicas por los nuevos marcadores que se han ido desarrollando, y continúa el debate sobre qué combinación utilizar para alcanzar mayor rendimiento diagnóstico, pronostico y terapéutico. A continuación se revisan los avances actuales en biomarcadores cardiacos y su potencial integración a la práctica clínica habitual.
Palabras clave: biomarcadores, cardiopatía isquémica, inflamación, infarto agudo del miocardio.
En la actualidad, las enfermedades cardiovasculares se consideran la pandemia más significativa del siglo XXI. Dentro de ellas, la enfermedad coronaria es la más prevalente y la que más morbi-mortalidad genera; en el caso particular de Colombia, es la principal causa de muerte en individuos mayores de 45 años. La característica silenciosa de esta enfermedad ha impulsado la investigación de moléculas que permitan su diagnóstico precoz y sirvan como predictores pronóstico tanto en la fase crónica como en la aguda.
Fruto de estas investigaciones, en los últimos treinta años se ha producido un avance importante en el desarrollo de biomarcadores cardiacos. Entre ellos están los recién desarrollados ensayos de troponinas ultrasensibles para diagnóstico temprano, la medición de la albúmina modificada por isquemia que cuenta con alto valor predictivo negativo para la detección de isquemia miocárdica, el ligando de CD40 soluble para la clasificación e individualización del tratamiento, la utilidad de la proteína C reactiva como marcador de riesgo de enfermedad coronaria y las diversas técnicas de alto rendimiento como la proteómica, que permite la detección de múltiples biomarcadores potenciales. A pesar de ello, aún no se dispone de evidencia suficiente para sustituir los marcadores que recomiendan las asociaciones científicas por los nuevos marcadores que se han ido desarrollando, y continúa el debate sobre qué combinación utilizar para alcanzar mayor rendimiento diagnóstico, pronostico y terapéutico. A continuación se revisan los avances actuales en biomarcadores cardiacos y su potencial integración a la práctica clínica habitual.
Keywords: biomarkers, ischemic heart disease, inflammation, acute myocardial infarction.
Introducción
Según la Organización Panamericana de la Salud, las enfermedades cardiovasculares son la primera causa de muerte en todo el mundo y para el 2020 serán responsables de 25 millones de muertes al año (1). En toda Colombia, el infarto agudo del miocardio ocupa el segundo lugar en mortalidad tanto en hombres como en mujeres, con altas tasas de morbilidad (3), a excepción de Cartagena donde ocupa el tercero. Además, es la principal causa de muerte en individuos mayores de 45 años, superando las muertes violentas y el cáncer juntos (4).
Durante años, se han utilizado los criterios de Framingham para predecir el riesgo de padecer eventos cardiovasculares en la población general, pese a lo cual se sigue observando una elevada incidencia de eventos isquémicos agudos no detectados. Por esa razón, grandes grupos de investigación han centrado su atención en el estudio molecular de las enfermedades cardiovasculares con el objetivo de implementar el desarrollo de marcadores novedosos con fines preventivos, diagnósticos y pronósticos que permitan predecir, con mayor sensibilidad y especificidad, el desarrollo de un evento coronario agudo, especialmente en pacientes con riesgo intermedio y bajo (5).
En la última década se ha producido un importante avance científico y tecnológico, que ha permitido el desarrollo de técnicas innovadoras que se creían de ciencia ficción años atrás, como son las micromatrices de ADN, la proteómica y la nanotecnología. Tales técnicas han favorecido el descubrimiento de nuevas moléculas con utilidad potencial como biomarcadores; sin embargo, su papel en la práctica clínica habitual aún debe establecerse (6-8) (Tabla 1).
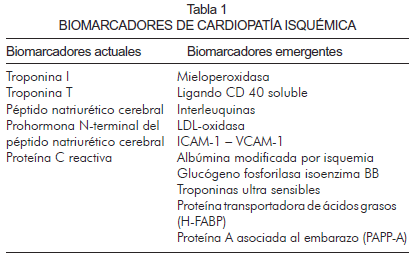
Biomarcadores cardiovasculares
Los biomarcadores son considerados como moléculas, proteínas o enzimas medibles en plasma, que proporcionan un valor diagnóstico y pronóstico independiente que refleja un estado de enfermedad o trastorno subyacente.
El biomarcador ideal en el síndrome coronario agudo, por ejemplo, debe elevarse rápidamente y permanecer así por un amplio período de tiempo; debe ser específico del tejido cardíaco, aparecer en cantidades proporcionales a la extensión del daño, su proceso de medición debe ser exacto, estar estandarizado y su resultado ser fácil de interpretar. Los marcadores que son empleados para cribado deben ser económicos y altamente sensibles, mientras aquellos que se usan para monitoreo de tratamiento deben contar con baja variabilidad biológica y su costo es menos importante (7, 9).
A continuación se estudiarán algunos de los marcadores con más evidencia científica actual en el contexto fisiopatológico, desde la lesión aterosclerótica hasta el infarto agudo del miocardio y su pronóstico (Figura 1).
Marcadores de disfunción endotelial
La aterosclerosis es una enfermedad inflamatoria crónica en la que el metabolismo de las lipoproteínas es un elemento clave en su patogenia. Cada vez se presta más atención a los niveles plasmáticos de los lípidos y al papel de los fármacos hipolipemiantes en la enfermedad coronaria (10). Las células endoteliales, en condiciones normales, captan las lipoproteínas de baja densidad (LDL) circulantes y las transportan hacia el espacio subendotelial, donde interactúan con proteoglicanos formando un complejo que es captado por los macrófagos locales (11). Cuando los niveles de LDL aumentan en el plasma, se incrementa su concentración en la pared vascular y entran en contacto con los radicales libres liberados por las células endoteliales, macrófagos y células musculares lisas, siendo modificados a LDL oxidado, para posteriormente ser fagocitados por células musculares lisas y macrófagos activados, los cuales hidrolizan y reesterifican el colesterol en gotitas lipídicas transformándose en células espumosas (12). Los efectos biológicos de las LDL oxidadas (Ox-LDL) son diversos e incluyen: reducción de la síntesis de óxido nítrico, disfunción endotelial y estimulación de la expresión de moléculas de adhesión como el ICAM-1 (molécula de adhesión intercelular-1) y VCAM-1 (molécula de adhesión vascular-1). En concentraciones elevadas poseen efectos citotóxicos, lo cual predispone a la desestabilización y ruptura de la placa (13). Dentro de los biomarcadores con más evidencia científica en esta fase se encuentran: LDL-OX, VCAM-1 e ICAM-1 y PAAP-1.
LDL oxidada (LDL-OX)
El papel de los niveles plasmáticos de LDL-OX en el síndrome coronario agudo ha sido objeto de varios estudios, y se ha mostrado que puede ser un importante marcador de cardiopatía isquémica. Imazu y colaboradores (14), examinaron la relación entre los niveles plasmáticos de LDL-OX, medida por inmunoensayo enzimático utilizando un anticuerpo contra LDL-OX (FOH1a/DLH3) y apolipoproteína B, en 94 pacientes, y encontraron que los niveles plasmáticos elevados de LDL-OX se asociaron con enfermedad coronaria, en especial con síndrome coronario agudo. Los niveles plasmáticos de LDL-OX fueron significativamente mayores en pacientes con síndrome coronario agudo de reciente aparición que en aquellos con progresión de un síndrome coronario agudo ya establecido (2,98 frente a 1,53 mg/dL, p=0,002). En el estudio de Ehara y colaboradores (15) se midieron los niveles de LDL-OX en 135 pacientes con síndrome coronario agudo, y se mostró que en los pacientes con infarto agudo del miocardio, los niveles de LDL-OX fueron significativamente mayores que en los pacientes con angina inestable (p <0,0005) o angina estable (p<0,0001) o en los controles (p<0,0001) (infarto agudo del miocardio: 1,95 ± 1,42 ng/5 microgramos de proteína LDL; angina inestable: 1,19 ± 0,74 ng/5 microgramos de proteína LDL y grupo control: 0,58 ± 0,23 ng/5 microgramos de proteína LDL). Este estudio sugiere que los niveles de LDL-OX muestran una correlación positiva significativa con la severidad de las distintas modalidades de síndrome coronario agudo.
Hoy se ha demostrado que los niveles de LDL oxidada mediante el uso de anticuerpos monoclonales E06, reportados como el contenido de LDL oxidada por cada partícula de apoB-100 (relación LDLox – apoB 100), se asocian fuertemente con enfermedad coronaria documentada por angiografía (estenosis de más del 50% del diámetro luminal) (14-18). Sin embargo, se requieren más estudios para determinar si la cuantificación de los niveles de oxidación de las lipoproteínas sirve como predictor de futuros eventos coronarios; hasta la fecha su empleo ha sido con fines investigativos y aun no se cuenta con métodos estandarizados para su aplicación en la práctica clínica.
Proteína A plasmática asociada al embarazo (PAPP-A)
La proteína A asociada al embarazo (PAPP-A) es una metaloproteinasa de alto peso molecular que fue identificada originalmente en el plasma de las mujeres embarazadas y se utilizó primariamente para el tamizaje de la trisomía fetal en el primer trimestre de gestación. La PAPP-A puede ser detectada en la sangre de pacientes con síndrome coronario agudo y se cree que es producida por las células activadas en las placas inestables para posteriormente ser liberada hacia la matriz extracelular (19). La PAPP-A se ha encontrado muy expresada en las placas erosionadas e inestables, pero solo mínimamente en las estables (20). Un estudio reciente, publicado por Mei y colaboradores, incluyó 129 pacientes con síndrome coronario agudo sin elevación del segmento ST con estenosis única a quienes se les cuantificaron los niveles de PAPP-A y PCRus antes de ser sometidos a intervención coronaria percutánea. Se observó que los pacientes con niveles de PAPP-A y PCRus más elevados (29,85 ± 19,51 mIu/L vs. 20,47 ± 14,33 mIu/L, p=0,007, y 5,63 ± 2,13 mg/L vs. 4,11 ± 1,28 mg/L, p=0,014, respectivamente), experimentaron más eventos cardiovasculares que aquellos con valores normales (21). En otro estudio publicado por You en 70 pacientes con síndrome coronario agudo (18 con angina inestable, 37 con infarto agudo del miocardio, 15 con angina estable y 15 controles sanos) a quienes se les cuantificaron los niveles de PAPP-A, PCRus y factor de necrosis tumoral alfa, se encontró que los niveles de PAPP-A fueron significativamente mayores en los pacientes con angina inestable e infarto agudo del miocardio (22).
Los niveles de PAPP-A mayores a 2,9 mIu/L predicen un incremento de 4,6 veces el riesgo de muerte cardiovascular, infarto agudo del miocardio o revascularización incluso sin elevación de las troponinas (23). Sin embargo, la evidencia sobre la PAPP-A como biomarcador para enfermedad coronaria aún es escasa y se requieren métodos estandarizados para su implementación en el escrutinio sistemático del síndrome coronario agudo.
Moléculas de adhesión: ICAM-1 y VCAM-1
Las moléculas de adherencia intercelular (ICAM-I) y las moléculas de adherencia a las células vasculares (V-CAM1), son muy importantes en el reclutamiento celular hacia el interior de la pared vascular. El ICAM-1, miembro de la superfamilia de las inmunoglobulinas, cumple un papel importante en la adhesión de células mononucleares a las células del endotelio vascular, ya que promueve la progresión de la placa aterosclerótica y transforma una placa estable en una inestable a través de la invasión de monocitos al ateroma (24). Existe evidencia disponible que muestra que los niveles elevados de ICAM-1 sirven como indicador del avance del proceso aterosclerótico, de la tendencia a la inestabilidad y ruptura de la placa, y del riesgo de padecer eventos coronarios (25, 26).
En el estudio PRIME se evaluaron los niveles séricos de ICAM-1 y VCAM-1 de 317 pacientes que sufrieron un evento coronario y 632 controles, durante cinco años de seguimiento. El riesgo relativo asociado con los niveles de ICAM-1 mayores comparados con los menores (> 625 vs. < 502) fue 2,45 (95% IC: 1,64-3,65, p<0,001) y permanecieron elevados después del ajuste para PCR (RR: 1,90; 95%, IC: 1,21-2,96, p=0,005). Se observó que los niveles plasmáticos elevados de ICAM-1 se asociaron con mayor riesgo de infarto y muerte por enfermedad coronaria, y concluyeron que los niveles plasmáticos de ICAM-1 pueden servir como marcadores de futuros eventos coronarios cualquiera que sea su presentación clínica. Además, al asociarse las mediciones simultáneas de PCR e ICAM-1 se define mejor el riesgo (27). De otra parte, Postadzhiyan evaluó los niveles séricos de ICAM-1, VCAM-1, PCR ultrasensible y troponina T en 75 pacientes con síndrome coronario agudo, 36 con angina de pecho estable y 25 sanos, y encontró que los niveles séricos de ICAM-1 y VCAM-1 discriminaron significativamente los pacientes con síndrome coronario agudo de aquellos con angina estable (p=0,014 y 0,05, respectivamente) y de los sanos (p<0,001 y 0,05 respectivamente) (28). El estudio ATHEROGENE demostró que concentraciones elevadas de ICAM-1, VCAM-1 y selectina E, se asociaron con causas de muerte cardiovascular en pacientes con enfermedad coronaria, correlacionándose de manera independiente los niveles de VCAM-1 como un factor predictivo de riesgo de eventos cardiovasculares (29).
Por otro lado, otros estudios obtuvieron resultados menos alentadores, en los que se demostró que los niveles de ICAM-1 no proporcionaban valor pronóstico diferente a los factores de riesgo convencionales (30, 31).
Marcadores de inflamación
Los factores de riesgo pro-inflamatorios (tabaquismo, hiperglicemia, dislipidemia e hipertensión arterial), desencadenan una serie de estímulos nocivos que estimulan la producción de leucocitos y moléculas de adhesión, las cuales a su vez facilitan la unión de los monocitos a las células endoteliales, su entrada y su acumulación en el espacio subendotelial. Una vez acumulados, dan inicio a la cascada inflamatoria, promoviendo el crecimiento, la desestabilización y la ruptura de la placa aterosclerótica, exponiendo así el núcleo ateronecrótico a la sangre periférica donde inducen la activación plaquetaria y activan la cascada inflamatoria y dan inicio a la trombosis (Figura 2). La inflamación representa un elemento clave en todas las etapas de la enfermedad aterosclerótica, desde el inicio hasta el desenlace de las complicaciones trombóticas (32). Por ello, los mediadores de la inflamación son atractivos como potenciales marcadores de esta enfermedad.
Existen múltiples estudios que muestran una asociación entre la inflamación y la enfermedad coronaria a través de la medición de gran variedad de biomarcadores. Sin embargo, sólo algunos de ellos son viables para su utilización en la práctica clínica después de considerar su estabilidad, la disponibilidad comercial de los reactivos, la estandarización que permita comparar resultados y la precisión de los ensayos medidos a través del coeficiente de variación (33). De los marcadores de inflamación con más evidencia científica disponible, el más utilizado clínicamente es la proteína C reactiva ultrasensible (PCR-us), aunque aún persiste la controversia sobre su utilidad clínica en los diferentes estadios de la enfermedad aterosclerótica y su presentación clínica.
Proteína C reactiva ultrasensible (PCR-us)
La proteína C reactiva, miembro de la familia de las pentraxinas, es sintetizada por los adipocitos hepáticos en respuesta a la inflamación. Desde 1944 se conoce que el plasma de los pacientes que han sufrido un infarto agudo del miocardio tiene una alta concentración de PCR (34), pero más que su alza tras la necrosis, interesa la elevación antes de ésta.
A pesar de conocer su vínculo con la enfermedad coronaria, los ensayos estándar no poseían la suficiente sensibilidad para detectar inflamación en el rango establecido como normal. Más recientemente, con el reconocimiento de que la inflamación es un componente crítico en la determinación de la estabilidad de la placa y con la disponibilidad de ensayos ultra sensibles, los niveles de PCR por debajo del rango establecido inicialmente como "normal" empezaron a tener un valor predictivo en los individuos con riesgo de enfermedad coronaria (35-37).
Evidencia reciente sugiere que la PCR-us puede ser sintetizada localmente por células musculares lisas y macrófagos en las lesiones ateroscleróticas (38, 39), por lo que puede tener efectos pro-inflamatorios directos y contribuir al inicio y progresión de la enfermedad aterosclerótica al inducir la expresión monocítica de moléculas de adhesión intracelular y vascular del endotelio. También produce la disminución de la concentración de la óxido nítrico sintetasa y de prostaciclinas en las células endoteliales, aumentando a su vez la concentración de endotelina-1. Además, los monocitos expuestos a la PCR aumentan la liberación de factor tisular, estimulando la migración celular y la adhesión de lipoproteínas de baja densidad oxidadas, lo que estimula la activación plaquetaria y la vía del factor tisular.
Múltiples estudios prospectivos de diferentes cohortes han demostrado que las concentraciones elevadas de PCR-us se asocian con aumento en el riesgo de eventos coronarios después del ajuste multivariable de los factores de riesgo tradicionales (40-41), por lo que según las guías del American College of Cardiology (ACC), la principal utilidad de la PCR-us es como adyuvante a la estratificación de riesgo cardiovascular en la población sana con riesgo moderado (recomendación con nivel de evidencia IIaB).
Un meta-análisis publicado por Danesh encontró que los individuos con niveles de PCR-us ubicados en el tercil superior tuvieron un riesgo relativo de 1,45 (IC 95%, 1,25-1,68) de eventos cardiacos mayores después del ajuste para los factores de riesgo convencionales comparados con los individuos con niveles en el tercil inferior (41).
Evidencia reciente del Women's Health Study sugiere que la adición de los niveles de PCR-us y la historia familiar de infarto agudo del miocardio prematuro a la escala global de riesgo del ATP III (Tercer panel de tratamiento del adulto, Framingham), proporciona una evaluación más específica del riesgo de eventos coronarios (42). En otro estudio publicado por Morrow y colaboradores, se definió que en pacientes con enfermedad coronaria estable y/o síndrome coronario agudo la PCR-us predice la recurrencia de episodios independiente de las troponinas cardíacas (43). Por otro lado, con el estudio JUPITER (44), que evaluó el uso de estatinas en pacientes asintomáticos con niveles de LDL por debajo de 130 mg/dL (3,4 mmol por litro) y de PCR-us por encima de 2 mg/L, se estableció el valor predictivo de la PCR para enfermedad coronaria en población aparentemente sana.
A pesar de la literatura abundante que hay en la actualidad sobre la PCR-us, las líneas guías internacionales sólo la recomiendan con grado IIa como útil para seleccionar pacientes para terapia con estatinas, si cumplen los siguientes requisitos:
• Pacientes de género masculino de 50 años o más.
• Mujeres de 60 años o más, con colesterol menor de 130 mg/dL, que no tomen hipolipemiantes, sin terapia de reemplazo hormonal o inmunosupresora y sin enfermedad cardiovascular clínica, enfermedad renal o contraindicaciones a las estatinas.
Interleucina 6 (IL-6)
Es una glicoproteína de cadena simple producida por muchos tipos celulares, incluyendo monocitos/macrófagos activados, células endoteliales y adipocitos.
Es capaz de estimular la secreción de proteína 1-quimioatrayente por parte de los macrófagos y participar en la proliferación de las células musculares lisas del endotelio vascular. Representa la principal citocina procoagulante, pero su función más importante es la amplificación de la cascada inflamatoria, por lo que interviene directamente en el proceso aterotrombótico.
En un estudio prospectivo de cohortes realizado por Rus, se evaluó el valor de la IL-6 como predictor de riesgo en sujetos sin enfermedad vascular y se reportó que los niveles de ésta eran indicadores de enfermedad coronaria, ictus e insuficiencia cardíaca (45). En el Health ABC study, se hizo seguimiento de los pacientes hospitalizados que presentaron infarto agudo del miocardio, angina refractaria o muerte, y se determinó que tuvieron mayores niveles de IL-6 al ingreso que los sujetos que permanecieron estables (46).
Estudios experimentales muestran que las células inmunes y las funciones inmunitarias varían con el ritmo circadiano. Los efectos biológicos de las citocinas exógenas cambian durante el ciclo noche/día (47, 48). Recientes avances en psiconeuroinmunología muestran que la secreción de citoquinas yace bajo control neuroendocrino (49), en el que la hipófisis ejerce un papel preponderante en la inmunidad a través de la secreción circadiana de melatonina (50, 51). Varios autores exponen teorías en las que proponen que el déficit nocturno de melatonina en los pacientes con síndrome coronario, puede contribuir al incremento de los niveles de IL-6 produciendo aumento de la reacción inflamatoria presente en la placa aterosclerótica, y por ende riesgo de su ruptura (52). Sin embargo, no existen guías de práctica clínica basadas en la evidencia que recomienden el uso de la IL-6 como marcador de síndrome coronario agudo.
CD40L
El ligando CD40 es una glicoproteína transmembranosa que contiene un dominio homólogo al factor de necrosis tumoral y es expresado principalmente por plaquetas y linfocitos T activados. La subsecuente fragmentación por metaloproteasas produce el ligando CD40 soluble, el cual es un fragmento soluble de 18 Kda utilizado para determinar la actividad biológica de CD40L (53). La unión de la forma soluble con el receptor de los linfocitos B lleva a su proliferación, adhesión y diferenciación. Por otro lado, la unión con el receptor de las células endoteliales tiene efectos proinflamatorios e indica la coagulación al inducir la expresión del factor tisular en los monocitos y células endoteliales. Además, esta unión produce la liberación de metaloproteasas que desestabilizan la placa aterosclerótica iniciando la trombosis coronaria (54-56). Dada la importancia del sistema CD40/sCD40L en la génesis de la aterotrombósis, también se ha intentado analizar si la determinación de sus valores plasmáticos tiene un valor pronóstico.
En el estudio CAPTURE se observaron concentraciones plasmáticas de sCD40L en pacientes con síndrome coronario agudo, las cuales se asociaron con un incremento en el riesgo de muerte e infarto agudo del miocardio no fatal (57). En el estudio OPUSTIMI16, se encontró que el valor predictivo del CD40L era independiente de las concentraciones de PCR y troponina I (58). Por su parte, en el ASAP se evidenció que el tratamiento con hipolipemiantes disminuye las concentraciones plasmáticas de CD40L independiente de las reducciones en el colesterol (59).
La mayor utilidad de esta proteína es permitir la individualización del tratamiento, así los pacientes que tienen concentraciones plasmáticas más elevadas se benefician del tratamiento con antagonistas de los receptores IIb/IIIa y se reduce el riesgo de sufrir infarto o muerte en los siguientes meses (60).
Sin embargo, numerosos estudios reportan incrementos en los niveles de sCD40L en varias enfermedades diferentes al síndrome coronario; enfermedades inflamatorias y enfermedades autoinmunes, esclerosis múltiple, diabetes mellitus e hipercolesterolemia, que lo convierten en un marcador inespecífico (11). Por otro lado, se han detectado incrementos de sCD40L durante el procesamiento de las pruebas pre-analíticas, lo que sugiere que la activación plaquetaria in vitro puede participar en la liberación de esta proteína, de manera que es necesario interpretar con cautela los resultados (61, 62). Además, a pesar de que se comercializan varios enzimoinmunoanálisis, no se describe un principio de medida estandarizado ni materiales de referencia certificados para el ligando CD40 soluble.
Mieloperoxidasa (MPO)
Es una hemoproteína tetramérica que está presente y es secretada por los fagocitos activados en los sitios de inflamación. Esta enzima genera productos intermedios del oxígeno al catalizar la conversión del peróxido de hidrógeno y cloruro a ácido hipocloroso, induciendo daño oxidativo a las células y tejidos. En las placas ateromatosas de pacientes con enfermedades aterotrombóticas hay fagocitos y por consiguiente mayor actividad de la enzima, y ya que ésta utiliza como substrato al óxido nítrico, es capaz de generar especies reactivas que dañan lípidos y proteínas, lo que contribuye a la peroxidación lipídica y por tanto a la formación de células espumosas. Lo anterior indica como la MPO participa en la progresión de desestabilización de la placa aterotrombótica y contribuye a su vulnerabilidad (63, 64).
En el estudio CAPTURE, Baldus y colaboradores (57) midieron los niveles de MPO en 1.090 pacientes con síndrome coronario agudo que presentaron muerte e infarto agudo del miocardio durante seis meses de seguimiento, y hallaron que aquellos con niveles elevados de MPO (> 350 µg/L; 31,3%) tuvieron mayor riesgo (tasa de riesgo relativo 2,25 [1,32-3,82]; p=0,003). Concluyeron que los niveles altos de MPO son un fuerte predictor de riesgo para eventos cardiovasculares subsecuentes y extienden la información pronóstica de los biomarcadores tradicionales. De igual forma, Brennan (65) obtuvo resultados similares en un grupo de 604 pacientes que acudieron a urgencias con dolor torácico sin evidencia inicial de infarto del miocardio, y demostró que los niveles de MPO predijeron su desarrollo independientemente de otros marcadores de inflamación, así como la muerte y la revascularización a los seis meses después del evento inicial. De otra parte, Apple sugirió que los pacientes con síntomas de síndrome coronario agudo que presentan niveles elevados de troponina y MPO, aumentan los episodios adversos en 43% (66). A pesar de ello, aún no se dispone de métodos estandarizados para la medición de la MPO y hasta el momento su principal utilidad clínica estriba en la estratificación de riesgo del paciente con síndrome coronario agudo, dado que es más un marcador de desestabilización de la placa que de daño oxidativo.
Marcadores de isquemia
La isquemia cardiaca es el mecanismo más común del síndrome coronario agudo subyacente, y cuando se instaura por periodos prolongados, puede inducir daño miocárdico y muerte celular.
El diagnóstico de isquemia es difícil en pacientes con dolor precordial agudo, particularmente en aquellos con electrocardiograma normal. Ninguna de las variables clínicas tradicionales (electrocardiograma de 12 derivaciones, biomarcadores de necrosis, técnicas de imagen) se consideran lo suficientemente sensibles ni específicas en la identificación de la isquemia cardíaca. Por tanto, se necesitan marcadores tempranos y altamente sensibles que permitan hacer un diagnóstico precoz.
Albúmina modificada por isquemia
La albúmina es la proteína de más alta concentración plasmática; entre sus funciones se encuentra el transporte de iones metálicos. Posee cuatro puntos de unión con diferentes especificidades para estos iones. Dos de ellas se ubican en su extremo aminoterminal y confieren la capacidad de unirse a los metales de transición. Cuando hay isquemia, en los capilares hipoxémicos se produce un cambio en el octapéptido terminal que reduce esta capacidad de unión. Probablemente, las especies reactivas de oxígeno son el agente causal de este cambio conformacional en la molécula de albúmina, haciéndola actuar como antioxidante con el fin de reducir el daño (67).
El carácter de marcador de isquemia ha quedado en evidencia en varios estudios. Bar-Or evaluó 114 pacientes con enfermedad coronaria, sin evidencia de síndrome coronario agudo, sometidos a angiografía, y 163 controles. En ellos, se determinaron los niveles de albúmina modificada por isquemia (IMA), proteína C reactiva ultrasensible (PCR-us) y péptido natriurético cerebral (NT-proBNP). Los niveles de IMA, PCR-us y NT-proBNP fueron mayores en los pacientes que en los controles. Para el diagnóstico de enfermedad coronaria, el mejor punto de corte de la IMA fue 101,5 KU/L con sensibilidad y especificidad de 87,7% y valor predictivo negativo de 83,3%. Por otro lado, los niveles de IMA se asociaron con mayor riesgo de enfermedad coronaria (OR= 1,23, 95% CL: 1,16-1,31; p < 0,001) (68).
Kazanis estudió 208 pacientes que ingresaron al servicio de urgencias con dolor torácico de menos de tres horas de evolución a quienes se les realizó un electrocardiograma de 12 derivaciones y muestras de sangre para medir troponinas y niveles de IMA. La sensibilidad de la albúmina modificada por isquemia fue de 82% comparada con 45% para el electrocardiograma y 20% para las troponinas. Las combinaciones IMA con electrocardiograma e IMA con troponinas, proporcionaron una sensibilidad de 92% y 90% respectivamente. Por último, evaluaron la sensibilidad de las tres pruebas combinadas, para hallar una sensibilidad de 95% para detectar dolor torácico de origen isquémico (69).
La albúmina modificada por isquemia aumenta la sensibilidad diagnóstica de los biomarcadores cardiacos convencionales. En un estudio publicado por Sinha, en 200 pacientes admitidos al servicio de urgencia con sospecha de isquemia miocárdica a quienes midieron niveles de mioglobina, isoforma 2 de la creatincinasa (CK-MB), troponina I (TnI) y albúmina modificada por isquemia, la combinación mioglobina, CK-MB y TnI proporcionó una sensibilidad diagnóstica de 57%, mientras que cuando se evaluaron en combinación con la IMA la sensibilidad aumento a 97% con un valor predictivo negativo de 92% (70). Debido a este alto valor predictivo negativo, la medición de la albúmina modificada por isquemia confiere información valiosa en el estudio del paciente con síndrome coronario agudo, y puede ayudar a excluir pacientes con baja probabilidad de isquemia miocárdica. Sin embargo, la IMA es una prueba que se puede elevar en cualquier situación que curse con isquemia, por lo que su empleo como única prueba en el estudio del paciente con dolor torácico que se sospecha es de origen isquémico, tiene una especificidad diagnóstica inaceptable, 13,6% (71). Por otro lado, es preciso tener cautela al momento de interpretar los resultados en pacientes con concentraciones bajas de albúmina, ya que se ha visto una correlación negativa entre ambas mediciones (72).
El principio usado para la detección de la albúmina modificada por isquemia es la espectrometría de absorción molecular UV-visible, que consiste en la detección de un complejo coloreado producto de la unión del cobalto añadido libre al ditiotreitol. Actualmente, se está desarrollando un inmunoanálisis (73).
Glucógeno fosforilasa isoenzima BB
La glucógeno fosforilasa (GP) hace parte fundamental en la regulación del metabolismo de los carbohidratos al catalizar el primer paso de la glucogenólisis, en el cual el glucógeno es convertido en glucosa 1-fosfato, utilizando fosfato inorgánico. Se han descrito tres isoformas diferentes: GPLL (hepática), GPMM (músculo) y GPBB (cerebro), de las cuales la MM y la BB están presentes en el corazón, y predomina la GPBB (74).
La GP está unida al glucógeno y al retículo sarcoplasmático formando un complejo macromolecular, denominado complejo retículo sarcoplasmático-glucogenólisis. El grado de asociación de la GP al complejo está determinado por el estado metabólico del miocardio. En situaciones de hipoxia tisular, la GP es liberada del complejo acumulándose en el citoplasma como una partícula soluble, generando un gradiente de concentración de GPBB en el compartimiento del retículo perisarcoplasmático, el cual, junto con el aumento de la permeabilidad capilar producto de la hipoxia, facilita la liberación de la GPBB hacia la circulación periférica (75).
La GPBB es liberada hacia la circulación periférica dos a cuatro horas después de iniciada la isquemia miocárdica y regresa a valores normales después de uno a dos días. Su detección se hace mediante técnicas de ELISA (76).
En un estudio publicado por Rabitzsch, en el que se incluyeron 107 pacientes con dolor torácico, se encontró que la GPBB fue más sensible que la CK, la CK-MB, la mioglobina y la troponina T para el diagnóstico de infarto agudo del miocardio y angina inestable dentro de las primeras cuatro horas de iniciado el dolor, con un valor predictivo positivo (VPP) de 94%, un valor predictivo negativo (VPN) de 78% y un área bajo la curva (AUC) de 0,91 (77). Un estudio más reciente publicado por Peetz, incluyó 61 pacientes con síndrome coronario agudo en quienes comparó la GPBB con los marcadores convencionales (troponina T, CPK-MBmasa y mioglobina). Luego de seis horas de iniciado el dolor, la GPBB tuvo mayor sensibilidad (95,5%-100%) y especificidad (94%-96%) que la mioglobina (sensibilidad 85%-95%) y que la CPK-MBmasa (sensibilidad 71,4%-91,3%) (78).
La GPBB es un marcador prometedor para el diagnóstico temprano del síndrome coronario agudo; sin embargo, se requieren más estudios sobre su especificidad y el desarrollo de métodos estandarizados que permitan su utilización de forma sistemática.
Marcadores de necrosis
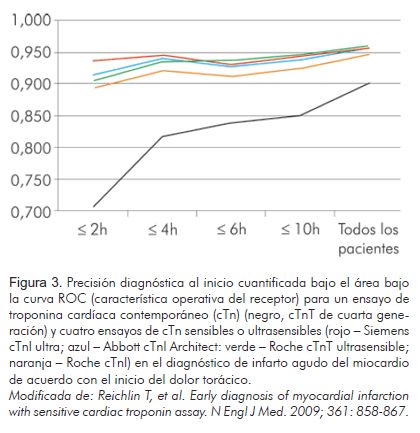
El término infarto al miocardio debería utilizarse cuando existe evidencia de necrosis miocárdica en el contexto clínico de isquemia miocárdica (8). Actualmente, la piedra angular en el diagnóstico del infarto al miocardio, según las guías de la NACB (79) así como las de la ESC y el ACC, son las troponinas cardiacas (recomendación con grado de evidencia IA) y el electrocardiograma (8, 80, 81). Este último usualmente es insuficiente para el diagnóstico debido a su baja sensibilidad y especificidad (82). En su parte, las troponinas son muy específicas de daño miocárdico, pero poco sensibles al momento de presentación del paciente, ya que para hacer el diagnóstico de infarto agudo del miocardio se requiere monitoreo prolongado (mínimo seis horas) y muestras seriadas (recomendación con grado de evidencia clase I) (83). Recientemente, el desarrollo tecnológico en los ensayos de troponinas cardiacas, ha permitido desarrollar nuevas técnicas mucho más sensible y con mejor precisión. El estudio APACE evaluó 786 pacientes que se presentaron al servicio de urgencias con clínica sugestiva de síndrome coronario agudo a quienes se les tomaron muestras para medir niveles de troponinas ultrasensibles mediante cuatro ensayos diferentes (Abbot-architect troponin I, Roche high-sensitive troponin T, Roche troponin I, y Siemens troponin I ultra) y muestras para medir troponinas mediante el ensayo convencional (Roche troponin T) (Figura 3). Se identificó infarto agudo al miocardio en 123 pacientes, en quienes se demostró la mejor efectividad diagnóstica de los ensayos ultrasensibles frente a la técnica convencional (ABC para el Abbott–Architect Troponin I, 0,96; 95% intervalo de confianza [IC], 0,94 a 0,98; para Roche High-Sensitive Troponin T, 0,96; 95% IC, 0,94 a 0,98; para Roche Troponin I, 0,95; 95% IC, 0,92 a 0,97; y para el Siemens Troponin I Ultra, 0,96; 95% IC, 0,94 a 0,98; vs. ABC para el ensayo convencional, 0,90; 95% IC, 0,86 a 0,94). El mismo comportamiento se observó en los pacientes con menos de tres horas de iniciado el dolor anginoso, el ABC fue 0,93 (95% IC, 0,88 a 0,99), 0,92 (95% IC, 0,87 a 0,97), 0,92 (95% IC, 0,86 a 0,99) y 0,94 (95% IC, 0,90 a 0,98) respectivamente, y para la técnica convencional fue 0,76 (95% IC, 0,64 a 0,88) (84). Un estudio multicéntrico de Keller publicado en 2009, incluyó 1.818 pacientes con sospecha de infarto agudo del miocardio en quienes se midieron niveles de troponina I mediante una técnica ultra sensible (Troponin I ultra) y niveles de troponinas mediante la técnica convencional (ensayo troponina T) al ingreso y a las tres y seis horas después del ingreso. De las muestras obtenidas al ingreso, la efectividad diagnóstica fue mayor con el ensayo de troponina I ultrasensible, área bajo la curva 0,96 comparado con la técnica convencional (ABC 0,85); la sensibilidad diagnóstica fue 90,7% y la especificidad de 90,2%. También se observó que los niveles superiores a 0,04 ng/mL son un factor de riesgo independiente para el desarrollo de complicaciones a treinta días (85). Con base en lo anterior, las nuevas técnicas de detección de troponinas mediante ensayos ultrasensibles, aumentan la efectividad diagnóstica en la detección temprana del síndrome coronario agudo; no obstante, aún se requieren más estudios para estandarizar la metodología y evaluar su costo-efectividad al momento de ser implementada en los servicios de urgencias.
Conclusiones
La búsqueda del biomarcador ideal continúa y probablemente no acabará nunca. Sigue la evaluación de las múltiples moléculas disponibles y de los nuevos marcadores potenciales como ensayos únicos y combinándolos entre sí. El futuro en el tratamiento del síndrome coronario probablemente irá enfocado en el análisis multimarcador; sin embargo nuestro conocimiento acerca del rol de cada uno de estos péptidos en la historia natural de la enfermedad, aún es restringido. Todos los marcadores mencionados en esta revisión tienen limitaciones; muchos de los estudios usan la muerte o los eventos cardiovasculares mayores como desenlace principal al ser fácilmente medibles; no obstante, esos desenlaces son el resultado de una constelación de eventos fisiopatológicos que aun no están claramente establecidos y que podrían ejercer un papel fundamental en el diagnóstico, pronóstico y tratamiento de la enfermedad cardiovascular. Con base en nuestra revisión de la literatura, los marcadores que parecen estar más cerca de cumplir los criterios de un biomarcador óptimo son las troponinas ultrasensibles, la albúmina modificada por isquemia, la mieloperoxidasa y el ligando CD40S (Tabla 2). Estos, junto con los que se encuentran ya incluidos en las guías publicadas por las sociedades científicas (troponina I y T, PCR-us, CPK-MB, mioglobina), podrían ampliar las fronteras de lo que se conoce acerca de la cardiopatía isquémica. A pesar de ello, de momento no es posible emitir una recomendación específica teniendo en cuenta la evidencia actual.
Bibliografía
1. Organización Panamericana de la Salud. World Health Statistics 2007. Disponible en: www.paho.org [ Links ]
2. Kesteloot H, Sans S, Kromhout D. Dynamics of cardiovascular and all-cause mortality in Western and Eastern Europe between 1970 and 2000. Eur Heart J. 2006; 27: 107-13. [ Links ]
3. Ministerio de la Protección Social. Informe sobre la situación de salud en Colombia-Indicadores de salud; 2007. [ Links ]
4. Pinedo J, Egea K, Mazenett E. Perfil epidemiológico de Cartagena de Indias, año 2010. Alcaldía Mayor de Cartagena. [ Links ]
5. Vivanco F, Martín-Ventura JL, Duran MC, Barderas MG, Blanco-Colido L, Dardé VM, et al. Quest for novel cardiovascular biomarkers by proteomic analysis. J Proteome Res. 2005; 4: 1181-91. [ Links ]
6. Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. International human genome sequencing consortium. Initial sequencing and analysis of the human genome. Nature 2001; 409: n860-921. [ Links ]
7. Vasan R. Biomarkers of cardiovascular disease: molecular basis and practical considerations. Circulation 2006; 113: 2335-62. [ Links ]
8. Clerico A. The increasing impact of laboratory medicine on clinical cardiology. Clin Chem Lab Med. 2003; 41: 871-83. [ Links ]
9. LaBaer J. So, you want to look for biomarkers. J Proteome Res. 2005; 4: 1053-9. [ Links ]
10. Brown MS, Goldstein JL. Lipoprotein metabolism in the macrophage. Ann Rev Biochem. 1983; 52: 223-61. [ Links ]
11. Steinberg D. Lewis A. Conner memorial lecture: oxidative modification of LDL and atherogenesis. Circulation 1997; 95: 1062-71. [ Links ]
12. Jialal I, Devaraj S. The role of oxidized low-density lipoprotein in atherogenesis. J Nutr 1996; 126 (Suppl 4): S1053-7. [ Links ]
13. Chatterjee S. Role of oxidized human plasma low density lipoproteins in atherosclerosis: effects on smooth muscle cell proliferation. Moll Cell Biochem 1992; 111: 143-7. [ Links ]
14. Imazu M, Ono K, Tadehara F, et al. Plasma levels of oxidized low density lipoprotein are associated with stable angina pectoris and modalities of acute coronary syndrome. Int Heart J. 2008; 49 (5): 515-24. [ Links ]
15. Tsimikas S, Bergmark C, Beyer RW, et al. Temporal increases in plasma markers of oxidized low-density lipoprotein strongly reflect the presence of acute coronary syndromes. J Am Coll Cardiol. 2003; 41: 360-370. [ Links ]
16. Tsimikas S, Lau HK, Han KR, et al. Percutaneous coronary intervention results in acute increases in oxidized phospholipids and lipoprotein(a): short-term and long-term immunologic responses to oxidized low-density lipoprotein. Circulation 2004; 109: 3164-3170. [ Links ]
17. Sotirios T, et al. Oxidized phospholipids, Lp(a) lipoprotein, and coronary artery disease. N Engl J Med 2005; 353: 46-57. [ Links ]
18. Libby P, Simon DI. Inflammation and thrombosis: the clot thickens. Circulation 2001; 103: 1718-20. [ Links ]
19. Heeschen C, et al. Pregnancy-associated plasma protein-A levels in patients with acute coronary syndromes: comparison with markers of systemic inflammation, platelet activation, and myocardial necrosis. J Am Coll Cardiol. 2005; 45 (2): 229-37. [ Links ]
20. Bayes-Genis A, Conover CA, Overgaard MT, et al. Pregnancy-associated plasma protein A as a marker of acute coronary syndromes. N Engl J Med. 2001; 345: 1022-9. [ Links ]
21. Mei WY, et al. Pregnancy-associated plasma protein predicts outcomes of percutaneous coronary intervention in patients with non-ST-elevation acute coronary syndrome. Heart Lung. 2010. [ Links ]
22. You L et al. A pilot study of the clinical relevance of the relationship between the serum level of pregnancy-associated plasma protein A and the degree of acute coronary syndrome. J Int Med Res. 2010; 38 (2): 625-32. [ Links ]
23. Lund J, Qin QP, Ilva T, Pettersson K, Voipio-Pulkki LM, Porela P, Pulkki K. Circulating pregnancy-associated plasma protein a predicts outcome in patients with acute coronary syndrome but no troponin I elevation. Circulation 2003; 108: 1924-1926. [ Links ]
24. Ridker PM, Hennekens CH, Roitman-Johnson B, Stampfer MJ, Allen J. Plasma concentration of soluble intercellular adhesion molecule 1 and risks of future myocardial infarction in apparently healthy men. Lancet 1998; 351: 88-92. [ Links ]
25. Hwang SJ, Ballantyne CM, Sharrett R, et al. Circulating adhesion molecules VCAM-1, ICAM-1, and E-selectin in carotid atherosclerosis and incident coronary heart disease cases: the atherosclerosis risk in communities (ARIC) study. Circulation 1997; 96: 4219-25. [ Links ]
26. Malik I, Danesh J, Whincup P, Bhatia V, Papacosta O, Walker M, et al. Soluble adhesion molecules and prediction of coronary heart disease: a prospective study and metaanalysis. Lancet 2001; 358: 971-6. [ Links ]
27. Luc G, Arveiler D, Evans A, Amouyel P, Ferrieres J, Bard JM, et al. Circulating soluble adhesion molecules ICAM-1 and VCAM-1 and incident coronary heart disease: the PRIME Study. Atherosclerosis 2003; 170: 169-176. [ Links ]
28. Postadzhiyan AS, Tzontcheva AV, Kehayov I, Finkov B. Circulating soluble adhesion molecules ICAM-1 and VCAM-1 and their association with clinical outcome, troponin T and C-reactive protein in patients with acute coronary syndromes. Clin Biochem 2008; 41: 126-133. [ Links ]
29. Blankenberg S, Rupprecht HJ, Bickel C, Peetz D, Hafner G, Tiret L, et al. Circulating cell adhesion molecules and death in patients with coronary artery disease. Circulation 2001; 104: 1336-42. [ Links ]
30. Malik I, Danesh J, Whincup P, Bhatia V, Papacosta O, Walker M, et al. Soluble adhesion molecules and prediction of coronary heart disease: a prospective study and meta-analysis. Lancet 2001; 358: 971-6. [ Links ]
31. Hansson GK. Mechanisms of disease inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 2005; 352: 1685-95. [ Links ]
32. Thomas A. Pearson, George A. Mensah, R. Wayne Alexander, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for healthcare professionals from the centers for disease control and prevention and the american heart association. Circulation 2003; 107: 499-511. [ Links ]
33. Löfström G. Comparison between the reaction of acute phase serum with Pneumococcus C-polysaccharide and with Pneumococcus type 27. Br J Exp Pathol. 1944; 25: 21-6. [ Links ]
34. Liuzzo G, Biasucci LM, Gallimore JR, et al. The prognostic value of C-reactive protein and serum amyloid A protein in severe unstable angina. N Engl J Med. 1994; 331: 417-424. [ Links ]
35. Morrow D, Rifai N, Antman E, et al. C-reactive protein is a potent predictor of mortality independently and in combination with troponin T in acute coronary syndromes. J Am Coll Cardiol. 1998; 31: 1460-1465. [ Links ]
36. Biasucci LM, Liuzzo G, Grillo RL, et al. Elevated levels of C-reactive protein at discharge in patients with unstable angina predict recurrent instability. Circulation 1999; 99: 855-860. [ Links ]
37. Kushner I, Broder ML, Karp D. Control of the acute phase response. Serum C-reactive protein kinetics after acute myocardial infarction. J Clin Invest 1978; 61: 235-42. [ Links ]
38. Calabro P, Willerson JT, Yeh ET. Inflammatory cytokines stimulated C-reactive protein production by human coronary artery smooth muscle cells. Circulation 2003; 108: 1930-2. [ Links ]
39. Yasojima K, Schwab C, McGeer EG, McGeer PL. Generation of C-reactive protein and complement components in atherosclerotic plaques. Am J Pathol 2001; 158: 1039-51. [ Links ]
40. Mora S, Musunuru K, Blumenthal RS. The clinical utility of high-sensitivity C-reactive protein in cardiovascular disease and the potential implication of JUPITER on current practice guidelines. Clin Chem 2009; 55: 219-28. [ Links ]
41. Danesh J, Wheeler JG, Hirschfield GM, Eda S, Eiriksdottir G, Rumley A, et al. C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease. N Engl J Med 2004; 350: 1387-1397. [ Links ]
42. Cook NR, Buring JE, Ridker PM. The effect of including C-reactive protein in cardiovascular risk prediction models for women. Ann Intern Med 2006; 145: 21-29. [ Links ]
43. Morrow D, Rifai N, Antman E, Weiner DL, McCabe CH, Cannon CP, et al. C-reactive protein is a potent predictor of mortality independently of and in combination with troponin T in acute coronary syndromes: a TIMI 11A substudy. Thrombolysis in myocardial infarction. J Am Coll Cardiol. 1998; 31: 1460-5. [ Links ]
44. Fonseca FA, Izar MC, et al. Primary prevention of vascular events in patients with high levels of C-reactive protein: the JUPITER study. Expert Rev Cardiovasc Ther. 2009; 7 (9): 1041-56. [ Links ]
45. Rus HG, Vlaicu R, Niculescu F. Interleukin-6 and inteleukin-8 protein and gene expression in human arterial atherosclerotic wall. Atherosclerosis 1996; 127: 263-271. [ Links ]
46. Cesari M, Penninx BW, Newman AB, Kritchevsky SB, Nicklas BJ, Sutton-Tyrrell K, et al. Inflammatory markers and onset of cardiovascular events: results from the Health ABC study. Circulation 2003; 108: 2317-22. [ Links ]
47. Abo T, Kawate K, Itoh K, Kumagai K. Studies on the bioperiodicity of the immune response. Circadian rhythms of human T, B and K cell traffic in the peripheral blood. J Immunol 1981; 126: 1360-6. [ Links ]
48. Maestroni GJM, Conti A, Pierpaoli W. Pineal melatonin, its fundamental immunoregulatory role in aging and cancer. Ann N Y Acad Sci 1988; 521: 140-8. [ Links ]
49. Guerrero JM, Reiter RJ. Melatonin-immune system relationship. Curr Top Med Chem 2002; 2: 167-79. [ Links ]
50. Domínguez-Rodríguez A, Abreu-González P, García M, Ferrer J, de la Rosa A, Vargas M, et al. Light/dark patterns of interleukin-6 in relation to the pineal hormone melatonin in patients with acute myocardial infarction. Cytokine 2004; 26: 89-93. [ Links ]
51. Schonbeck U, Libby P. The CD40/CDE154 receptor/ligand dyad. Cell Moll Life Sci 2001; 58: 4-43. [ Links ]
52. Van Kooten C, Banchereau J. CD40-CD40 ligand. J Leukoc Biol 2000; 67: 2-17. [ Links ]
53. Henn V, Steinbach S, Buchner P, Presek P, Kroczek RA. The inflammatory action of CD40 ligand (CD154) expressed on activated human platelets is temporally limited by coexpressed CD40. Blood 2001; 15: 1047-54. [ Links ]
54. Schonbeck U, Libby P. CD40 signaling and plaque instability. Circ Res 2001; 89: 1092-103. [ Links ]
55. Heeschen C, Dimmeler S, Hamm CW, van den Brand MJ, Boersma E, Zeiher AM, et al. Soluble CD40 ligand in acute coronary syndromes. N Engl J Med 2003; 348: 1104-11. [ Links ]
56. Andre P, Prasad KS, Denis CV, He M, Papalia JM, Hynes RO, et al. CD40L stabilizes arterial thrombi by a beta3 integrin-dependent mechanism. Nat Med. 2002; 8: 247-52. [ Links ]
57. Baldus S, Heeschen C, Meinertz T, Zeiher AM, Eiserich JP, Munzel T, CAPTURE Investigators, et al. Myeloperoxidase serum levels predict risk in patients with acute coronary syndromes. Circulation. 2003; 108: 1440-5. [ Links ]
58. Varo N, de Lemos JA, Libby P, Morrow DA, Murphy SA, Unzo R, et al. Soluble CD40L: risk prediction after acute coronary syndromes. Circulation 2003; 108: 1049-52. [ Links ]
59. Semb AG, Van Wissen S, Ueland T, Smilde T, Waehre T, Tripp MD, et al. Raised serum levels of soluble CD40 ligand in patients with familial hypercholesterolemia: down regulatory effect of statin therapy. J Am Coll Cardiol. 2003; 41: 275-9. [ Links ]
60. Kinlay S, Schwartz GG, Olsson AG, Rifai N, Sasiela WJ, Szarek M, et al. Effect of atorvastatin on risk of recurrent cardiovascular events after an acute coronary syndrome associated with high soluble CD40 ligand in the myocardial ischemia reduction with aggressive cholesterol lowering (MIRACL) study. Circulation. 2004; 110: 386-91. [ Links ]
61. Weber M, Rabenau B, Stanisch M, Elsaesser A, Mitrovic V, Heeschen C, et al. Influence of sample type and storage conditions on soluble CD40 ligand assessment. Clin Chem 2006; 52: 888-91. [ Links ]
62. Halldorsdottir AM, Stroker J, Porche-Sorbet R, Eby CS. Soluble CD40 ligand measurement inaccuracies attributable to specimen type, processing time, and ELISA method. Clin Chem 2005; 51: 1054-7. [ Links ]
63. Sugiyama S, Okada Y, Sukhova G, Virmani R, Heinecke J, Lobby P. Macrophage myeloperoxidase regulation by granulocyte macrophage colony-stimulating factor in human atherosclerosis and implications in acute coronary syndromes. Am J Pathol. 2001; 158: 879-91. [ Links ]
64. Nicholls SJ, Hazen SL. The role of myeloperoxidase in the pathogenesis of coronary artery disease. Jpn J Infect Dis. 2004; 57: S21-2. [ Links ]
65. Brennan ML, Penn MS, Van Lente F, Nambi V, Shishehbor MH, Aviles RJ, et al. Prognostic value of myeloperoxidase in patients with chest pain. N Engl J Med. 2003; 349: 1595-604. [ Links ]
66. Apple FS, Pearce LA, Chung A, Ler R, Murakamim MAM. Multiple biomarker use for detection of adverse events in patients presenting with symptoms suggestive of acute coronary syndrome. Clin Chem. 2007; 53: 874-81. [ Links ]
67. Mothes E, Faller P. Evidence that the principal CoII-binding site in human serum albumin is not at the N-terminus: implication on the albumin cobalt binding test for detecting myocardial ischemia. Biochemistry 2007; 46: 2267-74. [ Links ]
68. Bar-Or D, Curtis G, Rao N, Bampos N, Lau E. Characterization of the Co(2+) and Ni(2+) binding amino-acid residues of the N terminus of human albumin. An insight into the mechanism of a new assay for myocardial ischemia. Eur J Biochem. 2001; 268: 42-7. [ Links ]
69. Kazanis K, et al. Ischemia modified albumin, high-sensitivity c-reactive protein and natriuretic peptide in patients with coronary atherosclerosis. Clinica Chimica Acta 2009; 408 (1-2). [ Links ]
70. Sinha MK, Roy D, Gaze DC, Collinson PO, Kask JC. Role of ''Ischemia Modified Albumin'', a new biochemical marker of myocardial ischemia, in the early diagnosis of acute coronary syndromes. Emerg Med J. 2004; 21: 29-34. [ Links ]
71. Anwaruddin S, Januzzi Jr JL, Baggish AL, Lewandrowski EL, Lewandrowski KB. Ischemia-modified albumin improves the usefulness of standard cardiac biomarkers for the diagnosis of myocardial ischemia in the emergency department setting. Am J Clin Pathol. 2005; 123: 140-5. [ Links ]
72. Keating L, Benger JR, Beetham R, Bateman S, Veysey S, Kendall J, et al. The PRIMA study: presentation ischaemia modified albumin in the emergency department. Emerg Med J. 2006; 23: 764-8. [ Links ]
73. Zapico Muñiz E, Santalo' Bel M, Merce' Muntañola J, Montiel JA, Martínez Rubio A, Ordoñez Llanos J. Ischemia-modified albumin during skeletal muscle ischemia. Clin Chem. 2004; 50: 1063-5. [ Links ]
74. Sinhg et al. Cardiac biomarkers - the old and the new: a review. Coronary Artery Disease 2010; 21: 244-256. [ Links ]
75. Krause EG, Rabitzsch G, Noll F, Mair J, Puschendorf B. Glycogen phosphorylase isoenzyme BB in diagnosis of myocardial ischaemic injury and infarction. Mol Cell Biochem 1996; 160-161: 289-295. [ Links ]
76. Mair J. Glycogen phosphorylase isoenzyme BB to diagnose ischaemic myocardial damage. Clin Chim Acta 1998; 272: 79e86. [ Links ]
77. Rabitzsch G, Mair J, Lechleitner P, et al. Immunoenzymometric assay of human glycogen phosphorylase isoenzyme BB in diagnosis of ischemic myocardial injury. Clin Chem 1995; 41: 966e78. [ Links ]
78. Peetz D, Post F, Schinzel H, et al. Glycogen phosphorylase BB in acute coronary syndromes. Clin Chem Lab Med 2005; 43: 1351e8. [ Links ]
79. National Academy of Clinical Biochemistry. National Academy of Clinical Biochemistry Laboratory medicine practice guidelines: Clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem. 2007; 53: 552-74. [ Links ]
80. Anderson JL, Adams CD, Antman EM, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non ST-Elevation Myocardial Infarction): developed in collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions, and the Society of Thoracic Surgeons: endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. Circulation 2007; 116 (7): e148-e304. [ Links ]
81. Bassand JP, Hamm CW, Ardissino D, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28: 1598-660. [ Links ]
82. Wang K, Asinger RW, Marriott HJ. ST segment elevation in conditions other than acute myocardial infarction. N Engl J Med 2003; 349: 2128-35. [ Links ]
83. Macrae AR, Kavsak PA, Lustig V, et al. Assessing the requirement for the 6-hour interval between specimens in the American Heart Association Classification of Myocardial Infarction in Epidemiology and Clinical Research Studies. Clin Chem 2006; 52: 812-8. [ Links ]
84. Reichlin T, Hochholzer W, Bassetti S, Steuer S, Stelzig C, Hartwiger S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assay. N Engl J Med 2009; 361: 858-67. [ Links ]
85. Keller T, Zeller T, Peetz D, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med 2009; 361: 868-877. [ Links ]













