Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.19 no.6 Bogota Nov./Dec. 2012
Este artículo corresponde a una traducción autorizada del trabajo original publicado en Pulm Circ. 2011 Apr-Jun; 1 (2): 286-298.
(1) La Paz Children's Hospital, Madrid, Spain.
(2) Children's Hospital, University of Colorado School of Medicine, Aurora, Colorado, USA.
(3) Universidad Nacional de Colombia, Bogotá, Colombia.
(4) Kardiozentrum, La Paz, Bolivia.
(5) Sree Chitra Tirunal Institute for Medical Sciences and Technology, Trivandrum, India.
(6) University College, London, UK.
(7) Heart Institute, University of São Paulo, São Paulo, Brazil.
(8) University of Chicago at Illinois, Chicago, USA.
(9) National Institute of Cardiology, Mexico City, Mexico.
(10) Stollery Children's Hospital, University of Alberta, Edmonton, Alberta, Canada.
Correspondencia: Dr. Astrid E. Lammers. Department of Paediatric Cardiology, Great Ormond Street Hospital for Children, Great Ormond Street, London WC1N 3JH, UK E-mail: astridlammers@gmx.de
Recibido: 08/10/2012. Aceptado: 10/10/2012.
Las clasificaciones actuales de la hipertensión pulmonar han contribuido significativamente al conocimiento de la enfermedad vascular pulmonar, han facilitado ensayos farmacológicos y han mejorado nuestro conocimiento de las cardiopatías congénitas del adulto; sin embargo estas clasificaciones no son aplicables completamente a la enfermedad en el niño. La clasificación que aquí se propone se basa principalmente en la práctica clínica. Los objetivos específicos de esta nueva clasificación son mejorar las estrategias diagnósticas, promover la investigación clínica, mejorar nuestro conocimiento de la patogénesis, de la fisiología y de la epidemiología de la enfermedad y orientar el desarrollo de modelos de la enfermedad humana en el laboratorio y estudios en animales; también puede servir como un recurso docente. Se hace énfasis en los conceptos de maladaptación perinatal, alteraciones del desarrollo e hipoplasia pulmonar como factores causantes de la hipertensión pulmonar pediátrica; así mismo, en la importancia de los múltiples síndromes malformativos congénitos, genéticos y cromosómicos en la presentación de la hipertensión pulmonar pediátrica. La enfermedad vascular pulmonar hipertensiva en niños se divide en diez grandes categorías.
Palabras clave: hipertensión arterial pulmonar, cardiopatía congénita, Pediatría.
Current classifications of pulmonary hypertension have contributed a great deal to our understanding of pulmonary vascular disease, facilitated drug trials, and improved our understanding of congenital heart disease in adult survivors. However, these classifications are not applicable readily to pediatric disease. The classification system that we propose is based firmly in clinical practice. The specific aims of this new system are to improve diagnostic strategies, to promote appropriate clinical investigation, to improve our understanding of disease pathogenesis, physiology and epidemiology, and to guide the development of human disease models in laboratory and animal studies. It should be also an educational resource. We emphasize the concepts of perinatal maladaptation, maldevelopment and pulmonary hypoplasia as causative factors in pediatric pulmonary hypertension. We highlight the importance of genetic, chromosomal and multiple congenital malformation syndromes in the presentation of pediatric pulmonary hypertension. We divide pediatric pulmonary hypertensive vascular disease into 10 broad categories.
Keywords: pulmonary arterial hypertension, congenital heart disease, Pediatrics.
Introducción
La clasificación de la hipertensión pulmonar que fue concebida en el Simposium de Evian organizado por la OMS en 1998 (1), y las posteriores revisiones y modificaciones de Venecia (2) y Dana Point (3) han contribuido enormemente al conocimiento de la enfermedad vascular pulmonar, han facilitado los ensayos farmacológicos y han mejorado nuestro conocimiento de las cardiopatías congénitas del adulto; sin embargo, estas clasificaciones no son aplicables del todo a la edad pediátrica (4-7). Del debate sobre la clasificación de la hipertensión pulmonar en el niño en la reunión del Pulmonary Vascular Research Institute (PVRI) en Lisboa (Portugal) en 2010, surgió la necesidad bien reconocida del desarrollo de una clasificación de la enfermedad vascular pulmonar hipertensiva en el niño. También se reconoció que los médicos que tienen bajo su cuidado adultos con cardiopatía congénita deben estar en capacidad de usar esta clasificación. Esto dio origen al inicio del Taskforce pediátrico que se presentó en la reunión del PVRI en Panamá en 2011 cuyos resultados se resumen en este artículo.
Discusión
Dificultades para aplicar la clasificación de Dana Point al paciente pediátrico
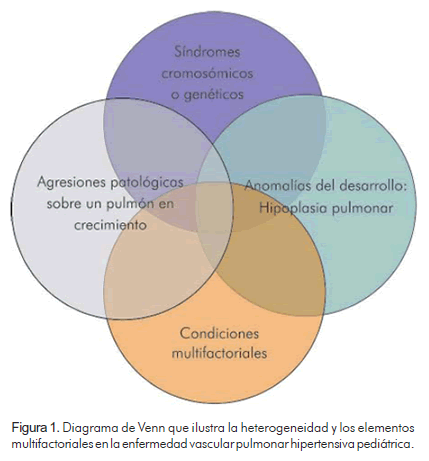
Las áreas de particular dificultad para aplicar la clasificación de Dana Point (3) al paciente pediátrico se mencionan aquí brevemente y en forma más extensa bajo encabezamientos específicos en este artículo. Las causas fetales de la enfermedad vascular pulmonar son importantes no solo en el paciente pediátrico sino también en el adulto ya que es probable que los eventos perinatales desempeñen un papel clave en el establecimiento del riesgo de hipertensión pulmonar. La clasificación de Dana Point no reconoce la importancia potencial de los mecanismos del desarrollo. La enfermedad vascular pulmonar hipertensiva, incluso cuando se presenta en la edad adulta puede estar relacionada con el desarrollo fetal, perinatal y de la temprana infancia. En la actualidad se reconocen muy bien las causas perinatales de la hipertensión sistémica y de la enfermedad arterial coronaria del adulto (8). La enfermedad vascular pulmonar neonatal recibió una atención poco significativa en Evian, Venecia y Dana Point; particularmente no se señalaron los conceptos de maladaptación perinatal, alteraciones del desarrollo e hipoplasia pulmonar como causales de la hipertensión pulmonar. Además, como herramienta para la valoración clínica en la vida real del niño, la clasificación de Dana Point no refleja la compleja heterogeneidad de factores que contribuyen a la enfermedad vascular pulmonar pediátrica (6) (Figura 1). Por ejemplo, en la práctica pediátrica, con frecuencia se evalúan pacientes con hipertensión pulmonar que pueden haber nacido prematuramente, con anomalías cromosómicas o genéticas, con cardiopatías, así como los pacientes con apneas del sueño, broncoaspiración crónica y enfermedad parenquimatosa pulmonar secundaria.
Objetivos de la "clasificación Panamá" del PVRI
La clasificación que se propone se basa principalmente en la práctica clínica. Los objetivos específicos de esta clasificación son: mejorar las estrategias diagnósticas, promover la investigación clínica y mejorar nuestro conocimiento de la patogénesis, fisiología y epidemiología de la enfermedad y orientar el desarrollo de modelos de la enfermedad humana en el laboratorio y estudios en animales; también puede ser un recurso docente. Esta clasificación no se basa en el tratamiento de la hipertensión pulmonar ni está diseñada para ser una guía terapéutica. La utilidad de un sistema clasificatorio efectivo se sustenta en su capacidad de ayuda para que nuestras observaciones en cada niño tengan sentido; además, debe estar suficientemente estructurado, de tal manera que permita una clasificación inequívoca pero lo suficientemente flexible que facilite la inclusión de ideas aún no descritas. Las clasificaciones son útiles en medicina si ellas proporcionan una estructura adecuada para el diagnóstico y manejo de una enfermedad y estimulan una visión epidemiológica. Una clasificación perfecta, como la tabla periódica, también tendría categorías que puedan incluir enfermedades no descritas o mecanismos para enfermedades complejas conocidas.
Agradecemos el gran valor de la clasificación de Dana Point (3) por lo cual se han dejado aspectos no modificados. Somos conscientes de que si la clasificación que sugerimos tiene algún mérito es porque (parafraseando a Isaac Newton en 1676) solamente estando sobre los hombros de los gigantes seremos capaces de ver más lejos. Con esto en mente proponemos una clasificación nueva de la enfermedad vascular pulmonar hipertensiva pediátrica.
Esquema general
Hemos usado el término enfermedad vascular pulmonar hipertensiva pediátrica en lugar de hipertensión pulmonar para excluir los pacientes que tienen hipertensión pulmonar sin que exista una resistencia vascular pulmonar elevada (Tabla 1). Eso ocurre en niños que tienen grandes cortocircuitos sistémico-pulmonares. Estos niños no requieren tratamiento farmacológico para la hipertensión pulmonar sino cirugía oportuna para cerrar el defecto; sin embargo, incluimos niños que han sido sometidos a varias etapas quirúrgicas para tratamiento de corazón univentricular que tienen resistencia vascular pulmonar elevada pero con una presión arterial pulmonar media menor de 25 mm Hg. Por lo tanto, sugerimos que la enfermedad vascular pulmonar hipertensiva en niños sea definida como una presión arterial pulmonar media mayor de 25 mm Hg y un índice de resistencia vascular pulmonar mayor a 3 unidades Wood/m2 para circulación biventricular. Sugerimos que la enfermedad vascular pulmonar hipertensiva después de la anastomosis cavo pulmonar sea definida como un índice de resistencia vascular pulmonar mayor de 3 unidades Wood/m2 o un gradiente transpulmonar mayor de 6 mm Hg (presión arterial pulmonar media menos presión media auricular izquierda), aunque la presión arterial pulmonar media sea menor de 25 mm Hg. Advertimos, además, que la resistencia vascular pulmonar calculada puede estar aumentada no solamente por incremento del gradiente transpulmonar sino también por la presencia de flujo pulmonar disminuido. Somos conscientes de que el flujo sanguíneo pulmonar puede ser difícil de valorar después de una anastomosis cavo pulmonar debido a la presencia de flujo pulmonar de varios orígenes.

La presión en cuña y las presiones auricular izquierda o ventricular sistémica de fin de diástole, pueden ser normales o elevadas y estos valores son importantes al considerar el diagnóstico diferencial.
Hemos dividido la enfermedad vascular pulmonar hipertensiva en niños en diez categorías que se señalan en orden de frecuencia de presentación (Tabla 1). No se ha publicado ningún estudio epidemiológico o registro de hipertensión pulmonar en niños a la fecha, por lo que podemos decir que las publicaciones han excluido alguna(s) de las categorías de la clasificación que proponemos; por lo tanto cuando esos datos estén disponibles, el orden de las categorías necesitarían una revisión. Hacemos énfasis en que hemos intentado proporcionar una clasificación clínicamente útil (Tabla 2) que permita la categorización de pacientes con causas multifactoriales de hipertensión pulmonar principalmente cuando se asocia con un síndrome o anomalía cromosómica. Para expresar lo heterogéneo de la enfermedad vascular pulmonar en niños, hemos incluido la posibilidad de que una enfermedad o condición pueda aparecer en diferentes categorías. Esto puede ocurrir por ejemplo, cuando enfermedades como la de células falciformes, o síndromes como el de cimitarra o antifosfolípido pueden causar diferentes tipos de enfermedad vascular pulmonar hipertensiva.
Categoría uno
Enfermedad vascular pulmonar prenatal o del desarrollo
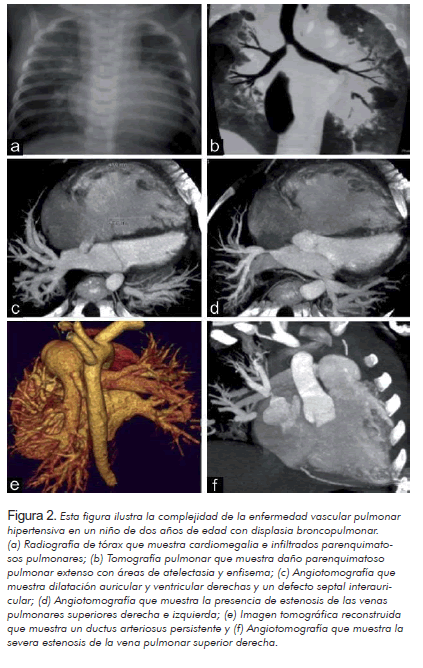
Quizás la diferencia más significativa entre el inicio de la enfermedad vascular pulmonar hipertensiva del adulto y el niño es que durante la vida fetal, neonatal o postnatal temprana, la vasculatura pulmonar está expuesta a insultos patológicos y/o ambientales mientras permanece aún en etapa de crecimiento y maduración, lo que puede dar origen a maladaptación, alteración del desarrollo o detención del crecimiento. Los intentos naturales de recuperación de los insultos pueden estar influenciados por los determinantes del desarrollo y la maduración. Esto puede originar secuelas únicas y diferentes de las que se ven en adultos expuestos a un insulto similar (Tabla 2). La unidad vascular pulmonar está compuesta de alvéolos, bronquíolos, capilares, arteriolas, vénulas y canales linfáticos, y el desarrollo es dependiente el uno del otro (9). La enfermedad de un elemento de la unidad vascular pulmonar puede afectar otros componentes, como ocurre por ejemplo en la hipertensión pulmonar persistente del recién nacido, en la displasia broncopulmonar (10) (Figura 2) y en la displasia alvéolo-capilar con mal alineamiento de las venas pulmonares (11).
In útero la circulación pulmonar fetal se caracteriza por presión arterial pulmonar elevada y resistencia arterial pulmonar marcadamente elevada. En las primeras horas de vida, los eventos circulatorios y respiratorios dramáticos que ocurren dan origen a vasodilatación pulmonar y al remodelamiento del lecho vascular pulmonar, lo cual reduce la resistencia vascular pulmonar con el consecuente aumento del flujo pulmonar. Si ocurre una circulación transicional pulmonar exitosa, la presión arterial pulmonar media disminuye en las primeras tres semanas de vida hasta un nivel de 10 a 20 mm Hg, es decir a niveles similares a los del adulto (12). En los niños pequeños el índice de resistencia vascular pulmonar es similar al del adulto (13). A pesar de esta adaptación fisiológica con reducción de la resistencia vascular pulmonar, el aspecto ultraestructural de las células del músculo liso no se parece al de las del adulto hasta alrededor de los 2 años de edad (14) y los factores de crecimiento fetal pueden influenciar la forma y función de la vasculatura pulmonar postnatal (10).
Es claro que los especialistas en hipertensión pulmonar pediátrica manejan un número creciente de neonatos y niños cuya hipertensión pulmonar puede tener un origen fetal, en particular la asociación de pre-eclampsia y displasia broncopulmonar (15), desórdenes asociados con hipoplasia pulmonar y enfermedades asociadas con enfermedad vascular pulmonar in útero (11, 16-25). La hipoplasia pulmonar, que resulta de la detención del desarrollo, es un concepto importante en cualquier clasificación de enfermedad vascular pulmonar neonatal. La enfermedad vascular hipertensiva en niños puede ocurrir en el contexto de varios grados de hipoplasia pulmonar, lo cual ha sido bien documentado particularmente en cardiopatías congénitas (9), hernia diafragmática congénita (26) y síndrome de Down (27, 28). También es relevante que la alveolarización y el desarrollo vascular pulmonar pueden continuar hasta los ocho años de vida (9). No se conoce muy bien la velocidad de crecimiento vascular y los cambios en el área de sección vascular pulmonar al nacimiento o en los primeros años de vida. Puede encontrarse hipoplasia pulmonar significativa en alrededor del 10% de autopsias neonatales y hasta en 50% de neonatos con anomalías congénitas (28-29). Es posible que diversos insultos vasculares postnatales, incluso los que resultan en la aparición de la enfermedad en la edad adulta, puedan dar origen a hipertensión pulmonar si los pacientes nacieron con un área de sección vascular pulmonar por debajo del percentil 3. Por tanto, la probabilidad de que se desarrolle hipertensión pulmonar a través de la vida puede estar relacionada con el área de sección arteriolar inicial al nacimiento con los efectos de cada insulto sucesivo debidos, al menos parcialmente, al balance entre la reserva vascular pulmonar y la tasa de desgaste vascular pulmonar debida al insulto patológico ya sea genético, epigenético o ambiental.
Categoría dos
Maladaptación vascular pulmonar perinatal
Esta categoría incluye solamente al síndrome de hipertensión pulmonar persistente del recién nacido (HPPRN) (Tabla 2). Reconocemos que hay considerable debate sobre los orígenes de la HPPRN y que ella puede reflejar una enfermedad vascular pulmonar in útero (30). Observaciones clínicas sobre neonatos con HPPRN severa que mueren durante los primeros días después del nacimiento y ya tienen signos patológicos de enfermedad vascular pulmonar crónica, sugieren que eventos intrauterinos pueden desempeñar un papel importante como causa de este síndrome (30-32). Estímulos intrauterinos adversos que ocurren al final de la gestación como flujo sanguíneo anormal, cambios en el sustrato o liberación de hormonas al pulmón, hipoxia crónica, hipertensión sistémica crónica, inflamación u otras causas, pueden alterar potencialmente la función y estructura vascular pulmonar contribuyendo a las anormalidades de adaptación postnatal (33, 34). Es probable que a medida que se conozcan mejor los mecanismos de la HPPRN, sea necesario revaluar la clasificación; sin embargo, hasta el momento la mayoría reconoce que la HPPRN es un desorden de la transición de la vida intrauterina a la extrauterina (35-43).
Los neonatos que nacen en la altura, con frecuencia necesitan más tiempo para adaptarse a la vida extrauterina y algunos de ellos requieren oxígeno suplementario por algunas semanas. Debido a la altura, la presión pulmonar permanece elevada por encima de los valores normales para la edad y hay un retraso en el remodelamiento arterial pulmonar después del nacimiento (44). También reconocemos el efecto considerable del nacimiento a grandes alturas (mayor de 2.500 m/snm) en el periodo postnatal temprano. Estas nuevas observaciones (4, 45) contrastan con informes previos (46). La HPPRN es una enfermedad que generalmente se presenta en los primeros días después del nacimiento; por lo tanto, sería prudente acelerar y ampliar la evaluación diagnóstica de cualquier neonato que presente hipertensión pulmonar sintomática mas allá de la primera semana de vida ya que la etiología puede no ser una HPPRN.
Categoría tres
Enfermedad cardiovascular pediátrica (cardiopatía)
En forma global, la enfermedad cardiovascular pediátrica puede ser la causa más común de enfermedad vascular pulmonar en niños (Tabla 2) (47-49).
En esta sección de la clasificación, la lista de cardiopatías es más extensa que la de la clasificación de Dana Point pero hemos mantenido la estructura básica de esta última clasificación en lo relacionado con los cortocircuitos (5, 7, 50, 51). Consideramos que lo esencial en el diagnóstico de un niño con cortocircuito e índice de resistencia vascular pulmonar elevado, es concluir si requiere una cirugía o una evaluación posterior. Hay considerable interés en evaluar si un periodo de tratamiento médico puede permitir un reparo quirúrgico en aquellos pacientes que tienen resistencias vasculares pulmonares limítrofes.
La interacción entre cardiopatía congénita y factores genéticos con frecuencia dificulta clasificar la causa de la enfermedad vascular pulmonar con certeza. Por ejemplo, ¿cómo puede clasificarse un niño que tiene un defecto del canal atrioventricular y una mutación del BMPR2? (52) o ¿cómo puede clasificarse un niño con un pequeño cortocircuito y una anomalía cromosómica coexistente? Esta clasificación permite que esta eventualidad pueda ser clarificada en el futuro porque tenemos en cuenta la interacción genética entre la cardiopatía y la enfermedad vascular pulmonar.
Se ha reconocido que en la transposición de grandes arterias después del switch atrial o arterial puede persistir enfermedad vascular pulmonar o presentarse de manera tardía, razón por la cual, debido a su frecuencia creciente, hemos especificado esta condición en la clasificación (53-55).
El síndrome de Eisenmenger clásico es una complicación bien reconocida como un desorden multisistémico; sin embargo, la diferenciación entre complejo y simple clínicamente es muy importante tanto para la supervivencia como para el nivel funcional (56). Algunos estudios han sugerido que los niños con síndrome de Eisenmenger pueden tener un deterioro más rápido que los adultos (57) y hay preocupación creciente porque los niños con cortocircuitos corregidos con hipertensión pulmonar persistente o recurrente tienen una peor evolución que los pacientes con síndrome de Eisenmenger o hipertensión pulmonar idiopática (47). Es probable que este último subgrupo requiera mayor estudio en el futuro.
La categoría titulada hipertensión venosa pulmonar incluye además las cardiomiopatías tanto adquiridas como congénitas (58-59).
• Enfermedad vascular pulmonar que se presenta posterior a la cirugía por estadios para el corazón univentricular: es amplio el uso de agentes específicos para el tratamiento de niños y adultos con hipertensión pulmonar que han tenido cirugía de Glenn o Fontan. Los datos preliminares del registro español sugieren que 14% de los niños que reciben sildenafil o bosentán tienen una lesión tipo corazón univentricular. La interacción de las circulaciones pulmonar y sistémica cuando la energía cinética para el flujo sanguíneo a través de ambas circulaciones se deriva de una masa ventricular única (y sin un ventrículo subpulmonar) es compleja y la resistencia vascular pulmonar cumple un papel fisiológico importante (60-62). Estudios resientes sugieren que la intolerancia al ejercicio (63-64) e incluso la bronquitis plástica y la enteropatía perdedora de proteína (67) pueden deberse en parte a una resistencia vascular pulmonar aumentada (61-68).
• Exposición a la hipoxia hipobárica y cardiopatía congénita: hemos incluido las cardiopatías congénitas en la altura bajo la categoría 9 porque la altura puede afectar tanto la incidencia como la anatomía del ductus arteriosus (69). Esto hace referencia también a los niños con trisomía 21 que nacen en la altura; además, el test de reactividad vascular pulmonar (incluyendo el test de hiperoxia prolongada) y los criterios de manejo, son diferentes en la altura en relación con los usados a nivel del mar (4-44, 45-69-72).
Categoría 4
Displasia broncopulmonar
La displasia broncopulmonar (Tabla 2) es la secuela más frecuente en el recién nacido pretérmino, que da origen a problemas cardiopulmonares persistentes en la niñez, lo cual se ha ido incrementando como un problema significativo en la edad adulta (73, 74). Doce por ciento de los nacimientos son prematuros, lo que implica un riesgo de displasia broncopulmonar o enfermedad pulmonar crónica relacionada con la prematurez. La displasia broncopulmonar es un desorden complejo y mucho más que una enfermedad parenquimatosa pulmonar crónica secundaria a las estrategias de ventilación. Aunque ha cambiado en las últimas décadas, la displasia broncopulmonar se caracteriza por una detención en el desarrollo alveolar y vascular pulmonar (75-78) que con frecuencia tiene orígenes prenatales (15); por lo tanto, un paciente con displasia broncopulmonar puede tener hipertensión pulmonar debido a una disminución en el crecimiento vascular pulmonar, agravado por hipoxia intermitente o crónica, hipercarbia por lesión del pulmón y de la vía aérea, cortocircuito sistémico pulmonar, disfunción cardiaca diastólica y estenosis de venas pulmonares (79-83) (Figura 2).
Categoría 5
Enfermedad vascular pulmonar hipertensiva pediátrica aislada o hipertensión arterial pulmonar pediátrica aislada
La categoría correspondiente a enfermedad vascular pulmonar hipertensiva aislada o hipertensión arterial pulmonar aislada (Tabla 2) se asemeja mucho a la clasificación de Dana Point (84-86). Sin embargo, sugerimos que el término "idiopática" se reserve para aquellos casos con verdadera hipertensión pulmonar "idiopática"; es decir, no asociada con alguna alteración genética, cromosómica, entre otras. En pediatría son comunes las dificultades con cualquier sistema de clasificación, si la hipertensión arterial pulmonar "idiopática" se diagnostica junto con un defecto genético o con un síndrome cromosómico (6).
Algunas drogas señaladas como causa de hipertensión pulmonar en niños, son diferentes o menos validadas que las descritas en adultos (porque se usan infrecuentemente en Pediatría) (87-92).
Categoría 6
Causas multifactoriales de hipertensión pulmonar asociadas con malformaciones congénitas
Cada día se reconoce más, que niños que nacen con malformaciones congénitas (Tabla 2) con frecuencia sufren enfermedad vascular pulmonar debido a varios factores que contribuyen a su desarrollo, como ocurre con la Asociación VACTERL y los síndromes de Charge, Down y Di George (23, 93-106). Además, vale la pena señalar que en pacientes con síndromes genéticos, la enfermedad vascular pulmonar secundaria a cortocircuitos puede progresar en forma más acelerada (107).
Categoría 7
Enfermedad pulmonar pediátrica
En niños cada día se reconoce con más frecuencia la coexistencia de ciertas enfermedades pulmonares con hipoplasia pulmonar (Tabla 2). La clasificación de la enfermedad pulmonar intersticial también sugiere que la hipoplasia pulmonar y la detención del crecimiento son una característica común en un número de enfermedades pulmonares intersticiales en la niñez (18) y la hipertensión pulmonar tiene un profundo impacto sobre su pronóstico (18). También se reconocen las causas genéticas de la enfermedad pulmonar y pueden tener impacto sobre la vasculatura pulmonar prenatal (33, 34, 108, 109).
Categoría 8
Enfermedad tromboembólica pulmonar
La incidencia de hipertensión pulmonar secundaria a enfermedad tromboembólica es más baja en los niños en comparación con los adultos, y en general, las enfermedades predisponentes o asociadas con tromboembolismo pulmonar también son diferentes en los niños (110-115). Aunque las opciones quirúrgicas para el tratamiento de la hipertensión pulmonar tromboembólica crónica se han explorado menos en los niños, el éxito logrado con estos procedimientos en los adultos estimula la consideración de esta opción en ciertos casos en la población pediátrica (Tabla 2) (116-117).
Categoría 9
Exposición a la hipoxia hipobárica en edad pediátrica
Los miembros del Task Force con amplia experiencia clínica trabajando en la altura, consideraron que la exposición a la hipoxia hipobárica o la hipertensión pulmonar relacionada con la altura, es suficientemente diferente de otras formas de hipertensión arterial pulmonar y que justificaba la inclusión de ésta como una categoría separada (Tabla 2). Estas diferencias incluyen la hipoxia en ausencia de enfermedad parenquimatosa pulmonar, diferentes aspectos genéticos y distintas estrategias de tratamiento (4, 44-46, 70, 72, 118-126).
Categoría 10
Enfermedad vascular pulmonar hipertensiva asociada con desórdenes de otros sistemas
En la tabla 2 se señalan los desórdenes que pueden complicarse por o asociarse con hipertensión pulmonar (100, 127, 148-155). Llamamos la atención sobre aspectos específicos de la enfermedad pediátrica como la hipertensión portal extrahepática secundaria a trombosis de la vena porta asociada a la colocación de líneas umbilicales y que puede no diagnosticarse porque las pruebas de función hepáticas son normales.
Conclusión
Proponemos una extensa clasificación de la hipertensión pulmonar pediátrica que incluye desórdenes vasculares pulmonares hipertensivos que pueden presentarse en el neonato hasta el adolescente. Hacemos énfasis en la importancia de factores prenatales y perinatales, incluyendo las alteraciones del desarrollo y la hipoplasia pulmonar los cuales pueden contribuir al desarrollo de enfermedad vascular pulmonar. Sugerimos que la enfermedad vascular pulmonar hipertensiva en pediatría, sea definida como una presión arterial pulmonar media mayor de 25 mm Hg y un índice de resistencia vascular pulmonar mayor de 3.0 U/Wood/m2 para las circulaciones biventriculares y, un índice de resistencia vascular pulmonar mayor de 3.0 U/Wood/m2 o un gradiente transpulmonar mayor de 6 mm Hg para las derivaciones cavopulmonares, incluso si la presión arterial pulmonar media es menor de 25 mm Hg.
Hemos clasificado la enfermedad vascular pulmonar hipertensiva en diez categorías y esta clasificación que proponemos se basa principalmente en la práctica clínica. Los objetivos específicos son: mejorar el enfoque diagnóstico, promover la investigación clínica y el conocimiento de la patogénesis, fisiología y epidemiología y que sirva de guía para el desarrollo de modelos de la enfermedad humana en el laboratorio y en la experimentación animal. Esperamos al menos que esta clasificación sirva como catalizador para lograr finalmente unos mejores resultados en nuestros pacientes. Si hay omisiones o se considera que debe hacerse cambios para mejorarla, se pide a los lectores interesados nos lo hagan saber a través de la página web del PVRI: http//pvri.info/home.
Bibliografía
1. Rich S. Primary pulmonary hypertension: Executive summary from the world symposium-primary pulmonary hypertension 1998. Paper presented at: World Health Organisation, 1998; Evian. [ Links ]
2. Simonneau G, Galie N, Rubin LJ, Langleben D, Seeger W, Domenighetti G, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol. 2004; 43 (Suppl 12): 5S-12. [ Links ] PubMed
3. Simonneau G, Robbins IM, Beghetti M, Channick RN, Delcroix M, Denton CP, et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol. 2009; 54: S43-54. [ Links ] PubMed
4. Díaz G. Aspectos generales; definición clasificación y epidemiología. In: Díaz G, Sandoval J, Sola A, editors. Hipertensión Pulmonar en Niños. Bogotá: Editorial Médica Distribuna; 2011. p. 9-19. [ Links ]
5. van Albada ME, Berger RM. Pulmonary arterial hypertension in congenital cardiac disease -the need for refinement of the Evian-Venice classification. Cardiol Young. 2008; 18: 10-7. [ Links ] PubMed
6. van Loon RL, Roofthooft MT, van Osch-Gevers M, Delhaas T, Strengers JL, Blom NA, et al. Clinical characterization of pediatric pulmonary hypertension: Complex presentation and diagnosis. J Pediatr. 2009; 155: 176-182. [ Links ]e1. PubMed
7. Schulze-Neick I, Beghetti M. Classifying pulmonary hypertension in the setting of the congenitally malformed heart-cleaning up a dog's dinner. Cardiol Young. 2008; 18: 22-5. [ Links ] PubMed
8. Barker DJ. The developmental origins of adult disease. J Am Coll Nutr. 2004; 23 (Suppl 6): 588S-95. [ Links ] PubMed
9. Reid LM. Lung growth in health and disease. Br J Dis Chest. 1984; 78: 113-34. [ Links ] PubMed
10. Abman SH. Impaired vascular endothelial growth factor signaling in the pathogenesis of neonatal pulmonary vascular disease. Adv Exp Med Biol. 2010; 661: 323-35. [ Links ] PubMed
11. Eulmesekian P, Cutz E, Parvez B, Bohn D, Adatia I. Alveolar capillary dysplasia: A six-year single center experience. J Perinat Med. 2005; 33: 347-52. [ Links ] PubMed
12. Rowe R, James L. The normal pulmonary arterial pressure during the first year of life. J Pediatr. 1957; 51: 1-4. [ Links ] PubMed
13. Lock J, Einzig S, Moller J. Hemodynamic responses to exercise in normal children. Am J Cardiol. 1978; 41: 1278-84. [ Links ] PubMed
14. Haworth SG. Pulmonary hypertension in childhood. Eur Respir J. 1993; 6: 1037-43. [ Links ] PubMed
15. Hansen AR, Barnes CM, Folkman J, McElrath TF. Maternal preeclampsia predicts the development of bronchopulmonary dysplasia. J Pediatr. 2010; 156: 532-6. [ Links ] PubMed
16. Maeno YV, Kamenir SA, Sinclair B, van der Velde ME, Smallhorn JF, Hornberger LK. Prenatal features of ductus arteriosus constriction and restrictive foramen ovale in d-transposition of the great arteries. Circulation. 1999; 99: 1209-14. [ Links ] PubMed
17. Castillo M, Vade A, Lim-Dunham JE, Masuda E, Massarani-Wafai R. Pulmonary interstitial glycogenosis in the setting of lung growth abnormality: Radiographic and pathologic correlation. Pediatr Radiol. 2010; 40: 1562-5. [ Links ] PubMed
18. Deutsch GH, Young LR, Deterding RR, Fan LL, Dell SD, Bean JA, et al. Diffuse lung disease in young children: Application of a novel classification scheme. Am J Respir Crit Care Med. 2007; 176: 1120-8. [ Links ] PMC free article. PubMed
19. Chen S, Ursell PC, Adatia I, Hislop AA, Giannikopoulos P, Hornberger LK. Prenatal diagnosis of primary pulmonary hypoplasia in fraternal twins. Ultrasound Obstet Gynecol. 2010; 35: 113-6. [ Links ] PubMed
20. Inwald D, Brown K, Gensini F, Malone M, Goldman A. Open lung biopsy in neonatal and paediatric patients referred for extracorporeal membrane oxygenation (ECMO) Thorax. 2004; 59: 328-33. [ Links ] PMC free article. PubMed
21. Yu S, Shao L, Kilbride H, Zwick DL. Haploinsufficiencies of FOXF1 and FOXC2 genes associated with lethal alveolar capillary dysplasia and congenital heart disease. Am J Med Genet A. 2010; 152: 1257-62. [ Links ] PubMed
22. Stankiewicz P, Sen P, Bhatt SS, Storer M, Xia Z, Bejjani BA, et al. Genomic and genic deletions of the FOX gene cluster on 16q24.1 and inactivating mutations of FOXF1 cause alveolar capillary dysplasia and other malformations. Am J Hum Genet. 2009; 84: 780-91. [ Links ] PMC free article. PubMed
23. Shaw-Smith C. Genetic factors in esophageal atresia, tracheo-esophageal fistula and the VACTERL association: Roles for FOXF1 and the 16q24.1 FOX transcription factor gene cluster, and review of the literature. Eur J Med Genet. 2010; 53: 6-13. [ Links ] PMC free article. PubMed
24. Vassal HB, Malone M, Petros AJ, Winter RM. Familial persistent pulmonary hypertension of the newborn resulting from misalignment of the pulmonary vessels (congenital alveolar capillary dysplasia) J Med Genet. 1998; 35: 58-60. [ Links ] PMC free article. PubMed
25. Han RN, Babaei S, Robb M, Lee T, Ridsdale R, Ackerley C, et al. Defective lung vascular development and fatal respiratory distress in endothelial NO synthase-deficient mice: A model of alveolar capillary dysplasia? Circ Res. 2004; 94: 1115-23. [ Links ] PubMed
26. Kitagawa M, Hislop A, Boyden EA, Reid L. Lung hypoplasia in congenital diaphragmatic hernia: A quantitative study of airway, artery, and alveolar development. Br J Surg. 1971; 58: 342-6. [ Links ] PubMed
27. Cooney TP, Thurlbeck WM. Pulmonary hypoplasia in Down's syndrome. N Engl J Med. 1982; 307: 1170-3. [ Links ] PubMed
28. Sherer DM, Davis JM, Woods JR., Jr Pulmonary hypoplasia: A review. Obstet Gynecol Surv. 1990; 45: 792-803. [ Links ] PubMed
29. Askenazi SS, Perlman M. Pulmonary hypoplasia: Lung weight and radial alveolar count as criteria of diagnosis. Arch Dis Child. 1979; 54: 614-8. [ Links ] PMC free article. PubMed
30. Murphy JD, Vawter GF, Reid LM. Pulmonary vascular disease in fatal meconium aspiration. J Pediatr. 1984; 104: 758-62. [ Links ] PubMed
31. Geggel RL, Reid LM. The structural basis of PPHN. Clin Perinatol. 1984; 11: 525-49. [ Links ] PubMed
32. Haworth SG, Reid L. Persistent fetal circulation: Newly recognized structural features. J Pediatr. 1976; 88: 614-20. [ Links ] PubMed
33. Guillot L, Carre A, Szinnai G, Castanet M, Tron E, Jaubert F, et al. NKX2 1 mutations leading to surfactant protein promoter dysregulation cause interstitial lung disease in "Brain-Lung-Thyroid Syndrome" Hum Mutat. 2010; 31: E1146-62. [ Links ] PubMed
34. Boggaram V. Thyroid transcription factor-1 (TTF-1/Nkx2.1/TITF1) gene regulation in the lung. Clin Sci (Lond) 2009; 116: 27-35. [ Links ] PubMed
35. Kinsella JP, Neish SR, Shaffer E, Abman SH. Low-dose inhalational nitric oxide in persistent pulmonary hypertension of the newborn. Lancet. 1992; 340: 819-20. [ Links ] PubMed
36. Kinsella JP, Abman SH. Recent developments in the pathophysiology and treatment of persistent pulmonary hypertension of the newborn. J Pediatr. 1995; 126: 853-64. [ Links ] PubMed
37. Abman SH, Chatfield BA, Hall SL, McMurtry IF. Role of endothelium-derived relaxing factor during transition of pulmonary circulation at birth. Am J Physiol. 1990; 259: H1921-7. [ Links ] PubMed
38. Steinhorn RH, Kinsella JP, Pierce C, Butrous G, Dilleen M, Oakes M, et al. Intravenous sildenafil in the treatment of neonates with persistent pulmonary hypertension. J Pediatr. 2009; 155: 841-847. [ Links ]e1. PubMed
39. Steinhorn RH. Neonatal pulmonary hypertension. Pediatr Crit Care Med. 2010; 11 (Suppl 2): S79-84. [ Links ] PMC free article. PubMed
40. Thebaud B, Tibboel D. Pulmonary hypertension associated with congenital diaphragmatic hernia. Cardiol Young. 2009; 19 (Suppl 1): 49-53. [ Links ] PubMed
41. Kinsella JP, Ivy DD, Abman SH. Pulmonary vasodilator therapy in congenital diaphragmatic hernia: Acute, late, and chronic pulmonary hypertension. Semin Perinatol. 2005; 29: 123-8. [ Links ] PubMed
42. Chang AC, Macrae D. Neonates with congenital cardiac defects and pulmonary hypertension. Cardiol Young. 2009; 19 (Suppl 1): 4-7. [ Links ] PubMed
43. Baquero H, Soliz A, Neira F, Venegas ME, Sola A. Oral sildenafil in infants with persistent pulmonary hypertension of the newborn: A pilot randomized blinded study. Pediatrics 2006; 117: 1077-83. [ Links ] PubMed
44. Peñaloza D, Sime F, Ruiz L. Pulmonary hemodynamics in children living at high altitudes. High Alt Med Biol. 2008; 9: 199-207. [ Links ] PubMed
45. Díaz G, Márquez A. Hipertensión pulmonar en niños a moderada altura. En: hipertensión pulmonar en niños. Díaz G, Sandoval J, Sola A, editors. Hipertensión Pulmonar en Niños. Bogotá: Editorial Médica Distribuna; 2011. p. 266-84. [ Links ]
46. Gamboa R, Marticorena E. Pulmonary arterial pressure in newborn infants in high altitude. Arch Inst Biol Andina. 1971; 4: 55-66. [ Links ] PubMed
47. Haworth SG, Hislop AA. Treatment and survival in children with pulmonary arterial hypertension: The UK Pulmonary Hypertension Service for Children 2001-2006. Heart 2009; 95: 312-7. [ Links ] PubMed
48. Adatia I, Kothari SS, Feinstein JA. Pulmonary hypertension associated with congenital heart disease: Pulmonary vascular disease: The global perspective. Chest 2010; 137 (Suppl 6): 52S-61. [ Links ] PubMed
49. Fasnacht MS, Tolsa JF, Beghetti M. The Swiss registry for pulmonary arterial hypertension: The paediatric experience. Swiss Med Wkly. 2007; 137: 510-3. [ Links ] PubMed
50. Adatia I, Mullen M, Kulik TJ. Pulmonary venous hypertension or pulmonary hypertension due to left heart disease. Prog Pediatr Cardiol. 2009; 27: 35-42. [ Links ]
51. Kulik T, Mullen M, Adatia I. Pulmonary arterial hypertension associated with congenital heart disease. Prog Pediatr Cardiol. 2009; 27: 25-33. [ Links ]
52. Roberts KE, McElroy JJ, Wong WP, Yen E, Widlitz A, Barst RJ, et al. BMPR2 mutations in pulmonary arterial hypertension with congenital heart disease. Eur Respir J. 2004; 24: 371-4. [ Links ] PubMed
53. Cordina R, Celermajer D. Late-onset pulmonary arterial hypertension after a successful atrial or arterial switch procedure for transposition of the great arteries. Pediatr Cardiol. 2010; 31: 238-41. [ Links ] PubMed
54. Kumar A, Taylor G, Sandor G, Patterson M. Pulmonary vascular disease in neonates with transposition of the great arteries and intact ventricular septum. Br Heart J. 1993; 69: 442-5. [ Links ] PMC free article. PubMed
55. Sreeram N, Petros A, Peart I, Arnold R. Progressive pulmonary hypertension after the arterial switch procedure. Am J Cardiol. 1994; 73: 620-1. [ Links ] PubMed
56. Daliento L, Somerville J, Presbitero P, Menti L, Brach-Prevert S, Rizzoli G, et al. Eisenmenger syndrome factors relating to deterioration and death. Eur Heart J. 1998; 19: 1845-55. [ Links ] PubMed
57. van Loon RL, Hoendermis ES, Duffels MG, Vonk-Noordegraaf A, Mulder BJ, Hillege HL, et al. Long-term effect of bosentan in adults versus children with pulmonary arterial hypertension associated with systemic-to-pulmonary shunt: Does the beneficial effect persist? Am Heart J. 2007; 154: 776-82. [ Links ] PubMed
58. Bograd AJ, Mital S, Schwarzenberger JC, Mosca RS, Quaegebeur JM, Addonizio LJ, et al. Twenty-year experience with heart transplantation for infants and children with restrictive cardiomyopathy: 1986-2006. Am J Transplant. 2008; 8: 201-7. [ Links ] PubMed
59. Daftari B, Alejos JC, Perens G. Initial experience with sildenafil, bosentan, and nitric oxide for pediatric cardiomyopathy patients with elevated pulmonary vascular resistance before and after orthotopic heart transplantation. J Transplant. 2010; 2010: 656984. [ Links ] PMC free article. PubMed
60. de Leval MR. The Fontan circulation: A challenge to William Harvey? Nat Clin Pract Cardiovasc Med. 2005; 2: 202-8. [ Links ] PubMed
61. de Leval MR, Deanfield JE. Four decades of Fontan palliation. Nat Rev Cardiol. 2010; 7: 520-7. [ Links ] PubMed
62. Khambadkone S, Li J, de Leval MR, Cullen S, Deanfield JE, Redington AN. Basal pulmonary vascular resistance and nitric oxide responsiveness late after Fontan-type operation. Circulation 2003; 107: 3204-8. [ Links ] PubMed
63. La Gerche A, Gewillig M. What limits cardiac performance during exercise in normal subjects and in healthy Fontan patients? Int J Pediatr 2010. 2010; pii: 791291. [ Links ]
64. Giardini A, Balducci A, Specchia S, Gargiulo G, Bonvicini M, Picchio FM. Effect of sildenafil on haemodynamic response to exercise and exercise capacity in Fontan patients. Eur Heart J. 2008; 29: 1681-7. [ Links ] PubMed
65. Humpl T, Reyes JT, Holtby H, Stephens D, Adatia I. Beneficial effect of oral sildenafil therapy on childhood pulmonary arterial hypertension: Twelve-month clinical trial of a single-drug, open-label, pilot study. Circulation 2005; 111: 3274-80. [ Links ] PubMed
66. Apostolopoulou SC, Papagiannis J, Rammos S. Bosentan induces clinical, exercise and hemodynamic improvement in a pre-transplant patient with plastic bronchitis after Fontan operation. J Heart Lung Transplant. 2005; 24: 1174-6. [ Links ] PubMed
67. Uzun O, Wong JK, Bhole V, Stumper O. Resolution of protein-losing enteropathy and normalization of mesenteric Doppler flow with sildenafil after Fontan. Ann Thorac Surg. 2006; 82: e39-40. [ Links ] PubMed
68. Ovaert C, Thijs D, Dewolf D, Ottenkamp J, Dessy H, Moons P, et al. The effect of bosentan in patients with a failing Fontan circulation. Cardiol Young. 2009; 19: 331-9. [ Links ] PubMed
69. Heath A, Stewart K, Mendes J, Ramirez M, Freudenthal F. Does High altitude protect against irreversible pulmonary hypertension? PVRI Rev. 2010; 2: 131-3. [ Links ]
70. Sime F, Banchero N, Peñaloza D, Gamboa R, Cruz J, Marticorena E. Pulmonary hypertension in children born and living at high altitudes. Am J Cardiol. 1963; 11: 143-9. [ Links ] PubMed
71. Penaloza D, Arias-Stella J, Sime F, Recavarren S, Marticorena E. The Heart and pulmonary circulation in children at high altitudes: physiological, anatomical, and clinical observations. Pediatrics 1964; 34: 568-82. [ Links ] PubMed
72. Penaloza D, Arias-Stella J. The heart and pulmonary circulation at high altitudes: Healthy highlanders and chronic mountain sickness. Circulation 2007; 115: 1132-46. [ Links ] PubMed
73. Cutz E, Chiasson D. Chronic lung disease after premature birth. N Engl J Med. 2008; 358: 743-5. [ Links ] author reply 745-6. PubMed
74. Mourani PM, Mullen M, Abman SH. Pulmonary hypertension in bronchopulmonary dysplasia. Prog Pediatr Cardiol. 2009; 27: 43-8. [ Links ]
75. Stenmark KR, Abman SH. Lung vascular development: Implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 2005; 67: 623-61. [ Links ] PubMed
76. Coalson JJ. Pathology of new bronchopulmonary dysplasia. Semin Neonatol. 2003; 8: 73-81. [ Links ] PubMed
77. Bancalari E, Claure N. Definitions and diagnostic criteria for bronchopulmonary dysplasia. Semin Perinatol. 2006; 30: 164-70. [ Links ] PubMed
78. Baraldi E, Filippone M. Chronic lung disease after premature birth. N Engl J Med. 2007; 357: 1946-55. [ Links ] PubMed
79. Khemani E, McElhinney DB, Rhein L, Andrade O, Lacro RV, Thomas KC, et al. Pulmonary artery hypertension in formerly premature infants with bronchopulmonary dysplasia: Clinical features and outcomes in the surfactant era. Pediatrics. 2007; 120: 1260-9. [ Links ] PubMed
80. Krishnan U, Krishnan S, Gewitz M. Treatment of pulmonary hypertension in children with chronic lung disease with newer oral therapies. Pediatr Cardiol. 2008; 29: 1082-6. [ Links ] PubMed
81. Drossner DM, Kim DW, Maher KO, Mahle WT. Pulmonary vein stenosis: Prematurity and associated conditions. Pediatrics. 2008; 122: e656-61. [ Links ] PubMed
82. Seale AN, Webber SA, Uemura H, Partridge J, Roughton M, Ho SY, et al. Pulmonary vein stenosis: The UK, Ireland and Sweden collaborative study. Heart. 2009; 95: 1944-9. [ Links ] PubMed
83. Mourani PM, Sontag MK, Ivy DD, Abman SH. Effects of long-term sildenafil treatment for pulmonary hypertension in infants with chronic lung disease. J Pediatr. 2009; 154: 379-84. [ Links ] PMC free article. PubMed
84. Moledina S, Hislop AA, Foster H, Schulze-Neick I, Haworth SG. Childhood idiopathic pulmonary arterial hypertension: A national cohort study. Heart. 2010; 96: 1401-6. [ Links ] PubMed
85. Girerd B, Montani D, Coulet F, Sztrymf B, Yaici A, Jais X, et al. Clinical outcomes of pulmonary arterial hypertension in patients carrying an ACVRL1 (ALK1) mutation. Am J Respir Crit Care Med. 2010; 181: 851-61. [ Links ] PubMed
86. Fraisse A, Jais X, Schleich JM, di Filippo S, Maragnes P, Beghetti M, et al. Characteristics and prospective 2-year follow-up of children with pulmonary arterial hypertension in France. Arch Cardiovasc Dis. 2010; 1 03: 66-74. [ Links ] PubMed
87. Mathew R, Huang J, Katta US, Krishnan U, Sandoval C, Gewitz MH. Immunosuppressant-induced endothelial damage and pulmonary arterial hypertension. J Pediatr Hematol Oncol. 2011; 33: 55-8. [ Links ] PubMed
88. Yildizdas D, Erdem S, Kucukosmanoglu O, Yilmaz M, Yuksel B. Pulmonary hypertension, heart failure and neutropenia due to diazoxide therapy. Adv Ther. 2008; 25: 515-9. [ Links ] PubMed
89. Silvani P, Camporesi A, Mandelli A, Wolfler A, Salvo I. A case of severe diazoxide toxicity. Paediatr Anaesth. 2004; 14: 607-9. [ Links ] PubMed
90. Karaman MG, Atalay F, Tufan AE, Erdogan A. Pulmonary arterial hypertension in an adolescent treated with methylphenidate. J Child Adolesc Psychopharmacol. 2010; 20: 229-31. [ Links ] PubMed
91. Lewman LV. Fatal pulmonary hypertension from intravenous injection of methylphenidate (Ritalin) tablets. Hum Pathol. 1972; 3: 67-70. [ Links ] PubMed
92. Barst RJ, Abenhaim L. Fatal pulmonary arterial hypertension associated with phenylpropanolamine exposure. Heart 2004; 90: e42. [ Links ] PMC free article. PubMed
93. Patel MS, Taylor GP, Bharya S, Al-Sanna'a N, Adatia I, Chitayat D, et al. Abnormal pericyte recruitment as a cause for pulmonary hypertension in Adams-Oliver syndrome. Am J Med Genet. 2004; 129A: 294-9. [ Links ] PubMed
94. Bergman JE, Blake KD, Bakker MK, du Marchie Sarvaas GJ, Free RH, van Ravenswaaij-Arts CM. Death in CHARGE syndrome after the neonatal period. Clin Genet. 2010; 77: 232-40. [ Links ] PubMed
95. Baskar S, Kulkarni ML, Kulkarni AM, Vittalrao S, Kulkarni PM. Adams-Oliver syndrome: Additions to the clinical features and possible role of BMP pathway. Am J Med Genet A. 2009; 149: 1678-84. [ Links ] PubMed
96. Hess OM, Steurer J, Goebel NH, Kuhlmann U, Krayenbuhl HP. Goldenhar syndrome. Schweiz Med Wochenschr. 1979; 109: 19-23. [ Links ] PubMed
97. Argueta-Morales IR, Meador LC, Nykanen DG, DeCampli WM. Infantile form of scimitar syndrome with contralateral pulmonary vein stenosis. Pediatr Cardiol. 2010; 31: 550-2. [ Links ] PubMed
98. Salerno T, Guccione P, Malena S, Cutrera R. Horseshoe lung associated with unique left pulmonary vein: An unreported association. Pediatr Cardiol. 2010; 31: 905-7. [ Links ] PubMed
99. Cua CL, Blankenship A, North AL, Hayes J, Nelin LD. Increased incidence of idiopathic persistent pulmonary hypertension in Down syndrome neonates. Pediatr Cardiol. 2007; 28: 250-4. [ Links ] PubMed
100. Levine OR, Harris RC, Blanc WA, Mellins RB. Progressive pulmonary hypertension in children with portal hypertension. J Pediatr. 1973; 83: 964-72. [ Links ] PubMed
101. Simeoni S, Puccetti A, Chilosi M, Tinazzi E, Prati D, Corrocher R, et al. Type 1 neurofibromatosis complicated by pulmonary artery hypertension: A case report. J Med Invest. 2007; 54: 354-8. [ Links ] PubMed
102. Stewart DR, Cogan JD, Kramer MR, Miller WT, Jr, Christiansen LE, Pauciulo MW, et al. Is pulmonary arterial hypertension in neurofibromatosis type 1 secondary to a plexogenic arteriopathy? Chest 2007; 132: 798-808. [ Links ] PubMed
103. Engel PJ, Baughman RP, Menon SG, Kereiakes DJ, Taylor L, Scott M. Pulmonary hypertension in neurofibromatosis. Am J Cardiol. 2007; 99: 1177-8. [ Links ] PubMed
104. Aoki Y, Kodama M, Mezaki T, Ogawa R, Sato M, Okabe M, et al. von Recklinghausen disease complicated by pulmonary hypertension. Chest 2001; 119: 1606-8. [ Links ] PubMed
105. Banka S, Newman WG, Ozgul RK, Dursun A. Mutations in the G6PC3 gene cause Dursun syndrome. Am J Med Genet A. 2010; 152: 2609-11. [ Links ] PubMed
106. Scurr I, Wilson L, Lees M, Robertson S, Kirk E, Turner A, et al. Cantu syndrome: Report of nine new cases and expansion of the clinical phenotype. Am J Med Genet A. 2011; 155: 508-18. [ Links ] PubMed
107. Suzuki K, Yamaki S, Mimori S, Murakami Y, Mori K, Takahashi Y, et al. Pulmonary vascular disease in Down's syndrome with complete atrioventricular septal defect. Am J Cardiol. 2000; 86: 434-7. [ Links ] PubMed
108. Matsumura Y, Ban N, Inagaki N. Aberrant catalytic cycle and impaired lipid transport into intracellular vesicles in ABCA3 mutants associated with nonfatal pediatric interstitial lung disease. Am J Physiol Lung Cell Mol Physiol. 2008; 295: L698-707. [ Links ] PubMed
109. Park SK, Amos L, Rao A, Quasney MW, Matsumura Y, Inagaki N, et al. Identification and characterization of a novel ABCA3 mutation. Physiol Genomics. 2010; 40: 94-9. [ Links ] PubMed
110. Babyn PS, Gahunia HK, Massicotte P. Pulmonary thromboembolism in children. Pediatr Radiol. 2005; 35: 258-74. [ Links ] PubMed
111. Tavil B, Kuskonmaz B, Kiper N, Cetin M, Gumruk F, Gurgey A. Pulmonary thromboembolism in childhood: A single-center experience from Turkey. Heart Lung. 2009; 38: 56-65. [ Links ] PubMed
112. Brandstetter Y, Weinhouse E, Splaingard ML, Tang TT. Cor pulmonale as a complication of methylmalonic acidemia and homocystinuria (Cbl-C type) Am J Med Genet. 1990; 36: 167-71. [ Links ] PubMed
113. Staser JA, Alam T, Applegate K. Calcified pulmonary thromboembolism in a child with sickle cell disease: Value of multidetector CT in patients with acute chest syndrome. Pediatr Radiol. 2006; 36: 561-3. [ Links ] PubMed
114. Bonderman D, Wilkens H, Wakounig S, Schafers HJ, Jansa P, Lindner J, et al. Risk factors for chronic thromboembolic pulmonary hypertension. Eur Respir J. 2009; 33: 325-31. [ Links ] PubMed
115. Branch GL, Castle RF. Thromboembolic complications in primary endocardial fibroelastosis. J Pediatr. 1966; 69: 250-8. [ Links ] PubMed
116. Johnson JN, Driscoll DJ, McGregor CG. Pulmonary thromboendarterectomy in adolescents and young adults. Pediatr Pulmonol. 2010; 45: 614-8. [ Links ] PubMed
117. Lambert V, Durand P, Devictor D, Planche C, Serraf A. Unilateral right pulmonary thromboendarterectomy for chronic embolism: A successful procedure in an infant. J Thorac Cardiovasc Surg. 1999; 118: 953-4. [ Links ] discussion 57. PubMed
118. Groves BM, Droma T, Sutton JR, McCullough RG, McCullough RE, Zhuang J, et al. Minimal hypoxic pulmonary hypertension in normal Tibetans at 3,658 m. J Appl Physiol. 1993; 74: 312-8. [ Links ] PubMed
119. Fagan KA, Weil JV. Potential genetic contributions to control of the pulmonary circulation and ventilation at high altitude. High Alt Med Biol. 2001; 2: 165-71. [ Links ] PubMed
120. Yaron M, Niermeyer S, Lindgren KN, Honigman B, Strain JD, Cairns CB. Physiologic response to moderate altitude exposure among infants and young children. High Alt Med Biol. 2003; 4: 53-9. [ Links ] PubMed
121. Maggiorini M, Leon-Velarde F. High-altitude pulmonary hypertension: A pathophysiological entity to different diseases. Eur Respir J. 2003; 22: 1019-25. [ Links ] PubMed
122. Fasules JW, Wiggins JW, Wolfe RR. Increased lung vasoreactivity in children from Leadville, Colorado, after recovery from high-altitude pulmonary edema. Circulation. 1985; 72: 957-62. [ Links ] PubMed
123. Gabry AL, Ledoux X, Mozziconacci M, Martin C. High-altitude pulmonary edema at moderate altitude (< 2,400 m; 7,870 feet): A series of 52 patients. Chest 2003; 123: 49-53. [ Links ] PubMed
124. Das BB, Wolfe RR, Chan KC, Larsen GL, Reeves JT, Ivy D. High-altitude pulmonary edema in children with underlying cardiopulmonary disorders and pulmonary hypertension living at altitude. Arch Pediatr Adolesc Med. 2004; 158: 1170-6. [ Links ] PubMed
125. Durmowicz AG. Pulmonary edema in 6 children with Down syndrome during travel to moderate altitudes. Pediatrics 2001; 108: 443-7. [ Links ] PubMed
126. Sui GJ, Liu YH, Cheng XS, Anand IS, Harris E, Harris P, et al. Subacute infantile mountain sickness. J Pathol. 1988; 155: 161-70. [ Links ] PubMed
127. Ivy DD, Feinstein JA, Humpl T, Rosenzweig EB. Non-congenital heart disease associated pediatric pulmonary arterial hypertension. Prog Pediatr Cardiol. 2009; 27: 13-23. [ Links ] PMC free article. PubMed
128. Cataltepe S, van Marter LJ, Kozakewich H, Wessel DL, Lee PJ, Levy HL. Pulmonary hypertension associated with nonketotic hyperglycinaemia. J Inherit Metab Dis. 2000; 23: 137-44. [ Links ] PubMed
129. del Toro M, Arranz JA, Macaya A, Riudor E, Raspall M, Moreno A, et al. Progressive vacuolating glycine leukoencephalopathy with pulmonary hypertension. Ann Neurol. 2006; 60: 148-52. [ Links ] PubMed
130. Leal GN, de Paula AC, Leone C, Kim CA. Echocardiographic study of paediatric patients with mucopolysaccharidosis. Cardiol Young. 2010; 20: 254-61. [ Links ] PubMed
131. Ueno M, Murakami T, Takeda A, Kubota M. Efficacy of oral sildenafil in a beraprost-treated patient with severe pulmonary hypertension secondary to type I glycogen storage disease. Circ J. 2009; 73: 1965-8. [ Links ] PubMed
132. Hino T, Hayashida A, Okahashi N, Wada N, Watanabe N, Obase K, et al. Portopulmonary hypertension associated with congenital absence of the portal vein treated with bosentan. Intern Med. 2009; 48: 597-600. [ Links ] PubMed
133. Ohno T, Muneuchi J, Ihara K, Yuge T, Kanaya Y, Yamaki S, et al. Pulmonary hypertension in patients with congenital portosystemic venous shunt: A previously unrecognized association. Pediatrics. 2008; 121: e892-9. [ Links ] PubMed
134. Iqbal CW, Krowka MJ, Pham TH, Freese DK, El Youssef M, Ishitani MB. Liver transplantation for pulmonary vascular complications of pediatric end-stage liver disease. J Pediatr Surg. 2008; 43: 1813-20. [ Links ] PubMed
135. Newman B, Feinstein JA, Cohen RA, Feingold B, Kreutzer J, Patel H, et al. Congenital extrahepatic portosystemic shunt associated with heterotaxy and polysplenia. Pediatr Radiol. 2010; 40: 1222-30. [ Links ] PubMed
136. Alghamdi MH, Steinraths M, Panagiotopoulos C, Potts JE, Sandor GG. Primary pulmonary arterial hypertension and autoimmune polyendocrine syndrome in a pediatric patient. Pediatr Cardiol. 2010; 31: 872-4. [ Links ] PubMed
137. Xing Y, Song HM, Wu XY, He YY, Wei M. Clinical analysis of pulmonary arterial hypertension secondary to connective tissue disease in children. Zhonghua Er Ke Za Zhi. 2008; 46: 822-6. [ Links ] PubMed
138. Haworth SG, Hislop A, Reid L. Editorial: Progressive pulmonary hypertension in children with portal hypertension. J Pediatr. 1974; 84: 783-5. [ Links ] PubMed
139. Silver MM, Bohn D, Shawn DH, Shuckett B, Eich G, Rabinovitch M. Association of pulmonary hypertension with congenital portal hypertension in a child. J Pediatr. 1992; 120: 321-9. [ Links ] PubMed
140. Naeye RL. "Primary" pulmonary hypertension with coexisting portal hypertension.A retrospective study of six cases. Circulation. 1960; 22: 376-84. [ Links ] PubMed
141. Saunders JB, Constable TJ, Heath D, Smith P, Paton A. Pulmonary hypertension complicating portal vein thrombosis. Thorax 1979; 34: 281-3. [ Links ] PMC free article. PubMed
142. Bower JS, Dantzker DR, Naylor B. Idiopathic pulmonary hypertension associated with nodular pulmonary infiltrates and portal venous thrombosis. Chest 1980; 78: 111-3. [ Links ] PubMed
143. Cohen MD, Rubin LJ, Taylor WE, Cuthbert JA. Primary pulmonary hypertension: An unusual case associated with extrahepatic portal hypertension. Hepatology 1983; 3: 588-92. [ Links ] PubMed
144. Edwards BS, Weir EK, Edwards WD, Ludwig J, Dykoski RK, Edwards JE. Coexistent pulmonary and portal hypertension: morphologic and clinical features. J Am Coll Cardiol. 1987; 10: 1233-8. [ Links ] PubMed
145. Yutani C, Imakita M, Ishibashi-Ueda H, Okubo S, Naito M, Kunieda T. Nodular regenerative hyperplasia of the liver associated with primary pulmonary hypertension. Hum Pathol. 1988; 19: 726-31. [ Links ] PubMed
146. Wanless IR, Albrecht S, Bilbao J, Frei JV, Heathcote EJ, Roberts EA, et al. Multiple focal nodular hyperplasia of the liver associated with vascular malformations of various organs and neoplasia of the brain: A new syndrome. Mod Pathol. 1989; 2: 56-62. [ Links ]
147. Padeh S, Laxer RM, Silver MM, Silverman ED. Primary pulmonaryy hypertension in a patient with systemic-onset juvenile arthritis. Arthritis Rheum. 1991; 34: 1575-9. [ Links ] PubMed
148. Connor P, Veys P, Amrolia P, Haworth S, Ashworth M, Moledina S. Pulmonary hypertension in children with Evans syndrome. Pediatr Hematol Oncol. 2008; 25: 93-8. [ Links ] PubMed
149. Nagai H, Yasuma K, Katsuki T, Shimakura A, Usuda K, Nakamura Y, et al. Primary antiphospholipid syndrome and pulmonary hypertension with prolonged survival.A case report. Angiology 1997; 48: 183-7. [ Links ] PubMed
150. Espinosa G, Cervera R, Font J, Asherson RA. The lung in the antiphospholipid syndrome. Ann Rheum Dis. 2002; 61: 195-8. [ Links ] PMC free article. PubMed
151. Sharma S, Kirpalani AL, Kulkarni A. Severe pulmonary hypertension in a young patient with end-stage renal disease on chronic hemodialysis. Ann Pediatr Cardiol. 2010; 3: 184-6. [ Links ] PMC free article. PubMed
152. Yigla M, Nakhoul F, Sabag A, Tov N, Gorevich B, Abassi Z, et al. Pulmonary hypertension in patients with end-stage renal disease. Chest. 2003; 123: 1577-82. [ Links ] PubMed
153. Unal A, Sipahioglu M, Oguz F, Kaya M, Kucuk H, Tokgoz B, et al. Pulmonary hypertension in peritoneal dialysis patients: Prevalence and risk factors. Perit Dial Int. 2009; 29: 191-8. [ Links ] PubMed
154. Amin M, Fawzy A, Hamid MA, Elhendy A. Pulmonary hypertension in patients with chronic renal failure: Role of parathyroid hormone and pulmonary artery calcifications. Chest 2003; 124: 2093-7. [ Links ] PubMed
155. Havlucu Y, Kursat S, Ekmekci C, Celik P, Serter S, Bayturan O, et al. Pulmonary hypertension in patients with chronic renal failure. Respiration 2007; 74: 503-10. [ Links ] PubMed
156. Adatia I. Pulmonary veno-occlusive disease. In: Freedom RM, Yoo SJ, Mikailian H, Williams WG, editors. The natural and modified history of congenital heart disease. New York: Futura; 2004. p. 513. [ Links ]
157. Kobayashi D, Cook A, Williams D. Pulmonary hypertension secondary to partial pulmonary venous obstruction in a child with Cantú syndrome. Pediatr Radiol. 2010; 45: 727-9. [ Links ]
158. Gewillig M, Brown SC, De Catte L, Debeer A, Eyskens B, Cossey V, et al. Premature foetal closure of the arterial duct: Clinical presentations and outcome. Eur Heart J. 2009; 30: 1530-6. [ Links ] PubMed
159. Van Marter LJ, Leviton A, Allred EN, Pagano M, Sullivan KF, Cohen A, et al. Persistent pulmonary artery hypertension of the newborn and smoking and aspirin and nonsteroidal anti inflammatory drug consumption during pregnancy. Pediatrics. 1996; 97: 658-63. [ Links ] PubMed
160. Siu KL, Lee WH. Maternal diclofenac sodium ingestion and severe neonatal pulmonary hypertension. J Paediatr Child Health. 2004; 40: 152-3. [ Links ] PubMed
161. Schiessl B, Schneider KT, Zimmerman A, Kainer F, Friese K, Oberhoffer R. Prenatal constriction of the fetal ductus arteriosus-related to maternal pain medication? Z Geburtshilfe Neonatol. 2005; 209: 65-8. [ Links ] PubMed
162. Alano MA, Ngougmna E, Ostrea EM, Jr, Konduri GG. Analysis of nonsteroidal anti-inflammatory drugs in meconium and its relation to persistent pulmonary hypertension of the newborn. Pediatrics 2001; 107: 519-23. [ Links ] PubMed
163. Zender M, Klinge J, Kruger C, Singer H, Scharf J. Severe pulmonary hypertension in a neonate caused by premature closure of the ductus arteriosus following maternal treatment with diclofenac: A case report. J Perinat Med. 1998; 26: 231-4. [ Links ] PubMed
164. Mas C, Menahem S. Premature in utero closure of the ductus arteriosus following maternal ingestion of sodium diclofenac. Aust N Z J Obstet Gynaecol. 1999; 39: 106-7. [ Links ] PubMed
165. Talati AJ, Salim MA, Korones SB. Persistent pulmonary hypertension after maternal naproxen ingestion in a term newborn: A case report. Am J Perinatol. 2000; 17: 69-71. [ Links ] PubMed













