Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.20 no.1 Bogota Jan./Feb. 2013
(1) Grupo de investigación en Ejercicio Físico y Deportes. Programas de Fisioterapia, Universidad Manuela Beltrán. Bogotá, Colombia.
(2) Facultad de Cultura Física, Deporte y Recreación, Universidad Santo Tomás, Bogotá, Colombia.
Correspondencia: Dr. Robinson Ramírez, Correo electrónico: robin640@hotmail.com
Recibido: 18/01/2012. Aceptado: 16/08/2012.
Cambios metabólicos in utero establecen patrones fisiológicos y estructurales a largo plazo que pueden "programar" la salud durante la vida adulta, teoría popularmente conocida como "hipótesis de Barker". La programación fetal implica que durante los períodos críticos del crecimiento prenatal, ciertos cambios en el entorno hormonal y nutricional del embrión, pueden alterar la expresión del genoma fetal, en tejidos con funciones fisiológicas y metabólicas en la etapa adulta. La evidencia sugiere que patologías como enfermedad vascular (por ejemplo, hipertensión), síndrome metabólico y diabetes mellitus tipo 2, pueden "programarse" durante las primeras etapas del desarrollo fetal y manifestarse en etapas tardías, al interactuar con el estilo de vida y otros factores de riesgo adquiridos convencionales con el medio ambiente. El objetivo de esta revisión es presentar evidencia adicional que apoye la asociación entre el bajo peso al nacer, con el aumento en la prevalencia de la hipertensión arterial en la edad adulta. Se revisan la función endotelial, el estrés oxidativo, la resistencia a la insulina y la función mitocondrial, como posibles mecanismos celulares y moleculares.
Palabras clave: programación fetal, enfermedad cardiovascular, hipertensión arterial.
Metabolic changes in utero establish long-term physiological and structural patterns which can "program" health in adulthood, theory popularly known as "Barker hypothesis". The fetal programming implies that during critical periods of prenatal growth, some changes in hormonal and nutritional environment of the embryo can alter fetal genome expression in tissues with physiological and metabolic functions in adulthood. Evidence suggests that pathologies like vascular disease (eg, hypertension), metabolic syndrome and type 2 diabetes mellitus, may "be programmed" during the early stages of fetal development and manifest in later stages, when interacting with lifestyle and other conventional acquired risk factors with the environment. The aim of this review is to present additional evidence to support the association between low birth weight with the increased prevalence of arterial hypertension in adulthood. We review endothelial function, oxidative stress, insulin resistance and mitochondrial function, as possible cellular and molecular mechanisms.
Keywords: fetal programming, cardiovascular disease, hypertension.
Introducción
Durante mucho tiempo se consideró que el feto en etapa de desarrollo in utero se encontraba exento de sufrir algún daño por agentes externos, pues se suponía que estaba protegido dentro del vientre materno (1). Sin embargo, varios autores han demostrado que cambios metabólicos in utero establecen patrones fisiológicos y estructurales a largo plazo que pueden "programar" la salud durante la vida adulta (2-4). Los estudios de Barker y colaboradores, en la década de 1980, establecieron que la incidencia de algunas enfermedades en el adulto, como hipertensión arterial, accidente vascular, diabetes mellitus tipo 2 y dislipidemias, se relacionaban con el ambiente intrauterino durante la gestación <hipótesis de Barker> (5-7). Junto a Barker, varios autores observaron en Países Bajos que regiones con alta mortalidad infantil presentaban también alta mortalidad por enfermedad coronaria en el adulto (6, 7).
Aunado a lo anterior, se ha reportado asociación entre el bajo peso y la talla al nacer, con aumento en el riesgo de sufrir posteriormente enfermedades como hipertensión arterial, síndrome metabólico y accidente vascular (8, 9). Cambios en el peso o en la composición corporal al nacer, ya sea en el rango superior de la normalidad para la edad gestacional (10) (LGA por su sigla en inglés, large for gestational age), o reducciones significativas en el tamaño y peso al nacer (SGA por su sigla en inglés, small for gestational age), podrían dar lugar a secuelas metabólicas del adulto (11, 12) (Figura 1).
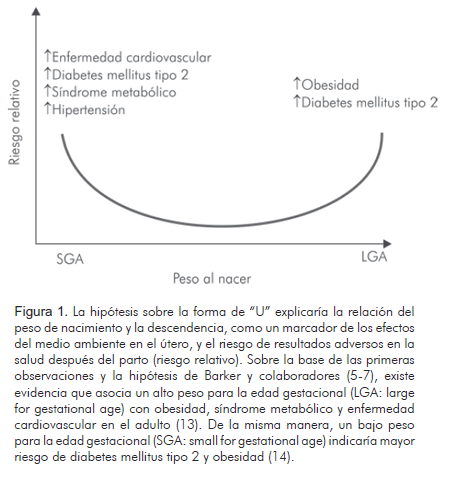
Posteriormente, otras investigaciones confirmaron esta relación y en la actualidad se tratan de esclarecer algunos de los mecanismos (15, 16). En el plano experimental, la restricción nutricional durante la gestación, ha mostrado que afecta irreversiblemente la estructura, el metabolismo y la función en algunos órganos "programando" al adulto a patologías futuras (17, 18). No obstante, circunstancias de sedentarismo, excesos de alimento y bebidas -tipo dieta occidental-, han determinado que la respuesta metabólica post-natal se manifieste en enfermedades crónicas no transmisibles como hipertensión arterial, resistencia a la insulina e inflamación crónica de bajo grado, componentes del denominado síndrome metabólico, el cual se asocia con mayor riesgo de diabetes mellitus tipo 2 y mortalidad por enfermedades cardiovasculares (7, 18, 19).
Mecanismos relacionados con la programación fetal de la hipertensión arterial
La hipótesis sobre los orígenes relacionados con programación fetal, propone que la enfermedad coronaria, el accidente cerebrovascular, la hipertensión arterial y la diabetes mellitus tipo 2, se originan en la plasticidad del desarrollo que ocurre en respuesta a factores maternos y placentarios durante la vida fetal y la lactancia (20). En este sentido, se ha postulado que la hipertensión arterial puede ser causada por el menor número de glomérulos que tienen las personas de talla pequeña como los infantes con bajo peso al nacer.
El segundo proceso comprende la regulación hormonal y metabólica. Un recién nacido prematuro o con bajo peso al nacer, presenta mayor susceptibilidad de tener un patrón metabólico "ahorrativo" para el manejo de los nutrientes. La resistencia a la insulina y un estado de estrés oxidativo, que se asocia con el bajo peso al nacer, podrían ser considerados desde esta perspectiva como la persistencia de la respuesta fetal para la preservación de glucosa en el cerebro, a expensas del transporte de este carbohidrato al músculo para su propio metabolismo y crecimiento. Según la hipótesis del fenotipo ahorrador (thrifty phenotype hipótesis) un crecimiento fetal pobre ocasionaría una disminución en el número de células pancreáticas β y una disminución de la capacidad para producir insulina, lo que si además se asocia con obesidad, conduce en la edad adulta a alteraciones del metabolismo de los carbohidratos. La evidencia en cuanto a que recién nacidos con bajo peso al nacer presentarán resistencia insulínica es fuerte. Una revisión sistemática publicada en 2008 por Whincup y colaboradores (21) reportó que, en la mayoría de las poblaciones estudiadas, el peso al nacimiento era inversamente relacionado con el riesgo de padecer diabetes mellitus tipo 2 e hipertensión arterial.
Una tercera asociación entre el bajo peso al nacer y la programación fetal de la hipertensión arterial del adulto, es que las personas de talla pequeña al nacer son más vulnerables a las influencias ambientales adversas durante las etapas posteriores de la vida. Sin embargo, no existe una asociación clara entre peso elevado y mayor riesgo de hipertensión arterial.
Disfunción endotelial e hipertensión del adulto
Los mecanismos que median la programación fetal de la hipertensión arterial del adulto probablemente son numerosos (22-24). Por ejemplo, varios autores han demostrado cambios en la función renal (reducción del número de nefronas), el sistema neuroendocrino (desregulación del eje hipotálamo-pituitaria-adrenal) y el sistema vascular (activación vascular y reducción de la densidad de las arteriolas y capilares) (25, 26). Recientemente, Ligi y colaboradores (27) centraron su hipótesis en el origen de las anomalías vasculares y las propiedades angiogénicas endoteliales de las células formadoras de colonias (ECFC) presentes en la sangre del cordón umbilical de infantes con bajo peso al nacer, en comparación con bebés nacidos a término y mediante parto normal. Las ECFC son un tipo de células que se caracterizan por su capacidad de formar colonias de células endoteliales in vitro y reparar los daños fisiológicos ocasionados por el cambio en el fenotipo vascular (Figuras 2A y 2B).
Ligi y su equipo (27) reportaron que colonias cultivadas de ECFC provenientes de niños con bajo peso al nacer, presentaron una capacidad reducida para formar estructuras tubulares y capilares, así como menor capacidad proliferativa y menor potencial angiogénico (Figuras 3A y 3B).
Los anteriores hallazgos proporcionan la primera evidencia en humanos de la relación entre el peso al nacer y las propiedades angiogénicas de las ECFC, y un mecanismo potencial de aberración microvascular, estrechamiento arteriolar y angiogénesis reducida, descrito previamente en modelos animales (28-30). Curiosamente, estos investigadores encontraron una correlación fuerte inversa entre el peso al nacer y los "defectos angiogénicos" de las ECFC, con niños con pesos menores a 1.500 g (Figura 2A). Este hallazgo concuerda con varios estudios epidemiológicos que muestran una correlación entre el riesgo de hipertensión arterial en adultos jóvenes y el grado de inmadurez al nacer (31, 32).
Óxido nítrico y programación fetal
La retención de sodio en ratas con hipertensión prenatal programada, también puede ser el resultado del desequilibrio de la biodisponibilidad del óxido nítrico. En el riñón, el óxido nítrico cuenta con numerosas funciones importantes como la regulación de la hemodinámica renal, el mantenimiento de la perfusión medular, la modulación de la respuesta túbulo-glomerular y la reabsorción de sodio tubular, lo que resulta en un efecto neto de la natriuresis y la diuresis (33).
Cavanal y colaboradores (34) midieron la producción de óxido nítrico en segmentos de aorta de hijos de madres diabéticas, y observaron que la producción basal de óxido nítrico estaba deprimida significativamente en el grupo de hijos de madres diabéticas en comparación con el control. Luego de la estimulación con acetilcolina (ACh) o bradicinina (BK), la producción de óxido nítrico aumentó significativamente en todos los grupos, pero el incremento fue de mayor magnitud en los controles. Por otra parte, la disminución renal de ANG 1-7 también pueden interferir con la producción y biodisponibilidad del óxido nítrico, según lo sugerido por Li y colaboradores (35). Estos autores observaron que el efecto vasodilatador de la ANG 1-7 en anillos de aorta del ratón, fue completamente abolido con el pre-tratamiento con L-NAME, locual indica que el óxido nítrico endotelial interviene en el efecto vasodilatador de la ANG 1-7 en este modelo experimental.
El mecanismo exacto de la aparición de hipertensión arterial en los hijos de madres con alteraciones metabólicas durante la gestación, no se entiende por completo. Sin embargo, varios factores pueden contribuir al desarrollo de hipertensión arterial del adulto, reforzando la necesidad de una estrecha vigilancia del metabolismo materno y placentario durante el embarazo para evitar cambios permanentes en la homeostasis de la descendencia (36, 37).
El bajo peso al nacer y su relación con la función vascular y el estrés oxidativo
Es importante destacar que tanto el bajo peso al nacer, como el parto prematuro, inducen cambios en el desarrollo vascular, debido a la inmadurez de varios sistemas biológicos que son modulados por el medio ambiente intrauterino y extrauterino. La importancia de este cambio ambiental como un evento clave en la etiopatología de la disfunción vascular, radica en el crecimiento inapropiado de los vasos sanguíneos que se desarrollan normalmente durante el parto a término. Entre muchas otras diferencias, el medio ambiente intrauterino normal es marcadamente hipóxico en comparación con el medio ambiente extrauterino. A lo largo de la gestación, el feto se prepara progresivamente para la transición hacia el medio ambiente relativamente rico en oxígeno extrauterino, como lo demuestra el aumento considerable de la concentración de enzimas antioxidantes durante las últimas semanas de gestación (38). Si la entrega ocurre antes de tiempo (particularmente antes de las 32 semanas), esta preparación no se completa, y el feto queda susceptible a factores ambientales tales como el estrés oxidativo (39).
Adicional al estado de estrés oxidativo, la exposición excesiva de glucocorticoides fetales puede aumentar el riesgo de desarrollo de trastornos hipertensivos, confiriendo mayor riesgo de co-morbilidad cardiovascular del adulto (40). Se ha observado que niños con bajo peso al nacer, en la vida adulta presentan riesgo independiente de sufrir enfermedades psiquiátricas y cardiovasculares, asociadas a desregulación de los niveles placentarios de 11β-HSD (11β-hidroxiesteroide deshidrogenasa) (41). Una menor regulación de los niveles de 11β-HSD, aumenta la exposición del feto a los glucocorticoides maternos (42) y como respuesta adaptativa, se acelera la maduración fetal intrauterina, como fue demostrado recientemente por Roghair y colaboradores (43), quienes exploraron los orígenes tempranos de la hipertensión arterial, en un modelo de ratas tratadas con un inhibidor de la 11β-HSD (CBX: carbenoxolona) durante la última semana de gestación. Se demostró que el aumento de la presión arterial se acompañaba de disfunción vascular y producción exagerada de O2- en los adultos masculinos, pero no en las mujeres, en las crías expuestas a CBX. Aunque se sabe que el exceso de glucocorticoides induce la producción de O2- vascular (44) y el estrés oxidativo, se ha asociado con la disfunción vascular programada (45, 46), si bien estas interacciones no han sido evaluadas desde una perspectiva de desarrollo.
No obstante, queda aún por responder ¿cómo afecta exactamente este cambio ambiental las características vasculares de niños provenientes de parto prematuro o con bajo peso al nacer? Una posibilidad es que la capacidad angiostática observada en recién nacidos con bajo peso al nacer, sea el resultado de una exposición prematura al medio extrauterino, y dicha capacidad aun no se da. Si es así, se podría especular, desde un punto de vista molecular, que el bajo peso al nacer induce defectos en los perfiles de expresión génica que se evidencian en angiogénesis y desequilibrio angiostático reducidos. Dichos cambios abarcan: a) Desregulación de moléculas con propiedades angiostáticas (como e-NOS, AKT) (47), b) Baja regulación de metaloproteasas de matriz (MMP-2 y MMP-9) (48) que degradan la membrana basal y permiten la migración de ECFC, y c) Inapropiada regulación de factores de crecimiento vascular (VEGF, FGF, PGF), incremento de moléculas asociadas con capacidad de proliferación tumoral (PLXDC-1) (49) y disminución de citoquinas con actividad angiogénica (CXCL-1 y CXCL-5) (50) (Figura 4).
En consecuencia, una alteración del patrón de expresión génica concuerda con defectos de la vasculogénesis, falta de anastomosis y activación vascular. Sin embargo, estos hallazgos no prueban totalmente la relación causal y directa del bajo peso al nacer, con los defectos vasculares en la vida post-natal, aunque se sugiere que contribuye a la alteración del potencial angiogénico de las células ECFC, como fue demostrado por Ligi y colaboradores (27) (Figura 4).
Resistencia a la insulina, diabetes gestacional y programación de la hipertensión arterial del adulto
Situaciones que alteran la función vascular durante la vida fetal y neonatal (51), como hiperglicemia (52), diabetes gestacional (53, 54), resistencia a la insulina (55) o hiperoxia (56), favorecen el desarrollo de enfermedades cardiovasculares, metabólicas y endocrinas en la vida adulta (57-59). Sin embargo, la relación entre un ambiente prenatal inadecuado debido a alteraciones metabólicas maternas, sigue siendo tema de debate. Amri y colaboradores (60) mostraron una disminución del número de nefronas en la descendencia de ratas con diabetes gestacional, tratadas con estreptozotocina (STZ) al inicio del embarazo. En otros estudios, Rocha y colaboradores (61) y Magaton y colaboradores (62) examinaron el efecto de la diabetes mellitus inducida, en ratas antes del apareamiento, sobre la presión arterial y la función renal de la descendencia. Aunque los resultados mostraron incrementos de las cifras tensionales, no se reportaron cambios en el número de nefronas luego del aislamiento glomerular. Por el contrario, Tran y colaboradores (63), mostraron en ratones diabéticos Tg-Hoxb7, que los riñones de crías recién nacidas de madres diabéticas tenían glomérulos con menor área funcional y reducción relativa del número de nefronas, resultado que concuerda con lo reportado por Ortiz y colaboradores (64) al estudiar ratas tratadas con dexametasona en diferentes períodos durante el embarazo, y observar reducción del número glomerular en las crías tratadas.
Además de la aparición de hipertensión arterial en los hijos provenientes de madres con diabetes gestacional, se ha observado mayor riesgo de obesidad (65) y diabetes mellitus tipo 2 (66). Silverman y colaboradores (67) evaluaron la descendencia de mujeres con diabetes mellitus pre-gestacional (tipos 1 y 2), y diabetes gestacional, y observaron que la prevalencia de intolerancia a la glucosa y resistencia a la insulina fue significativamente mayor en estos grupos al ser comparados con el control. Resultados similares obtuvieron Pettitt y su equipo (68), quienes estudiaron el efecto de la tolerancia a la glucosa anormal en la descendencia durante el embarazo de mujeres indígenas PIMA. Los autores correlacionaron las anomalías metabólicas que existen en el embarazo diabético, con estados de resistencia a la insulina, hipertensión arterial, obesidad y diabetes en los hijos. El mecanismo por el cual la hiperglicemia materna aumenta el riesgo metabólico en los hijos no se entiende por completo. Es posible que el aumento en la oferta de la glucosa para el feto pudiera actuar como un estímulo para mejorar la producción de insulina y exponer al feto a la hiperinsulinemia. Se postula también que el aumento de la producción de leptina fetal puede contribuir al trastorno metabólico en la etapa post-natal (69, 70). El aumento de las concentraciones de hormonas como la insulina y la leptina, en períodos críticos del desarrollo puede originar un metabolismo "endógeno teratogénico disfuncional" (71). Por ejemplo, las crías de ratas hiperglicémicas desarrollan "programación metabólica" de las neuronas del hipotálamo (neuro-peptidérgicas), provocando un aumento de su actividad neuropeptídica y orexigénica, lo cual podría conducir a un estado de hiperfagia y al consecuente aumento de peso (72).
Fuera del efecto de la insulina en el metabolismo de los hidratos de carbono, esta hormona participa en otras funciones, incluyendo: modificación del metabolismo de lípidos y proteínas, transporte de aminoácidos y iones, regulación del ciclo celular, apoptosis y síntesis de óxido nítrico (73, 74). Además de la insulina, otras hormonas, como la angiotensina II (ANG II) y la norepinefrina, pueden influir en varios procesos biológicos relacionados con la aparición de hipertensión arterial (75, 76). La ANG II afecta la señalización de la insulina a través de la vía de las proteínas SOCS-3. Se postula también que actúa a través del receptor AT-1 disminuyendo la producción de óxido nítrico insulino-dependiente, por la inhibición de las proteínas ERK-1/2 y la activación de JNK (77). Por otra parte, la ANG II, a través del receptor AT-1, aumenta la actividad de la NADPH oxidasa, incrementando la generación de ROS (78). Recientemente, Zhou y colaboradores (79) demostraron que la regulación de la ANG II y el estrés oxidativo se asocian con disfunción endotelial y resistencia a la insulina en pacientes hipertensos sensibles a la excreción de sodio renal, que es otro factor importante que contribuye a la aparición de hipertensión arterial del adulto.
Rocco y colaboradores (80) estudiaron la excreción de sodio de los hijos diabéticos con y sin sobrecarga de sodio y observaron que, en condiciones normales, los hijos de madres diabéticas presentaron valores de excreción de sodio similar a los del grupo control. Sin embargo, luego de la sobrecarga de sodio, los hijos de madres diabéticas no alcanzaron los valores de excreción de sodio del grupo control. De manera semejante, Nehiri y su grupo (81) examinaron la excreción de sodio en hijos de madres diabéticas que recibieron una dieta alta en sodio durante tres días consecutivos. El estudio de la corteza renal en los hijos de madres diabéticas, reveló un aumento de la expresión del canal epitelial de sodio (ENAC) y sodio/potasio ATPasa (Na+/K+ ATPasa), sin alteraciones en el intercambiador de sodio/hidrógeno (NHE3) o de otros transportadores, sugiriendo que la retención de sodio se debía al aumento en la reabsorción de los segmentos distales de la nefrona.
Bioenergética mitocondrial: papel de la mitocondria
La pérdida del potencial de membrana mitocondrial (?ψm) y la inducción de la permeabilidad transitoria mitocondrial se encuentran estrechamente relacionadas con eventos mitocondriales durante la apoptosis como evento propio de las células (82) y algunas complicaciones durante la gestación como retardo en el crecimiento intrauterino (RCIU), prematurez y bajo peso al nacer (83). La principal consecuencia de la apertura prolongada del poro de permeabilidad transitoria mitocondrial es la despolarización debida a la desaparición del gradiente de protones y la consecuente inhibición de la respiración mitocondrial.
Se conoce que un desacople en la función mitocondrial, debido a la pérdida y/o reducción de la eficiencia energética o del ?ψm, llevan a reducción de la síntesis de ATP, acumulación anormal de intermediarios metabólicos, y producción de ROS, lo cual contribuye a la alteración de la función metabólica placentaria y vascular (84). La actividad de los complejos de la cadena respiratoria puede verse reducida o comprometida debido a un aporte inadecuado de oxígeno celular, como ocurre en procesos de arteriosclerosis, anemia y preclampsia (85). Por ejemplo, en pacientes con neuropatía óptica hereditaria de Leber éstos presentan mutaciones en el complejo I mitocondrial (86), y también se ha observado un incremento en la generación de ROS; en sujetos que padecen la enfermedad de Parkinson (87), este fenómeno también parece estar relacionado.
En condiciones de hipoxia fetal, el exceso de ROS genera un aumento en los niveles Ca2+ citosólico, provocando su acumulación en la mitocondria y, con ello, la pérdida del ?ψm. En cultivos celulares donde se previene dicha acumulación mediante el uso de fármacos capaces de disipar el potencial eléctrico, como es el caso del protonóforo (FCCP: Carbonylcyanide p-trifluoromethoxyphenylhydrazone), se previenen los procesos de muerte celular, lo que indica que la pérdida del ?ψm resulta crucial para la activación de la cascada de señalización que conduce a la muerte celular. Asimismo, el bloqueo de la producción de ROS mediante el uso de fármacos con actividad de catalasa (CAT) o de superóxido dismutasa (MnSOD), ha mostrado eficacia para prevenir la pérdida del ?ψm, en mitocondrias aisladas y cultivos celulares. En neuronas tratadas con EU-134, -un fármaco con actividad de superóxido dismutasa e inhibidor de señales apoptóticas en diferentes modelos animales-, éste demostró ser útil en el mantenimiento fisiológico del ?ψm (88, 89).
Se ha reportado que los ROS pueden disminuir la biogénesis mitocondrial y alterar el funcionamiento mitocondrial produciendo disfunción mitocondrial placentaria con el consecuente empeoramiento de la hipoxia tisular y alteraciones del desarrollo placentario (90, 91). Esto se ha observado a través del aumento en la expresión de diversos reguladores de la biogénesis mitocondrial, entre ellos, el factor de transcripción mitocondrial A (Tfam) y los factores respiratorios nucleares 1 y 2 (NRF-1 y NRF-2). También en placentas de gestantes con bajo peso al nacer, se han observado cambios mitocondriales bioenergéticos y funcionales (92, 93). Ali y colaboradores (94) reportaron que en células endoteliales la activación del PGC-1α induce la expresión de la hemoxigenasa, una proteína de respuesta al estrés oxidativo. Recientemente Barrès y colaboradores (95) encontraron una correlación negativa entre la hipermetilación de citosinas (no CpG) del promotor del PGC-1α, y la expresión proteica y la densidad mitocondrial en células musculares de sujetos con diabetes mellitus tipo 2. Adicionalmente, en ratones que recuperan su estado nutricional, hubo una restauración de los niveles de la eNOS y la biogénesis mitocondrial en tejido adiposo y músculo, asociándose además a reducción de peso en comparación con ratones normales (1, 15).
A lo anterior se suman resultados de una amplia gama de estudios que apoyan el papel de algunos factores maternos y placentarios como: dislipemia, hipertensión arterial materna, estrés oxidativo, dieta inadecuada, sobrepeso/obesidad, y en particular, la reducción de la biogénesis mitocondrial en la patogénesis metabólica en la gestante con el consecuente bajo peso al nacer o prematurez, que conllevaría a la programación fetal de la hipertensión arterial (Figura 4). Sin embargo, este mecanismo, podría ser modulado por los cambios en el fenotipo celular placentario, resultado de la adaptación metabólica como un estado de estrés oxidativo o disfunción endotelial.
Perspectivas futuras
El siguiente paso en el camino de las hipótesis descritas en esta revisión, son los estudios en estados metabólicos alterados como preeclampsia, RCIU, diabetes gestacional e hipertensión inducida por el embarazo, -factores asociados en la hipótesis de programación fetal de hipertensión arterial-.
También sería interesante explorar algunas vías de señalización relacionadas con la biogénesis mitocondrial (PCG-1α, Tfam, NRF-1 y NRF-2), estado redox (NFKβ) y cambios en la demanda energética (MAPK). En la actualidad, se sabe muy poco de los cambios en la función vascular y la biogénesis mitocondrial en estados metabólicos relacionados con la programación fetal de la hipertensión arterial. Se postula que dicho efecto podría desempeñar un efecto en la atenuación asociada con la edad mitocondrial "disfunción" en enfermedades relacionadas con el metabolismo oxidativo (miopatías, cáncer y enfermedad mental).
La promoción de la lactancia materna prolongada, el retraso en la introducción de la alimentación complementaria (96), la revisión a la baja de la carga proteica en el primer año de vida, la práctica de ejercicio físico durante la gestación (97-99), entre otros, son pasos reales sobre los que caminan la Nutrición, la Pediatría, la Endocrinología y la Gineco-Obstetricia de hoy (100).
Conflicto de intereses
No hay conflicto de intereses.
Fuentes de financiamiento
El estudio no tuvo ninguna fuente externa de financiamiento.
Bibliografía
1. Martínez de Villarreal L. Programación fetal de enfermedades expresadas en la etapa adulta. Med Univer. 2008; 10: 108-113. [ Links ]
2. Vieau D. Perinatal nutritional programming of health and metabolic adult disease. World J Diabetes. 2011; 2: 133-116. [ Links ]
3. Hall JG. The importance of the fetal origin of adult disease for geneticists. Clin Genet. 2007; 72: 67-72. [ Links ]
4. Bloomfield FH. Epigenetic modifications may play a role in the developmental consequences of early life events. J Neurodev Disord. 2011; 3: 348-355. [ Links ]
5. Barker DPJ. Fetal programming: influences on development and disease in later life. NIH Monograph Series. New York: Marcel Dekker; 2000. [ Links ]
6. Baker JL, Olsen LW, Sorensen TIA. Childhood body-mass index and the risk of coronary heart disease in adulthood. N Engl J Med. 2007; 357: 2329-2333. [ Links ]
7. López-Jaramillo P, López-López J. Fetal programming and cardiometabolic diseases: the role of angiotensin II and inflammation. Clínica e Investigación en Arteriosclerosis 2010; 22 (Supl 2): 37-40. [ Links ]
8. Barker DJP, Osmond C, Winter PD, Margetts B, Simmonds SJ. Weight in infancy and death from ischaemic heart disease. Lancet. 1989; 2: 577-580. [ Links ]
9. Koletzko B, Dodds P, Akerblom H, Ashwell M. Early nutrition and its later consequences: new opportunities Perinatal Programming of Adult Health - EC Supported Research, Springer Science + Business Media, Inc.; 2005. [ Links ]
10. López-Jaramillo P. Cardiometabolic diseases in Latin america: the role of fetal programming in response to maternal malnutrition. Rev Esp Card. 2009; 62: 670-676. [ Links ]
11. Cutfield WS, Hofman PL, Vickers M, Breier B, Blum WF, Robinson EM. IGFs and binding proteins in short children with intrauterine growth retardation. J Clin Endocrinol Metab. 2002; 87: 235-239. [ Links ]
12. Hofman PL, Cutfield WS, Robinson EM. Insulin resistance in short children with intrauterine growth retardation. J Clin Endocrinol Metab. 1997; 82: 402-406. [ Links ]
13. Oken E, Gillman MW. Fetal origins of obesity. Obes Res. 2003; 11: 496-506. [ Links ]
14. Whitaker RC. Predicting preschooler obesity at birth: the role of maternal obesity in early pregnancy. Pediatrics. 2004; 114: e29-36. [ Links ]
15. Ramírez-Vélez R. In utero fetal programming and its impact on health in adulthood. Endocrinol Nutr. 2012; 59: 383-93. [ Links ]
16. Fall CH, Stein CE, Kumaran K, Cox V, Osmond C, Barker DJ. Size at birth, maternal weight, and type 2 diabetes in South India. Diabetic Med. 1998; 15: 220-227. [ Links ]
17. Bertram CE, Hanson MA. Animal models and programming of the metabolic syndrome. Br Med Bull. 2001; 60: 103-121. [ Links ]
18. Pinho Franco MDC, Nigro D. Intrauterine undernutrition-renal and vascular origin of hypertension. Cardiovascular Research. 2003; 60: 228-234. [ Links ]
19. Ramírez-Vélez R. Postprandial lipemia induces endothelial dysfunction and higher insulin resistance in healthy subjects. Endocrinol Nutr. 2011; 58: 529-35. [ Links ]
20. López-Jaramillo P, Silva SY, Rodríguez Salamanca N, Duran A, Mosquera W, Castillo V. Are Nutrition-induced epigenetic changes the link between socioeconomic pathology and cardiovascular diseases? American Journal of Therapeutics 2008; 15: 362-372. [ Links ]
21. Whincup PH, Kaye SJ, Owen CG. Birth weight and risk of type 2 diabetes: a systematic review. JAMA. 2008; 300: 2886-2897. [ Links ]
22. Keijzer-Veen MG, Finken MJ, Nauta J, Dekker FW, Hille ET, Frölich M, et al. Dutch POPS-19 Collaborative Study Group. Is blood pressure increased 19 years after intrauterine growth restriction and preterm birth? A prospective follow-up study in The Netherlands. Pediatrics. 2005; 116: 725-731. [ Links ]
23. Bergvall N, Iliadou A, Tuvemo T, Cnattingius S. Birth characteristics and risk of high systolic blood pressure in early adulthood: socioeconomic factors and familial effects. Epidemiology. 2005; 16: 635-640. [ Links ]
24. Johansson S, Iliadou A, Bergvall N, Tuvemo T, Norman M, Cnattingius S. Risk of high blood pressure among young men increases with the degree of immaturity at birth. Circulation. 2005; 112: 3430-3436. [ Links ]
25. Cheung YF, Wong KY, Lam BC, Tsoi NS.Relation of arterial stiffness with gestational age and birth weight. Arch Dis Child. 2004; 89: 217-221. [ Links ]
26. Ligi I, Grandvuillemin I, Andres V, Dignat-George F, Simeoni U. Low birth weight infants and the developmental programming of hypertension: a focus on vascular factors. Semin Perinatol. 2010; 34: 188-192. [ Links ]
27. Ligi I, Simoncini S, Tellier E. A switch toward angiostatic gene expression impairs the angiogenic properties of endothelial progenitor cells in low birth weight preterm infants. Blood. 2011; 118: 1699-1709. [ Links ]
28. Mitchell P, Liew G, Rochtchina E. Evidence of arteriolar narrowing in low-birth-weight children. Circulation. 2008; 118: 518-524. [ Links ]
29. Kistner A, Jacobson L, Jacobson SH, Svensson E, Hellstrom A. Low gestational age associated with abnormal retinal vascularization and increased blood pressure in adult women. Pediatr Res. 2002; 51: 675-680. [ Links ]
30. Pladys P, Sennlaub F, Brault S. Microvascular rarefaction and decreased angiogenesis in rats with fetal programming of hypertension associated with exposure to a low-protein diet in utero. Am J Physiol Regul Integr Comp Physiol. 2005; 289: R1580-R1588. [ Links ]
31. Bilge I, Poyrazoglu S, Bas F, Emre S, Sirin A, Gokalp S, et al. Ambulatory blood pressure monitoring and renal functions in term small-for-gestational age children. Pediatr Nephrol. 2011; 26: 119-126. [ Links ]
32. Keijzer-Veen MG, Dülger A, Dekker FW, Nauta J, van der Heijden BJ. Very preterm birth is a risk factor for increased systolic blood pressure at a young adult age. Pediatr Nephrol. 2010; 25: 509-516. [ Links ]
33. Mount PF, Power DA. Nitric oxide in the kidney: functions and regulation of synthesis. Acta Physiol 2006; 187: 433-446. [ Links ]
34. Cavanal MF, Gomes GN, Forti AL, Rocha SO, Franco MC, Fortes ZB, et al. The influence of L-arginine on blood pressure, vascular nitric oxide and renal morphometry in the offspring from diabetic mothers. Pediatr Res 2007; 62: 145-150. [ Links ]
35. Li P, Chappell MC, Ferrario CM, Brosnihan KB. Angiotensin-(1-7) augments bradykinin-induced vasodilation by competing with ACE and releasing nitric oxide. Hypertension. 1997; 29: 394-400. [ Links ]
36. López-Jaramillo P, Pradilla LP, Castillo V, Lahera V. Socioeconomical pathology as determinant of regional differences in the prevalence of metabolic syndrome and pregnancy-induced hypertension. Rev Esp Card. 2007; 60: 168-178. [ Links ]
37. Lopez-Jaramillo P. Defining the research priorities to fight the burden of cardiovascular diseases in Latin America. Journal of Hypertension. 2008; 26: 1886-1889. [ Links ]
38. Frank L, Sosenko IR. Prenatal development of lung antioxidant enzymes in four species. J Pediatr. 1987; 110: 106-110. [ Links ]
39. Lee JW, Davis JM. Future applications of antioxidants in premature infants. Curr Opin Pediatr. 2011; 23: 161-166. [ Links ]
40. Kibler JL, Joshi K, Ma M. Hypertension in relation to posttraumatic stress disorder and depression in the US National Comorbidity Survey. Behav Med. 2009; 34: 125-132. [ Links ]
41. Dy J, Guan H, Sampath-Kumar R, Richardson BS, Yang K. Placental 11beta-hydroxysteroid dehydrogenase type 2 is reduced in pregnancies complicated with idiopathic intrauterine growth Restriction: evidence that this is associated with an attenuated ratio of cortisone to cortisol in the umbilical artery. Placenta. 2008; 29: 193-200. [ Links ]
42. Welberg LA, Seckl JR, Holmes MC. Inhibition of 11beta-hydroxysteroid dehydrogenase, the foeto-placental barrier to maternal glucocorticoids, permanently programs amygdala GR mRNA expression and anxiety-like behaviour in the offspring. Eur J Neurosci. 2000; 12: 1047-1054. [ Links ]
43. Roghair RD, Segar JL, Volk KA, Chapleau MW, Dallas LM, Sorenson AR, Scholz TD, Lamb FS. Vascular nitric oxide and superoxide anion contribute to sex-specific programmed cardiovascular physiology in mice. Am J Physiol Regul Integr Comp Physiol. 2009; 296: R651-662. [ Links ]
44. Iuchi T, Akaike M, Mitsui T, Ohshima Y, Shintani Y, Azuma H, Matsumoto T. Glucocorticoid excess induces superoxide production in vascular endothelial cells and elicits vascular endothelial dysfunction. Circ Res. 2003; 92: 81-87. [ Links ]
45. Cambonie G, Comte B, Yzydorczyk C, Ntimbane T, Germain N, Lê NL, Pladys P, Gauthier C, Lahaie I, Abran D, Lavoie JC, Nuyt AM. Antenatal antioxidant prevents adult hypertension, vascular dysfunction, and microvascular rarefaction associated with in utero exposure to a low-protein diet. Am J Physiol Regul Integr Comp Physiol. 2007; 292: R1236-1245. [ Links ]
46. Franco Mdo C, Dantas AP, Akamine EH, Kawamoto EM, Fortes ZB, Scavone C, Tostes RC, Carvalho MH, Nigro D. Enhanced oxidative stress as a potential mechanism underlying the programming of hypertension in utero. J Cardiovasc Pharmacol. 2002; 40: 501-509. [ Links ]
47. Zhang Y, Fisher N, Newey SE, et al. The impact of proliferative potential of umbilical cord-derived endothelial progenitor cells and hypoxia on vascular tubule formation in vitro. Stem Cells Dev. 2009; 18: 359-375. [ Links ]
48. van Hinsbergh VW, Koolwijk P. Endothelial sprouting and angiogenesis: matrix metalloproteinases in the lead. Cardiovasc Res. 2008; 78: 203-212. [ Links ]
49. Beaty RM, Edwards JB, Boon K, Siu IM, Conway JE, Riggins GJ. PLXDC1 (TEM7) is identified in a genome-wide expression screen of glioblastoma endothelium. J Neurooncol. 2007; 81: 241-248. [ Links ]
50. Keeley EC, Mehrad B, Strieter RM. Chemokines as mediators of neovascularization. Arterioscler Thromb Vasc Biol. 2008; 28: 1928-1936. [ Links ]
51. López-Jaramillo P, Lahera V, López-López J. Epidemic of cardiometabolic diseases: A Latin American point of view. Ther Adv Card Dis. 2011; 5: 119-31. [ Links ]
52. Ingram DA, Lien IZ, Mead LE, et al. In vitro hyperglycemia or a diabetic intrauterine environment reduces neonatal endothelial colony-forming cell numbers and function. Diabetes. 2008; 57: 724-731. [ Links ]
53. Roman AS, Rebarber A, Fox NS, Klauser CK, Istwan N, Rhea D, Saltzman D. The effect of maternal obesity on pregnancy outcomes in women with gestational diabetes. J Matern Fetal Neonatal Med. 2011; 24: 723-727. [ Links ]
54. Tsadok MA, Friedlander Y, Paltiel O, Manor O, Meiner V, Hochner H, et al. Obesity and blood pressure in 17-year-old offspring of mothers with gestational diabetes: insights from the Jerusalem Perinatal Study. Exp Diabetes Res. 2011; 2011: 906154. [ Links ]
55. Gomes GN, Gil FZ. Prenatally programmed hypertension: role of maternal diabetes. Braz J Med Biol Res. 2011; 44: 899-904. [ Links ]
56. Balasubramaniam V, Mervis CF, Maxey AM, Markham NE, Abman SH. Hyperoxia reduces bone marrow, circulating, and lung endothelial progenitor cells in the developing lung: implications for the pathogenesis of bronchopulmonary dysplasia. Am J Physiol Lung Cell Mol Physiol. 2007; 292: L1073-L1084. [ Links ]
57. Roseboom TJ, van der Meulen JH, Osmond C, Barker DJ, Ravelli AC, Schroeder-Tanka JM, et al. Coronary heart disease after prenatal exposure to the Dutch famine, 1944-45. Heart. 2000; 84: 595-598. [ Links ]
58. Aerts L, Van Assche FA. Intra-uterine transmission of disease. Placenta. 2003; 24: 905-911. [ Links ]
59. Barker DJ, Bagby SP, Hanson MA. Mechanisms of disease: in utero programming in the pathogenesis of hypertension. Nat Clin Pract Nephrol. 2006; 2: 700-707. [ Links ]
60. Amri K, Freund N, Vilar J, Merlet-Benichou C, Lelievre-Pegorier M. Adverse effects of hyperglycemia on kidney development in rats: in vivo and in vitro studies. Diabetes. 1999; 48: 2240-2245. [ Links ]
61. Rocha SO, Gomes GN, Forti AL, do Carmo Pinho FM, Fortes ZB, de Fatima CM, et al. Long-term effects of maternal diabetes on vascular reactivity and renal function in rat male offspring. Pediatr Res. 2005; 58: 1274-1279. [ Links ]
62. Magaton A, Gil FZ, Casarini DE, Cavanal MF, Gomes GN. Maternal diabetes mellitus - early consequences for the offspring. Pediatr Nephrol. 2007; 22: 37-43. [ Links ]
63. Tran S, Chen YW, Chenier I, Chan JS, Quaggin S, Hebert MJ, et al. Maternal diabetes modulates renal morphogenesis in offspring. J Am Soc Nephrol. 2008; 19: 943-952. [ Links ]
64. Ortiz LA, Quan A, Zarzar F, Weinberg A, Baum M. Prenatal dexamethasone programs hypertension and renal injury in the rat. Hypertension. 2003; 41: 328-334. [ Links ]
65. Dabelea D. The predisposition to obesity and diabetes in offspring of diabetic mothers. Diabetes Care. 2007; 30 (Suppl 2): S169-S174. [ Links ]
66. Simeoni U, Barker DJ. Offspring of diabetic pregnancy: long-term outcomes. Semin Fetal Neonatal Med. 2009; 14: 119-124. [ Links ]
67. Silverman BL, Metzger BE, Cho NH, Loeb CA. Impaired glucose tolerance in adolescent offspring of diabetic mothers. Relationship to fetal hyperinsulinism. Diabetes Care. 1995; 18: 611-617. [ Links ]
68. Pettitt DJ, Bennett PH, Saad MF, Charles MA, Nelson RG, Knowler WC. Abnormal glucose tolerance during pregnancy in Pima Indian women. Long-term effects on offspring. Diabetes. 1991; 40 (Suppl 2): 126-130. [ Links ]
69. Tapanainen P, Leinonen E, Ruokonen A, Knip M. Leptin concentrations are elevated in newborn infants of diabetic mothers. Horm Res. 2001; 55: 185-190. [ Links ]
70. Manderson JG, Patterson CC, Hadden DR, Traub AI, Leslie H, McCance DR. Leptin concentrations in maternal serum and cord blood in diabetic and nondiabetic pregnancy. Am J Obstet Gynecol. 2003; 188: 1326-1332. [ Links ]
71. Plagemann A. 'Fetal programming' and 'functional teratogenesis': on epigenetic mechanisms and prevention of perinatally acquired lasting health risks. J Perinat Med. 2004; 32: 297-305. [ Links ]
72. Franke K, Harder T, Aerts L, Melchior K, Fahrenkrog S, Rodekamp E, et al. "Programming" of orexigenic and anorexigenic hypothalamic neurons in offspring of treated and untreated diabetic mother rats. Brain Res. 2005; 1031: 276-283. [ Links ]
73. Saltiel AR, Kahn CR. Insulin signalling and the regulation of glucose and lipid metabolism. Nature. 2001; 414: 799-806. [ Links ]
74. Pessin JE, Saltiel AR. Signaling pathways in insulin action: molecular targets of insulin resistance. J Clin Invest. 2000; 106: 165-169. [ Links ]
75. Peliciari-Garcia RA, Marcal AC, Silva JA, Carmo-Buonfiglio D, Amaral FG, Afeche SC, et al. Insulin temporal sensitivity and its signaling pathway in the rat pineal gland. Life Sci. 2010; 87: 169-174. [ Links ]
76. Velloso LA, Folli F, Perego L, Saad MJ. The multi-faceted cross-talk between the insulin and angiotensin II signaling systems. Diabetes Metab Res Rev. 2006; 22: 98-107. [ Links ]
77. Folli F, Kahn CR, Hansen H, Bouchie JL, Feener EP. Angiotensin II inhibits insulin signaling in aortic smooth muscle cells at multiple levels. A potential role for serine phosphorylation in insulin/angiotensin II crosstalk. J Clin Invest. 1997; 100: 2158-2169. [ Links ]
78. Skultetyova D, Filipova S, Riecansky I, Skultety J. The role of angiotensin type 1 receptor in inflammation and endothelial dysfunction. Recent Pat Cardiovasc Drug Discov. 2007; 2: 23-27. [ Links ]
79. Zhou MS, Schulman IH, Raij L. Vascular inflammation, insulin resistance, and endothelial dysfunction in salt-sensitive hypertension: role of nuclear factor kappa B activation. J Hypertens. 2010; 28: 527-535. [ Links ]
80. Rocco L, Gil FZ, da Fonseca Pletiskaitz TM, de Fátima Cavanal M, Gomes GN. Effect of sodium overload on renal function of offspring from diabetic mothers. Pediatr Nephrol. 2008; 23: 2053-2060. [ Links ]
81. Nehiri T, Duong Van Huyen JP, Viltard M, Fassot C, Heudes D, Freund N, et al. Exposure to maternal diabetes induces salt-sensitive hypertension and impairs renal function in adult rat offspring. Diabetes. 2008; 57: 2167-2175. [ Links ]
82. Wang Q, Frolova AI, Purcell S, Adastra K, Schoeller E, Chi MM, et al. Mitochondrial dysfunction and apoptosis in cumulus cells of type I diabetic mice. PLoS One. 2010; 28 (5): e15901. [ Links ]
83. Wakefield SL, Lane M, Mitchell M. Impaired mitochondrial function in the preimplantation embryo perturbs fetal and placental development in the mouse. Biol Reprod. 2011; 84: 572-580. [ Links ]
84. Zhang DX, Gutterman DD. Mitochondrial reactive oxygen species-mediated signaling in endothelial cells. Am J Physiol Heart Circ Physiol. 2007; 292: H2023-H2031. [ Links ]
85. Treem WR, Sokol RJ. Disorders of the mitochondria. Semin Liver Dis.1998; 18: 237-253. [ Links ]
86. Brown MD, Trounce IA, Jun AS, Allen JC, Wallace DC. Functional analysis of lymphoblast and cybrid mitochondria containing the 3460, 11778, or 14484 Leber's hereditary optic neuropathy mitochondrial DNA mutation. J Biol Chem. 2000; 275: 39831-39836. [ Links ]
87. Sheehan JP, Swerdlow RH, Parker WD, Miller SW, Davis RE, Tuttle JB. Altered calcium homeostasis in cells transformed by mitochondria from individuals with Parkinson's disease. J Neurochem. 1997; 68: 1221-1233. [ Links ]
88. Pong K, Doctrow SR, Huffman K, Adinolfi CA, Baudry M. Attenuation of staurosporineinduced apoptosis, oxidative stress, and mitochondrial dysfunction by synthetic superoxide dismutase and catalase mimetics, in cultured cortical neurons. Exp Neurol. 2001; 171: 84-97. [ Links ]
89. Rong Y, Doctrow SR, Tocco G, Baudry M. EUK134, a synthetic superoxide dismutase and catalase mimetic, prevents oxidative stress and attenuates kainateinduced neuropathology. Proc Natl Acad Sci U S A.1999; 96: 9897-902. [ Links ]
90. Lattuada D, Colleoni F, Martinelli A, Garretto A, Magni R, Radaelli T, Cetin I. Higher mitochondrial DNA content in human IUGR placenta. Placenta. 2008; 29: 1029-1033. [ Links ]
91. Carty DM, Delles C, Dominiczak AF. Novel biomarkers for predicting preeclampsia.Trends Cardiovasc Med. 2008; 18: 186-194. [ Links ]
92. Hung TH, Burton GJ. Hypoxia and reoxygenation: a possible mechanism for placental oxidative stress in preeclampsia. Taiwan J Obstet Gynecol. 2006; 45: 189-200. [ Links ]
93. Wang Y, Walsh SW. Placental mitochondria as a source of oxidative stress in pre-eclampsia. Placenta. 1998; 19: 581-586. [ Links ]
94. Ali F, Ali NS, Bauer A, Boyle JJ, Hamdulay SS, Haskard DO, Randi AM, Mason JC. PPARdelta and PGC1alpha act cooperatively to induce haem oxygenase-1 and enhance vascular endothelial cell resistance to stress. Cardiovasc Res. 2010; 85: 701-710. [ Links ]
95. Barrès R, Osler ME, Yan J, Rune A, Fritz T, Caidahl K, Krook A, Zierath JR. Non-CpG methylation of the PGC-1alpha promoter through DNMT3B controls mitochondrial density. Cell Metab. 2009; 10: 189-198. [ Links ]
96. Aguilar, Mateus JC, Ramírez-Vélez R, Mosquera M, Echeverry I, Ortega JG, Romero M. Potencial efecto del ejercicio físico y del consumo de micronutrientes durante la gestación en factores maternos y placentarios asociados a Enfermedades Crónicas No transmisibles (ECNT) del adulto. Colom Med. 2009; 4: 425-36. [ Links ]
97. Ramírez-Vélez R, Aguilar de Plata AC, Escudero MM, Echeverry I, Ortega JG, Salazar B, et al. Influence of regular aerobic exercise on endothelium-dependent vasodilation and cardiorespiratory fitness in pregnant women. J Obstet Gynaecol Res. 2011; 37: 1601-8. [ Links ]
98. Ramírez-Vélez R, Romero M, Echeverri I, Ortega JG, Mosquera M, Salazar B, et al. A factorial randomized controlled trial to evaluate the effect of micronutrients supplementation and regular aerobic exercise on maternal endothelium-dependent vasodilatation and oxidative stress of the newborn. Trials. 2011; 28 (12): 60. [ Links ]
99. Ramírez-Vélez R, Aguilar AC, Mosquera M, García RG, Reyes LM, López-Jaramillo P. Clinical trial to assess the effect of physical exercise on endothelial function and insulin resistance in pregnant women. Trials. 2009; 17 (10): 104. [ Links ]
100. Moreno-Villares JM, Galiano MJ. La programación metabólica: cómo influye la alimentación en el período de lactante en el desarrollo de la enfermedad cardiovascular del adulto de Segovia. Nutr Clin Med. 2009; 3: 109-121. [ Links ]













