Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cardiología
versión impresa ISSN 0120-5633
Rev. Colomb. Cardiol. vol.20 no.2 Bogota mar./abr. 2013
(1) Universidad CES. Medellín, Colombia.
(2) Facultad de Ciencias de la Salud, Universidad de Caldas. Manizales, Colombia.
(3) Clínica Shaio. Bogotá, Colombia.
(4) Centro de Atención Integral a Personas con Diabetes (CAIAD), Corozal. Colombia.
(5) Clínica de Síndrome Metabólico, Prediabetes y Diabetes, Fundación Oftalmológica de Santander-FOSCAL. Bucaramanga, Colombia.
(6) Facultad de Medicina, Universidad Militar Nueva Granada. Bogotá, Colombia.
Correspondencia: Dr. Mauricio Duque. Cra. 24B No. 16-26. Medellín. Teléfono: (57-4) 3120850 - 4447378. Correo electrónico: mauricioduque@une.net.co
Recibido: 19/08/2012. Aceptado: 21/01/2013.
La neuropatía autonómica diabética cardiovascular es un trastorno en el cual una alteración en la regulación del sistema nervioso cardiovascular, por parte del sistema nervioso autónomo, desemboca en una constelación de síntomas, que pueden ir desde intolerancia al ejercicio hasta muerte súbita. Si bien no se conoce su prevalencia exacta, se estima que es alta en pacientes diabéticos, particularmente en aquellos con diabetes de larga data y con presencia de otras comorbilidades. Su reconocimiento temprano puede facilitar el manejo de estos pacientes y a su vez disminuir los costos asociados a pruebas e intervenciones innecesarias con el objetivo de evitar complicaciones asociadas con la enfermedad.
Palabras clave: diabetes mellitus, sistema cardiovascular, sistema nervioso autónomo, síncope.
Cardiac autonomic diabetic neuropathy is a condition in which impairment of the autonomic control of the cardiovascular system leads to a myriad of symptoms, ranging from mild exercise intolerance to sudden cardiac death. Even though its exact prevalence is unknown, it is believed that it is highly prevalent in patients with long-standing diabetes, particularly those who have other pathologic conditions. Early detection is expected to have a positive impact in patient treatment, lowering costs associated with unnecessary tests and treatments, while at the same time avoiding disease-related complications.
Keywords: diabetes mellitus, cardiovascular system, autonomic nervous system, syncope.
Introducción
La neuropatía autonómica diabética cardiovascular es una entidad caracterizada por una alteración en la regulación del sistema cardiovascular por parte del sistema nervioso autónomo, cuya prevalencia probablemente es subestimada. En los últimos anos el interés despertado por esta condición ha ido en aumento a medida que se documentan mejor su mecanismo fisiopatológico, su epidemiología y sus manifestaciones clínicas.
Aspectos generales
En el momento de la evolución del hombre en que se adquirió la posición erguida, el organismo se vio forzado a cambios fisiológicos importantes que le permitieran (mediante la activación del sistema nervioso autónomo) modificar sus parámetros hemodinámicos para asegurar una adecuada perfusión cerebral al realizar variantes de posición (particularmente al pasar del decúbito a la bipedestación). En condiciones normales, al asumir el decúbito hay un flujo retrógrado hacia las venas de los miembros inferiores, y una subsiguiente disminución del gasto cardíaco. En pacientes sanos, éste es detectado por mecanorreceptores del miocardio auricular y ventricular y por barorreceptores del arco aórtico y del seno carotídeo, que, al ser activados, disminuyen la actividad del sistema nervioso parasimpático aumentando al mismo tiempo la activación del sistema nervioso simpático. Esto se traduce en un incremento transitorio de la frecuencia cardíaca y del volumen eyectado, a la vez que se produce una vasoconstricción periférica (particularmente venosa). Dichos cambios ocurren en fracciones de segundo y le permiten al individuo permanecer en posición erguida sin comprometer el flujo sanguíneo cerebral (y por ende, manteniendo la conciencia).
Hay enfermedades (como la diabetes, entre otras) que producen danos en el sistema nervioso autónomo e impiden que los cambios descritos se produzcan (ello a su vez conduce a una gran cantidad de síntomas y manifestaciones clínicas que se describen a continuación); esto se conoce como disautonomía cardiovascular. De esta manera, la neuropatía autonómica diabética cardiovascular se define como la alteración en el control autonómico cardiovascular (documentado por pruebas de función autonómica cardiovascular) que se produce en el contexto de la diabetes y tras haber descartado otras causas (1).
Magnitud del problema
La prevalencia estimada de neuropatía autonómica diabética cardiovascular es de 20% en la población general de pacientes diabéticos, y aumenta hasta 65%-70% en pacientes de edad avanzada, con diabetes de larga data mal controlada y con otras comorbilidades (hipercolesterolemia, hipertensión arterial, obesidad) (2-6). Incluso, se ha descrito disfunción autonómica en pacientes con síndrome metabólico e intolerancia a la glucosa (sin diabetes mellitus establecida), lo que probablemente habla de un dano progresivo, que se iniciaría desde el mismo momento que comienzan las alteraciones metabólicas (7). Adicionalmente, la presencia de otros marcadores de dano microvascular (retinopatía, neuropatía, gastropatía y nefropatía), se correlaciona con un riesgo mayor de padecer neuropatía autonómica diabética cardiovascular. Incluso en pacientes con diabetes mellitus insulinodependiente se ha documentado disautonomía, antes de que ésta muestre manifestaciones clínicas.
Los pacientes con algún tipo de disautonomía cardíaca tienen tasas de mortalidad a cinco anos, con promedio de 30% (16%-53%), lo que equivale a un riesgo relativo de 3,45 (8-10). El 25% de la diabetes mellitus tipo I y el 33% de la tipo II, desencadenan algún tipo de disautonomía. Se asocia con insuficiencia cardíaca cinco veces más que la población general, puede existir antes de que se diagnostique la diabetes y se relaciona con un deterioro importante en la calidad de vida llegando a ser una enfermedad incapacitante similar a una artritis reumatoide. Además, se les ha documentado el doble de incidencia de infarto del miocardio, enfermedad cerebrovascular y muerte súbita; tienen un riesgo relativo de mortalidad de 2,4 veces más que los que no tienen disautonomía autonómica cardiovascular. La mortalidad se produce por aumento del QTc, por la isquemia silente, por presentar anormalidades en la inervación cardíaca, lo cual se ha documentado por exámenes de medicina nuclear como la MIBG y por un incremento importante en la enfermedad coronaria y de la falla cardíaca.
La disautonomía cardíaca secundaria a diabetes mellitus guarda relación con la duración de esta última, con el pobre control de las cifras de glicemia y con el aumento de la edad. Se ha demostrado que un adecuado tratamiento disminuye la progresión de la disautonomía, se asocia a polineuropatía periférica, a microangiopatía y a gastroparesia. Se han visto correlaciones para el desarrollo de neuropatía autonómica cardíaca como: edad, obesidad, consumo de cigarrillo, niveles de HB A1c, cifras de presión arterial, polineuropatía simétrica y retinopatía (9, 10).
Mecanismo fisiopatológico
Si bien no están claros los mecanismos fisiopatológicos que están detrás de la neuropatía autonómica diabética cardiovascular, se sabe que el resultado final es una destrucción progresiva de las fibras nerviosas del sistema nervioso autónomo. Al parecer, se presentan cambios en el estado oxidativo de la neurona, mediados por la hiperglicemia y los mecanismos metabólicos asociados a ella (Figura 1) (11-13):
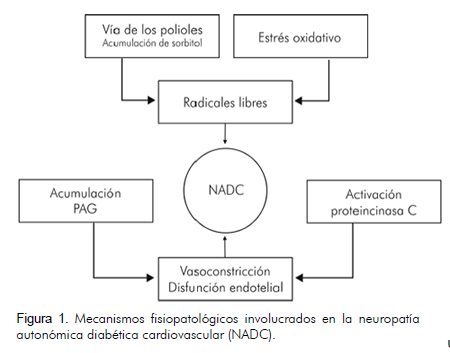
Activación de la vía del poliol: en la vía de los polioles, la glucosa es convertida de manera secuencial en sorbitol (mediante la aldosa reductasa) y posteriormente en fructosa (mediante la sorbitol deshidrogenasa). La aldosa reductasa es activada en presencia de concentraciones elevadas de glucosa; para su funcionamiento requiere como cofactor el NADPH (el cual se convierte en NADH). A su vez, el NADPH es el cofactor necesario en el manejo de los radicales libres de oxígeno, por lo cual el aumento en la síntesis de sorbitol (con el subsiguiente consumo de NADPH) imposibilita el manejo de los radicales libres.
Aumento en la producción de radicales libres.
Activación de la proteincinasa C: la hiperglicemia favorece la síntesis de diacil-glicerol, el cual es el segundo mensajero en la activación de la proteincinasa C, lo que se traduce en una disminución en los niveles de óxido nítrico. Esto favorece la vasoconstricción y el subsiguiente dano isquémico a nivel del tejido nervioso.
Acumulación de productos avanzados de glicación (PAG): la hiperglicemia favorece la acumulación de PAG, los cuales contribuyen al aumento en los niveles de angiotensina y de proteincinasa C (a través del aumento en la síntesis de ácidos grasos libres); estos dos mecanismos están involucrados en la vasoconstricción y disfunción endotelial.
Dado que se afectan más las fibras nerviosas largas y de distal a proximal, aparece primero el compromiso del vago (el cual se manifiesta como una pérdida del tono parasimpático, con taquicardia sinusal al prevalecer el sistema nervioso simpático). Posteriormente, comienza el compromiso de la inervación simpática, iniciando en el ápex cardíaco y progresando hacia la base.
Manifestaciones clínicas
Las manifestaciones clínicas de la neuropatía autonómica diabética cardiovascular están relacionadas con la pérdida de la regulación autonómica del sistema cardiovascular, e incluyen:
Intolerancia al ejercicio: la alteración de la frecuencia cardíaca y la presión arterial con el ejercicio, usualmente acompanadas por incompetencia cronotrópica, predisponen al paciente a presentar síntomas severos con el ejercicio (incluso llegando al síncope). Muchas veces esta manifestación es subvalorada, atribuyéndosela a otras patologías o simplemente a desacondicionamiento físico. Los síntomas inician con astenia y adinamia con el ejercicio. El diagnóstico se hace con una prueba de esfuerzo donde la frecuencia cardíaca se incrementa menos del 80% de la frecuencia cardíaca esperada.
Isquemia silente: si bien la pérdida de la inervación no es responsable de manera directa de los fenómenos de isquemia, el mismo proceso que lleva a la neuropatía autonómica diabética cardiovascular es responsable por el dano microvascular que favorece la isquemia. Adicionalmente, la pérdida de la inervación hace más factibles los episodios de isquemia silente (14).
Taquicardia sinusal inapropiada: se define como una frecuencia cardíaca mayor de 100 lpm en reposo (y en ausencia de otras causas que expliquen la taquicardia) o un Holter de 24 horas con una frecuencia cardíaca promedio de 90 lpm o más. Los pacientes presentan síntomas muy inespecíficos, pero muy incapacitantes, como astenia, adinamia, mareos, frialdad en las extremidades, dolores en miembros inferiores, sensación de taquicardia constante, e incluso se acentúa en las horas de la noche en decúbito.
Hipotensión ortostática: se define como el descenso de 30 mm Hg o más en la presión sistólica o más de 10 mm Hg en la presión diastólica al cambiar del decúbito a la bipedestación, asociado a síntomas de hipoperfusión cerebral. Los síntomas pueden ir desde mareos, sudoración o visión borrosa hasta presíncope o síncope. Aproximadamente 6% a 18% de los pacientes con diabetes mellitus tienen hipotensión ortostática de acuerdo con esta definición (15).
Hipotensión postprandial: es secundaria al dano en la inervación del lecho esplácnico y se correlaciona con la existencia de hipotensión ortostática. Los síntomas inicialmente aparecen después de comidas copiosas, y cuando progresa la enfermedad, con cualquier tipo de alimentación.
Inestabilidad perioperatoria: se manifiesta como bradicardia y/o hipotensión principalmente en la inducción de la anestesia (aun en procedimientos menores), lo que se asocia a más incidencia de uso de inotrópicos y de problemas hemodinámicos tras-operatorios; además de alteraciones importantes en la temperatura en el postoperatorio.
Síndrome de taquicardia postural ortostática: aumento de 30 lpm o frecuencia cardíaca >120 lpm en los primeros diez minutos después de la bipedestación sin cambios significativos en la presión arterial. Se asocia con síntomas importantes como palpitaciones, astenia y adinamia al ponerse de pie.
Trastornos de la función diastólica: independiente de la presencia o no de enfermedad coronaria o de hipertensión arterial, los pacientes con neuropatía autonómica diabética cardiovascular presentan fibrosis intersticial. Estos se deben a cambios metabólicos sumados al disbalance entre el simpático y el parasimpático, los cuales estimulan el sistema renina-angiotensina-aldosterona y producen aumento del crecimiento de los fibroblastos y apoptosis cardíaca, desarrollando así un incremento importante de la presión diastólica final y produciendo síntomas de falla cardíaca izquierda.
Prolongación del intervalo Qtc y heterogeneidad de las propiedades eléctricas del miocardio: se presenta por el disbalance autonómico en la inervación cardíaca y es un factor predictor independiente de muerte. Este disbalance de la inervación se ha relacionado recientemente con anomalías en el ángulo del QRS con respecto a la onda T en vectorcardiografía, el cual es un reflejo de la alteración de las propiedades electrofisiológicas del miocardio. Esto produce una dispersión en los períodos refractarios y en la velocidad de conducción (a su vez sustrato para la aparición de arritmias ventriculares) (16).
Muerte súbita: la presencia de neuropatía autonómica diabética cardiovascular (detectada mediante al menos dos pruebas) se asocia con un riesgo relativo de mortalidad de 1,55-3,65 (8, 17). Si bien los estudios iniciales apuntaban hacia un mayor riesgo de muerte súbita, estudios más recientes han documentado alta prevalencia de enfermedad coronaria y de disfunción del ventrículo izquierdo en pacientes con neuropatía autonómica diabética cardiovascular, lo cual podría explicar, en parte pero no totalmente, el aumento en el riesgo de muerte súbita (14).
Adicionalmente, la neuropatía autonómica diabética cardiovascular se asocia con otras condiciones patológicas del sistema cardiovascular (todas ellas reflejo del trastorno metabólico subyacente y el impacto del mismo sobre el sistema cardiovascular) como: arterioesclerosis (18), hipertrofia del ventrículo izquierdo y pérdida de la variación circadiana de la presión arterial. La disfunción diastólica de la diabetes mellitus tipo 2 muestra asociación tanto con marcadores regionales de integridad simpática como con marcadores clínicos de neuropatía autonómica cardíaca. En diabetes mellitus tipo 1, la neuropatía autonómica cardiavascular está ligada al desarrollo de miocardiopatía diabética porque la disfunción ventricular izquierda a menudo precede u ocurre en ausencia de estenosis aórtica o hipertensión (17).
Evaluación
Historia clínica y examen físico
Algunos de los signos de neuropatía diabética tales como taquicardia en reposo, ortostatismo, taquicardia postural ortostática e intolerancia al ejercicio pueden ser fácilmente evaluados en la historia clínica y el examen físico inicial. Aunque estos hallazgos no son específicos de neuropatía autonómica diabética cardiovascular, sí deben alertar al clínico sobre la posibilidad de dicha condición con el fin de iniciar los estudios indicados.
Evaluación de los reflejos autonómicos cardiovasculares
Pese a que no existe un estándar para establecer el diagnóstico de esta patología, se dispone de varios exámenes que permiten evaluar el funcionamiento del sistema nervioso cardiovascular y que, por tanto, son útiles en el diagnóstico. Algunas de estas pruebas evalúan el control parasimpático, tales como el test de Valsalva, los cambios posturales de la presión arterial y las variaciones de la presión arterial con la respiración profunda. Otras pruebas como el test de mesa basculante ("tilt table test"), el test de "handgrip" (respuesta de la presión arterial al empunar de forma sostenida el puno) y la variabilidad de la frecuencia cardíaca mediante el test de Holter, evalúan el control del sistema nervioso simpático. El test de sensibilidad barorrefleja evalúa tanto el simpático como el parasimpático; el Holter de 24 horas se usa para medir la frecuencia cardíaca, la variabilidad de la frecuencia cardíaca (VFC), la isquemia silente, la dispersión del QT y el intervalo QTc. Dicha prueba brinda información útil al momento del diagnóstico y en la clasificación del riesgo. El MAPA (monitoreo ambulatorio de la presión arterial) es importante para evaluar hipertensión arterial nocturna, con el no descenso fisiológico en la noche, lo que sugiere trastorno importante de la regulación de la presión arterial, todo por problemas de disautonomía diabética. Vale la pena resaltar que el test de "handgrip" no se considera una prueba útil para uso clínico, de ahí que se reserve únicamente para uso experimental (1). Adicionalmente, en pacientes con retinopatía diabética se sugiere evitar el uso de la prueba de Valsalva ante el riesgo de sangrado y desprendimiento de la retina. El test de mesa basculante se debe hacer con medición de la presión arterial y de la frecuencia cardíaca latido a latido; esto incrementa de forma importante la sensibilidad y especificidad del este método. Es ideal realizarlo con equipos del tipo ¨SNC System® o Finapress®.
El diagnóstico de neuropatía autonómica diabética cardiovascular se establece cuando el paciente presenta dos pruebas de frecuencia cardíaca alteradas (cambios en la frecuencia cardíaca al ponerse de pie, durante el Valsalva o durante la inspiración) asociadas a la presencia de ortostatismo (1). Sin embargo, al ser ésta una enfermedad en la cual el paciente muestra un deterioro progresivo a lo largo del tiempo (presentando inicialmente alteración en la inervación cardíaca y posteriormente cambios en la frecuencia cardíaca) (19), la presencia de una sola prueba alterada probablemente ubica al paciente en un estadio temprano de la enfermedad y por lo tanto requiere seguimiento cercano. Hasta el momento no se han determinado criterios de diagnóstico unificados para afirmar la presencia de neuropatía autonómica diabética cardiovascular. No obstante, una anormalidad en dos o tres pruebas de frecuencia cardíaca de las que se expondrán más adelante, se considera como criterio suficiente para el diagnóstico temprano de la neuropatía en mención (19).
Criterios de diagnóstico según el Subcommittee of the Toronto Consensus Panel on Diabetic Neuropathy (20)
El consenso elaborado por el Subcommittee of the Toronto Consensus Panel on Diabetic Neuropathy, recomienda los siguientes criterios para establecer tanto el diagnóstico como la clasificación de la neuropatía autonómica cardiovascular.
La variación de la frecuencia cardíaca durante la respiración profunda y la maniobra de Valsalva, son índices de la función parasimpática, mientras que la hipotensión ortostática, la respuesta de la presión arterial a la maniobra de Valsalva y la distensión muscular isométrica sostenida son indicios de la función simpática. Estas pruebas autonómicas no invasivas deberían usarse para el diagnóstico de la neuropatía autonómica diabética cardiovascular en la práctica clínica, gracias a su sencillez, reproducibilidad y sensibilidad (21).
En la actualidad se utilizan siete parámetros para la detección temprana de la neuropatía autonómica diabética cardiovascular: las tres bandas de frecuencia de análisis espectral (muy baja frecuencia, baja frecuencia y alta frecuencia) más las pruebas de Ewing (incluida la prueba de hipotensión ortostática). De ahí que sea posible confirmar el diagnóstico de dicha entidad cuando al menos tres de las siete pruebas mencionadas resultan anormales, con una especificidad del 100%; cuando sólo dos son anormales, es posible hablar de neuropatía autonómica diabética cardiovascular incipiente, cuyo diagnóstico posee una especificidad del 98% (20).
Pruebas de Ewing
Dentro de las cinco pruebas descritas tradicionalmente por Ewing, tres son recomendadas por la American Diabetes Association y la American Academy of Neurology para el diagnóstico de neuropatía autonómica diabética cardiovascular en pacientes con diabetes mellitus tipo 2 justo cuando se confirma esta enfermedad y en pacientes con diabetes mellitus tipo 1 cinco anos después de haber sido diagnosticada. Las tres pruebas recomendadas son la prueba de respiración profunda, la maniobra de Valsalva y la prueba ortostática. Después de la primera evaluación, estos exámenes deben realizarse anualmente. La especificidad de estas tres pruebas es superior al 91% y su sensibilidad oscila entre 93% y 98% (20).
El test de Holter
Hoy día los equipos de Holter incorporan el análisis sistematizado de la variabilidad RR y el análisis de esta misma mediante el análisis de Fourrier, pudiéndose ya desglosar la actividad autonómica en dominio de tiempo y dominio de frecuencia.
En pacientes con una disfunción vagal predominante, la amplitud de las ondas de alta frecuencia se ve reducida o inexistente, mientras que en una disfunción simpática predominante las amplitudes de alta y baja frecuencia están reducidas. Los casos más avanzados se caracterizan por la ausencia de todas las bandas de frecuencia, además de su alta sensibilidad (99%) y especificidad (100%).
La mayor parte de las modalidades diagnósticas disponibles para determinar la polineuropatía sensitivo-motriz diabética miden principalmente la función de las fibras grandes. Las nuevas técnicas que evalúan la función de las fibras pequenas no son de fácil acceso. La función sudomotora simpática está relacionada con una incapacidad común en pacientes diabéticos y sus anormalidades surgen en una etapa temprana de la diabetes. Uno de los factores de riesgo más reconocidos en la úlcera de pie en pacientes diabéticos, es la transpiración excesiva en esta zona. Recientemente, el Neuropad®, un parche adhesivo capaz de detectar la transpiración por medio del cambio de color, ha sido propuesto como una prueba económica, fácil y práctica para la evaluación de la función sudomotora en el pie. Este parche corresponde a una herramienta de diagnóstico confiable tanto para determinar la neuropatía autonómica diabética cardiovascular como para determinar la polineuropatía diabética sensitivomotriz, aunque con una exactitud moderada. Extender el tiempo de observación a quince minutos fue de gran utilidad para el diagnóstico.
Es indispensable tener en cuenta los factores que pueden alterar esta prueba (uso de betabloqueadores, diuréticos, antidepresivos tricíclicos, anticonvulsivantes, entre otros), y la presencia de cualquier enfermedad cardiovascular a excepción de la hipertensión, como de otra enfermedad detectada como claudicación intermitente, ausencia del pulso tibial posterior o úlceras isquémicas en los pies.
Dada la limitada sensibilidad de la prueba de hipotensión postural al igual que la limitada especificidad del Neuropad® como prueba para detectar la neuropatía autonómica diabética cardiovascular, se comprobó que el uso concomitante de éstos permite obtener mayor información respecto a la función simpática.
Tamización
Se sugiere la tamización en todos los pacientes con diabetes tipo 2 al momento del diagnóstico y todos los pacientes con diabetes tipo 1 cinco anos después del diagnóstico, particularmente en quienes no ha sido posible hacer un control glicémico adecuado (definido por una HbA1c > 7%), o que presenten otras comorbilidades (obesidad, hipertensión, dislipidemia) o evidencia de dano microvascular (1), como también en aquellos con taquicardia inexplicada, hipotensión ortostática, pobre tolerancia al ejercicio o cirugía mayor programada. Sin embargo, se recomienda la realización de una prueba de ortostatismo anual en pacientes diabéticos mayores de 50 anos, independiente de los síntomas (1).
Tratamiento
Al igual que en las otras complicaciones asociadas a la diabetes, en los pacientes con neuropatía autonómica diabética cardiovascular se debe hacer un manejo agresivo de la glicemia, el perfil lipídico, las cifras de presión arterial y la modificación del estilo de vida (disminución de peso, inicio de la actividad física). Particularmente, en pacientes con diabetes mellitus tipo 1, el manejo intensivo de la glicemia se asocia con menor riesgo de aparición de neuropatía autonómica diabética cardiovascular, mientras que en pacientes con el tipo 2, se ha relacionado con una disminución en la progresión de la enfermedad (2, 21). Una vez establecido el diagnóstico de neuropatía autonómica diabética cardiovascular, el manejo depende del tipo específico de trastorno autonómico que tenga el paciente.
Hipotensión ortostática
Buena parte del tratamiento de la hipotensión ortostática se basa en medidas no farmacológicas tales como la elevación de la cabecera de la cama 10° (lo cual disminuye la diuresis nocturna) (22, 23), el uso de medias de gradiente (24, 25), la realización de los cambios de posición de manera gradual, el inicio de actividad física con ejercicios isotónicos, el aprendizaje de maniobras "abortivas" de los síntomas (cruzar las piernas, agacharse, tensionar los músculos) (23, 26) y el aumento del consumo de agua y sal (aproximadamente dos a tres litros de agua por día y hasta 10 g de sal) (26, 27). Adicionalmente, se debe evaluar la necesidad de continuar medicamentos que pueden empeorar el cuadro clínico (antidepresivos tricíclicos, vasodilatadores, diuréticos). En aquellos pacientes en quienes estas medidas no logran el control de los síntomas, se han empleado, con cierto éxito, fármacos como la piridostigmina, inhibidores de la recaptación de serotonina como la sertralina, la somatostatina o la eritropoyetina (en pacientes con hemoglobina por debajo de 11 g/dL). No obstante, probablemente la fludrocortisona (un agonista mineralocorticoide; dosis 0,1-0,3 mg/día), es el medicamento que mayor interés ha generado en el manejo de la hipotensión ortostática, con base en los resultados de estudios pequenos que mostraron mejoría sintomática (28-30). Cabe anotar que la presencia de hipotensión ortostática debe tenerse en cuenta al momento de iniciar un programa de reacondicionamiento físico, pues de lo contrario puede haber accidentes durante el mismo.
Hipotensión perioperatoria
Es fundamental reconocer la presencia de neuropatía autonómica diabética cardiovascular antes de un procedimiento quirúrgico, ya que estos pacientes pueden sufrir episodios de hipotensión significativa que pueden llegar a ser de muy difícil manejo. Previo al procedimiento, se recomienda hacer una infusión de solución salina de 1.000 mL para llenar el lecho vascular siempre y cuando no existan contraindicaciones para ello. Durante el procedimiento quirúrgico debe evitarse el uso de vasodilatadores y la hipotermia (para lo cual se recomienda la utilización de marcas térmicas, debido a que la hipotermia disminuye el metabolismo de los fármacos y potencia sus efectos a nivel vascular). Si no hay mejoría se recomienda usar vasopresores (ya sea prequirúrgicamente mediante el empleo de midodrina o en el intraoperatorio con el uso de efedrina y pseudoefedrina).Vale la pena resaltar que, en algunos casos, la bradicardia muestra una respuesta mínima al uso de atropina, por lo cual se debe utilizar adrenalina (13). En cuanto a los fármacos anestésicos, aun no hay información suficiente como para definir los efectos hemodinámicos de uno u otro fármaco, por lo cual no existe evidencia que indique el anestésico de elección que permita una mayor estabilidad hemodinámica (12).
Taquicardia sinusal inapropiada
El manejo se hace con aumento de la ingesta hídrica y del consumo de sal; se pueden usar la fludrocortisona y los vasopresores descritos anteriormente y dar un buen entrenamiento con ejercicio progresivo. En la actualidad está en evaluación el uso de ivabradina, que parece controlar los síntomas de forma adecuada.
Intolerancia al ejercicio
Todo lo descrito previamente más un programa de rehabilitación cardiovascular para reacondicionar el corazón al ejercicio.
Como alternativa terapéutica, hoy está en uso el ácido alfa lipoico –también conocido como ácido tióctico– para el tratamiento de la neuropatía autonómica diabética cardiovascular, y se cuenta con algunos trabajos iniciales que han demostrado que puede estabilizar la enfermedad y evitar que ésta progrese (31). En el estudio DEKAN, una investigación multicéntrica, aleatorizada, controlada, de cuatro meses de duración, se evaluó la seguridad y la eficacia del tratamiento con ácido alfa lipoico en pacientes diabéticos no insulinodependientes con neuropatía autonómica diabética cardiovascular (32), y se encontró que éste es bien tolerado, reduce los síntomas autonómicos y mejora significativamente la variabilidad de la frecuencia cardíaca en esta población.
Conclusiones
Con el mayor entendimiento de los mecanismos fisiopatológicos subyacentes y de la epidemiología, el número de pacientes a quienes se les detecta neuropatía autonómica diabética cardiovascular va en aumento. Se espera que esto permita elaborar un esquema terapéutico adecuado, con el fin de evitar complicaciones y a su vez mejorar el control glicémico, limitando el dano a otros órganos.
CONFLICTO DE INTERESES: los autores manifiestan no tener conflictos de interés.
Bibliografía
1. Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev. 2011. [ Links ]
2. Pop-Busui R, Low PA, Waberski BH, et al. Effects of prior intensive insulin therapy on cardiac autonomic nervous system function in type 1 diabetes mellitus: the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications study (DCCT/EDIC). Circulation 2009; 119: 2886-93. [ Links ]
3. Low PA, Benrud-Larson LM, Sletten DM, et al. Autonomic symptoms and diabetic neuropathy: a population-based study. Diabetes Care 2004; 27: 2942-7. [ Links ]
4. Ziegler D, Gries FA, Muhlen H, Rathmann W, Spuler M, Lessmann F. Prevalence and clinical correlates of cardiovascular autonomic and peripheral diabetic neuropathy in patients attending diabetes centers. The Diacan Multicenter Study Group. Diabete & Metabolisme 1993; 19: 143-51. [ Links ]
5. Valensi P, Paries J, Attali JR. Cardiac autonomic neuropathy in diabetic patients: influence of diabetes duration, obesity, and microangiopathic complications--the French multicenter study. Metabolism 2003; 52: 815-20. [ Links ]
6. Ayad F, Belhadj M, Paries J, Attali JR, Valensi P. Association between cardiac autonomic neuropathy and hypertension and its potential influence on diabetic complications. Diabet Med. 2010; 27: 804-11. [ Links ]
7. Laitinen T, Lindstrom J, Eriksson J, et al. Cardiovascular autonomic dysfunction is associated with central obesity in persons with impaired glucose tolerance. Diabet Med. 2011; 28: 699-704. [ Links ]
8. Maser RE, Mitchell BD, Vinik AI, Freeman R. The association between cardiovascular autonomic neuropathy and mortality in individuals with diabetes: a meta-analysis. Diabetes Care 2003; 26: 1895-901. [ Links ]
9. O'Brien IA, McFadden JP, Corrall RJ. The influence of autonomic neuropathy on mortality in insulin-dependent diabetes. The Quarterly Journal of Medicine 1991; 79: 495-502. [ Links ]
10. Ewing DJ, Campbell IW, Clarke BF. Assessment of cardiovascular effects in diabetic autonomic neuropathy and prognostic implications. Annals of Internal Medicine 1980; 92: 308-11. [ Links ]
11. Pop-Busui R. Cardiac autonomic neuropathy in diabetes: a clinical perspective. Diabetes Care 2010; 33: 434-41. [ Links ]
12. Kadoi Y. Anesthetic considerations in diabetic patients. Part I: preoperative considerations of patients with diabetes mellitus. Journal of Anesthesia 2010; 24: 739-47. [ Links ]
13. Oakley I, Emond L. Diabetic cardiac autonomic neuropathy and anesthetic management: review of the literature. AANA Journal 2011; 79: 473-9. [ Links ]
14. Vinik AI, Maser RE, Mitchell BD, Freeman R. Diabetic autonomic neuropathy. Diabetes Care 2003; 26: 1553-79. [ Links ]
15. Kempler P, Tesfaye S, Chaturvedi N, et al. Blood pressure response to standing in the diagnosis of autonomic neuropathy: the EURODIAB IDDM Complications Study. Arch Physiol Biochem. 2001; 109: 215-22. [ Links ]
16. Voulgari C, Moyssakis I, Perrea D, Kyriaki D, Katsilambros N, Tentolouris N. The association between the spatial QRS-T angle with cardiac autonomic neuropathy in subjects with Type 2 diabetes mellitus. Diabet Med. 2010; 27: 1420-9. [ Links ]
17. Pop-Busui R, Evans GW, Gerstein HC, et al. Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Diabetes Care 2010; 33: 1578-84. [ Links ]
18. Prince CT, Secrest AM, Mackey RH, Arena VC, Kingsley LA, Orchard TJ. Cardiovascular autonomic neuropathy, HDL cholesterol, and smoking correlate with arterial stiffness markers determined 18 years later in type 1 diabetes. Diabetes Care 2010; 33: 652-7. [ Links ]
19. Scholte AJ, Schuijf JD, Delgado V, et al. Cardiac autonomic neuropathy in patients with diabetes and no symptoms of coronary artery disease: comparison of 123I-metaiodobenzylguanidine myocardial scintigraphy and heart rate variability. European Journal of Nuclear Medicine and Molecular Imaging 2010; 37: 1698-705. [ Links ]
20. Ewing DJ, Martyn CN, Young RJ, Clarke BF. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care 1985; 8: 491-8. [ Links ]
21. The effect of intensive diabetes therapy on measures of autonomic nervous system function in the Diabetes Control and Complications Trial (DCCT). Diabetologia 1998; 41: 416-23. [ Links ]
22. Omboni S, Smit AA, van Lieshout JJ, Settels JJ, Langewouters GJ, Wieling W. Mechanisms underlying the impairment in orthostatic tolerance after nocturnal recumbency in patients with autonomic failure. Clinical Science (London, England: 1979) 2001; 101: 609-18. [ Links ]
23. van Lieshout JJ, ten Harkel AD, Wieling W. Physical manoeuvres for combating orthostatic dizziness in autonomic failure. Lancet 1992; 339: 897-8. [ Links ]
24. Podoleanu C, Maggi R, Brignole M, et al. Lower limb and abdominal compression bandages prevent progressive orthostatic hypotension in elderly persons: a randomized single-blind controlled study. Journal of the American College of Cardiology 2006; 48: 1425-32. [ Links ]
25. Smit AA, Wieling W, Fujimura J, et al. Use of lower abdominal compression to combat orthostatic hypotension in patients with autonomic dysfunction. Clinical autonomic research: official Journal of the Clinical Autonomic Research Society 2004; 14: 167-75. [ Links ]
26. Moya A, Sutton R, Ammirati F, et al. Guidelines for the diagnosis and management of syncope (version 2009). European Heart Journal 2009; 30: 2631-71. [ Links ]
27. Claydon VE, Hainsworth R. Salt supplementation improves orthostatic cerebral and peripheral vascular control in patients with syncope. Hypertension 2004; 43: 809-13. [ Links ]
28. Finke J, Sagemuller I. [Fludrocortisone in the treatment of orthostatic hypotension: ophthalmodynamography during standing(author's transl)]. Deutsche Medizinische Wochenschrift (1946) 1975; 100: 1790-2. [ Links ]
29. Ten Harkel AD, Van Lieshout JJ, Wieling W. Treatment of orthostatic hypotension with sleeping in the head-up tilt position, alone and in combination with fludrocortisone. Journal of Internal Medicine 1992; 232: 139-45. [ Links ]
30. van Lieshout JJ, ten Harkel AD, Wieling W. Fludrocortisone and sleeping in the head-up position limit the postural decrease in cardiac output in autonomic failure. Clinical autonomic research : official Journal of the Clinical Autonomic Research Society 2000; 10: 35-42. [ Links ]
31. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review. Treatments in Endocrinology 2004; 3: 173-89. [ Links ]
32. Ziegler D, Schatz H, Conrad F, Gries FA, Ulrich H, Reichel G. Effects of treatment with the antioxidant alpha-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). Deutsche Kardiale Autonome Neuropathie. Diabetes Care 1997; 20: 369-73. [ Links ]













