Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cardiología
versión impresa ISSN 0120-5633
Rev. Colomb. Cardiol. vol.20 no.2 Bogota mar./abr. 2013
Instituciones: Semillero de investigación en Medicina Interna MEDICAL, Universidad de Caldas, Servicio de Cirugía Cardiovascular, Hospital Militar Nueva Granada y Servicio de Cirugía Cardiovascular, Fundación Santa Fe de Bogotá.
(1) Semillero de Investigación en Medicina Interna. Universidad de Caldas. Manizales, Colombia.
(2) Hospital Militar Central, Bogotá, Colombia.
(3) Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(4) Universidad Militar Nueva Granada. Bogotá, Colombia.
Correspondencia: Dr. Camilo Alvarado Castro. Apartado aéreo: 275 Manizales, Caldas. Correo electrónico: camilo.alvarado5@gmail.com
Recibido: 18/05/2012. Aceptado: 04/02/2013.
La disección aórtica clásica es el síndrome aórtico más habitual. El común denominador de los síndromes aórticos agudos es la disrupción de la capa media, la presencia de hemorragia dentro de la pared (hematoma intramural), la separación extensa y progresiva de las capas en forma longitudinal (disección aórtica) y la disrupción de la pared debido a una placa ateromatosa que se ulcera (úlcera aterosclerótica penetrante). Los factores de riesgo asociados con mayor frecuencia son la hipertensión arterial (72%), la aterosclerosis (31%) y el antecedente de cirugía cardíaca previa. La clasificación de la disección aórtica aguda depende del sitio anatómico donde se encuentra el daño intimal y del segmento aórtico afectado. Las dos clasificaciones más usadas son los sistemas de DeBakey y Standford. El síntoma más común es el dolor torácico. En diferentes algoritmos se han usado la combinación de signos clínicos, herramientas no imaginológicas (electrocardiograma, los biomarcadores y la radiografía de tórax), y técnicas diagnósticas como el ecocardiograma, la tomografía axial computarizada, la aortografía y la resonancia magnética nuclear. Los síndromes aórticos agudos que comprometen la aorta ascendente son emergencias quirúrgicas.
Conclusiones: la disección aórtica continúa siendo una enfermedad vascular catastrófica, a pesar del manejo con técnicas quirúrgicas y el advenimiento de nuevas intervenciones endovasculares. La sospecha clínica y la consulta al especialista en cirugía cardiovascular son pilares fundamentales en el abordaje terapéutico temprano de los pacientes afectados por los síndromes aórticos agudos.
Palabras clave: disección de aorta, aneurisma torácico, arco aórtico, taponamiento cardiaco, hipertensión arterial.
Classic aortic dissection is the most common aortic syndrome. The common denominator of acute aortic syndromes is the disruption of the middle layer, the presence of hemorrhage within the aortic wall (intramural hematoma), longitudinal extensive and progressive separation of the layers (aortic dissection) and disruption of the wall due to ulceration of an atheromatous plaque (penetrating atheromatous ulcer). The risk factors most frequently associated with aortic dissection are hypertension (72%), atherosclerosis (31%) and a history of previous cardiac surgery. The classification of acute aortic dissection depends on the anatomical site of the intimal damage and the affected aortic segment. The two most widely used classifications are the DeBakey and Stanford systems. The most common symptom is chest pain. The combination of clinical signs, non-imaginological tools (electrocardiogram, biomarkers and chest radiography), and diagnostic techniques such as echocardiography, computed tomography, aortography and MRI have been used in different algorithms. Acute aortic syndromes that involve the ascending aorta are surgical emergencies.
Conclusions: aortic dissection remains a catastrophic vascular disease, despite surgical management techniques and the advent of new endovascular interventions. Clinical suspicion and consultation with a cardiovascular surgeon are cornerstones in the early therapeutic approach for patients affected by acute aortic syndromes.
Keywords: aortic dissection, thoracic aneurysm, aortic arch, cardiac tamponade, arterial hypertension.
Introducción
Los síndromes aórticos agudos constituyen un reto importante en la práctica médica del servicio de emergencias. La disección aórtica aguda, la úlcera aterosclerótica penetrante y el hematoma intramural, son un grupo destacable de patologías de origen vascular. Los estudios poblacionales sugieren que la incidencia de disección aguda se encuentra en los rangos de 2 a 3,5 por cada 100.000 personas en el año, correlacionándose con aproximadamente 6.000 a 10.000 casos nuevos anuales en los Estados Unidos (1, 2). Su pico de incidencia se observa entre la sexta y la séptima décadas de la vida y se asocia, en gran porcentaje de casos, con hipertensión arterial, desórdenes del tejido conectivo (síndrome de Ehlers – Danlos y síndrome de Marfan principalmente), consumo crónico de cocaína y trauma toracoabdominal (3). El dolor es el síntoma más común. Las posibles intervenciones médicas o quirúrgicas y su impacto en el pronóstico, implican necesariamente un abordaje diagnóstico adecuado que incluya estratificación, estudios imaginológicos y disponibilidad de recursos y de expertos en Cardiología y Cirugía cardiovascular (4).
Definiciones
El común denominador de los síndromes aórticos agudos es la disrupción de la capa media de la aorta, con presencia de hemorragia dentro de la pared (hematoma intramural), separación extensa y progresiva de las capas en forma longitudinal (disección aórtica) o disrupción que compromete todo el espesor de la pared debido a una placa ateromatosa preexistente que se ulcera (úlcera aterosclerótica penetrante). La disección aórtica clásica es el síndrome aórtico más característica, pues es la responsable del 80% al 90% de todos los síndromes aórticos agudos (5). Tanto el hematoma intramural como la úlcera aterosclerótica se consideran precursores o variantes de la disección aórtica y se observan en 10% a 20% de los casos (6).
Fisiopatología
La arteria aorta contiene colágeno, elastina y células musculares que contribuyen a la integridad estructural, la distensibilidad y el tono vascular, respectivamente. A medida que avanza la edad, los cambios degenerativos conllevan daño en los tejidos elásticos y pérdida del músculo liso. La enfermedad puede estar relacionada con la ruptura primaria de la íntima de la arteria, donde la presión pulsátil del flujo sanguíneo induce la separación longitudinal de las capas arteriales. También se sugiere como evento inicial, la ruptura de los vasa vasorum con inicio de una hemorragia intramural, la subsecuente disrupción de la capa íntima y la formación de la disección. La mayoría de estas disecciones se propaga en dirección anterógrada, lo cual genera síndromes de mala perfusión distal, pero en ocasiones lo puede hacer en forma retrógrada y causar disfunción de la válvula aórtica o infarto agudo del miocardio por afectación del seno de Valsalva de la arteria coronaria derecha (7). El aumento de la presión dentro del lumen falso, induce distensión y colapso del lumen verdadero, reducción de su calibre e hipoperfusión distal (8).
Epidemiología
Los estudios más importantes sobre el comportamiento epidemiológico de los síndromes aórticos agudos se derivan del registro IRAD (International Registry of Acute Aortic Dissection). Todos ellos apuntan a la diferencia en el comportamiento de los factores de riesgo entre las distintas poblaciones que se estudian. El conocimiento de la incidencia de disección aórtica en la población general es limitado. Diversos estudios señalan una incidencia de 2,6 a 3,5 casos por 100.000 pacientes (9). La incidencia global estimada es de 5 a 30 casos por millón por año. Se ha observado un predominio del sexo masculino con una razón hombre/mujer de 2:1. En cuanto a la edad de presentación se ha observado un pico de incidencia entre la sexta y la séptima décadas.
Condiciones de riesgo
Los factores de riesgo asociados con mayor frecuencia según el estudio IRAD son la hipertensión arterial en 72%, seguido de los antecedentes de aterosclerosis en 31% y el antecedente de la cirugía cardíaca previa en 18% (Tabla 1). La condición genética de riesgo más asidua es el síndrome de Marfan, en 4%-5% (10). Respecto al embarazo, en 2011 Thallman y colaboradores sugirieron que por sí sólo no constituye una entidad asociada a un riesgo importante; sin embargo cuando la mujer es hipertensa o presenta de base una condición como el síndrome de Marfan, aumenta la posibilidad de disección aórtica tipo A durante el embarazo y de disección aórtica tipo B durante el postparto (11). De otro lado, 4% de las disecciones aórticas tienen un componente iatrogénico relacionado con intervenciones como la cirugía valvular aórtica, el cateterismo y el reemplazo de arco aórtico.

Predictores de la enfermedad
El tipo de disección y la aparición de complicaciones constituyen importantes factores predictores. Los pacientes con disección aórtica tipo A aumentan su tasa de mortalidad entre 1% y 2% durante cada hora, en las primeras 24 a 48 horas de la presentación; si no se realiza tratamiento hasta 50% de los pacientes morirán en la primera semana por complicaciones que incluyen: ruptura, taponamiento cardíaco y valvulopatía aórtica. Los pacientes con disección tipo B no complicada, tienen una tasa de mortalidad de 10% a 30 días. Por el contrario, quienes desarrollan complicaciones como trombosis arterial de piernas, insuficiencia renal, isquemia visceral o rotura contenida, a menudo requieren reparación urgente de la aorta y la tasa de mortalidad es de 20% al día 2 y de 25% a los 30 días. En 2002, Mehta y colaboradores propusieron el papel predictor del ritmo circadiano y los periodos estacionales, en los picos de incidencia de disección aórtica observados en la población. Encontraron mayor incidencia entre las 6:00 y las 12:00 horas y en los primeros meses del año (época de invierno) (12). El hematoma intramural constituye otro importante predictor. Su presencia a nivel de la aorta ascendente se asocia a 50% de mortalidad cuando se compara con otros segmentos aórticos (13). En 2008, Chang y colaboradores, en un estudio en 55 pacientes, sugirieron un papel importante de la falsa luz intravascular y las complicaciones intrahospitalarias. Informaron que el área máxima del lumen falso (MLFA) mayor a 922 mm2 y el compromiso de dos o más ramas arteriales (renales, mesentéricas), se asocian en forma significativa con un número mayor de complicaciones hospitalarias como progresión de la disección, ruptura e isquemia tisular distal (14).
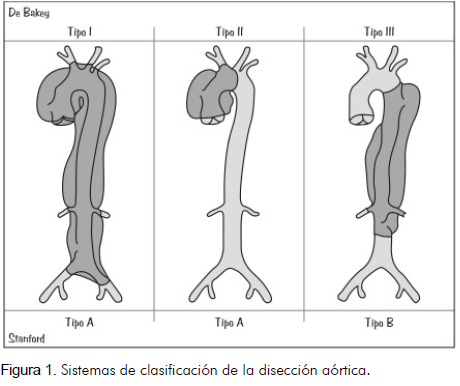
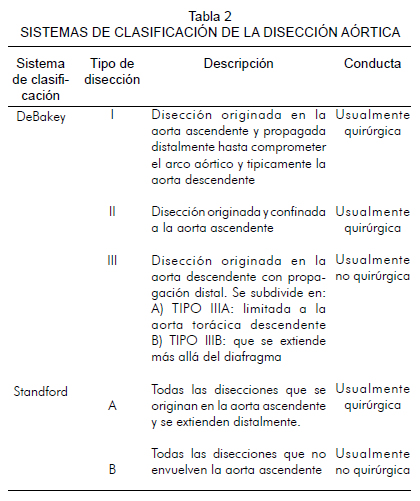
Sistemas de clasificación
La clasificación de la disección aórtica aguda depende del sitio anatómico donde se encuentra el daño intimal y del segmento aórtico afectado por la separación de las capas arteriales. Estas clasificaciones son importantes porque permiten definir manejos y conductas quirúrgicas o no quirúrgicas (1). Las dos clasificaciones más usadas son los sistemas de DeBakey y Standford (Figura 1 y tabla 2).
Manifestaciones clínicas
Los síntomas clínicos más frecuentes se observan en la tabla 3. El síntoma más común es el dolor torácico retroesternal o interescapular, que se da hasta en 96% de los casos. Hagan y colaboradores reportan una prevalencia de 84,8% con localización torácica en la mayoría de casos de disección tipo A y localización abdominal en la disección tipo B. Se observó que típicamente presentaba comienzo agudo (64,4%), tenía carácter lancinante o transfixiante (72,7%) e irradiación hacia los miembros inferiores (2). Después del dolor, el síntoma que se observa con más frecuencia es el síncope (33%) (22). Éste se asocia con mayor mortalidad hospitalaria y complicaciones como: taponamiento cardíaco, disección aórtica proximal y accidente cerebrovascular (15).

Diagnóstico
Es indispensable contar en el nivel de atención con ayudas imaginológicas que permitan confirmar el diagnóstico, determinar la clasificación, la localización del daño y la extensión de la disección aórtica. En diferentes algoritmos se han usado estratégicamente la combinación de signos clínicos, herramientas no imaginológicas como el electrocardiograma, los biomarcadores y la radiografía de tórax, y técnicas diagnósticas de imagen como el ecocardiograma, la tomografía axial computarizada, la aortografía y la resonancia magnética nuclear (16).
Electrocardiografía
Los cambios electrocardiográficos asociados a disección aórtica se enumeran en la tabla 3.
Radiografía de tórax
El 18% de los pacientes puede tener una radiografía de tórax anormal y los cambios se dan habitualmente cuando hay compromiso de la aorta ascendente (17). Los hallazgos que indican disección en la radiografía simple de tórax son: ensanchamiento mediastinal (50%), configuración anormal de la aorta (66%), ensanchamiento del botón aórtico que sobrepasa la subclavia izquierda, engrosamiento de la pared aórtica y separación del calcio en la íntima del borde externo de la sombra de la aorta mayor de 5 mm, doble sombra aórtica, hemotórax, desviación de la tráquea, depresión del bronquio principal izquierdo y desviación esofágica (18).
Biomarcadores
Estos se enumeran en la tabla 4. El cuadro hemático puede presentar una ligera leucocitosis, con disminución en la hemoglobina y el hematocrito. El compromiso de las arterias renales suele generar elevación del nitrógeno ureico y la creatinina, además de hematuria, oliguria y anuria. Las enzimas cardíacas pueden sugerir isquemia coronaria secundaria al compromiso de los senos de Valsalva. La proteína C reactiva se reconoce como indicador de inflamación vascular y como factor predictor de riesgo cardiovascular. Sus niveles séricos elevados (superiores a 15 mg/dL), se han asociado con complicaciones como derrame pleural e hipoxemia (19).

Ecocardiografía
De todas las modalidades imaginológicas el ultrasonido por ecocardiografía transtorácica (ETT) y transesofágica (ETE), es la herramienta más difundida en pacientes que ingresan al servicio de urgencias en estado de choque y con alta sospecha clínica de disección aórtica aguda. La sensibilidad de la ETT varía de 35% a 80% y la especificidad entre 39% y 96%. Su sensibilidad mejora al evaluar la aorta ascendente (78% a 100%), pero es baja (31% – 55%) cuando se evalúa la aorta descendente. Es un método no invasivo, portátil y fácilmente disponible; permite identificar complicaciones de la válvula aórtica y anormalidades de la motilidad de la pared. Sin embargo, es muy limitado en su capacidad de visualizar la aorta más allá de la raíz debido al tamaño de la ventana acústica y la presencia de configuraciones anatómicas torácicas como el enfisema pulmonar y la obesidad (20).
De otra parte, optimiza la ventana acústica, que es la principal limitante de la ectranstorácica, y proporciona mayor visualización. Su sensibilidad es de 97% a 100% para identificar el flap intimal y de 77% a 87% para identificar el sitio de entrada. También permite detectar dirección del flujo y complicaciones valvulares como regurgitación aórtica y pericárdicas como hemopericardio (21). La ETE está contraindicada en los casos de enfermedad esofágica, várices o tumores y puede no ser tolerada hasta en 3% de los pacientes. Es un método operador-dependiente, requiere sedación, no permite observar la aorta infra-abdominal y tiene un punto ciego a nivel del arco aórtico ascendente distal, características que constituyen sus principales limitaciones.
Tomografía axial computarizada (TAC)
La TAC helicoidal con contraste intravenoso es la prueba diagnóstica más utilizada. Una de sus principales ventajas es la no invasividad. Su sensibilidad es mayor al 90%, con una especificidad por encima del 85%; en los casos de compromiso de la aorta ascendente su sensibilidad disminuye a menos del 80%. Shiga y colaboradores en una revisión de 16 estudios con un total de 1.139 pacientes, encontraron que la TAC helicoidal mostró superioridad en la detección de disección aórtica aguda en pacientes con bajo riesgo para desarrollar la entidad (22).
Resonancia magnética nuclear
Es un método no invasivo, no requiere medio de contraste y provee mejor definición respecto al tipo y la localización de la lesión. Tiene alta sensibilidad y especificidad (cercanas al 100%) para la detección de todos los tipos de disección, excepto para formas muy discretas.
Aortografía
Antes del advenimiento de las nuevas técnicas diagnósticas, el aortograma era considerado como patrón de oro para el diagnóstico de disección aórtica. A pesar de sus limitaciones, su sensibilidad alcanza el 87% y su especificidad varía entre 75% a 94%. Sus ventajas principales tienen que ver con la visualización de valvulopatía aórtica, la presencia de disección de arterias coronarias y la detección de trombosis del lumen falso. Su principal desventaja se relaciona con la poca disponibilidad, la utilización de catéter, el uso de agentes de contraste nefrotóxicos y su alto costo (23).
No existe un consenso con relación a la ayuda imaginológica en los casos de disección aórtica. Se considera como método ideal aquel que no es invasivo, que no utiliza medios de contraste, que está disponible en la cabecera del paciente, que muestra hallazgos en tiempo real y que es favorable respecto a los costos para el sistema de salud. Cada decisión y cada protocolo se adaptan a la situación específica y a la disponibilidad de recursos. Por ejemplo, en pacientes con alta sospecha de disección aórtica aguda e inestables desde el punto vista hemodinámico, se recomienda el uso del ultrasonido por ecocardiografía antes de someterlos a cirugía de urgencia (24). Por el contrario, en pacientes con disección aórtica crónica se recomienda la resonancia magnética nuclear.
Tratamiento
La mayoría de las recomendaciones se encuentran en nivel de evidencia C dada la dificultad para realizar estudios aleatorizados controlados. Los síndromes aórticos agudos que comprometen la aorta ascendente (tipo A) son emergencias quirúrgicas; por el contrario, si comprometen la aorta descendente (tipo B) la conducta es médica y conservadora, siempre y cuando no se encuentren asociados a complicaciones como mala perfusión distal, ruptura inminente, hipertensión no controlable o dolor intratable (25). En la actualidad se están desarrollando técnicas de reparación endovascular con resultados prometedores; de hecho, se ha incluido a la disección tipo B complicada y no complicada como indicación de corrección mediante técnica endovascular (26). Todo apunta a que el tratamiento endovascular disminuye en forma significativa las complicaciones neurológicas, la estancia intrahospitalaria y la morbimortalidad al año de la intervención (27).
Manejo médico conservador
Las principales medidas generales tienen un nivel de evidencia C e incluyen: reposo absoluto, administración de oxígeno y monitorización de signos vitales, principalmente presión arterial. La meta de reducción de la presión arterial sistólica se ubica entre 100 y 120 mm Hg con frecuencia cardíaca entre 60 y 80 pulsaciones por minuto. Los principales medicamentos y las dosis se observan en la tabla 5. Se recomienda la administración de medicamentos analgésicos opiáceos (morfina, meperidina), dados sus efectos benéficos en la disminución de la secreción de catecolaminas, presión arterial y taquicardia (28).
La indicación de terapia médica en disección aórtica aguda y crónica tipo B sin complicaciones, históricamente ha sido recomendada en la mayoría de publicaciones, debido a que las técnicas quirúrgicas se asocian con una alta mortalidad intrahospitalaria, que en algunos estudios supera el 30%. Adicionalmente, el riesgo de complicaciones postoperatorias como lesión de la médula espinal e isquemia mesentérica, oscila entre 14% y 67% (2).
Manejo quirúrgico
La mortalidad preoperatoria es de 3% en pacientes estables sometidos a intervención temprana y llega a 30% en pacientes donde la intervención es tardía y compleja. En todos los casos de disección se recomienda la hipotermia profunda y el arresto circulatorio. Estos datos sugieren la importancia de un diagnóstico precoz para evitar la progresión y la aparición de complicaciones.
Protección cerebral
La neuroprotección clásica se fundamentaba en la reducción del metabolismo cerebral; incluye el uso de hipotermia, anestésicos, corticoides, calcioantagonistas y magnesio. La hipotermia profunda se emplea de forma rutinaria en la protección cerebral en todos los casos de cirugía relacionada con disección de la arteria aorta, asociada al paro circulatorio global con o sin perfusión cerebral anterógrada o retrógrada. Para realizar un paro circulatorio se debe reducir la temperatura nasofaríngea a 17ºC-18ºC y la temperatura rectal a 20ºC. Después de alcanzar las temperaturas deseadas, se detiene la bomba arterial, se clampea la línea arterial, al mismo tiempo que se desciende la altura de la cabeza del paciente para evitar una embolia gaseosa (posición de Trendelemburg). La hipotermia durante el paro cardiocirculatorio está relacionada con la seguridad del procedimiento. A 28°C la fase de seguridad es de 9 a 15 minutos, y a 15°C es de aproximadamente una hora.
Manejo quirúrgico en la disección tipo A
La disección aórtica tipo A es una emergencia quirúrgica, y una vez diagnosticada debe realizarse la corrección de inmediato (Clase I, nivel de evidencia C). La mortalidad de la intervención oscila entre 12% y 36%. La cirugía se realiza con circulación extracorpórea o puente cardiopulmonar, preferiblemente con perfusión cerebral anterógrada.
La vía de elección para la canulación arterial es la arteria femoral o la arteria axilar; para el retorno venoso se canula la aurícula derecha si se interviene la aorta ascendente o se canulan ambas venas cavas si se interviene el cayado aórtico. Se coloca un catéter de descompresión en la vena pulmonar superior derecha hacia el ventrículo izquierdo y se realiza cardioplejía anterógrada a través de los ostium coronarios, y retrógrada a través del seno coronario. Los cinco aspectos básicos de la intervención incluyen: abordaje por esternotomía mediana, extirpación del segmento aórtico ascendente afectado por la disección, cierre de la falsa luz en la porción inicial del cayado aórtico mediante sutura continua de polipropileno, reparación o reemplazo de la válvula aórtica, si está comprometida, y reconstrucción de la aorta ascendente mediante la interposición de un injerto de dacrón suturado en el extremo proximal a la unión sinotubular y en el extremo distal al cayado mediante suturas de polipropileno. Cuando se presenta compromiso de la válvula aórtica y está indicado el reemplazo de la misma, la reconstrucción se realiza desde el anillo valvular, mediante un injerto valvulado y con reimplante de coronarias.
Manejo quirúrgico de la disección aórtica tipo B
La intervención quirúrgica está indicada sólo en caso de complicaciones como: ruptura, isquemia de órganos distales, dolor refractario, hipertensión no controlada, dilatación progresiva de la falsa luz y otras condiciones que comprometen la vida del paciente. Aquellos con disección aórtica tipo B, inestables y con complicaciones como isquemia renal o mesentérica, tienen una tasa de mortalidad operatoria de 50% y 88% respectivamente.
Tradicionalmente, la sustitución quirúrgica del segmento aórtico enfermo se lleva a cabo a través de toracotomía posterolateral izquierda con reconstrucción a través de un reemplazo con prótesis del segmento que contiene el punto de entrada o flap de la íntima donde se origina el flujo del falso lumen, en condiciones intraoperatorias que incluyen ventilación selectiva pulmonar, heparinización completa, circulación extracorpórea, hipotermia profunda, drenaje de líquido cefalorraquídeo y paro circulatorio en un intento por minimizar la morbilidad (accidente cerebrovascular, complicaciones neurológicas) y la mortalidad asociada (29). Las técnicas de canulación utilizadas son la derivación femoro-femoral o by-pass veno-arterial, donde se coloca una cánula venosa a través de la vena femoral hasta la aurícula derecha y la sangre retorna al paciente tras realizar el intercambio gaseoso, por la arteria femoral; en la derivación izquierda o by-pass izquierdo se canula la arteria femoral y la aurícula izquierda, la sangre es drenada desde la aurícula izquierda, y la parte distal a la pinza de oclusión aórtica es perfundida de forma retrógrada.
La elección terapéutica en pacientes controlados médicamente y que progresan a un estado de disección aórtica crónica tipo B, se ubica en el terreno de la controversia médica. En 1970 Daily y colaboradores no encontraron diferencias significativas entre los pacientes manejados con terapia conservadora y los intervenidos mediante cirugía. Es por ello que en muchas regiones se reserva la cirugía abierta sólo en caso de complicaciones.
Complicaciones postoperatorias
Las complicaciones hemorrágicas y neurológicas son los problemas postoperatorios más frecuentes. La paraplejía y la paraparesia son complicaciones influenciadas por factores como la duración del clampeo de aorta (0% de incidencia si es menor de 14 min, 100% de incidencia si es mayor de 1 hora), la temperatura, el nivel del clampeo (infrarrenal: 0,1%, diafragmático 25% e istmo aórtico 95%), el clampeo de subclavia izquierda, la distancia entre los clamps y la presencia de circulación colateral a la médula espinal. La aparición de accidente cerebrovascular como complicación, está relacionada con la edad, el tiempo de paro cardiocirculatorio y el tiempo de colocación del bypass cardiopulmonar. Otras complicaciones importantes incluyen: hemorragia, disfunción de los injertos de sustitución aórtica, redisección y ruptura de la luz falsa, dilatación progresiva del segmento aórtico, cardiopatía isquémica, falla cardiaca y arritmias, falla renal aguda e insuficiencia respiratoria.
Conclusiones
La disección aórtica aguda, la úlcera aterosclerótica penetrante y el hematoma intramural, constituyen un importante grupo de entidades clínicas asociadas a una importante tasa de morbi-mortalidad en pacientes que ingresan al servicio de urgencias. La disponibilidad de recursos en técnicas diagnósticas imaginológicas, permite mejorar el pronóstico y el seguimiento a largo plazo; de hecho, define la conducta más apropiada en el contexto de la localización de la lesión, la edad y las comorbilidades asociadas. Al día de hoy, la disección aórtica continúa siendo una enfermedad vascular catastrófica, a pesar del manejo con técnicas quirúrgicas y el advenimiento de nuevas intervenciones endovasculares, de ahí que la sospecha clínica y la consulta al especialista en cirugía cardiovascular sean pilares fundamentales en el abordaje terapéutico temprano de los pacientes afectados por los síndromes aórticos agudos.
Bibliografía
1. Nienaber C, Powell J. Management of acute aortic syndromes. Eur Heart J 2011. doi:10.1093/eurheartj/ehr186. [ Links ]
2. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA. 2000; 283: 897-903. [ Links ]
3. Icen H, Cristoph Nienaber C. Tratamiento de los síndromes aórticos agudos. Rev Esp Cardiol. 2007; 60 (5): 526-41. [ Links ]
4. Trimarchi S, Nienaber CA, Rampoldi V, Myrmel T, Suzuki T, Bossone E, et al. Role and results of surgery in acute type B aortic dissection: insights from the International Registry of Acute Aortic Dissection (IRAD). Circulation. 2006; 114: 357e64. [ Links ]
5. Parish LM, Gorman III JH, Kahn S, et al. Aortic size in acute type A dissection: Implications for preventative ascending aortic replacement. Eur J Cardiothorac Surg. 2009; 35: 941. [ Links ]
6. Ganaha F, Miller DC, Sugimoto K, Do YS, Minamiguchi H, Saito H, et al. Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer: a clinical and radiological analysis. Circulation. 2002; 106: 342-8. [ Links ]
7. Collins JS, Evangelista A, Nienaber CA, et al. Differences in clinical presentation, management, and outcomes of acute type A aortic dissection in patients with and without previous cardiac surgery. Circulation. 2004; 110 (Suppl II): II-237. [ Links ]
8. Tsai TT, Evangelista A, Nienaber CA, Myrmel T, Meinhardt G, Cooper JV, et al. Partial thrombosis of the false lumen in patients with acute type B aortic dissection. N Engl J Med. 2007; 357: 349e59. [ Links ]
9. Suzuki T, Mehta RH, Ince H, Nagai R, Sakomura Y, Weber F, et al. Clinical Profiles and Outcomes of Acute Type B Aortic Dissection in the Current Era: Lessons From the International Registry of Aortic Dissection (IRAD). Circulation. 2003; 108: II312-II317. [ Links ]
10. Tsai T, Nienaber C, Eagle K. Acute aortic syndromes. Circulation 2005;112: 3802-3813. [ Links ]
11. Thalmann M, Sodeck Gottfriend, Domanovits H, Grassberger M. Acute type A aortic dissection and pregnancy; a population based study. Eur J Cardiothorac Surg. 2011. Article in press. [ Links ]
12. Mehta RH, Manfredini R, Hassan F, et al. Chronobiological patterns of acute aortic dissection. Circulation. 2002; 106: 1110-1115. [ Links ]
13. Evangelista A, Mukherjee D, Mehta RH, O'Gara PT, Fattori R, Cooper JV, et al. Acute intramural hematoma of the aorta: a mystery in evolution. Circulation 2005; 111: 1063e70. [ Links ]
14. Chang CP, Liu JC, Liou YM. The role of false lumen size in prediction of in-Hospital complications after acute type B aortic dissection. J Am Coll Cardiol. 2008; 52 (14). [ Links ]
15. Park SW, Hutchison S, Mehta RH, Isselbacher EM, Cooper JV, Fang J, et al. Association of painless acute aortic dissection with increased mortality. Mayo Clin Proc. 2004; 79: 1252e7 [ Links ]
16. Nallamothu BK, Mehta RH, Saint S, Llovet A, Bossone E, Cooper JV, et al. Syncope in acute aortic dissection: diagnostic, prognostic, and clinical implications. Am J Med. 2002; 113: 468e71. [ Links ]
17. Earnest F, Muhm JR, Sheedy PF. Roentgenographic findings in thoracic aortic dissection. Mayo Clin Proc. 1979; 54: 43. [ Links ]
18. Calderón J, Carvajal C. Disección aórtica. Cuidado Crítico cardiovascular. Sociedad Colombiana de Cardiología y Cirugía Cardiovascular. Bogota: 2004. p. 295-307. [ Links ]
19. Sugano Y, Anzai T, Yoshikawa T, Satoh T, Iwanaga S, Hayashi T, et al. Serum C reactive protein elevation predicts poor clinical outcome in patients with distal type acute aortic dissection: association with the occurrence of oxygenation impairment. Int J Cardiol. 2005; 102: 39-45. [ Links ]
20. Scott CH, Keane MG, Ferrari VA. Echocardiographic evaluation of the thoracic aorta. Semin Roentgenol 2001; 36: 325-333. [ Links ]
21. Shiga T, Wajima Z, Apfel C, et al. Diagnostic accuracy of transesophageal echocardiography, helical computed tomography, and magnetic resonance imaging for suspected thoracic aortic disease: systematic review and metaanalysis. Arch Intern Med. 2006; 166: 1350-1356. [ Links ]
22. Hines G, Dracea C, Katz D. Diagnosis and management of acute type A aortic dissection. Cardiology in Review. 2011; 19: 226-232. [ Links ]
23. Tsai TT, Nienaber CA, Eagle KA. Acute aortic syndromes. Circulation 2005; 112: 3802-3813. [ Links ]
24. Eggebrecht H, Nienaber CA, Neuhauser M et al. Endovascular stentgraft placement in aortic dissection: a meta-analysis. Eur Heart J. 2005; 4: 489-98. [ Links ]
25. Svensson LG, Kouchoukos NT, Miller DC, Bavaria JE, Coselli JS, Curi MA, et al. Society of Thoracic Surgeons Endovascular Surgery Task Force. Expert consensus document on the treatment of descending thoracic aortic disease using endovascular stent-grafts. Ann Thorac Surg. 2008; 85: 1-41. [ Links ]
26. Liu JC, Zhang JZ, Yang J, Zuo J, Zhang JB, Yu SQ, et al. Combined interventional and surgical treatment for acute aortic type A dissection. Cardiovasc Intervent Radiol. 2008; 31: 745-750. [ Links ]
27. Parker JD, Golledge J. Outcome of endovascular treatment of acute type B aortic dissection. Ann Thorac Surg. 2008; 86: 1707-1712. [ Links ]
28. Fattori R, Tsai TT, Myrmel T, Evangelista A, Cooper JV, Trimarchi S, Li J, et al. Complicated acute type B dissection: is surgery still the best option? A report from the International Registry of Acute Aortic Dissection. JACC Cardiovasc Interv. 2008; 1: 395-402. [ Links ]
29. Estrera AL, Miller CC, Huynh TT, Azizzadeh A, Porat EE, Vinnerkvist A, et al. Preoperative and operative predictors of delayed neurologic deficit following repair of thoracoabdominal aortic aneurysm. J Thorac Cardiovasc Surg. 2003; 126: 1288-1294. [ Links ]













