Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.21 no.1 Bogota Jan./Feb. 2014
(1) Departamento de Cardiología Clínica, Fundación Clínica Shaio. Bogotá, Colombia.
(2) Programa de Cardiología Universidad El Bosque. Bogotá, Colombia.
(3) Fundación Clínica Shaio. Bogotá, Colombia.
Departamento de Cardiología clínica y Medicina Interna, Fundación Clínica Shaio.
Correspondencia: Dr. Fernán Mendoza, Fundación Clínica Shaio, Diagonal 115 A, No. 70C-75. Bogotá, Colombia. Tel.: (57-1) 253 3822, correo electrónico: fernan.mendoza@shaio.org
Recibido: 25/06/2012. Aceptado: 10/05/2013.
INTRODUCCIÓN: las complicaciones relacionadas con el sangrado constituyen un problema importante en los pacientes que ingresan con síndrome coronario agudo, pues se asocian con morbilidad y mortalidad importantes. El puntaje "CRUSADE", estudiado y validado, identifica ocho predictores de sangrado mayor en el hospital y constituye una herramienta útil para comprobar el riesgo de sangrado.
OBJETIVO: establecer las características operativas del puntaje de sangrado "CRUSADE" para determinar el riesgo de sangrado mayor en pacientes con síndrome coronario agudo sin elevación del ST. Establecer cual es el mejor punto de corte del puntaje "CRUSADE" en nuestro medio, con base en la curva de características operativas del receptor (ROC).
MATERIALES Y MÉTODOS: se agruparon pacientes desde el 1º. de julio de 2011 hasta el 30 de noviembre del mismo año, detallando diferentes variables. Se realizó la curva ROC y se determinó: punto de corte, sensibilidad, especificidad, valores predictivos positivos y negativos y razones de verosimilitud.
RESULTADOS: se presenta el análisis de 330 pacientes, con edad promedio de 66,5 años, 68,4% de género masculino. El promedio de puntaje "CRUSADE" fue de 27,9; el 18,18% presentó sangrado mayor, el 56,9% angina inestable y el 43,0% infarto agudo del miocardio sin elevación del ST. Se determinó el área bajo la curva cuyo resultado fue 0,8114 (IC 95%; 0,75 – 0,87). Utilizando un punto de corte mayor o igual a 35, los resultados aportaron una sensibilidad del 70% (IC 95%; 55,57 – 82, 43), una especificidad del 77,41% (IC 95%; 72,23 – 82,58), un valor predictivo positivo de 40,78% (IC 95%; 30,80 – 50,75), un valor predictivo negativo de 92,07% (IC 95%; 88,34 – 95,81), una razón de verosimilitud positiva 3,10 (2,35 – 4,08) y una razón de verosimilitud negativa 0,39 (0,26 – 0,57).
CONCLUSIONES: el punto de corte para el puntaje "CRUSADE" propuesto, es mayor o igual a 35. Dada la importancia de realizar una estratificación del riesgo de sangrado, estos resultados sirven para recomendar la implementación sistemática del puntaje de sangrado "CRUSADE", y si este es mayor o igual a 35, establecer las recomendaciones para disminuir el riesgo de sangrado, y por ende, la morbilidad y la mortalidad.
PALABRAS CLAVE: hemorragia, síndrome coronario agudo sin elevación del ST, disfunción renal, tratamiento anticoagulante, anemia.
INTRODUCTION: the bleeding-related complications are a major problem in patients admitted with acute coronary syndrome because they are associated with significant morbidity and mortality. "CRUSADE" score, studied and validated, identifies eight predictors of major bleeding in the hospital and is a useful tool to verify the risk of bleeding.
OBJECTIVE: to establish the operational characteristics of the bleeding "CRUSADE" score to determine the risk of major bleeding in patients with acute coronary syndrome without ST elevation. Establish which is the best "CRUSADE" score cutoff in our environment, based on the curve of the receiver operating characteristics (ROC).
MATERIALS AND METHODS: patients were grouped from July 1, 2011 to November 30, 2011, detailing different variables. The ROC curve was calculated and cut point, sensitivity, specificity, positive and negative predictive values and likelihood ratios were determined.
RESULTS: the analysis of 330 patients with mean age 66.5 years and 68.4% of male gender is presented. The average "CRUSADE" score was 27.9. 18.18% had major bleeding, 56.9% unstable angina, and 43.0 % acute myocardial infarction without ST elevation. The area under the curve was determined and the result was 0.8114 (95% CI; 0.75 to 0.87). Using a cutoff point greater than or equal to 35, the results provided a sensitivity of 70 % (95% CI, 55.57 to 82.43), a specificity of 77.41% (95% CI, 72.23 to 82.58), a positive predictive value of 40.78% (95% CI; 30.80 to 50.75 ), a negative predictive value of 92.07% (95% CI; 88.34 to 95.81), a positive likelihood ratio 3.10 (2.35 to 4.08) and a negative likelihood ratio 0.39 (0.26 to 0.57).
CONCLUSIONS: the cutoff point for the proposed "CRUSADE" score is greater than or equal to 35. Given the importance of conducting a risk stratification of bleeding, these results serve to recommend the systematic implementation of the "CRUSADE" bleeding score and if this is greater than or equal to 35, establish recommendations to reduce the risk of bleeding and consequently morbidity and mortality.
KEYWORDS: hemorrhage, acute coronary syndrome without ST elevation, renal dysfunction, anticoagulant treatment, anemia.
Introducción
Las complicaciones relacionadas con el sangrado constituyen un problema importante en los pacientes que ingresan al servicio de urgencias con un síndrome coronario agudo; estas complicaciones no isquémicas se asocian con morbilidad y mortalidad significativas (1-3).
La frecuencia de hemorragia mayor está entre el 2% al 9%, pero puede incrementarse hasta el 30% dependiendo de variables como: tipo de tratamiento utilizado, instituciones donde se recibe la atención, realización o no de intervención coronaria percutánea y toma o no de todos los tipos de sangrado (1-3).
El puntaje CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with early implementation of the ACC/AHA guidelines) Bleeding Score, estudiado y validado en un número inicial de 71.277 pacientes y luego en 17.857 pacientes en 485 sitios de Estados Unidos, identificó ocho predictores de sangrado mayor en el hospital: género, historia de diabetes, enfermedad vascular previa, signos de falla cardíaca, frecuencia cardiaca al ingreso, presión arterial sistólica al ingreso, hematocrito y depuración de creatinina. Luego de realizado el puntaje se clasifican los pacientes en: muy bajo riesgo, bajo riesgo, moderado riesgo, alto riesgo y muy alto riesgo (1, 11, 20, 25) (tablas 1 y 2).


La definición de sangrado mayor por CRUSADE incluye: hemorragia intracraneal, sangrado retroperitoneal, descenso del hematocrito mayor o igual al 12%, transfusión de glóbulos rojos cuando el hematocrito es mayor o igual al 28% o transfusión cuando el hematocrito es menor al 28% y el sangrado es evidente.
El objetivo principal del estudio fue establecer las características operativas del puntaje de sangrado "CRUSADE" para determinar el riesgo de sangrado mayor en pacientes con síndrome coronario agudo sin elevación del ST, que consultan al servicio de urgencias y son hospitalizados.
Materiales y métodos
Constituye un estudio de pruebas diagnósticas en el que se utilizó el puntaje de sangrado "CRUSADE" como prueba diagnóstica, para lo cual se revisaron las historias clínicas de 330 pacientes desde el 1º de julio de 2011 hasta el 30 de noviembre del mismo año. Se detallaron las siguientes variables: edad, género, presión arterial al ingreso, frecuencia cardíaca, peso, hemoglobina inicial, creatinina, depuración de creatinina (fórmula de Cockcroft – Gault), signos y síntomas de falla cardíaca, diabetes mellitus, enfermedad vascular periférica, puntaje CRUSADE, presencia de sangrado mayor, clasificación de sangrado GUSTO, tipo de sangrado, mortalidad hospitalaria, días de estancia, medicamentos utilizados y realización de procedimientos de intervención percutánea.
Criterios de inclusión
Sujetos con edad mayor o igual a 18 años y que cumplieran los siguientes criterios de síndrome coronario agudo sin elevación del ST: dolor torácico de características anginosas, en reposo, de al menos diez minutos de duración dentro de las 24 horas previas a la hospitalización y al menos uno de los siguientes criterios (25, 26):
• Cambios electrocardiográficos en al menos dos derivaciones contiguas caracterizadas por cualquiera de las siguientes características: nueva o presumiblemente nueva depresión del ST > 0,1 mv o elevación transitoria (< 30 minutos) del ST > 0,1 mv, o cambios de la onda T que sugirieran isquemia subepicárdica.
• Detección del aumento y del descenso de biomarcadores cardíacos (troponina I o T o fracción MB de la CK â MB.
Con base en el estudio CRUSADE bleeding score (Circulation. 2009; 119: 1873 – 1882), se determinó el número de sujetos que sangraron, de acuerdo con la clasificación de riesgo: muy bajo riesgo < 20 (3,1%), bajo riesgo 21 – 30 (5,5%), moderado riesgo 31 – 40 (8,6%), alto riesgo 41 – 50 (11,9%) y muy alto riesgo > 50 (19,5%). Luego se elaboró una tabla de 2 X 2, teniendo en cuenta dos grupos, grupo 1: pacientes de muy alto riesgo, alto riesgo y moderado riesgo de sangrado, y grupo 2: pacientes de bajo riesgo y de muy bajo riesgo de sangrado; con esos datos se realizó el cálculo de sensibilidad (85%) y especificidad (55%). A través del programa Epidat 3.1 para el cálculo del tamaño de la muestra y las siguientes variables: sensibilidad del 85%, especificidad del 55% y prevalencia de sangrado de 20% (ésta se tomó de un análisis preliminar que se realizó en la institución y una evaluación de expertos), se obtuvo un tamaño de muestra de 501 pacientes. Para las variables continuas se utilizaron medidas de tendencia central y medidas de dispersión y para las variables categóricas tablas de frecuencia y porcentajes. Se estableció el mejor punto de corte, luego de elaborar la curva de características operativas del receptor, realizando cálculos de sensibilidad y especificidad, valores predictivos positivos y negativos y razones de probabilidad para un estudio positivo y negativo. Para el análisis de los datos se utilizó el programa Stata 11.1 (serial number 30110578562).
Resultados
Se presentó un análisis de 330 pacientes, con edad promedio de 66,5 años, 68,4% de género masculino, promedio de presión sistólica al ingreso 131,0 mm Hg, frecuencia cardiaca 73 latidos por minuto, peso promedio 70,4 kg, hemoglobina y hematocrito inicial 14,7 g/dL y 43, 39% respectivamente. No se presentaron sangrados intracerebral ni intra–abdominal; hubo seis casos de hemorragia gastrointestinal, hematoma inguinal en 8,1%, pseudoaneurisma 1,2% y equimosis 10,3%. El diagnóstico del tipo de síndrome coronario agudo fue 56,97% para angina inestable y 43,03% para infarto agudo de miocardio sin elevación del ST (tabla 3).
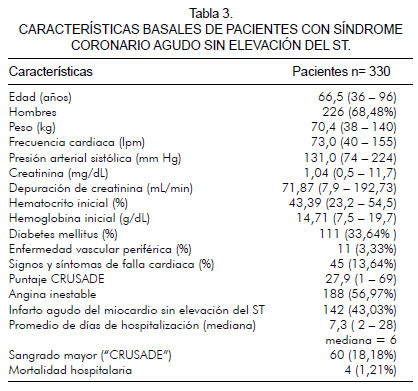
El nivel promedio de creatinina fue de 1,04 y la depuración de creatinina por la fórmula de Cockcroft – Gault fue de 74,87 mL/min. El 13,64% de pacientes tuvo signos y síntomas de falla cardiaca y el 33,61% padecía diabetes; el promedio del puntaje "CRUSADE" fue de 27,91. El 18,18% de los sujetos presentó sangrado mayor según la clasificación "CRUSADE"; con base en la clasificación "GUSTO", el 12,02% tuvo sangrado moderado - severo.
Se registraron cuatro muertes (1,21%) por falla ventilatoria, sepsis pulmonar y arritmia.
Respecto al empleo de medicamentos, se utilizó enoxaparina en el 97,58% de los pacientes, fondaparinux en el 1,21%, clopidogrel en el 70,61% y aspirina en el 97,88%.
El sangrado mayor fue de 18,18%.
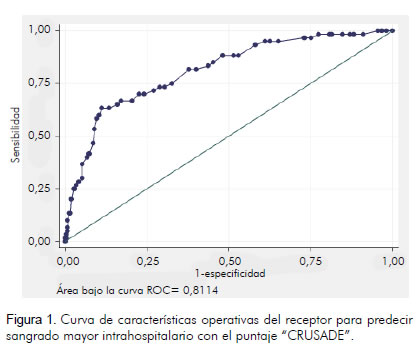
Se determinó el área bajo la curva cuyo resultado fue 0,8114 (IC 95%; 0,75 – 0,87) (figura 1).
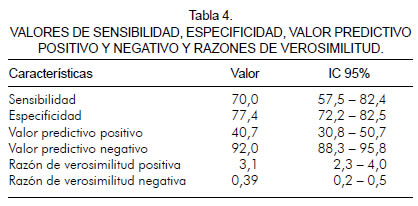
Utilizando un punto de corte de 35, los resultados aportaron un sensibilidad del 70% (IC 95%; 55,5 – 82, 4), una especificidad del 77,4% (IC 95%; 72,2 – 82,5), un valor predictivo positivo de 40,7% (IC 95%; 30,8 – 50,7), un valor predictivo negativo de 92,0% (IC 95%; 88,3 – 95,8), una razón de verosimilitud positiva de 3,1 (2,3 – 4,0) y una razón de verosimilitud negativa de 0,39 (0,2 – 0,5) (tabla 4).
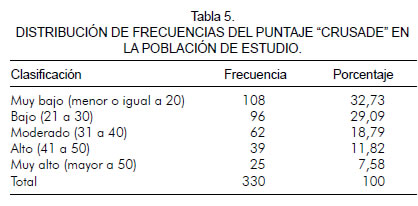
En la tabla 5 se describe la frecuencia de pacientes con relación al puntaje.
Al comparar el porcentaje de pacientes en las diferentes categorías de riesgo de nuestro estudio con los resultados de los estudios "CRUSADE" y de una cohorte española, se determinó que el porcentaje de pacientes con puntaje alto y muy alto fue mayor en los registros "CRUSADE" y en la cohorte (tabla 6).
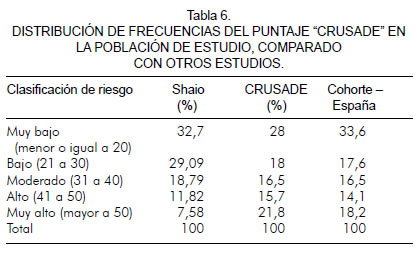
Se describió la distribución porcentual de sangrado mayor según la categoría de puntuación de "CRUSADE", y se encontró que los pacientes clasificados con un puntaje alto y muy alto presentaron más episodios de sangrado mayor; los sujetos con un puntaje alto tuvieron un sangrado mayor del 51,2% y en los pacientes con un puntaje muy alto el sangrado mayor fue del 64% (figura 2).
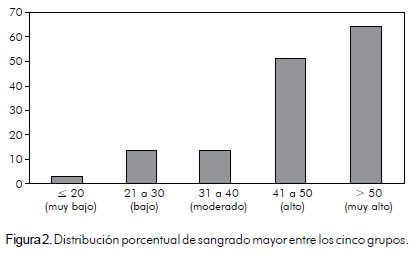
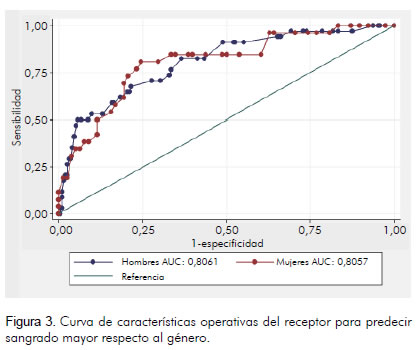
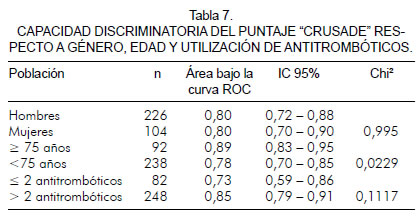
Se realizó una curva de características operativas del receptor en la que se compararon hombres y mujeres; de acuerdo con ésta el puntaje "CRUSADE" tiene buena capacidad discriminatoria para ambos. No se encontraron diferencias significativas; el área bajo la curva ROC para hombres fue de: 0,80 (IC 95%; 0,72 – 0,88) y para mujeres fue de 0,80 (IC 95%; 0,70 – 0,90) p = 0,9958 (figura 3). Además se analizó con la edad, clasificando a los pacientes en mayores o iguales a 75 años y menores de 75 años permaneciendo la misma capacidad discriminatoria; para menores de 75 años el área bajo la curva ROC fue de 0,78 (IC 95%; 0,70 – 0,85) y para mayores de 75 años o de esa edad, fue de 0,89 (IC 95%; 0,83 – 0,95) p = 0,0229; esto mostró diferencias estadísticamente significativas, teniendo mejor capacidad discriminatoria en los pacientes mayores o iguales a 75 años (figura 4).
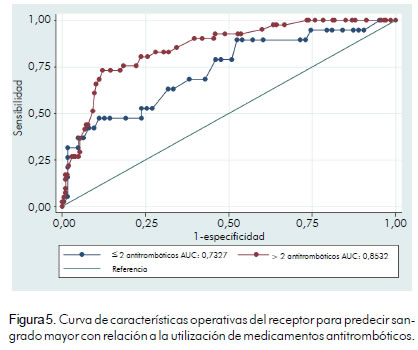
En cuanto a la utilización o no de antitrombóticos los pacientes se clasificaron en aquellos que utilizan dos o menos antitrombóticos y los que usan más de dos antitrombóticos; en ambos casos la prueba tuvo capacidad discriminatoria, sin establecerse una diferencia significativa. Para dos o menos antitrombóticos, el área bajo la curva ROC fue de 0,73 (IC 95%; 0,59 – 0,86) y para más de dos antitrombóticos fue de 0,85 (IC 95%; 0,79 – 0,91) p = 0,117 (figura 5, tabla 7).
La mediana de días de hospitalización fue de seis días (2 – 28).
Con relación a los tipos de sangrado, ninguno presentó sangrado intracerebral ni intraabdominal; seis (1,82%) tuvieron sangrado gastrointestinal, dos (0,61%) hematuria, siete (2,12%) epistaxis, 27 (8,18%) hematoma inguinal, cuatro (1,21%) pseudoaneurisma inguinal y 34 (10,30%) equimosis en el sitio del cateterismo. Respecto a otros tipos de sangrado se encontraron: hematoma por catéter para diálisis, sangrado en herida de safenectomía, herida en implante del marcapaso, hemotórax y sangrado por tubo mediastinal.
Discusión
Las complicaciones relacionadas con el sangrado constituyen un problema importante en los pacientes que ingresan al servicio de urgencias con síndrome coronario agudo; estas complicaciones no isquémicas se asocian con morbilidad y mortalidad considerables (1, 3, 8, 11).
Existen diferentes modelos para estratificar a los pacientes que tienen más riesgo de sangrado; éstos se describen en los estudios: GRACE (Global Registry of Acute Coronary Events), STEEPLE (Safety and Efficacy of Enoxaparin in PCI Patients, an International Randomized Evaluation), REPLACE (Randomized Evaluation in Percutaneous Coronary Intervention Linking Angiomax to Reduced Clinical Events), el puntaje basado en los estudios ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) y HORIZONS – AMI (Harmonizing Outcomes with RevasculariZatiON and Stents in Acute Myocardial Infarction) y el puntaje del registro CRUSADE (Can rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with early implementation of the ACC/AHA guidelines) Bleeding Score. Los tres últimos han establecido escalas cuantificadas para estratificar a los pacientes entre muy bajo, bajo, moderado, alto y muy alto riesgo de sangrado intrahospitalario y esto se correlaciona con la morbimortalidad (1, 3, 8, 9, 10, 18, 19).
De manera rutinaria en las instituciones no se aplica ningún puntaje de riesgo y en evaluaciones iniciales se observan problemas con el manejo de anticoagulantes, antiagregantes y episodios de sangrado, principalmente en la población de alto riesgo; de manera adicional las definiciones de sangrado mayor o menor, varían de acuerdo con los diferentes estudios y autores.
En lo que respecta a la edad de los pacientes, en el estudio "CRUSADE", el promedio fue de 67 años, en la cohorte de España de 66,5 años y en el estudio de Mendoza y colaboradores fue de 66,5 años. En el "CRUSADE", 39,8% fueron mujeres, en la población Española 26,7% (diferencia significativa) y en nuestro medio 31,52% (1, 21) (tabla 3).
Las complicaciones de sangrado son las complicaciones no isquémicas más observadas en el manejo de los pacientes con síndrome coronario agudo (1, 2). De acuerdo con todas las limitaciones con relación a las definiciones de sangrado (definición de TIMI, GUSTO, CRUSADE), se estima que la frecuencia de sangrado mayor está entre el 2% al 8% y es del 30% para cualquier tipo de sangrado; así mismo depende del tipo de tratamiento usado, la realización de procedimientos invasivos, el tipo y la dosis de antitrombóticos y antiplaquetarios, entre otros (1, 2).
En este estudio el porcentaje de sangrado mayor estuvo en el 18,18%, cifra que concuerda con las de análisis previos, donde se había determinado que el porcentaje de sangrado en nuestro medio era mayor; en el "CRUSADE" fue de 9,4% en el grupo total y de 9,6% en la cohorte de validación, y en la cohorte española fue de 9,5% (1, 21). Varias razones pudieran explicar por qué el porcentaje de sangrado es mayor en nuestro medio, principalmente aquellas que están relacionadas con las características propias de la población como: bajo peso, falta de listas de chequeos para seguir la dosificación de antiagregantes y anticoagulantes, desconocimiento del tema y la no utilización sistemática de un puntaje para determinar riesgo de sangrado.
La mortalidad en nuestra población fue de 1,21% comparado con 2,7% en el estudio "CRUSADE" y 5,1% en la cohorte de España.
Se determinó el área bajo la curva, cuyo resultado fue 0,8114 (95% IC; 0,75 – 0,87) (figura 1). En la población española fue de 0,82 (95% IC; 0,770 – 0,867) p < 0,001 y en el estudio "CRUSADE" fue un estadístico "C" de 0,72 para la población total y de 0,71 para la cohorte de validación. El estadístico "C" es equivalente al área bajo la curva ROC (características operativas del receptor), y se considera que un modelo con un estadístico "C" mayor de 0,7 tiene buena capacidad discriminatoria.
Se evaluaron los diferentes valores de l puntaje "CRUSADE" en la población y se definió un punto de corte mayor o igual a 35, como el valor que brinda el mejor equilibrio entre sensibilidad y especificidad. Sensibilidad del 70% (IC 95%; 55,57 – 82, 43), especificidad del 77,41% (IC 95%; 72,2 – 82,5), valor predictivo positivo del 40,7% (IC 95%; 30,8 – 50,7), valor predictivo negativo del 92,07% (IC 95%; 88,3 – 95,8), razón de verosimilitud positiva 3,10 (2,3 – 4,0) y razón de verosimilitud negativa 0,39 (0,2 – 0,5) (tabla 4).
Si se hubiera tomado un punto de corte mayor o igual a 40, la sensibilidad habría disminuido al 63,33%, aunque la especificidad hubiese aumentado al 88,89%. El porcentaje de clasificados correctamente sería de 84,24% con una razón de verosimilitud positiva de 5,7 y de verosimilitud negativa de 0,41. Se considera, pues, que al tratarse de un puntaje que estratifica riesgo de sangrado y si este ocurre, hay complicaciones potenciales para los pacientes (cinco veces riesgo de infarto, cuatro veces de muerte y tres veces de ataque cerebrovascular), de ahí que sea mejor un punto de corte más bajo que tiene una mejor sensibilidad para poder instaurar las medidas tendientes a disminuir este riesgo; además al tener un porcentaje de sangrado mayor de 18,18% en nuestro estudio, tomar el punto de corte de 35 aportaría un mejor balance entre sensibilidad y especificidad, con lo que a un mayor número de pacientes se le ofrecerían medidas de seguridad para disminuir este riesgo con una adecuada capacidad discriminatoria.
El promedio del puntaje "CRUSADE" fue de 27,91 y la clasificación del sangrado con relación a la magnitud fue la siguiente: el número de pacientes con puntaje muy bajo fue de 108 (32,73%), el bajo fue de 96 (29,09%), el moderado de 62 (18,79%), el alto de 39 (11,82%) y el muy alto de 25 (7,58%) (tabla 5).
Cuando se comparó con el registro "CRUSADE" y con la cohorte española, la diferencia más importante se observó en los grupos de bajo riesgo, donde el porcentaje fue mayor en la población del estudio y en el grupo de muy alto riesgo en el que el porcentaje fue mayor en las poblaciones del "CRUSADE" y en la cohorte española. El aspecto a tener en cuenta es que a pesar de que en el registro "CRUSADE" y en la cohorte española el porcentaje de pacientes con clasificación de sangrado alto y muy alto es mayor que en nuestra población (alto riesgo: 15,7% y 14,1% respectivamente vs. 11,82 y muy alto riesgo: 21,8% y 18,2% respectivamente vs. 7,58%), el porcentaje de sangrado mayor fue menor, posiblemente por las estrategias que se siguen para disminuir este riesgo (tabla 6).
De otra parte, se realizó una curva de características operativas del receptor en la que se compararon hombres y mujeres; se encontró que el puntaje "CRUSADE" tiene buena capacidad discriminatoria para ambos géneros y no se hallaron diferencias significativas entre ambos; el área bajo la curva ROC para hombres fue de 0,80 (IC 95%; 0,72 – 0,88) y para mujeres de 0,80 (IC 95%; 0,70 – 0,90) p = 0,9958; en el registro español no se encontraron diferencias por género (figura 3).
Además se analizó con la edad al clasificar a los pacientes en mayores o iguales a 75 años y menores de 75 años permaneciendo la misma capacidad discriminatoria; para menores de 75 años el área bajo la curva ROC fue de 0,78 (IC 95%; 0,70 – 0,85) y para mayores o iguales a 75 años de 0,89 (IC 95%; 0,83 – 0,95) p = 0,0229; con diferencias significativas. Así, entonces, para pacientes mayores o iguales a 75 años, se concluyó que tiene mejor capacidad discriminatoria, resultados de esperar por lo que se describe en los diferentes estudios donde la edad es una variable independiente asociada con el riesgo de sangrado (1, 3, 20, 21) (figura 4).
En cuanto a la utilización o no de antitrombóticos, los pacientes se clasificaron entre los que utilizan dos o menos antitrombóticos y los que utilizan más de dos antitrombóticos. En ambos casos la prueba tiene una capacidad discriminatoria, sin establecerse una diferencia significativa; para dos o menos antitrombóticos, el área bajo la curva ROC fue de 0,73 (IC 95%; 0,59 – 0,86) y para más de dos antitrombóticos fue de 0,85 (IC 95%; 0,79 – 0,91) p = 0,117 (figura 5, tabla 7).
En la cohorte española encontraron que para pacientes que usan dos o más antitrombóticos y han sido sometidos a intervención coronaria percutánea, el puntaje tiene mejor capacidad discriminatoria, 0,80 (IC 0,742–0,852), pero cuando no se realizó cateterismo la capacidad discriminatoria de la prueba no fue buena, 0,56 (IC 0,210 – 0,915).
El impacto del sangrado sobre el pronóstico se describe en el registro GRACE (Global Registry of Acute Coronary Events) donde se presentó una asociación significativa con la muerte intrahospitalaria (OR ajustada de 1,64). En registros y estudios de más de 30.000 pacientes, el sangrado mayor se asoció, durante el primer mes, con tres veces el riesgo de ataque cerebrovascular (ACV), cuatro veces el de muerte y cinco veces el de infarto (1, 3, 20).
Los predictores independientes de sangrado mayor en el registro GRACE fueron: edad (OR 1,22 con incremento cada 10 años p = 0,0002), género femenino (OR 1,36, p = 0,0116), historia de sangrado (OR 2,18, p = 0,014), uso de intervención coronaria percutánea (OR 1,63, p= 0,0005), historia de insuficiencia renal (OR 1,53, p= 0,0062), uso de inhibidores de la GP IIb/IIIa (OR 1,86, p= 0,0001), entre otros (1, 3).
Presentar sangrado durante un síndrome coronario agudo tiene gran impacto sobre el pronóstico. El sangrado mayor en el registro GRACE se asoció con incremento del riesgo de muerte hospitalaria (OR 1,64, 95% 1,18 – 2,28, p < 0,001). En el estudio OASIS – 5, el riesgo de eventos isquémicos a treinta días se relacionó fuertemente con la aparición de sangrado mayor. El porcentaje de muerte fue 12,9% vs. 2,8%, el de infarto 13,9 vs. 3,6% y el de ataque cerebrovascular de 3,6 vs. 0,8%, para aquellos que tuvieron sangrado en comparación con los que no. La disfunción renal desempeña un papel crítico, de ahí que deba realizarse un cálculo de la depuración renal (fórmula de Cockcroft – Gault o por la fórmula de MDRD) y reajustar los medicamentos correspondientes.
Los siguientes son factores que contribuyen a peor pronóstico asociado con sangrado (3, 7, 8, 11, 23):
1. Falla renal asociada a las complicaciones hemodinámicas del sangrado.
2. Anemia, hipotensión, hipoperfusión y disminución del aporte a un corazón con antecedentes de angina o infarto.
3. Potencial efecto adverso de la transfusión (incremento de mediadores inflamatorios, alta afinidad del oxígeno a la hemoglobina por disminución del ácido 2,3 difosfoglicérico, alteraciones del eritrocito en la sangre almacenada, depleción de óxido nítrico y alteración de la vasodilatación para mejorar la oxigenación tisular).
4. Activación de un estado pro-trombótico (estimulación de la antiagregación plaquetaria y d el sistema renina-angiotensina-aldosterona) y pro-inflamatorio durante el sangrado.
5. Incremento del riesgo de eventos isquémicos por el efecto de rebote que ocurre al retirar los medicamentos antiplaquetarios y antitrombóticos.
La prevención del sangrado ha llegado a ser una meta tan importante como la prevención de episodios isquémicos. En el estudio OASIS-5, la diferencia en mortalidad entre los dos grupos fue casi totalmente asociada, en el grupo de fondaparinux, con la reducción del sangrado. Por tanto, el médico debe establecer el riesgo trombótico – isquémico y el de complicaciones hemorrágicas.
El sangrado menor no requiere la interrupción del tratamiento del síndrome coronario agudo, pero en casos de sangrado mayor, como gastrointestinal, retroperitoneal, hemorragia intracraneal o pérdida severa de sangre, es indispensable la interrupción y neutralización del tratamiento antiplaquetario y antitrombótico. En la práctica clínica el riesgo de suspender el tratamiento antiplaquetario y antitrombótico debe balancearse contra el riesgo de un evento trombótico, en particular si el paciente ha sido sometido a revascularización percutánea e implante de stent. El riesgo de eventos trombóticos agudos después de suspender el tratamiento antiplaquetario y antitrombótico es máximo después de cuatro a cinco días pero persiste por treinta días o más.
En algunos casos de sangrado es necesaria la transfusión de glóbulos rojos, proceso que está asociado con mayor riesgo de muerte, infarto e isquemia recurrente (3, 7, 8, 11, 23).
Adicionalmente, se ha reconocido que durante la práctica clínica rutinaria los médicos pueden utilizar dosis excesivas de anticoagulantes y antiplaquetarios, hecho que se reporta como una causa frecuente de sangrado.
En reportes del registro "CRUSADE", se informó al menos un error en la dosis de heparina no fraccionada o de heparina de bajo peso molecular o de los inhibidores de la glicoproteína IIb/IIIa, usada para el manejo de los síndromes coronarios agudos sin elevación del ST, en el 45% de los pacientes; y de igual forma, 15% de los eventos de sangrado se atribuyó a errores en las dosis. Por ello se recomienda que las instituciones cuenten con listas de chequeo, evaluación y seguimiento a la aplicación de las guías para disminuir estos episodios, y llevar a los médicos a ser más estrictos en la selección del tratamiento, la dosificación de los antitrombóticos y la elección de las estrategias invasivas. Por ejemplo en el uso de anticoagulantes como la bivalirudina (con una estrategia invasiva) y el fondaparinux (en estrategia conservadora), se reportaron resultados similares en eficacia anti-isquémica cuando se comparó con la terapia estándar (heparina de bajo peso molecular y heparina no fraccionada), pero con tasas de sangrado menores; igualmente, el antiplaquetario prasugrel en el estudio TRITON – TIMI 38, demostró superioridad en eficacia anti-isquémica pero mayores tasas de sangrado cuando se comparó con clopidogrel.
Las siguientes estrategias ayudan a disminuir el riesgo de sangrado en pacientes con un puntaje de sangrado "CRUSADE" mayor o igual a 35:
1. Pesar al paciente.
2. Calcular la depuración de creatinina por medio de la fórmula de Cockcroft – Gault, mL/min) o MDRD.
3. Reajustar los medicamentos de acuerdo con la edad y el cálculo de la depuración de creatinina.
4. Usar heparina no fraccionada para pacientes en diálisis o con depuración de creatinina menor a 15 mL/min, pues es la que ofrece mejor seguridad.
5. Tener presente que el fondaparinux es una opción en reemplazo de la enoxaparina en pacientes de alto riesgo de sangrado con síndrome coronario agudo, con base en el estudio OASIS-5. No utilizar si la depuración de creatinina es menor a 30 mL/min.
6. Si no hay otra indicación para la anticoagulación, suspender este tratamiento o utilizarlo el menor tiempo posible.
7. Realizar cateterismo radial en pacientes con síndrome coronario agudo que ameriten cateterismo cardiaco y tengan alto riesgo de sangrado.
8. Utilizar dispositivos de cierre vascular luego del procedimiento de hemodinamia. El uso de dispositivos de cierre vascular es razonable con el propósito de obtener una hemostasia rápida y una deambulación temprana comparado con la compresión manual (recomendación clase IIa, nivel de evidencia B).
9. En caso de ser necesario, la terapia triple de aspirina, una tienopiridina (clopidogrel) y warfarina, debería ser utilizada el menor tiempo posible; con niveles de INR entre 2,0 y 2,5, y la dosis de aspirina debe oscilar entre 81 y 100 mg.
10. Utilizar stents convencionales en el grupo de pacientes con alto riesgo de sangrado y necesidad de anticoagulación a largo plazo (ejemplo fibrilación auricular permanente).
11. Evaluar el riesgo de sangrado gastrointestinal y utilizar un inhibidor de la bomba de protones si el paciente lo amerita.
12. Controlar el sangrado, en caso de que éste ocurra, con medidas hemostáticas específicas para retirar el tratamiento antiplaquetario en el menor tiempo posible.
13. Tratar las hemorragias menores preferiblemente sin interrumpir los tratamientos activos.
14. Efectuar transfusión de sangre sólo en caso de deterioro hemodinámico o cuando el hematocrito sea menor al 25% o la concentración de hemoglobina menor a 7 g/dL.
15. Encargar al grupo de enfermería la elaboración de una lista de chequeo donde se identifique el cumplimiento y la vigilancia de varios puntos incluyendo la presencia de sangrado, la correcta utilización del nomograma cuando se emplea heparina no fraccionada, la vigilancia de las pruebas de coagulación, entre otras.
16. Establecer un sistema de alerta en los pacientes con un puntaje "CRUSADE" mayor o igual a 35.
Las guías de la Sociedad Europea de Cardiología recomiendan determinar el puntaje de riesgo para sangrado "CRUSADE" en conjunto con el riesgo isquémico (GRACE) en pacientes con síndrome coronario agudo (Recomendación clase I, nivel de evidencia B) (25).
Limitaciones del estudio
La definición de sangrado mayor, que no está unificada y varía de acuerdo con series y autores, debe ser revisada; además, en el análisis deberían incluirse otros tipos de sangrado menor que tienen importancia clínica.
Igualmente, se debe evaluar y validar este puntaje de sangrado en la población de síndrome coronario agudo con elevación del ST puesto que se tomó sólo aquella con síndrome coronario agudo sin elevación del ST.
El cálculo del tamaño de la muestra fue de 501 pacientes, pero finalmente se presentó el análisis de 330 pacientes; la explicación se basa en que se había realizado un análisis a priori con 150 pacientes donde se encontró que el punto de corte del puntaje "CRUSADE" fue 35, y este resultado aportaba una especificidad mayor a la utilizada para el cálculo del tamaño de muestra; luego al realizar el análisis con 330 pacientes permanecieron los resultados de sensibilidad y mayor especificidad, con buena capacidad discriminatoria. De manera adicional, en la población de estudio se encontró un porcentaje de sangrado mayor que el reportado en la literatura, y teniendo en cuenta que los resultados no variaban de manera significativa, se consideró importante para beneficio de los pacientes, reportar los resultados con 330 participantes, para que en la institución se iniciara la utilización sistemática del puntaje. Esto condujo a implementar en la historia clínica el uso obligatorio del puntaje, con el punto de corte de 35, y aplicar las estrategias mencionadas para disminuir el sangrado en estos pacientes.
Conclusiones
El punto de corte para el puntaje "CRUSADE" propuesto para nuestra población es mayor o igual a 35. Dada la importancia de realizar una estratificación de riesgo de sangrado, este estudio sirve para implementar de manera sistemática en nuestra institución el puntaje de sangrado "CRUSADE", y si este es mayor o igual a 35, establecer las recomendaciones para disminuir el riesgo de sangrado y con ello la morbilidad y la mortalidad.
Esta estrategia debe incluirse en las políticas institucionales de seguridad para el paciente.
Bibliografía
1. Sudherwal S, Bach R, Chen A, Gage B, Rao S, Newby K, et al. Baseline Risk of Major Bleeding in Non- ST - Segment Elevation Myocardial Infarction. The CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines) Bleeding Score. Circulation. 2009; 119: 1873-82. [ Links ]
2. Anderson J. Stopping the hemorrhage. A new baseline bleeding score brings us a step closer for patients with non - ST - elevation myocardial infarction. Circulation. 2009; 119: 1846-49. [ Links ]
3. Moscucci M, Fox KA, Cannon CP, Klein W, López - Sendón J, Montalescot G, et al. Predictors of major bleeding in acute coronary syndromes: the Global Registry of Acute Coronary Events (GRACE). Eur Heart J. 2003; 24: 1815-23. [ Links ]
4. Antman EM, Cohen M, Bernink, et al. The TIMI risk Score for unstable angina/Non ST elevation MI. A method for prognostication and therapeutic decision making. JAMA. 2000; 284: 835-42. [ Links ]
5. Boersma E, Pieper KS, Steyerberg EW, Wilcox RG, Chang WC, Lee KL, et al. Predictors of outcome in patients with acute coronary syndromes without persistent ST - segment elevation. Results from an international trial of 9461 patients. The PURSUIT Investigators. Circulation. 2000; 101: 2557-67. [ Links ]
6. Anderson JL, Adams CD, Antman EM, Bridges CR, Califf RM, Casey DE Jr, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-Elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non-ST-Elevation Myocardial Infarction) developed in collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions, and the Society of Thoracic Surgeons endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. J Am Coll Cardiol. 2007; 50: e1-e157. [ Links ]
7. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. The Task Force for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes of the European Society of Cardiology. Eur Heart J. 2007; 28: 1598-660. [ Links ]
8. Sobieraj-Teague M, Gallus A, Eikelbomm JW. The risk of iatrogenic bleeding in acute coronary syndromes and long - term mortality. Current Opinion in Cardiology. 2008; 23: 327-34. [ Links ]
9. Montalescot G, White HD, Gallo R, Cohen M, Steg PG, Aylward PE, et al. Enoxaparin versus unfractionated heparin in elective percutaneous coronary intervention. N Engl J Med. 2006; 355: 1006-17. [ Links ]
10. Feit F, Voeltz M, Attubato M, Lincoff M, Cheew D, Bittl J, et al. Predictors and impact of major hemorrhage on mortality following percutaneous coronary intervention from the REPLACE - 2 Trail. Am J Cardiol. 2007; 100: 1364-69. [ Links ]
11. Rao SV, O'Grady K, Peiper KS, Granger CB, Newby LK, Van de Werf F, et al. Impact of bleeding severity on clinical outcomes among patients with acute coronary syndromes. Am J Cardiol. 2005; 96: 1200-1206. [ Links ]
12. Melloni C, Mahaffey K. Management of acute coronary syndromes in patients with renal dysfunction. Curr Op Cardiol. 2008; 23: 320-26. [ Links ]
13. Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, et al. Comparison of and enoxaparin in acute coronary syndromes: the OASIS - 5 randomized trial. N Engl J Med. 2006; 354: 1464-76. [ Links ]
14. Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST - segment elevation myocardial infarction: the OASIS - 6 randomized trial. JAMA. 2006; 295: 1519-30. [ Links ]
15. Mendoza F, Isaza D, Beltrán R, Jaramillo C. Guías Colombianas de Cardiología, Síndrome coronario agudo sin elevación del ST. Rev Colomb Cardiol. 2008; 15 (Supl. 39): 141-232. [ Links ]
16. Mehran R, Pocock S, Nikolsky E, Clayton T, Dangas G, Kiryane A, et al. A risk score to predict bleeding in patients with acute coronary syndromes. J Am Coll Cardiol. 2010; 55: 2556-66. [ Links ]
17. Brinker J. The score is in but is the final decision? J Am Coll Cardiol. 2010; 55: 2567-68. [ Links ]
18. Stone GW, White HD, Ohman EM, et al. Acute catheterization and urgent intervention triage strategy (ACUITY) Trial Investigators. Bivalirudin in patients with acute coronary syndromes undergoing percutaneous coronary intervention: a subgroup analysis from the Acute Catheterization and urgent intervention triage strategy (ACUITY) trial. Lancet. 2007; 369: 907-19. [ Links ]
19. Stone GW, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR, Dudek D, et al; for the HORIZONS-AMI Trial Investigators. Bivalirudin during primary PCI in acute myocardial infarction. N Engl J Med. 2008; 358: 2218-30. [ Links ]
20. Rao S. Hemorragia en pacientes con síndromes coronarios agudos: de un hallazgo molesto a un reto importante. Rev Esp Cardiol. 2010; 63 (1): 1-4. [ Links ]
21. Abu - Assi E, Gracía - Acuña JM, Ferreira González I, Peña Gil C, Gayoso- Diz P, González - Juanatey JR. Evaluating the performance of the can rapid risk stratification of unstable angina patients suppress adverse outcomes with early implementation of the ACC/AHA Guidelines (CRUSADE) bleeding score in a contemporary spanish cohort of patients with non - ST - segment elevation acute myocardial infarction. Circulation. 2010; 121: 2419-26. [ Links ]
22. Mehran R, Rao S, Bhatt DL, Gibson M, Caixeta A, Eikelboom J, et al. Standardized Bleeding Definitions for Cardiovascular Clinical Trials. A Consensus report from the bleeding academic research consortium. Circulation. 2011; 123: 2736-47. [ Links ]
23. Steg G, Huber K, Andreotti F, Arnasen H, Atar D, Badimon, et al. Bleeding in acute syndromes and percutaneous coronary interventions: position paper by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J. 2011; 32: 1854-64. [ Links ]
24. Gutierrez A, Rao S. Incidencia, outcomes and management of bleeding in non - ST elevation acute coronary syndromes. Cleveland Clinic J Med. 2010; 77: 369-79. [ Links ]
25. Hamm C, Bassand JP, Agewall S, Bax J, Boersma E, Bueno H, et al. Guía de práctica clínica de la Sociedad Europea de Cardiología, para el manejo del síndrome coronario agudo en pacientes sin elevación persistente del segmento ST. Rev Esp Cardiol. 2012; 65 (2): 173, e1-e55. [ Links ]
26. Wright RS, Anderson JL, Adams CD, Bridges CR, Casey DE Jr, Ettinger SM, et al. 2011. ACCF/AHA focused update of the guidelines for the management of patients with unstable angina/non - ST elevation myocardial infarction (updating the 2007 guideline): a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2011; 57: 1-40. [ Links ]
27. Hicks KA, Stockbridge NL, Targum SL, Temple RJ. Bleeding academic research consortium consensus report. The Food and Drug Administration Perpective. Circulation 2011; 123: 2664-65. [ Links ]
28. Dauerman HL, Rao SV, Resnic F, Applegate RJ. Bleeding avoidance strategies. Consensus and Controversy. J Am Coll Cardiol. 2011; 58: 1-10. [ Links ]
29. Salam AM. Evolving role of bivalirudin in percutaneous coronary interventions; impact of the REPLACE -2 study. Expert Opin Investig Drugs. 2003; 12 (6): 1027-33. [ Links ]













