Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.21 no.1 Bogota Jan./Feb. 2014
Jaiber Gutiérrez, MD.(1, 3); Jairo Sánchez, MD.(1, 2); Juan G. Echeverri, MD.(2, 4)
Fundación Valle del Lili. Cali, Colombia.
(1) Fundación Valle del Lili. Cali, Colombia.
(2) Universidad CES. Cali, Colombia.
(3) Universidad ICESI. Cali, Colombia.
(4) Clínica DIME. Cali, Colombia.
Correspondencia: Dr. Iván Quintero, Fundación Valle del Lili. Av. Simón Bolívar. Cra. 98 # 18-49. Cali. Colombia. (057) (2) 331 9090. Ext. 4122. Correo electrónico: ivanquint@gmail.com
Recibido: 21/02/2013. Aceptado: 19/09/2013.
En niños con insuficiencia o estenosis valvular significativa, la intervención de la válvula, ya sea valvuloplastia o reemplazo valvular, suele ser inevitable. El seguimiento de estos pacientes puede ser complejo; los síntomas iniciales de disfunción valvular protésica son inespecíficos y en ocasiones es difícil diferenciar entre los efectos de la disfunción valvular, las patologías no cardíacas, la disfunción ventricular y la hipertensión pulmonar. Aunque el examen físico puede alertar al clínico acerca de alteraciones, se requieren otros métodos diagnósticos para evaluar la función de la prótesis. La ecocardiografía Doppler es el método de elección no invasivo para estudiar la función valvular y pese a que muchas de las mediciones y parámetros de normalidad y anormalidad son extrapolados de estudios en adultos, se han tratado de definir estándares en pacientes pediátricos. Este documento ofrece una revisión acerca de las técnicas usadas en el estudio de las válvulas protésicas con base en literatura científica, consensos internacionales y opiniones de expertos.
Palabras clave: cardiología, prótesis valvular, ecocardiografía.
In children with significant valvular insufficiency or stenosis, valve surgery, either valvuloplasty or valve replacement is usually inevitable. The monitoring of these patients can be complex, the initial symptoms of prosthetic valve dysfunction are nonspecific and sometimes difficult to differentiate between the effects of valvular dysfunction, non-cardiac pathologies, ventricular dysfunction and pulmonary hypertension. Although physical examination may alert the clinician about alterations, other diagnostic methods to assess the function of the prosthesis is required. Doppler echocardiography is the noninvasive method of choice to study valvular function and although many of the measurements and parameters of normality and abnormality are extrapolated from adult studies have been attempted to define standards in pediatric patients. This document provides an overview about the techniques used in the study of prosthetic valves based on scientific literature, international consensus and expert opinion.
Keywords: cardiology, valvular prosthesis, Echocardiography.
Introducción
La implantación de prótesis valvulares en población pediátrica es infrecuente; no obstante, la mejoría en los diagnósticos en etapa fetal, los avances en técnicas quirúrgicas, la circulación extracorpórea y las estrategias de manejo perioperatorio, hacen posible que la población infantil sea candidata a un reemplazo valvular como última medida luego de que se haya realizado un reparo valvular no exitoso o en el caso de que se contraindique (1-3).
El método de elección para la evaluación de prótesis valvulares es la ecocardiografía, aunque existen otras técnicas consideradas como complementarias, como la cinefluoroscopia, la tomografía computarizada y la resonancia magnética.
el mismo Al evaluar mediante ecocardiografía una prótesis valvular se puede observar que ésta funcione de manera adecuada o inadecuada; además existe la posibilidad de que aunque la prótesis funcione correctamente, haya una alteración de la relación entre el orificio valvular protésico efectivo y el orificio valvular nativo en relación con la superficie corporal del paciente, situación conocida como desigualdad prótesis-paciente o "patient-prothesis missmatch", condición que puede desencadenar repercusiones hemodinámicas y deterioro clínico en los pacientes a mediano y largo plazo (4).
La desigualdad prótesis-paciente, es una de las principales complicaciones al emplear prótesis valvulares en población pediátrica, pues el individuo aumentará su superficie corporal y el tamaño de las cámaras cardiacas, llegando a quedar pequeña la prótesis valvular en algún momento, en relación con las necesidades fisiológicas del organismo en constante crecimiento, situación que se agrava en los casos de estenosis aórtica o mitral donde, de base, existe hipoplasia del anillo valvular (5).
Dado que la evidencia científica para la evaluación de prótesis valvulares en Pediatría es escasa, este artículo tiene como objetivo describir las técnicas y los métodos ecocardiográficos, con base en recomendaciones de las guías americanas de ecocardiografía (6), las cuales han sido modificadas y adaptadas a la población pediátrica.
Evaluación general
Se debe realizar una evaluación integral a fin de establecer una adecuada correlación entre los datos relacionados con el implante, el estado clínico y los hallazgos ecocardiográficos, con el objetivo de efectuar una aproximación clínica al estado de la válvula protésica.
Datos clínicos
Al iniciar la valoración de las prótesis valvulares, es conveniente indagar por información clínica relevante, especialmente datos de fecha e indicación del implante, tipo y tamaño de la válvula, síntomas o hallazgos clínicos relacionados, así como datos de presión arterial y frecuencia cardiaca, peso, talla y superficie corporal.
Evaluación ecocardiográfica bidimensional
Mediante una evaluación rigurosa se mide el tamaño de las cámaras cardiacas, el grosor de las paredes, el diámetro del tracto de salida del ventrículo izquierdo en mesosístole y de los anillos valvulares en telediástole, así como el diámetro de la aorta ascendente en telediástole. Igualmente, se hace una estimación de la presión sistólica en la arteria pulmonar; todas las mediciones llevadas a cabo se comparan con los valores Z respectivos, lo cual permite realizar una valoración objetiva y reproducible (7, 8).
De igual manera se evalúan los movimientos de apertura y cierre de las partes de la prótesis valvular, al igual que la presencia de calcificaciones valvulares, ecodensidades anormales o engrosamiento de la prótesis, características del anillo de sutura y movimientos de separación o rotación anormales durante el ciclo cardiaco (9).
Ecocardiografía Doppler
Las mediciones a través de la técnica Doppler se llevan a cabo en ritmo sinusal y con una frecuencia cardíaca dentro de los rangos normales para el paciente, y trata de evitarse la toma de éstas bajo llanto, fiebre, anemia y otras situaciones que producen un estado hiperdinámico, que altere los resultados obtenidos en el ecocardiograma (7).
Mediante Doppler continuo se determinan velocidades y gradientes a través de las prótesis valvulares, mediciones que son dependientes del tamaño, del tipo de la válvula y del flujo a través de la misma.
El cálculo del gradiente transvalvular, nativo o protésico, se realiza mediante la ecuación de Bernoulli simplificada, donde el gradiente equivale a 4 x V2, siendo V la velocidad pico del flujo transvalvular en metros por segundo (10).
Es por eso que el gradiente transvalvular sobrestima gradientes en situaciones donde se presentan velocidades de flujo elevadas, como en desigualdad prótesis-paciente, gasto cardiaco elevado y en prótesis de diámetro pequeño (11, 12).
De igual manera, es indispensable tener en cuenta el tipo de prótesis valvular, pues existen diferencias en el flujo y, por supuesto, en el gradiente transvalvular. Como se observa en la figura 1, en las bioprótesis la velocidad del flujo aumenta al pasar a través de la válvula; no obstante, este incremento se produce de manera simétrica, a diferencia de la prótesis mecánica con doble hemidisco, donde la velocidad del flujo aumenta en mayor proporción en la región central que en la periférica. Por esto las mediciones de Doppler transvalvular a través de prótesis mecánicas de doble hemidisco, sobreestiman gradientes con relación a las bioprótesis (13-15).
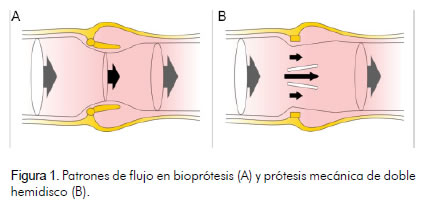
Funcionamiento normal de una prótesis
Se puede concluir que una prótesis tiene una función normal si cumple los siguientes parámetros:
• Presencia de movimiento adecuado de las partes de la prótesis y sin engrosamiento del anillo o de las válvulas.
• Área de orificio efectivo protésico adecuado para la superficie corporal del paciente.
• Ausencia de signos de repercusión hemodinámica, como aumento en el tamano de las cámaras o disfunción sistólica y/o diastólica de los ventrículos.
• Flujos Doppler normales a nivel de las válvulas protésicas, sin estenosis ni insuficiencia patológica; sin embargo, es importante destacar que las prótesis valvulares mecánicas poseen jets de lavado con características similares a los de insuficiencia valvular, y corresponden a componentes protectores que actúan como mecanismo antitrombótico, y se diferencian de la insuficiencia patológica por ser dos jets centrales y dos laterales delgados de baja velocidad y confluentes (6) (figura 2).
Funcionamiento anormal
Es un estado en el cual se identifica movimiento inadecuado de las válvulas, estenosis o insuficiencia valvular, engrosamiento del anillo y de las válvulas, o ambos, dilatación de las cámaras, signos de dehiscencia de suturas, trombosis, tromboembolia, pseudoaneurisma, endocarditis y tejido neoformado conocido como pannus el cual invade y causa disfunción protésica (6).
Desigualdad prótesis-paciente
Situación determinada por una prótesis valvular normofuncionante con mecanismos de oclusión y cierre adecuados, pero pequeña para las necesidades hemodinámicas en relación con la composición corporal del paciente, es decir, con alteración entre la relación del área efectiva del orificio protésico y el orificio valvular normal nativo de acuerdo con la superficie corporal. De esta manera hace que un mismo volumen pase a través de un orificio más pequeño (16).
La desigualdad prótesis-paciente es causada por el crecimiento normal del corazón y del paciente en relación con la prótesis implantada, con lo cual se produce un aumento de las velocidades de flujo transvalvular y, por tanto, de los gradientes, comportándose muy similar a un estado de estenosis valvular residual (17).
El impacto en la población pediátrica de la condición de desigualdad prótesis-paciente aún no está establecido, y la evidencia de esta condición sobre el desenlace clínico en la población adulta es controversial; sin embargo, se ha asociado con mejoría pobre de la clase funcional, menor regresión de la hipertrofia y sobrevida disminuida a corto y mediano plazo, especialmente si hay disfunción ventricular (18-22).
El área efectiva del orificio es la herramienta para establecer si existe o no desigualdad prótesis-paciente, la cual se calcula a partir de la ecuación de continuidad mediante el método Doppler. Una vez obtenida la medición se correlaciona con los valores Z correspondientes a la superficie corporal; si ésta es menor de Z -2 se propone como diagnóstico desigualdad prótesis-paciente.
Es importante destacar que el diámetro interno del anillo, estipulado por las casas productoras de la válvula, sobrestiman el orificio efectivo, y por ello no se tiene en cuenta este valor (6).
Cálculos hemodinámicos en prótesis aórticas
Velocidad pico y gradiente de presión transvalvular
El gradiente transvalvular depende de la velocidad del flujo captado por Doppler continuo, y equivale, según la fórmula de Bernoulli simplificada, a cuatro veces el cuadrado de la velocidad pico medida, menos la velocidad del tracto de salida del ventrículo izquierdo (TSVI) al cuadrado:
 P = 4 x (V2AoV – V2 TSVI)
P = 4 x (V2AoV – V2 TSVI)En la mayoría de los casos, los valores de velocidad del tracto de salida del ventrículo izquierdo al cuadrado son insignificantes comparados con la velocidad máxima aórtica y la ecuación de Bernoulli puede ser simplificada a:
 P = 4 x V2 AoV
P = 4 x V2 AoVPor lo tanto, se recomienda no usar la ecuación de Bernoulli simplificada cuando las velocidades de TSVI excedan de 1,5 m/s.
Cálculo del área efectiva del orificio (AEO)
Se obtiene con base en el principio de ley de conservación de masa, donde el volumen de sangre en el tracto de salida del ventrículo izquierdo es igual al volumen en la aorta; dicho volumen se mide a través de la ecuación de continuidad:
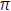 (radio TSVI)2 x VTI TSVI
(radio TSVI)2 x VTI TSVI
Donde:
DTSVI: corresponde al área de corte transversal proximal a la válvula, es decir, en el tracto de salida medido a 0,5 cm del anillo aórtico y equivale a: 2 (radio TSVI)2 o (Diámetro TSVI) x 0,786.
(radio TSVI)2 o (Diámetro TSVI) x 0,786.
VTI PrV: integral velocidad tiempo medida por Doppler continuo a través de la prótesis.
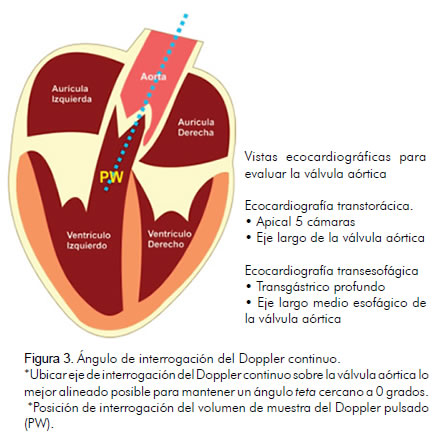
VTI TSVI: integral velocidad tiempo medida por Doppler pulsado en el tracto de salida del ventrículo izquierdo (figura 3).
El volumen latido equivale a: DTSVI x VTI TSVI
Se recomienda no usar el área de la válvula protésica pues normalmente existe discordancia entre esta medida y el área del tracto de salida (6).
Para realizar un cálculo adecuado y un análisis del área del orificio protésico efectivo se identifica o descarta la presencia de cortocircuitos que pueden afectar el flujo transvalvular, tal como sucede en la comunicación interauricular donde hay disminución del flujo a través de la válvula aórtica y mitral; por el contrario, el ductus arterioso persistente aumentaría dicho flujo. Se debe tener en cuenta que la medición del área del tracto de salida del ventrículo izquierdo, al ser estimada por presunciones de geometría circular, no puede valorarse en pacientes con obstrucciones a este nivel (15).
Estenosis valvular de la prótesis aórtica
Se identifica por la presencia de velocidad de flujo y gradiente transvalvular elevados, mayor duración de la sístole, pico de velocidad sistólico retrasado, tiempo de aceleración prolongado, contorno redondo simétrico del área bajo la curva del Doppler continuo y trastorno en la relación de integrales (23-27) (tabla 1).
Cada uno de estos hallazgos se intensifica con el aumento de la estenosis, a diferencia de un escenario con disfunción ventricular, donde una ligera elevación del gradiente puede indicar estenosis significativa.
Un parámetro interesante y de importancia especial en la población pediátrica, es la relación de integrales. Su valor corresponde a la integral velocidad tiempo en el tracto de salida del ventrículo izquierdo medido a través de Doppler pulsado y dividido por la integral velocidad tiempo del flujo transvalvular aórtico medido con Doppler continuo (24). Esta relación, a diferencia de los otros parámetros, no está afectada por condiciones de alto flujo a través de la válvula, que como se mencionó anteriormente, son situaciones frecuentes en el paciente pediátrico.
Desigualdad prótesis-paciente en válvula aórtica
Se caracteriza por elevación de velocidades y de gradientes, área de orificio efectivo menor que Z-2, movimientos adecuados de apertura y cierre de las partes de la prótesis valvular, tiempo de aceleración no prolongado e índice de integrales mayor que 0,25 (6).
Cabe resaltar que el diagnóstico de desigualdad prótesis-paciente es difícil de diferenciar de una situación funcional de alto flujo y de un patrón combinado con estenosis valvular protésica (28).
Insuficiencia valvular aórtica protésica
La insuficiencia valvular moderada a severa se caracteriza por un jet de insuficiencia que ocupe más de la tercera parte del diámetro del tracto de salida del ventrículo izquierdo e integral velocidad tiempo del flujo diastólico reverso en la aorta descendente mayor a 15 cm (6).
Métodos tales como tiempo de hemipresión, fracción y volumen regurgitante, los cuales son empleados comúnmente en la población adulta, no están avalados en la evaluación de valvulopatías y por tanto de prótesis valvulares en Pediatría (7).
Es importante destacar que los hallazgos ecocardiográficos deben correlacionarse con la situación clínica y con la presencia o no de trastornos anatómicos y/o funcionales de las cámaras cardiacas, tales como dilatación de cavidades y trastorno de la función sistodiastólica.
Evaluación de prótesis mitral
Estenosis mitral
La estenosis mitral se identifica mediante la elevación de la velocidad pico, gradiente medio y la integral velocidad tiempo mediante Doppler continuo a través del flujo transvalvular protésico (tabla 2).
De igual manera, se evalúa el área efectiva del orificio protésico de acuerdo con la ecuación de continuidad, estableciendo que el volumen latido, que fue calculado por la válvula aórtica, es similar al volumen que pasa a través de la válvula mitral, claro está, sin que haya trastornos anatómicos o funcionales que afecten la inferencia de esta medición, tal como la insuficiencia valvular mitral o aórtica significativa, así como la comunicación interventricular (24).
El gradiente medio transvalvular normal es menor de 5 a 6 mm Hg; sin embargo, en la población adulta se han reportado gradientes hasta de 10 a 12 mm Hg como normales en válvulas mecánicas tipo Starr-Edwards y St. Jude respectivamente (29), situación que también ha sido descubierta en la evaluación de nuestros pacientes pediátricos con prótesis mecánicas, donde se han encontrado estos gradientes, probablemente explicados por los cambios de velocidad transvalvular previamente descritos en la figura 1. No obstante, en estos pacientes se encuentran con índice de integrales normales y sin repercusión hemodinámica, evidenciada por ausencia de dilatación de cavidades o cambios en la velocidad de las venas pulmonares.
Cálculo del área efectivo del orificio protésico en posición mitral: volumen latido / VTI PrMV
Equivale a la relación entre el volumen latido del tracto de salida del ventrículo izquierdo y la relación de integrales velocidad tiempo a través de la prótesis mitral (30).
Evaluación de la relación de integrales de prótesis en posición mitral = VTI PrMV/ VTI TSVI
En esta ocasión y a diferencia de la evaluación de la prótesis aórtica, la integral de la prótesis mitral corresponde al numerador mas no al denominador. Es importante destacar que la relación de integrales es el mejor parámetro en población pediátrica y en condiciones de alto gasto cardiaco, pues no es tan afectada por estas situaciones como sí sucede con las otras mediciones (31).
Insuficiencia mitral
Se identifica mediante la presencia en el Doppler continuo de un jet regurgitante denso con onda sistólica máxima temprana, importante flujo de convergencia sistólico en el ventrículo izquierdo, aumento de la relación de integrales (VTI PrMV/ VTI LVOT) e incremento de la presión en la arteria pulmonar (32).
Medidas tales como área de orificio regurgitante, vena contracta, fracción regurgitante y radio de pisa no son medidas avaladas para definir la severidad de las lesiones valvulares en la población pediátrica y por tanto de la disfunción valvular protésica en este mismo grupo de pacientes (7).
Desigualdad prótesis-paciente en válvula mitral
Se identifica por un área efectiva menor que Z -2, las partes de la prótesis valvular con movimientos adecuados de apertura y cierre, tiempo de aceleración no prolongado e índice de integrales menor que 2,5 (33).
No obstante, el diagnóstico de desigualdad prótesis-paciente es difícil de diferenciar de una situación funcional de alto flujo y de un patrón combinado con estenosis valvular protésica (34).
Pruebas complementarias para diferenciar entre desigualdad prótesis–paciente y disfunción valvular protésica
Uno de los retos de la evaluación integral de las prótesis valvulares es diferenciar entre desigualdad prótesis-paciente y disfunción valvular protésica; incluso definir si hay una mezcla de estos dos estados, llega a ser un evento desafiante.
La cinefluoroscopia, el cateterismo cardiaco, la tomografía y la resonancia magnética son herramientas menos precisas, aunque complementarias, respecto a los métodos ecocardiográficos en la evaluación de prótesis valvulares (35).
La cinefluoroscopia permite visualizar la movilidad del mecanismo oclusor, así como también la tomografía, siendo esta última de gran utilidad además para evaluar pannus (36).
El cateterismo cardiaco permite la medición directa de presiones, gradientes y flujo. No obstante, el cálculo del gradiente transmitral requiere del uso de la presión en cuña de la arteria pulmonar, situación que conduce a sobreestimación de gradientes e infraestimación del área valvular efectiva (37).
¿Qué decisiones tomar respecto a la disfunción valvular protésica o la desigualdad prótesis-paciente?
Si la disfunción valvular o la desigualdad prótesis-paciente son catalogadas como severas, sin ninguna duda se debe realizar el cambio valvular; sin embargo, siempre es preciso evaluar de manera integral la repercusión hemodinámica de esta condiciones para poder sustentar la toma de una decisión quirúrgica en condiciones de afectación leves a moderadas.
Conclusión
La ecocardiografía Doppler es el método de elección para la evaluación y el seguimiento de la función de las válvulas cardíacas protésicas. La imagen Doppler con y sin color y las modalidades espectrales desempeñan un papel central en el análisis de la función protésica y cardíaca, permitiendo la identificación temprana de disfunción valvular y su repercusión hemodinámica. El paciente pediátrico impone retos particulares, para los cuales son indispensables la valoración completa, que incluye el estudio de la velocidad pico y el gradiente del flujo transvalvular, el área efectiva del orificio, la relación de integrales, el análisis de las características del jet valvular, la cuantificación de cámaras cardíacas y la determinación de la función ventricular.
Es importante recordar que las mediciones deben llevarse a cabo en condiciones cercanas a las basales, pues los parámetros se alteran en estados híper e hipodinámicos, y toda aquella intervención o manejo expectante en cuanto a la disfunción valvular protésica o desigualdad prótesis-paciente, requiere una evaluación integral.
CONFLICTOS DE INTERESES: los autores manifiestan no tener conflictos de intereses.
Biliografía
1. Van Doorn C, Yates R, Tsang V, deLeval M, Elliott M. Mitral valve replacement in children: mortality, morbidity and haemodynamic status up to medium term follow up. Heart. 2000; 84: 636-642. [ Links ]
2. Lam BK, Chan V, Hendry P, Ruel M, Masters R, Bedard P, et al. The impact of patient-prosthesis mismatch on late outcomes after mitral valve replacement. J Thorac Cardiovasc Surg. 2007; 133: 1464-73. [ Links ]
3. Karamlou T, Jang K, Williams WG, Caldarone CA, Van Arsdell G, Coles JG, et al. Outcomes and associated risk factors for aortic valve replacement in 160 children: a competing-risks analysis. Circulation. 2005; 112: 3462-9. [ Links ]
4. Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart. 2006; 92: 1022-9. [ Links ]
5. Muneretto C, Bisleri G, Negri A, Manfredi J. The concept of patient-prosthesis mismatch. J Heart Valve Dis. 2004; 13 (Suppl 1): S59-62. [ Links ]
6. Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography's Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009; 22 (9): 975-1014. [ Links ]
7. Lopez L, Colan SD, Frommelt PC, Ensing GJ, Kendall K, Younoszai AK, et al. Recommendations for quantification methods during the performance of a pediatric echocardiogram: a report from the Pediatric Measurements Writing Group of the American Society of Echocardiography Pediatric and Congenital Heart Disease Council. J Am Soc Echocardiogr. 2010; 23 (5): 465-95. [ Links ]
8. Chubb H, Simpson JM. The use of Z-scores in paediatric cardiology. Ann Pediatr Cardiol. 2012; 5 (2): 179-84. [ Links ]
9. Muratori M, Montorsi P, Teruzzi G, Celeste F, Doria E, Alamanni F, et al. Feasibility and diagnostic accuracy of quantitative assessment of mechanical prostheses leaflet motion by transthoracic and transesophageal echocardiography in suspected prosthetic valve dysfunction. Am J Cardiol. 2006; 97: 94-100. [ Links ]
10. Saad RM, Barbetseas J, Olmos L, Rubio N, Zoghbi WA. Application of the continuity equation and valve resistance to the evaluation of St. Jude Medical prosthetic aortic valve dysfunction. Am J Cardiol. 1997; 80 (9): 1239-42. [ Links ]
11. Marcus RH, Heinrich RS, Bednarz J, Lupovitch S, Abruzzo J, Borok R, et al. Assessment of small-diameter aortic mechanical prostheses: physiological relevance of the Doppler gradient, utility of flow augmentation, and limitations of orifice area estimation. Circulation. 1998; 98 (9): 866-72. [ Links ]
12. Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol. 2000; 36: 1131-41. [ Links ]
13. Rashtian MY, Stevenson DM, Allen DT, Yoganathan AP, Harrison EC, Edmiston WA, et al. Flow characteristics of four commonly used mechanical heart valves. Am J Cardiol. 1986; 58: 743-52. [ Links ]
14. Sprecher DL, Adamick R, Adams D, Kisslo J. In vitro color flow, pulsed and continuous wave Doppler ultrasound masking of flow by prosthetic valves. J Am Coll Cardiol. 1987; 9: 1306-10. [ Links ]
15. Kocis KC, Snider AR, Lupinetti FM, Bove EL. Doppler forward flow profiles of St. Jude Medical prosthetic valves in pediatric patients. Am J Cardiol. 1994; 74: 77-9. [ Links ]
16. Sachweh JS, Tiete AR, Mühler EG, Groetzner J, Gulbins H, Messmer BJ, et al. Mechanical aortic and mitral valve replacement in infants and children. Thorac Cardiovasc Surg. 2007; 55: 156-162. [ Links ]
17. Panidis IP, Ross J, Mintz GS. Normal and abnormal prosthetic valve function as assessed by Doppler echocardiography. J Am Coll Cardiol. 1986; 8: 317-26. [ Links ]
18. Daneshvar SA, Rahimtoola SH. Valve prosthesis-patient mismatch (VP-PM): a long-term perspective. J Am Coll Cardiol. 2012; 60 (13): 1123-35. [ Links ]
19. Dumesnil JG, Pibarot P. Prosthesis-patient mismatch and clinical outcomes: the evidence continues to accumulate. J Thorac Cardiovasc Surg. 2006; 131: 952-955. [ Links ]
20. Blais C, Dumesnil JG, Baillot R, Simard S, Doyle D, Pibarot P. Impact of valve prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circulation. 2003; 108: 983-8. [ Links ]
21. Tasca G, Brunelli F, Cirillo M, DallaTomba M, Mhagna Z, Troise G, et al. Impact of valve prosthesis-patient mismatch on left ventricular mass regression following aortic valve replacement. Ann Thorac Surg. 2005; 79: 505-10. [ Links ]
22. Blackstone EH, Cosgrove DM, Jamieson WR, Birkmeyer NJ, Lemmer JH Jr, Miller DC, et al. Prosthesis size and long-term survival after aortic valve replacement. J Thorac Cardiovasc Surg. 2003; 126: 783-96. [ Links ]
23. Otto CM, Pearlman AS, Comess KA, Reamer RP, Janko CL, Huntsman LL. Determination of the stenotic aortic valve area in adults using Doppler echocardiography. J Am Coll Cardiol. 1986; 7: 509-17. [ Links ]
24. Baumgartner H, Khan SS, DeRobertis M, Czer LS, Maurer G. Doppler assessment of prosthetic valve orifice area. An in vitro study. Circulation. 1992; 85 (6): 2275-83. [ Links ]
25. Grigg L, Fulop J, Daniel L, Weisel R, Rakowski H. Doppler echocardiography assessment of prosthetic heart valves. Echocardiography. 1990; 7 (2): 97-114. [ Links ]
26. Rosenhek R, Binder T, Maurer G, Baumgartner H. Normal values for Doppler echocardiographic assessment of heart valve prostheses. J Am Soc Echocardiogr. 2003; 16: 1116-27. [ Links ]
27. Zoghbi WA, Farmer KL, Soto JG, Nelson JG, Quinones MA. Accurate noninvasive quantification of stenotic aortic valve area by Doppler echocardiography. Circulation. 1986; 73: 452-9. [ Links ]
28. Hanayama N, Christakis GT, Mallidi HR, Joyner CD, Fremes SE, Morgan CD, et al. Patient prosthesis mismatch is rare after aortic valve replacement: valve size may be irrelevant. Ann Thorac Surg. 2002; 73: 1822-9. [ Links ]
29. Bitar JN, Lechin ME, Salazar G, Zoghbi WA. Doppler echocardiographic assessment with the continuity equation of St. Jude Medical mechanical prostheses in the mitral valve position. Am J Cardiol. 1995; 76: 287-93. [ Links ]
30. Dumesnil JG, Honos GN, Lemieux M, Beauchemin J. Validation and applications of mitral prosthetic valvular areas calculated by Doppler echocardiography. Am J Cardiol. 1990; 65: 1443-8. [ Links ]
31. Malouf JF, Ballo M, Connolly HM, Hodge DO, Herges RM, Mullany CJ, et al. Doppler echocardiography of 119 normal-functioning St. Jude Medical mitral valve prostheses: a comprehensive assessment including time-velocity integral ratio and prosthesis performance index. J Am Soc Echocardiogr. 2005; 18: 252-6. [ Links ]
32. Vitarelli A, Conde Y, Cimino E, Leone T, D'Angeli I, D'Orazio S, et al. Assessment of severity of mechanical prosthetic mitral regurgitation by transoesophageal echocardiography. Heart. 2004; 90: 539-44. [ Links ]
33. Masuda M, Kado H, Tatewaki H, Shiokawa Y,Yasui H. Late results after mitral valve replacement with bileaflet mechanical prosthesis in children: evaluation of prosthesis-patient mismatch. Ann Thorac Surg. 2004; 77: 913-7. [ Links ]
34. Alexiou C, Galogavrou M, Chen Q, McDonald A, Salmon AP, Keeton BK, et al. Mitral valve replacement with mechanical prostheses in children: improved operative risk and survival. Eur J Cardiothorac Surg. 2001; 20 (1): 105-13. [ Links ]
35. Bazeed MF, Moselhy MS, Rezk AI, Al-Murayeh MA. Low radiation dose non-contrast cardiac CT: is it of value in the evaluation of mechanical aortic valve. Acta Radiol. 2012; 53 (4): 389-93. [ Links ]
36. Cianciulli TE, Lax JA, Beck MA, Cerruti FE, Gigena GE, Saccheri MC, et al. Cinefluoroscopic assessment of mechanical disc prostheses: its value as a complementary method to echocardiography. J Heart Valve Dis. 2005; 14 (5): 664-73. [ Links ]
37. Schoenfeld MH, Palacios IF, Hutter AM Jr, Jacoby SS, Block PC. Underestimation of prosthetic mitral valve areas: role of transseptal catheterization in avoiding unnecessary repeat mitral valve surgery. J Am Coll Cardiol. 1985; 5 (6): 1387-92. [ Links ]













