Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Colomb. Cardiol. vol.22 no.3 Bogota May/June 2015
https://doi.org/10.1016/j.rccar.2015.03.010
http://dx.doi.org/10.1016/j.rccar.2015.03.010
Endocarditis de Libman-Sacks
Libman-Sacks endocarditis
Carolina Saldarriagaa, Ana G. Múneraa,b, Mauricio Duquea,c
a Universidad CES, Medellín, Colombia
b Hospital General de Medellín, Medellín, Colombia
c CES Cardiología, Medellín, Colombia
Recibido el 4 de junio de 2014
Aceptado el 20 de marzo de 2015
correo electrónico:mauricioduquemd@gmail.com(M.Duque).
Resumen
La endocarditis de Libman-Sacks es una manifestación cardiaca bien reconocida del lupus eritematoso sistémico en la que se observan vegetaciones valvulares estériles, con predominio en el lado izquierdo del corazón, especialmente en la válvula mitral. La mayoría de los pacientes son asintomáticos; sin embargo, en la presentación clínica la forma aguda puede imitar a la de una endocarditis infecciosa (endocarditis pseudoinfecciosa) y complicar tanto el diagnóstico diferencial como el tratamiento.
Se reporta el caso de un paciente de género masculino, de 63 años, quien manifestó signos y síntomas compatibles con endocarditis infecciosa, y cuyos diferentes estudios demostraron una endocarditis de Libman-Sacks que respondió de forma favorable al tratamiento inmunosupresor.
Palabras clave: Endocarditis. Imágenes de ecografía. Inflamación. Infección.
Abstract
The Libman-Sacks endocarditis is a well-recognized systemic lupus erythematosus manifestation in which cardiac valvular sterile vegetations are observed predominantly in the left side of the heart, especially in the mitral valve. Most patients are asymptomatic; however, the acute clinical presentation may mimic an infectious endocarditis (pseudo-infectious endocarditis) and complicate both the differential diagnosis and treatment.
The case of a 63 year-old male patient, who presented signs and symptoms consistent with infectious endocarditis and whose several studies demonstrated Libman-Sacks endocarditis and who responded favorably to immunosuppressive therapy, is reported.
Keywords:Endocarditis. Ultrasound images. Inflammation. Infection.
Introducción
La endocarditis de Libman-Sacks, también conocida como endocarditis verrucosa atípica, es una manifestación cardiaca bien reconocida del lupus eritematoso sistémico, encontrándose en uno de cada 10 pacientes con la enfermedad, en quienes se demuestran vegetaciones valvulares estériles, que afectan con mayor frecuencia las válvulas del lado izquierdo del corazón, en especial la valva posterior de la mitral. La mayoría son asintomáticos; sin embargo, la presentación clínica puede simular una endocarditis infecciosa que hace difícil el diagnóstico diferencial y el tratamiento. A continuación se reporta un caso clínico de endocarditis de Libman-Sacks que se asemejó a una endocarditis infecciosa y evolucionó de manera satisfactoria con el tratamiento inmunosupresor. Se hace, así mismo, una revisión de la literatura.
Caso
Paciente de género masculino, de 63 años, quien ingresó por un cuadro clínico de cuatro meses de evolución de disnea, edema de miembros inferiores, asociado a malestar general, fiebre subjetiva y artralgias de pequeñas articulaciones. Tenía antecedentes personales de hipertensión arterial y ex tabaquismo, y no refirió antecedentes familiares relevantes.
Al examen físico se halló alerta, orientado, afebril, con pulso de 100 latidos por minuto, frecuencia respiratoria de 18 respiraciones por minuto, presión arterial 132/70 mm Hg. Conjuntivas pálidas y cuello con ingurgitación yugular grado II. La auscultación cardiopulmonar reveló ruidos cardiacos rítmicos sin soplos, murmullo vesicular disminuido globalmente, con roncus escasos bibasales. Presentaba abdomen con hepatomegalia no dolorosa, extremidades con edema grado II con fóvea y pulsos conservados. Piel acartonada con sinovitis en carpo y en articulaciones metacarpofalángicas.
Los análisis de laboratorio revelaron elevación de reactantes de fase aguda, anemia normocítica normocrómica, linfopenia, trombocitosis, coombs directo positivo +++, y pruebas de función hepática y renal normales.
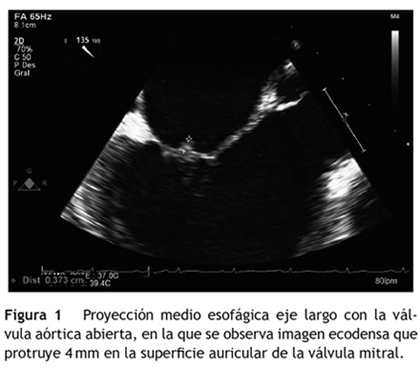
Desde su ingreso presentó picos febriles, por lo que se solicitaron hemocultivos y ecocardiografía transesofágica; esta última reportó engrosamiento del cuerpo de la valva anterior de la válvula mitral (grosor hasta de 6,0 mm), imagen ecodensa que protruía 4,0 mm en la superficie auricular de la válvula compatible con vegetación, insuficiencia mitral trivial con origen en la superficie de coaptación y derrame pericárdico trivial (fig. 1).
De acuerdo con este resultado y dados los picos febriles persistentes, se inició cubrimiento antibiótico para posible endocarditis infecciosa con ampicilina/sulbactam, vancomicina y gentamicina.
Los hemocultivos seriados fueron negativos.
Se obtuvieron resultados de estudios adicionales solicitados: VDRL reactivo 8 dils, factor reumatoideo positivo 296 UI/mL, ANAS positivos patrón homogéneo 1:1280, anti-DNA positivo 1:160, anti-Ro positivo 2,96, anti-La negativo y anti-Sm negativos. Hipocomplementemia C3 (70 mg/dL) y C4 (6 mg/dL) por nefelometría, anticuerpos anticardiolipina IgG (aCL) positivos 42 U y prueba presuntiva para virus de inmunodeficiencia humana negativa.
Estos resultados y la clínica del paciente configuraron el diagnóstico de lupus eritematoso sistémico y por tanto se consideró la posibilidad de endocarditis de Libman-Sacks.
Persistió con picos febriles y deterioro de su condición clínica a pesar del tratamiento antibiótico; presentó, además, cambios del comportamiento y alucinaciones auditivas. Se ordenó resonancia magnética cerebral que reportó en la secuencia de Flair y en el T2, múltiples focos de hiperintensidad en la sustancia blanca y en los centros semiovales en forma bilateral, con restricción en la difusión tisular, que sugirieron múltiples eventos isquémicos lacunares recientes. Fue valorado por Neurología que consideró compromiso por vasculitis lúpica del sistema nervioso central.
Se iniciaron esteroides sistémicos con metilprednisolona intravenosa y se continuó con prednisona oral a dosis de 1 mg/kg/día con lo cual se observó respuesta clínica adecuada, así como resolución del cuadro febril y de las alteraciones neuropsiquiátricas.
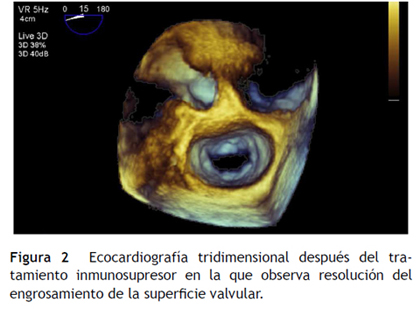
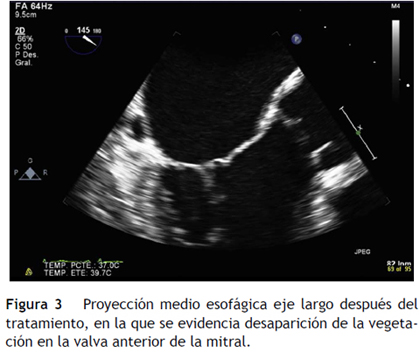
Una semana después se realizó ecocardiografía transesofágica de control que reportó disminución del grosor de la valva anterior de la mitral (entre 4,0 y 6,0 mm) y resolución de la vegetación evidenciada (figs. 2 y 3).
Generalidades
El lupus eritematoso sistémico es una enfermedad inflamatoria crónica, multisistémica, que afecta principalmente a las mujeres, con una relación mujer hombre de 9:1 y que se diagnostica generalmente entre los 20 y los 50 años; sin embargo entre el 15 y el 18,5% de los casos se diagnostica antes de los 18 años y entre el 18 y el 24,5% después de los 50 años de edad1.
Puede afectar cualquier estructura cardiaca durante su curso, en cuyo caso dicho compromiso cardiovascular constituye la causa principal de mortalidad en la fase no inicial, tal como lo describió Urowitz en su serie de Toronto desde 19702. Más del 50% de los pacientes tiene algún tipo de compromiso cardiaco, y muchos de estos son asintomáticos. Aunque no parece existir una diferencia marcada entre géneros, Molina et al.3 encontraron que los hombres de origen latino con lupus eritematoso sistémico presentaban más compromiso cardiopulmonar y trombosis vasculares.
Bertoli4 en la cohorte LUMINA (lupus in minorities, nature versus nurture), describió las diferencias entre el lupus eritematoso sistémico de inicio tardío (diagnóstico a los 50 años o más) y el de inicio temprano (40 años o menos al momento del diagnóstico); el análisis multivariado mostró que el subgrupo de inicio después de los 50 años presentó más compromiso neurológico, enfermedad cardiovascular e hipertrigliceridemia, mayor daño orgánico acumulado y mortalidad, que su contraparte de inicio antes de los 40 años. La evolución de esta cohorte muestra que el lupus eritematoso sistémico de inicio tardío no es una entidad benigna como lo han tratado de expresar algunos autores; si bien cursa con menor actividad de la enfermedad y menor frecuencia de nefropatía, tiene mayor índice de daño acumulado, más comorbilidades, mayor compromiso neurológico y cardiovascular y mayor mortalidad.
Compromiso cardiaco en el lupus eritematoso sistémico
La pericarditis tradicionalmente ha sido la manifestación cardiaca más frecuente del lupus, de hecho, puede ser el síntoma de presentación en un 2% de los casos. Debido a la inmunosupresión los pacientes lúpicos pueden desarrollar pericarditis infecciosa por Salmonella, Candida y micobacterias5.
La miocarditis clínicamente evidente es rara en el lupus eritematoso sistémico; la mayoría de los estudios han mostrado una prevalencia cercana del 10%5.
En estos pacientes se han descrito varias anormalidades valvulares, incluyendo endocarditis de Libman-Sacks, engrosamiento valvular, insuficiencia y estenosis valvular5. Un estudio con ecocardiografía transesofágica demostró una prevalencia de anormalidades valvulares del 61% en pacientes con lupus eritematoso sistémico comparado con 9% en los controles, con vegetaciones en el 43% de los pacientes con lupus vs. con ninguna en los controles. También se encontró mayor incidencia de prolapso de la válvula mitral en lupus eritematoso sistémico, aproximadamente en 25% de los casos vs. 9% de controles6.
Epidemiología
Como ya se expresó, la endocarditis de Libman-Sacks es una manifestación cardiaca bien reconocida del lupus eritematoso sistémico, en la que se encuentran vegetaciones valvulares estériles o masas. La descripción inicial fue hecha por Emanuel Libman y Benjamin Sacks en 1923, quienes reportaron lesiones valvulares en cuatro pacientes con lupus eritematoso sistémico con compromiso de la válvula tricúspide7.
La prevalencia actual de la endocarditis de Libman-Sacks ha disminuido desde la introducción del tratamiento esteroide; se encuentra en uno de cada 10 pacientes con lupus. Los hallazgos ecocardiográficos anormales pueden ser sugestivos, pero el diagnóstico definitivo requiere evaluación del tejido patológico8.
Características anatómicas
Las verrucosidades generalmente son pequeñas (1-4 mm de diámetro), inmóviles, en forma de guisante, aplanadas o levantadas; más frecuentemente afectan las válvulas del lado izquierdo, en especial la valva posterior de la mitral hacia la superficie auricular, pero pueden comprometer cualesquiera de las cuatro válvulas cardiacas, o múltiples válvulas simultáneamente. Adicionalmente, las lesiones verrucosas se pueden encontrar en las cuerdas tendinosas, la superficie endocárdica y los músculos papilares. El compromiso valvular del lado derecho es menos común9.
Patogénesis
Se plantea que la patogénesis de la enfermedad es secundaria al depósito de trombos de fibrina y plaquetas en las válvulas ya afectadas por daño inmunológico mediado por complejos inmunes10. Los anticuerpos antifosfolípidos aceleran la formación de trombos y generan mayor daño valvular e inflamación. Se ha reportado que el riesgo de enfermedad valvular depende del subtipo de aPL, siendo mayor para anticoagulante lúpico e IgG anticardiolipina (aCL)11.
Características ecocardiográficas
Se han descrito dos patrones morfológicos ecocardiográficos: masas valvulares (vegetaciones) y engrosamiento valvular. En la ecocardiografía las vegetaciones aparecen como masas de diferente tamaño, con bordes irregulares, adheridas firmemente a la superficie valvular y que no exhiben movimiento independiente de la valva, con una localización predominante en la porción proximal y media de las valvas12.
Diagnóstico diferencial
Este comprende la enfermedad valvular reumática, la endocarditis infecciosa y la endocarditis trombótica no bacteriana (marántica).
En los pacientes con lupus eritematoso sistémico el engrosamiento de las valvas generalmente es difuso y no localizado en las puntas de estas como es el caso típico de la enfermedad reumática. Cuando el compromiso está localizado en el lupus eritematoso sistémico tiende a comprometer más la porción basal o media de las valvas; la calcificación no es una característica prominente en lupus y el compromiso del aparato subvalvular es mínimo13.
Las vegetaciones en lupus eritematoso sistémico difieren de las infecciosas en su localización, apariencia y movilidad. Estas se localizan predominantemente cerca de la base de las valvas, mientras que las infecciosas casi siempre se ubican en la línea de cierre de las valvas. Las vegetaciones del lupus eritematosos sistémico son de ecodensidad heterogénea y usualmente muestran regiones centrales con alta reflexión, que sugiere tejido conectivo o calcificación, en tanto que las vegetaciones de la endocarditis infecciosa usualmente demuestran densidad homogénea de tejido blando. Así mismo, las vegetaciones del lupus no tienen movimiento independiente, se mueven paralelo al movimiento de la valva afectada, a diferencia de la endocarditis infecciosa donde las vegetaciones tienen movimiento vibratorio o rotatorio, por lo menos en parte independiente del movimiento de la válvula12.
En la endocarditis marántica las vegetaciones usualmente se hallan adheridas a la línea de cierre de la válvula12.
Presentación clínica
La mayoría de los pacientes con lesiones de Libman-Sacks son asintomáticos, sin embargo, la presentación clínica puede imitar a la de una endocarditis infecciosa con signos y síntomas que incluyen fiebre, artritis, nuevo soplo de regurgitación valvular con evidencia de vegetación, hemorragias en astilla, hipocomplementemia, niveles elevados de anticuerpos antifosfolípidos y hemocultivos negativos10. Algunos autores sugieren que tres exámenes de laboratorios simples ayudan en el diagnóstico diferencial:
- Recuento de leucocitos: si es bajo apunta hacia actividad lúpica únicamente y si se está muy elevado hacia una endocarditis infecciosa.
- Proteína C reactiva: los pacientes con lupus eritematoso sistémico usualmente no desarrollan una respuesta marcada de esta proteína con la actividad lúpica únicamente y su elevación significativa sugiere un proceso infeccioso concurrente.
- Niveles de aPLs: los niveles positivos bajos están a favor de la endocarditis infecciosa, mientras que los niveles moderados a altos apuntan hacia actividad lúpica10.
Las principales complicaciones de la endocarditis de Libman-Sacks son la insuficiencia valvular, la endocarditis infecciosa y las tromboembolias14.
Tratamiento
El tratamiento de cualquier compromiso cardiaco en lupus eritematoso sistémico depende de su severidad. La arteritis coronaria, la miocarditis sintomática y la valvulitis usualmente requieren dosis altas de corticosteroides, con o sin tratamiento adjunto con ciclofosfamida o azatioprina. Sin embargo, no hay evidencia de que el tratamiento con esteroides pueda prevenir el daño valvular15.
La anticoagulación a largo término está claramente indicada como prevención secundaria en pacientes con enfermedad valvular con aPLs que ya han experimentado un evento embólico. El que la sola presencia de altos títulos de aPLs en pacientes con enfermedad valvular documentada sea una indicación de anticoagulación profiláctica, amerita mayor evidencia15.
El manejo quirúrgico de la enfermedad valvular por lupus eritematoso sistémico tiene las mismas indicaciones que el manejo de las valvulopatías por otras causas. Las bioprótesis se han asociado con complicaciones como valvulitis recurrente; por tanto, el reemplazo con válvula mecánica parece ser la mejor opción en los pacientes con lupus15.
Discusión
En el caso expuesto se confirmó el diagnóstico de lupus eritematoso sistémico de inicio tardío con criterios de clasificación: ANAS positivos, inmunológicos (anti-DNA positivo, IgGaCL, VDRL reactivo, hipocomplementemia), compromiso articular, hematológico (anemia hemolítica autoinmune y linfopenia) y serositis (derrame pericárdico), con evidencia de compromiso neuropsiquiátrico y cardiovascular consecuente con endocarditis de Libman-Sacks de la válvula mitral, siendo este el compromiso valvular más frecuente de acuerdo con lo publicado en estudios previos. El cuadro clínico inicial sugirió endocarditis infecciosa con importante elevación de la proteína C reactiva y síndrome febril, sin embargo la evolución clínica, los altos títulos de aPLs, los leucocitos en el límite inferior, los hemocultivos negativos, la ausencia de respuesta al tratamiento antibiótico y la respuesta satisfactoria al manejo inmunosupresor con esteroides reafirmaron el diagnóstico de endocarditis de Libman-Sacks.
Conclusión
La endocarditis de Libman-Sacks es una manifestación cardiaca reconocida del lupus eritematoso sistémico, que se encuentra en uno de cada 10 pacientes con la enfermedad y puede ser la forma de manifestación en algunos de estos. Tiene predilección por las válvulas del lado izquierdo del corazón, siendo el compromiso de la válvula mitral el más prevalente. El compromiso valvular en el lupus eritematoso sistémico se asocia con la presencia de anticuerpos aPLs, especialmente IgGaCL. El curso clínico usualmente es asintomático pero en algunos casos puede llevar a disfunción valvular (en especial insuficiencia) y complicaciones tromboembólicas (principalmente accidente cerebrovascular). La forma aguda puede simular el cuadro de una endocarditis infecciosa y el diagnóstico diferencial es esencial para el tratamiento adecuado.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Gómez J.A., López F., Molina J.F. Manifestaciones cardiacas de las enfermedades reumáticas. Rev Colomb Reumatol.. 2002;9(3):203-13. [ Links ]
2. Urowitz M.B., Gladman D.D. Acclerated atheroma in lupus-background. Lupus. 2000;9:161-5. [ Links ]
3. Molina J.F., Drenkard C., Molina J., Uribe O., Anaya J.-M. Systemic lupus erythematosus in males. A study of 107 latinamerican patients. Medicine.. 1996;73:124-30. [ Links ]
4. Bertoli A., Alarcón G., Calvo-Alén J. Systemic lupus erythematosus in a multietnic US cohort. Clinical features, course, and outcome in patients with late-onset disease. Arth Rheum.. 2006;54(5):1580-7. [ Links ]
5. Villa-Forte A., Mandell B. Cardiovascular disorders and rheumatic disease. Rev Esp Cardiol.. 2011;64(9):809-17. [ Links ]
6. Roldan C., Shively B., Crawford M. An echocardiographic study of valvular heart disease associated with systemic lupus erythematosus. N Engl J Med.. 1996;335:1424-30. [ Links ]
7. Libman E., Sacks B. A hither to undescribed form of valvular and mural endocarditis. Arch Intern Med.. 1924;33:701-37. [ Links ]
8. Tektonidou M.M. Libman-Sacks endocarditis in systemic lupus erythematosus: prevalence, associations, andevolution. Am J Med.. 2007;120:636-42. [ Links ]
9. Galve E., Candell-Riera J., Pigrau C., Permanyer-Miralda G., Garcia-Del-Castillo H., Soler-Soler J. Prevalence, morphologic types, and evolution of cardiac valvular disease in systemic lupus erythematosus. N Engl J Med.. 1988;319:817-23. [ Links ]
10. Asherson R., Cervera R. Antiphospholipid anti bne cardiologist. Circulation.. 1991;84:920-3. [ Links ]
11. Zuily S., Regnault V. Increased risk for heart valve disease associated with antiphospholipid antibodies in patients with systemic lupus erythematosus meta-analysis of echocardiographic studies. Circulation.. 2011;124:215-24. [ Links ]
12. Omdal R., Lunde P., Rasmussen K., Mellgren S.I., Husby G. Transesophageal and transthoracic echocardiography and Doppler-examination in systemic lupus erythematosus. Scand J Rheumatol.. 2001;30:275-81. [ Links ]
13. Hojnik M., George J., Ziporen L. Heart valve involvement (Libman-Sacks endocarditis) in the antiphospholipid syndrome. Circulation.. 1996;92:1579-87. [ Links ]
14. Jensen K., Svenungsson E., de U. Cardiac valvular abnormalities are frequent in systemic lupus erythematosus with manifest arterial disease. Lupus.. 2002;11:744-52. [ Links ]
15. Doherty N.E., Siegel R.J. Cardiovascular manifestation of systemic lupus erythematosus. Am Heart J.. 1985;110:1257-65. [ Links ]