Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cardiología
versión impresa ISSN 0120-5633
Rev. Colomb. Cardiol. vol.23 no.4 Bogota jul./ago. 2016
https://doi.org/10.1016/j.rccar.2016.02.003
http://dx.doi.org/10.1016/j.rccar.2016.02.003
Terapia con anticuerpos monoclonales en Cardiología y Medicina Interna
Monoclonal antibody therapy in Cardiology and Internal Medicine
Christian David Adams-Sánchez a, Gabriel Jaime Tobón-García b
a Departamento de Medicina Interna, Universidad ICESI y Fundación Clínica Valle de Lili, Cali, Colombia
b Departamento de Medicina Interna y Reumatología, Fundación Valle de Lili, Cali, Colombia
Correo electrónico:Christian.adams.00@gmail.com(Christian David Adams-Sánchez)
Recibido el 4 de diciembre de 2015; Aceptado el 26 de febrero de 2016
Resumen
La terapia biológica basada en anticuerpos monoclonales, constituyen una nueva herramienta terapéutica, que de la mano del desarrollo de la biología molecular permiten intervenir puntos claves en la etiopatogenia de la enfermedad, permitiendo una terapia personalizada. Se han desarrollado nuevos anticuerpos monoclonales que intervienen en las enfermedades cardiovasculares, por lo que el entendimiento de los principios terapéuticos, los tipos y el mecanismo de acción de estos fármacos es esencial para un uso adecuado. En este artículo se discutirá el perfil de los anticuerpos monoclonales en la enfermedad cardiovascular, como los inhibidores de la PCSK-9 y el antídoto del Dabigatran, pasando por las moléculas ya conocidas como el abciximab, el antídoto de la digoxina y la terapia inmunomoduladora en el trasplante cardiaco. Del mismo modo, se evalúa una posible aplicación de los anticuerpos monoclonales usados en reumatología que podrían tener un papel importante en el manejo de las enfermedades cardiovasculares.
Palabras clave: Farmacología. Inmunología. Anticuerpos. Enfermedades cardiovasculares. Colesterol LDL.
Abstract
The monoclonal antibodies (mAb) constitute a new therapeutic tool in cardiovascular medicine, based in the development of the molecular biology in this area. The understanding of therapeutic principles, types and mechanism of action of these drugs is essential for proper use and management of adverse reactions. We discuss the profile of the PCSK-9 inhibitors, the Dabigatran antidote, the abciximab, the digoxin antidote, the therapy in heart transplantation, and a possible cardiovascular use of monoclonal antibodies used in rheumatology.
Keywords: Pharmacology. Immunology. Antibodies. Cardiovascular diseases. Low density lipoproteins cholesterol.
Introducción
Con el advenimiento de la terapia biológica basada en anticuerpos monoclonales (AcM), las posibilidades terapéuticas están en constante expansión, todo de la mano del desarrollo de la biología molecular donde el mayor entendimiento de la fisiopatología de las enfermedades genera nuevos blancos que impactan en la etiopatogenia de la enfermedad, permitiendo una terapia personalizada1–3.
Esta revisión pretende proporcionar: un panorama de los principios biológicos, el desarrollo, los objetivos terapéuticos, la farmacología y las reacciones adversas de los AcM de uso en la medicina cardiovascular.
Para entender los principios terapéuticos de la terapia con los AcM, se debe comprender los principios estructurales y funcionales de los anticuerpos, los cuales se vienen describiendo desde el año 1960, luego las técnicas de producción y sus primeros usos terapéuticos en medicina de trasplantes hacia el año 1986 con la utilización del muromonab (anticuerpo anti-CD3). Desde este punto, el desarrollo ha tenido importantes avances en la inmunomodulación, permitiendo amplias estrategias terapéuticas en: la reumatología, la hematooncología y los trasplantes. Esta experiencia se ha podido extrapolar a otras especialidades como: la medicina interna y la cardiología, donde la intervención de diferentes moléculas permite alterar el curso fisiopatológico de distintos fenómenos biológicos que derivan en la enfermedad cardiovascular3.
Metodología
Se realizó una búsqueda de la literatura para identificar los artículos de revisión sistemática, las series de casos, los metaanálisis o los estudios prospectivos sobre el tema publicados hasta septiembre de 2015 en Pubmed. Los criterios de búsqueda se basaron en términos MeSH como “monoclonal antibodies” y “cardiovascular disease” o “cardiology”, analizando los artículos más relevantes sobre el tema, de ahí se seleccionaron las terapias más relevantes y se realizó una búsqueda sistemática de ensayos clínicos sobre cada molécula para una revisión sistemática en cada grupo terapéutico.
Estructura y función
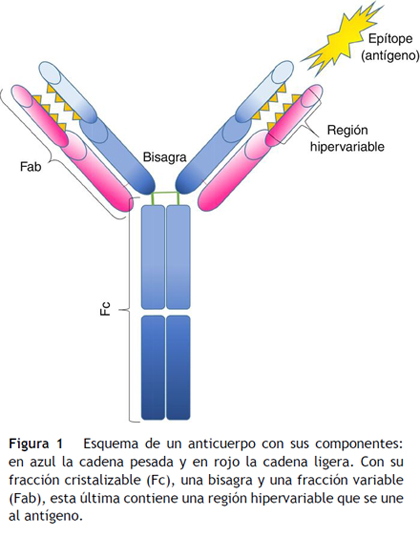
Los anticuerpos (o inmunoglobulinas) son moléculas producidas por los linfocitos B, y se componen de: 4 cadenas polipeptídicas, 2 pesadas y 2 ligeras, que se unen con una disposición de “Y”. Su estructura se puede dividir en una fracción cristalizable (Fc), una bisagra y una fracción variable (Fab), esta última con una región hipervariable1,4, (fig. 1). Estas moléculas pueden circular unidas a las membranas celulares o de manera soluble en el suero.
El uso terapéutico de los AcM se inicia desde el año 1975 en Cambridge, gracias a los doctores Georges Köhler y Cesar Milstein, quienes diseñan una técnica llamada hibridoma que usa células murinas para la producción de AcM contra una amplia variedad de antígenos (por medio de fusión de células murinas de mieloma inmortales con células esplénicas tipo B de animales hiperinmunes), lo que los hizo acreedores del Premio Nobel de Medicina y Fisiología en el año 19845,6. La producción industrial actual se realiza por la tecnología de ADN recombinante, usando sistemas de expresión celular de mamíferos4. Su aplicación clínica se inicia con el muromonab (anticuerpo murino contra el CD3) con una respuesta clínica importante en el manejo del rechazo de trasplante, aunque su uso fue limitado por la barrera inmunológica que generaba el receptor de los anticuerpos humanos lo que hacía que su eficacia fuera menor1. Por lo anterior, se tuvieron que desarrollar estrategias de recombinación de ADN, para diseñar moléculas más humanizadas o humanas que disminuyeran la inmunogenicidad de los AcM y pudieran facilitar la generación de mecanismos efectores en las células humanas por medio de los receptores Fc. La modificación inicial fueron los anticuerpos quiméricos que tenían secuencias murinas en la región Fab y secuencias humanas en el resto de su estructura, lo que mejoró el perfil farmacológico de la molécula1. Un ejemplo de este grupo es el abciximab, introducido en el año 19945. La tecnología, posteriormente permitió sustituir las secuencias murinas por humanas, exceptuando las regiones determinantes para la unión de antígenos generando los anticuerpos humanizados. Estas moléculas humanizadas tenían una mejor tolerancia. Subsecuentes avances lograron el desarrollo de una plataforma de fagos o por células de ratones transgénicos, que permite reemplazar en el ADN de las células madre los locus que codifican las inmunoglobulinas murinas por humanas, creando ratones transgénicos que producen las inmunoglobulinas humanas, lo que permitió el desarrollo de los AcM totalmente humanos donde el Anti-TNF adalimumab fue el primer medicamento de este grupo7.
Por tanto, los AcM se pueden dividir así (fig. 2)2,8:
- Murinos (sufijo:–omab): son 0% humanos, con alto potencial inmunogénico.
- Quiméricos (-ximab): 66% humanos, potencial inmunogénico intermedio.
- Humanizados (-zumab): 90% humanos, potencial inmunogénico bajo.
- Humanos (-umab): 100% humanos, potencial inmunogénico muy bajo.
Mecanismo de acción
El mecanismo de acción de los AcM se debe a la unión sobre la molécula blanco, los cuales pueden ser: receptores de superficie de membrana, proteínas asociadas a un sistema enzimático o proteínas circulantes, causando un efecto directo o indirecto sobre la función de un tejido9.
La región Fab que se une al antígeno no es la única que tiene un efecto terapéutico, en algunos casos la fracción cristalizable (Fc) también tiene efectos indirectos, estimulando el reclutamiento de las células efectoras, como las células inmunitarias citotóxicas y activando la cascada del complemento. También existe un efecto que se llama inmunoconjugación en la que el AcM se une a: los medicamentos, las toxinas, los radioisótopos o las citoquinas para permitir un efecto muy específico4.
Los AcM pueden ser administrados de manera parenteral por las rutas: intravenosa, subcutánea o intramuscular. Su administración puede estar asociada a reacciones infusionales. La vía intravenosa, es la más usada por la alta biodisponibilidad (cercana al 100%)1, con una difusión asociada al tamaño molecular, la polaridad, la lipofilidad, la concentración, la presión hidrostática y la afinidad por su molécula blanco9. Su eliminación se da principalmente por 2 vías: por endocitosis del complejo inmune (Ac–Ag) con degeneración lisosomal posterior, o por aclaramiento de la célula o molécula del sistema retículo endotelial. El tiempo de depuración es variable siendo más corto para los murinos (horas a días) y más largo para los humanos (semanas)1. La vía de excreción hepática o renal no tiene un papel significativo. El perfil de interacciones es muy bajo por su especificad terapéutica4.
Las reacciones adversas se pueden dividir principalmente en dos: la primera es el efecto del AcM sobre su proteína objeto que genera una alteración fisiológica significativa, como la de los anticuerpos contra el TNF alfa que se usa con fines antiinflamatorios y puede generar inmunosupresión, favoreciendo el desarrollo de infecciones, principalmente tuberculosis. El otro tipo de reacción adversa es la interacción del AcM o de la proteína intervenida sobre otros tejidos o sistemas enzimáticos diferentes a los esperados, como la inflamación epidérmica de los anticuerpos contra los factores de crecimiento epidérmicos en el manejo del cáncer2. Otras reacciones adversas son: las reacciones de hipersensibilidad por el síndrome de liberación de citoquinas, las desencadenadas por el excipiente o por la inmunogenicidad del AcM, cuya severidad es variable, pudiendo causar un compromiso anafiláctico2, e inclusive el síndrome coronario agudo como el síndrome de Kounis10. En varias revisiones sistemáticas se han evaluado los efectos cardiovasculares, donde no se ha visto un efecto adverso significativo que contraindique su uso en pacientes con enfermedad cardiaca.
La inmunogenicidad del AcM puede causar la generación de anticuerpos neutralizantes por parte del paciente, lo que se conoce como la respuesta antianticuerpo, lo que se asocia a una disminución en la eficacia y seguridad del AcM, en los anticuerpos murinos se presenta en el 84%, mientras que en los quiméricos en el 40%, en los humanizados en un 9% de los pacientes4.
Aplicaciones en Cardiología
A continuación se describen los avances principales de los AcM utilizados en cardiología según las principales indicaciones (tabla 1).
Antiplaquetarios
Abciximab: es un AcM quimérico, cuya fracción Fab (fracción ligadora de antígeno) está dirigida contra la glicoproteína IIb/IIIa plaquetaria, utilizada para la prevención de complicaciones trombóticas de las intervenciones coronarias percutáneas en el infarto agudo de miocardio con elevación de ST con evidencia angiográfica de trombo masivo, no reflujo o complicaciones trombóticas. Como reacciones adversas se presentan: la hipersensibilidad y la inmunogenicidad por sus características moleculares, y riesgo de sangrado en alrededor del 3.9% de los casos y la trombocitopenia inmune en el 10% de los pacientes después de la segunda aplicación8,11.
- Estudio CAPTURE: el abciximab en angina inestable refractaria en pacientes llevados a angioplastia. Estudio aleatorizado, controlado con placebo, multicéntrico involucrando 1.265 pacientes. El desenlace primario fue: muerte, infarto de miocardio, o reintervención urgente en los primeros 30 días. El uso de este anticuerpo redujo el desenlace primario (p: 0.012), sin reacciones adversas de importancia12.
- Estudio TIMI 14: demostró que el uso del abciximab puede ayudar a reducir la dosis de medicación trombolítica para un flujo TIMI 3, sin riesgo de sangrado13.
- Estudio GUSTO IV-ACS: el abciximab en pacientes con síndrome coronario agudo sin revascularización temprana. Estudio aleatorizado, multicéntrico, controlado con placebo involucrando 7.800 pacientes. El desenlace primario fue: muerte o infarto cardiaco en los primeros 30 días. En este estudio no se demostró beneficio de la infusión de 24 o 48 horas comparadas con el placebo (OR 1,0 IC 0,83-1,24). Dentro de los efectos adversos se evidenció mayor incidencia de la trombocitopenia, sin aumento el riesgo de sangrado14.
- Estudio BRAVE-3: este estudio aleatorizado, metacéntrico, controlado con placebo utilizó el abciximab en pacientes con infarto agudo de miocardio con elevación de ST en las primeras 24 horas previo a cateterismo. El estudio involucró 800 pacientes, cuyo desenlace fue el tamaño del infarto medido por Sestamibi. El uso de este AcM no mostró diferencia en el descenlace primario (p: 0,47), con aumento del riesgo de sangrado en el 1,8%15.
- Estudio INFUSE-AMI: este estudio aleatorizado, metacéntrico, abierto, estudió el uso del abciximab intracoronario en pacientes con infarto anterior extenso en 452 pacientes. El desenlace primario fue el tamaño del infarto determinado por resonancia magnética a los 30 días. La intervención redujo el tamaño del infarto de forma significativa (IC: 6,8% - 22,7%. p: 0,03)16.
Antídotos
Idarucizumab: es un AcM humanizado, cuya fracción Fab se une al dabigatran, con una afinidad 350 veces mayor del anticoagulante por el anticuerpo que por la trombina, lo que revierte su efecto desde el primer minuto de la infusión. Estudios realizados reportan efectos colaterales menores como la cefalea y el flush en pacientes con hemorragias asociadas al dabigatran17.
-
Estudio RE-VERSE AD: este estudio utilizó 5 gr intravenosos de este AcM para revertir el efecto del dabigatran en pacientes con sangrado serio o que requieren procedimientos urgentes. Involucró 90 pacientes, cuyo desenlace primario es el porcentaje de reversión del efecto del dabigatran en las primeras 4 horas. Se demostró un 100% de reversión en los primeros minutos, sin evidencia de efectos adversos atribuibles a la terapia18.
Antídoto contra la digoxina: el uso de la fracción Fab de origen ovino contra la digoxina (digibind), se indica en intoxicación aguda o crónica por este medicamento, manifestada con: las arritmias, la hiperpotasemia, o la inestabilidad hemodinámica asociada a concentraciones séricas mayores de 2 ugr/L (2.6 nmol/L), con una efectividad de reversión de la toxicidad del 50 al 80%. Dentro de las reacciones adversas se incluyen empeoramiento de la falla cardiaca, la hipopotasemia y la alergia (< 10% casos)19.
Trasplante de corazón
Muromonab (OKT3): el AcM murino contra el complejo CD3 de los linfocitos T, causando una disminución de estas células evitando el rechazo del órgano. Es utilizado en trasplante del corazón con rechazo agudo resistente a esteroides como complemento a la terapia con: ciclosporina o tacrolimus y micofenolato o azatioprina. Para demostrar su utilidad se deben medir los niveles de células CD3 basales y a los 4 días donde se espera un descenso a menos de 50 células en la citometria de flujo. Por ser un AcM murino presenta una alta incidencia de síndrome de liberación de citoquinas (70-100%), edema pulmonar (10-20%), inmunosupresión con infecciones (36%) y desarrollo de linfoma asociado a infección por virus Epstein Barr, por lo que su uso ha caído a menos del 1% de los trasplantes8,20.
Basiliximab: es un AcM quimérico contra el receptor IL-2, usado como terapia de inducción para reducir el rechazo agudo en el período postrasplante o contra el rechazo del injerto cardiaco. Su efectividad es menor que la inmunoglobulina antitimocito de conejo en rechazo agudo. Este medicamento posee baja incidencia de síndrome de liberación de citoquinas (en un 10% de los casos) y de anticuerpos contra la quimera comparado con los AcM murinos, al igual que cierto grado de inmunosupresión que favorece infecciones en especial por citomegalovirus, especialmente, cuando se usan con otros inmunosupresores8,20,21.
Daclizumab: este es un AcM humanizado contra la IL-2, utilizada como terapia de inducción en el trasplante cardiaco con menor perfil de inmunogenicidad que los otros AcM de este grupo, aunque su evidencia es contradictoria en la incidencia de rechazo agudo postrasplante tendiente a ser menor. También existen reportes sobre un posible aumento de mortalidad asociado a esta medicación8.
Moduladores de inflamación
Pexelizumab: es un AcM humanizado contra la proteína del complemento C5, bloqueando la formación del complejo de ataque de la membrana (C5b-9), lo cual se traduce en una disminución de la apoptosis celular. Tiene varios estudios en el infarto agudo de miocardio con elevación de ST y la cirugía cardiaca, en especial en la revascularización coronaria buscando disminuir el daño celular por isquemia y la reperfusión. Su efecto dura el tiempo durante el cual es infundido sin efectos adversos de importancia22.
- Estudio COMMA: el pexelizumab en infarto agudo de miocardio con elevación de ST tratado con angioplastia. Es un estudio aleatorizado, metacéntrico, placebo controlado. El desenlace primario fue el tamaño del infarto en 960 pacientes. La intervención en forma de bolo e infusión o solo bolo, no generó diferencias en el tamaño del infarto determinado por el área bajo la curva de creatina kinasa MB (p: 0,89), aunque la mortalidad a 90 días fue menor en el grupo de intervención (p: 0,014)23.
- Estudio COMPLY: el pexelizumab como terapia adjunta a fibrinólisis en infarto agudo de miocardio. Es un estudio aleatorizado, metacéntrico, placebo controlado. El desenlace primario fue el tamaño del infarto determinado por creatina kinasa MB. La intervención fue igual que en el estudio COMMA incluyendo 920 pacientes. Con relación a los desenlaces no se observaron diferencias en ninguno de los grupos (p: 0,85), ni diferencias en mortalidad o incidencia de infecciones24.
- Estudio APEX AMI: el pexelizumab en el infarto agudo de miocardio llevados a intervención coronaria percutánea. Es un estudio aleatorizado, metacéntrico, doble ciego, placebo controlado. El desenlace primario fue la mortalidad a 30 días en 5.745 pacientes. La intervención no demostró cambios en la mortalidad con respecto al placebo (IC 0,8 - 1,35. p: 0,78)25.
-
Estudio PRIMO-CABG: el pexelizumab en revascularización coronaria con el tiempo de clamp aórtico extendido con o sin cirugía valvular. Es un estudio multicéntrico, aleatorizado, placebo controlado. El desenlace primario fue compuesto en mortalidad e infarto postoperatorio a 30 días en 3.099 pacientes. La intervención redujo significativamente el desenlace de los pacientes sometidos a clamp aórtico prolongado (> 90 min.) con una p: 0,04326.
Tocilizumab: es un AcM humanizado contra el receptor de la IL-6. Múltiples estudios han demostrado la correlación entre los niveles de IL-6 con los niveles altos de la proteína C reactiva y el fibrinógeno, lo que se asocia con la presencia de enfermedad coronaria. Un consorcio para el análisis aleatorizado mendeliano del receptor de la IL-6 evaluó el efecto del tocilizumab usado en la artritis reumatoide y la inflamación articular sobre la incidencia de enfermedad coronaria, encontrando que el bloqueo del receptor IL-6 disminuye el riesgo de la enfermedad coronaria en este subgrupo de pacientes, documentado principalmente en el estudio ENTRACTE27,28.
- Estudio CANTOS: compara el riesgo de la enfermedad coronaria en pacientes con artritis reumatoide y en pacientes con terapia biológica de diferentes tipos. Es un estudio retrospectivo de cohorte, basado en el registro Medicare de Estados Unidos. Se evaluaron pacientes sin enfermedad coronaria documentada, mayores de 65 años, que iniciaban terapia con medicamentos biológicos, evaluando la incidencia del infarto de miocardio o la revascularización coronaria. Los pacientes en terapias con Anti-TNF tenían mayor riesgo comparado con el tocilizumab (HR 0,64. IC 0,41-0,99)29.
Canakinumab: es un AcM humano contra el receptor de la IL-1b, obteniendo un efecto antiinflamatorio y antitrombótico, en situaciones clínicas donde hay sobreexpresión de la IL-1B. Este medicamento disminuye la IL-6, el fibrinógeno y la proteína C reactiva sin efectos sobre las plaquetas. Tiene estudios en curso para uso en la enfermedad endotelial/cardiovascular27. En el momento es una molécula bien tolerada, con bajo perfil de las reacciones adversas30.
Gevokizumab: es un AcM humanizado contra IL-1B se encuentra en estudios para la enfermedad coronaria31.
Hipercolesterolemia
Evolocumab (AMG 145), alirocumab y bococizumab: los dos primeros son AcM humanos y el último humanizado, dirigidos contra la proprotein convertasa subtilisina/kexina tipo 9 (PCSK 9), proteína que media la degradación lisosomal del receptor de lipoproteínas de baja densidad (LDL) en el hepatocito, en menor grado en el intestino y el riñón. La inhibición de la interacción de la PCSK 9 con el receptor de LDL, disminuye la degradación de estos receptores lo que disminuye los niveles de LDL circulante32,33. Actualmente, han sido evaluados principalmente en estudios para hipercolesterolemia familiar y pacientes intolerantes a las estatinas34. Generalmente, estos anticuerpos presentan pocas reacciones adversas, siendo los más comunes los cuadros similares a síntomas gripales35. Se encuentran en la fase III más de treinta ensayos clínicos para el evolucumab y el alirocumab, que buscan nuevas indicaciones para su uso con desenlaces cardiovasculares en cuanto a regresión de la placa aterosclerótica en uso concomitante con las estatinas y los eventos cardiovasculares como se describe en https://clinicaltrials.gov.
- Estudio LAPLACE-TIMI 57: el evolocumab (AMG145) y la estatina para disminuir el colesterol LDL. Es un estudio fase 2, metacéntrico, aleatorizado, placebo controlado donde se evaluaron varias dosis y diferentes frecuencias de esta medicación. El desenlace primario fue la disminución del colesterol LDL después de 12 semanas de tratamiento evaluada en 631 pacientes. Al final del seguimiento se documentó una disminución del colesterol LDL hasta un 41% (p: < 0.001) dependiente de la dosis e independiente de otras variables. No se reportó aumento de las reacciones adversas36.
- Estudio GAUSS: el evolocumab en pacientes intolerantes a las estatinas. Fue un estudio fase 2, metacéntrico, aleatorizado, controlado con el ezetimibe, llevado a 12 semanas. Se evaluaron varias dosis cada 4 semanas de la intervención, con o sin el ezetimibe contra el ezetimibe y el placebo. El desenlace primario fue la disminución del colesterol LDL en 160 pacientes. Al final se evidenció una disminución significativa del colesterol LDL hasta un 63% (p: < 0,001) de los niveles iniciales. Los eventos adversos más frecuentes fueron las mialgias (15%)37.
- Estudio MENDEL: el evolocumab como monoterapia para manejo de la dislipidemia. Es un estudio fase 2, metacéntrico, aleatorizado, placebo controlado. Se evaluaron varias dosis a diferente frecuencia. El desenlace primario fue la disminución del colesterol LDL a las 12 semanas de tratamiento en 406 pacientes. Se evidenció un descenso significativo del colesterol LDL en todos los grupos (p: 0,001) hasta un 50%. No se reportaron reacciones adversas mayores, aunque la mitad de los pacientes presentó síntomas catarrales38.
- Estudio TESLA: el evolocumab en pacientes con hipercolesterolemia familiar homocigota. Es un estudio fase 3, metacéntrico, aleatorizado, placebo controlado que evaluó 420 mg cada mes, siendo el desenlace primario el descenso del colesterol LDL después de 12 semanas de tratamiento en 50 pacientes. Se observó al final del seguimiento una reducción significativa del colesterol LDL hasta 30% de los valores basales (p: < 0,001). Eventos adversos se evidenciaron en 36% de los pacientes, consistentes en síntomas respiratorios no complicados39.
- Estudio RUTHERFORD: el evolocumab en pacientes en hipercolesterolemia familiar heterocigota que no mejora con tratamiento convencional. Es un estudio fase 2, metacéntrico, doble ciego, aleatorizado, placebo controlado. Se evaluaron varias dosis. El desenlace primario fue el descenso del colesterol LDL después de 12 semanas de tratamiento en 167 pacientes. Se evidencio en los grupos de intervención un descenso hasta 55% del colesterol LDL (p: < 0,001) con buena tolerancia40.
- Estudio DESCARTES: el evolocumab como terapia hipolipemiante complementaria por 52 semanas. Es un estudio fase 3, metacéntrico, aleatorizado, doble ciego, placebo controlado en 901 pacientes que evaluó como desenlace primario la disminución del colesterol LDL y seguridad a la semana 52 de tratamiento. Se observó una disminución de 57% del colesterol LDL en el grupo de intervención (p: < 0,001), con evidencia moderada de las reacciones adversas (síntomas catarrales)41.
- Estudio OSLER: el evolocumab como terapia hipolipemiante por 52 semanas. Fue un estudio fase 3, metacéntrico, aleatorizado, abierto comparado con la terapia estándar que evaluó como desenlace primario la efectividad y seguridad a la semana 52 incluyendo 1.359 pacientes. El evolocumab redujo en un 52% los niveles del colesterol LDL (p: < 0,001), mientras que en los pacientes que suspendieron la terapia el colesterol tiende a retornar a valores basales. El 81% de las reacciones adversas observadas con la terapia fueron leves incluyendo síntomas gripales42.
- Estudio ODYSSEY OPTIONS I: el alirocumab como complemento o comparado con otras terapias hipolipemiantes. Es un estudio multicéntrico, aleatorizado, doble ciego cuyo desenlace primario fue el descenso del colesterol LDL a la semana 24 en 355 pacientes. Los pacientes intervenidos con el alirocumab lograron reducir los niveles del colesterol LDL de manera significativa comparado con los demás esquemas de tratamiento (p < 0,001) con un descenso hasta de 54%. Se reportaron reacciones adversas leves hasta en un 65% de los pacientes43.
-
Estudio ODYSSEY COMBO I: el alirocumab adicionado a terapia con las estatinas a dosis máxima en pacientes de alto riesgo cardiovascular fuera de metas. Es un estudio fase 3, metacéntrico, aleatorizado, placebo controlado evaluando como desenlace primario la disminución del colesterol LDL a la semana 24 en 316 pacientes. La intervención redujo en 48% los niveles del colesterol LDL (p: < 0,001), mientras el 75% de los pacientes alcanzaron metas. No se documentó aumento de las reacciones adversas44.
-
Estudio ODYSSEY LONG TERM: el alirocumab como tratamiento complementario a largo plazo en pacientes de alto riesgo cardiovascular. Es un estudio multicéntrico, aleatorizado, placebo controlado cuyo desenlace primario fue el descenso del colesterol LDL a las 78 semanas. La intervención disminuyó los niveles del colesterol LDL en un 62% (p: < 0,001), sin mayor incidencia de los eventos adversos como mialgias (5,4%) o inflamación en sitio de aplicación subcutánea. En un análisis post hoc se demuestra disminución de la incidencia de eventos cardiovasculares como: el infarto de miocardio, la enfermedad coronaria y la cerebrovascular (HR 0,52. IC 0,31-0,9. p: 0,02)45.
- Estudio ODYSSEY MONO: el alirocumab comparado con el ezetimibe como monoterapia. Es un estudio fase 3, metacéntrico, aleatorizado, ciego. El desenlace del estudio fue la disminución del colesterol LDL a la semana 24 en 103 pacientes. Este AcM demostró descenso significativo comparado con el ezetimibe (p: < 0,001), sin diferencias en incidencia a las reacciones adversas46.
- Estudios SPIRE I/II del Bococizumab se encuentra en estudios fase 2 y 3.
Miocarditis
Tocilizumab: los altos niveles de la IL-6 se asocian a un pobre pronóstico en la miocarditis aguda. Actualmente, este medicamento se encuentra en pruebas experimentales en modelos murinos de miocarditis por virus Coxackie B3, donde la terapia disminuye la carga viral y mantiene la estructura y función ventricular izquierda47.
Conclusiones
La terapia biológica con los AcM es una estrategia terapéutica de rápido crecimiento y desarrollo, permitiendo intervenir de manera específica los procesos fisiopatológicos de la enfermedad, con un perfil de seguridad alto con el desarrollo reciente de las moléculas humanas. En el momento la tendencia se inclina al desarrollo de los AcM humanos y se estima que en el momento hay más de 500 en investigación para su uso clínico incluyendo la rama cardiovascular de la medicina, con moléculas como los AcM contra la PCSK9 que han demostrado ser herramientas muy útiles, por lo que el entendimiento de estas moléculas es de vital importancia para su uso clínico responsable.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Mascelli M.A., Zhou H., Sweet R., Getsy J., Davis H.M., Graham M., et al. Molecular, biologic, and pharmacokinetic properties of monoclonal antibodies: impact of these parameters on early clinical development. J Clin Pharmacol. 2007;47(5):553-65. [ Links ]
2. Hausmann O.V., Seitz M., Villiger P.M., Pichler W.J. The Complex Clinical Picture of Side Effects to Biologicals. Med Clin North Am. Elsevier Ltd. 2010;94(4):791-804. [ Links ]
3. Foltz I.N., Karow M., Wasserman S.M. Evolution and emergence of therapeutic monoclonal antibodies what cardiologists need to know. Circulation. 2013;127(22):2222-30. [ Links ]
4. Keiser R.J., Huitema A.D., Schellens J.H., Beijnen J.H. Clinical Pharmacokinetics of Therapeutic Monoclonal Antibodies. Clin Pharmacokinet. 2010;49(8):498-607. [ Links ]
5. Beck A., Wurch T., Bailly C., Corvaia N. Strategies and challenges for the next generation of therapeutic antibodies. Nat Rev Inmunol. 2010;10:345-52. [ Links ]
6. Scheen A., Moutschen M. Les anticorps monoclonaux en thérapeutique. Rev Med Liege. 2009;64(5-6):233-6. [ Links ]
7. Nelson A.L., Dhimolea E., Reichert J.M. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov. 2010;9(10):767-74. [ Links ]
8. Hansel T.T., Kropshofer H., Singer T., Mitchell J.A., George A.J.T. The safety and side effects of monoclonal antibodies. Nat Rev Drug Discov. 2010;9(4):325-38. [ Links ]
9. Tabrizi M., Bornstein G.G., Suria H. Biodistribution mechanisms of therapeutic monoclonal antibodies in health and disease. AAPS J. 2010;12(1):33-43. [ Links ]
10. Kounis N.G., Soufras G.D., Kounis G.N. Antibodies against antibodies inducing Kounis syndrome. Int J Cardiol. 2013;168(5):4804-5. [ Links ]
11. Dziewierz A., Rakowski T., Dudek D. Abciximab in the management of acute myocardial infarction with ST-segment elevation: evidence-based treatment, current clinical use, and future perspectives. Ther Clin Risk Manag. 2014;10:567-76. [ Links ]
12. Capture T. Randomised placebo-controlled trial of abciximab before and during coronary intervention in refractory unstable angina: the CAPTURE Study. Lancet. 1997;349(9063):1429-35. [ Links ]
13. Antman E.M., Gibson C.M., de J.A., Giugliano R.P., McCabe C.H., Coussement P., et al. Combination reperfusion therapy with abciximab and reduced dose reteplase: results from TIMI 14. Eur Heart J. 2000;21(23):1944-53. [ Links ]
14. Simoons M.L. Effect of glycoprotein IIb/IIIa receptor blocker abciximab on outcome in patients with acute coronary syndromes without early coronary revascularisation: The GUSTO IV-ACS randomised trial. Lancet. 2001;357(9272):1915-24. [ Links ]
15. Mehilli J., Kastrati A., Schulz S., Früngel S., Nekolla S.G., Moshage W., et al. Abciximab in patients with acute ST-segment-elevation myocardial infarction undergoing primary percutaneous coronary intervention after clopidogrel loading a randomized double-blind trial. Circulation. 2009;119(14):1933-40. [ Links ]
16. Stone G.W., Carlton T.W., Wolff S.D., Brener S.J., Metzger D.C., Dizon J.M., et al. Intracoronary Abciximab and Aspiration Thrombectomy in Patients with Large Anterior Myocardial Infarction. JAMA. 2015;307(17):1817-26. [ Links ]
17. Costin J., Ansell J., Laulicht B., Bakhru S., Steiner S. Reversal agents in development for the new oral anticoagulants. Postgrad Med. 2014;126(7):19-24. [ Links ]
18. Pollack C.V., Reilly P.A., Eikelboom J., Glund S., Verhamme P., Bernstein R.A., et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015;:1-10. [ Links ]
19. Chan B., Buckley N. Digoxin-specific antibody fragments for the treatment of digoxin toxicity. Clin Toxicol. 2014;52:824-36. [ Links ]
20. Delgado J.F., Vaqueriza D., Sánchez V., Escribano P., Ruiz-Cano M.J., Renes E., et al. Induction treatment with monoclonal antibodies for heart transplantation. Transplant Rev. 2011;25(1):21-6. [ Links ]
21. Penninga L., Møller C., Gustafsson F., Gluud C., Da S. Immunosuppressive T-cell antibody induction for heart transplant recipients (Review). Cochrane Libr. 2013;:12. [ Links ]
22. Testa L., Meco M., Cirri S., Bedogni F. Pexelizumab and survival in cardiac surgery. Intensive Care Cardiovasc Anesth. 2011;3(1):23-4. [ Links ]
23. Granger C.B., Mahaffey K.W., Weaver W.D., Theroux P., Hochman J.S., Filloon T.G., et al. Pexelizumab, an anti-C5 complement antibody, as adjunctive therapy to primary percutaneous coronary intervention in acute myocardial infarction. Circulation. 2003;108(10):1184-90. [ Links ]
24. Mahaffey K.W., Granger C.B., Nicolau J.C., Ruzyllo W., Weaver W.D., Theroux P., et al. Effect of pexelizumab, an anti-C5 complement antibody, as adjunctive therapy to fibrinolysis in acute myocardial infarction. Circulation. 2003;108(10):1176-83. [ Links ]
25. Armstrong P.W. APEX-AMI Investigators Pexelizumab for Acute ST-Elevation Myocardial Infarction in Patients Undergoing Primary percutaneous Coronary intervention. JAMA. 2007;297(1):43-51. [ Links ]
26. Carrier M., Menasche P., Levy J.H., Newman M.F., Taylor K.M., Haverich A., et al. Inhibition of complement activation by pexelizumab reduces death in patients undergoing combined aortic valve replacement and coronary artery bypass surgery. J Thorac Cardiovasc Surg. 2006;131(2):352-6. [ Links ]
27. Ridker P.M., Lüscher T.F. Anti-inflammatory therapies for cardiovascular disease. Eur Heart J. 2014;35(27):1782-91. [ Links ]
28. Swerdlow D.I., Holmes M.V., Kuchenbaecker K.B., Engmann J.E.L., Shah T., Sofat R., et al. The interleukin-6 receptor as a target for prevention of coronary heart disease: a mendelian randomisation analysis. Lancet. 2012;379(9822):1214-24. [ Links ]
29. Ridker P.M., Thuren T., Zalewski A., Libby P. Interleukin-1B inhibition and the prevention of recurrent cardiovascular events: Rationale and Design of the Canakinumab Anti-inflammatory Thrombosis Outcomes Study (CANTOS). Am Heart J. 2011;162(4):597-605. [ Links ]
30. Dhimolea E. Canakinumab. MAbs. 2010;2(1):3-13. [ Links ]
31. Berman J.P., Farkouh M.E., Rosenson R.S. Emerging anti-inflammatory drugs for atherosclerosis. Expert opin Emerg Drugs. 2013;18(2):193-205. [ Links ]
32. Urban D., Pöss J., Böhm M., Laufs U. Targeting the proprotein convertase subtilisin/kexin type 9 for the treatment of dyslipidemia and atherosclerosis. J Am Coll Cardiol. 2013;62(16):1401-8. [ Links ]
33. Tavori H., Giunzioni I., Fazio S. PCSK9 inhibition to reduce cardiovascular disease risk: recent findings from the biology of PCSK9. Curr Opin Endocrinol Diabetes Obes. 2015;22(2):126-32. [ Links ]
34. Reiner Z., Catapano A.L., De G., Graham I., Taskinen M.R., Wiklund O., et al. ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J. 2011;32(14):1769-818. [ Links ]
35. Gencer B., Lambert G., Mach F. PCSK9 inhibitors. Swiss Med Wkly. 2015;:1-9. [ Links ]
36. Giugliano R.P., Desai N.R., Kohli P., Rogers W.J., Somaratne R., Huang F., et al. Efficacy, safety, and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 in combination with a statin in patients with hypercholesterolaemia (LAPLACE-TIMI 57). Lancet. 2012;380(9858):2007-17. [ Links ]
37. Sullivan D., Olsson A.G., Scott R., Kim J.B., Xue A. Effect of a Monoclonal Antibody to PCSK9 on low-Density Lipoprotein Cholesterol Levels in Statin - Intolerant Patients. the GAUSS Randomized Trial. JAMA. 2012;308(23):2497-506. [ Links ]
38. Koren M.J., Scott R., Kim J.B., Knusel B., Liu T., Lei L., et al. Efficacy, safety, and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 as monotherapy in patients with hypercholesterolaemia (MENDEL). Lancet. 2012;380(9858):1995-2006. [ Links ]
39. Raal F.J., Honarpour N., Blom D.J., Hovingh G.K., Xu F., Scott R., et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B). Lancet. 2015;385(9965):341-50. [ Links ]
40. Raal F., Scott R., Somaratne R., Bridges I., Li G., Wasserman S.M., et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: The reduction of LDL-C with PCSK9 inhibition in heterozygous familial hypercholesterolemia disorder (RUTHERFORD) randomized trial. Circulation. 2012;126(20):2408-17. [ Links ]
41. Blom D.J., Hala T., Bolognese M., Lillestol M.J., Toth P.D., Burgess L., et al. A 52-Week Placebo-Controlled Trial of Evolocumab in Hyperlipidemia. N Engl J Med. 2014;370(19):1809-19. [ Links ]
42. Koren M.J., Giugliano R.P., Raal F.J., Sullivan D., Bolognese M., Langslet G., et al. Efficacy and safety of longer-term administration of evolocumab (AMG 145) in patients with hypercholesterolemia: 52-week results from the open-label study of long-term evaluation against LDL-C (OSLER) randomized trial. Circulation. 2014;129(2):234-43. [ Links ]
43. Bays H., Gaudet D., Weiss R., Ruiz J.L., Watts G.F., Gouni-Berthold I., et al. Alirocumab as add-on to atorvastatin versus other lipid treatment strategies: ODYSSEY OPTIONS I randomized trial. J Clin Endocrinol Metab. 2015;100(8):3140-8. [ Links ]
44. Kereiakes D.J., Robinson J.G., Cannon C.P., Lorenzato C., Pordy R., Chaudhari U., et al. Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: The ODYSSEY COMBO I study. Am Heart J. 2014;169(6):906-15. [ Links ]
45. Robinson J.G., Farnier M., Krempf M., Bergeron J., Luc G., Averna M. Safety of Evolocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med. 2015;372(16):1489-99. [ Links ]
46. Roth E.M., Taskinen M.R., Ginsberg H.N., Kastelein J.J.P., Colhoun H.M., Robinson J.G., et al. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: Results of a 24 week, double-blind, randomized Phase 3 trial. Int J Cardiol. 2014;176(1):55-61. [ Links ]
47. Savvatis K., Müller I., Fröhlich M., Pappritz K., Zietsch C., Hamdani N., et al. Interleukin-6 receptor inhibition modulates the immune reaction and restores titin phosphorylation in experimental myocarditis. Basic Res Cardiol. 2014;109(6):449. [ Links ]