Introducción
La enfermedad de Chagas es una infección crónica cuyo agente etiológico es el protozoario Trypanosoma cruzi. Es la principal causa de miocardiopatía dilatada en países de Latinoamérica donde es endémica1 y cada vez cobra más importancia en países no endémicos debido a la migración2. Es una enfermedad olvidada (Neglected Tropical Disease) ya que los estudios de prevalencia son regionales; se considera que hay cifras importantes de subdiagnóstico, lo cual no permite conocer su verdadero impacto1.
En la infección por T. cruzi se ha descrito una fase aguda, una crónica asintomática (indeterminada) y una crónica sintomática (determinada). La fase aguda usualmente se diagnostica en niños de áreas endémicas o por reactivación en personas inmuno-suprimidas secundario a trasplantes o al VIH/SIDA; en la mayoría de casos es asintomática o se presentan síntomas constitutivos prodrómicos como fiebre, malestar general y cefalea. En algunas ocasiones se observan los signos clásicos de la enfermedad como el signo de Romaña (edema palpebral unilateral) o el chagoma (lesión nodular subcutánea en piel), ambos indicativos de la entrada de la forma infectiva del parásito o tripomastigote metacíclico2. En la trasmisión por vía oral, la presentación clínica suele ser diferente y tiende a complicarse más que la de transmisión vectorial, ya que aparecen con mayor frecuencia cuadros de cardiopatía aguda o meningoencefalitis3. Los síntomas desaparecen de 4 a 6 semanas posterior a la infección y el parásito es controlado por el sistema inmune, pero sin eliminarlo por completo; los individuos entran entonces en la fase indeterminada2. En esta fase, la parasitemia es difícil de detectar y el diagnóstico se realiza con métodos serológicos indirectos que buscan la presencia de anticuerpos específicos. Los métodos de diagnóstico disponibles para la evaluación de anticuerpos no son siempre adecuados debido a la divergencia que hay entre los múltiples antígenos presentes en los diferentes genotipos de parásito circulante y los antígenos disponibles en los estuches comerciales4. Algunos individuos desarrollan compromiso tisular, principalmente cardiaco y digestivo, siendo común la afección cardiaca (fase crónica sintomática)2,5. Alrededor del 30% de las personas infectadas presentan algún grado de miocarditis que puede llevar a falla cardiaca con una alta mortalidad prematura2. De acuerdo con la clasificación combinada del Colegio Americano de Cardiología (ACC) y la Asociación Americana del Corazón (AHA), en estadios avanzados de la enfermedad se encuentran alteraciones electrocardiográficas, disminución de la fracción de eyección del ventrículo izquierdo (FEVI), aumento del tamaño de las cavidades del corazón y una clase funcional alterada en la escala de Nueva York (NYHA)6. La falla cardiaca crónica secundaria a la cardiopatía chagásica crónica es de peor pronóstico que lo observado en pacientes con falla cardiaca por otras etiologías, presentándose con mayor morbimortalidad1,7,8.
Aunque el tratamiento antiparasitario sólo está indicado en la infección aguda incluyendo la infección congénita y la reactivación por inmunosupresión, actualmente se plantea que la eliminación del parásito podría prevenir la progresión del deterioro de la función cardiaca en pacientes con daño ya establecido9. Esta premisa se basa en que la persistencia del parásito induce una respuesta inmune disfuncional, que conlleva daño tisular y progresión de la enfermedad. El estudio clínico BENEFIT, en el cual se evaluó el efecto del tratamiento antiparasitario con benznidazol en pacientes con cardiopatía chagásica crónica establecida, demostró que si bien hay una reducción de la parasitemia no hay efecto en el cuadro clínico cardiaco durante 5 años de seguimiento9. No obstante, cuando el deterioro cardiaco es severo, las manifestaciones clínicas de la cardiopatía chagásica crónica como la falla cardiaca congestiva y las alteraciones de la conducción cardiaca son tratadas de manera similar que las cardiopatías por otras etiologías. Por lo tanto, los pacientes con cardiopatía chagásica crónica en estadio final pueden beneficiarse del trasplante cardiaco6.
Si bien el sistema inmune desempeña un papel determinante ven la lesión tisular y en el deterioro de la función cardiaca en la fase crónica de la enfermedad, en la mayoría de los casos se deduciría que la respuesta inmune es efectiva ya que controla el parásito sin inducir daño tisular. Después del proceso agudo, aproximadamente el 70% de las personas infectadas no desarrolla ninguna de las complicaciones posteriores2,6. Las evidencias que apoyan la eficacia del sistema inmune en la protección y el control de la enfermedad son las siguientes:
a) La desaparición de los síntomas cuando se supera la fase aguda se correlaciona con una disminución de la parasitemia hasta el punto de ser indetectable.
b) Hay reactivación de la enfermedad y reaparición de síntomas en pacientes inmuno-suprimidos con disminución de la población de linfocitos CD4+ como en el VIH/SIDA10.
c) Los estudios en modelos animales demuestran la participación de mecanismos inmunes protectores como anticuerpos, IFN-y linfocitos T CD8+11.
El objetivo de esta revisión es exponer el componente inmune celular como uno de los implicados en la patogénesis de la cardiopatía chagásica. Para ello se utilizarán como evidencia los estudios realizados en pacientes chagásicos crónicos trasplantados y los trabajos que asocian la disfunción celular de los linfocitos con la persistencia parasitaria.
Trasplante cardiaco en pacientes chagásicos crónicos comparado con pacientes aceptores no chagásicos
Por varios años se consideró que la cardiopatía chagásica crónica era una contraindicación relativa para el trasplante cardiaco debido a que es una enfermedad infecciosa y teóricamente no era posible la eliminación completa del parásito con el tratamiento. Asimismo, la posibilidad de reactivación del parásito secundaria al uso de terapias inmunosupresoras usadas para inducir tolerancia al injerto, era considerado un riesgo potencial12. Los estudios han demostrado que la cardiopatía chagásica crónica no es una contraindicación para trasplante. Incluso, en algunas cohortes se evidencia que los aceptores chagásicos presentan mayor sobrevida postrasplante que los pacientes con cardiopatía dilatada por otras etiologías; además, algunas complicaciones inherentes
al tratamiento inmunosupresor son menos frecuentes y menos severas5,12-16. La sobrevida, complicaciones, causas de mortalidad y pronóstico de los pacientes chagásicos trasplantados son comparados con los resultados obtenidos frente a grupos control de pacientes trasplantados por otras causas de cardiopatía dilatada como la cardiopatía isquémica y la cardiopatía dilatada idiopática.
En términos de supervivencia y mortalidad, en Brasil, han demostrado una mejor sobrevida a corto y a mediano plazo en los pacientes con cardiopatía chagásica trasplantados comparado con controles sometidos al mismo protocolo de trasplante (técnica quirúrgica, cuidados postoperatorios, protocolos de inmunosupresión y de reactivación). A largo plazo, aunque los resultados no son comparables por la poca cantidad de pacientes, también existe una tendencia a mayor sobrevida en los pacientes chagásicos. Al comparar las causas de mortalidad entre los diferentes grupos (cardiopatía chagásica crónica, cardiopatía isquémica, cardiopatía dilatada idiopática), es notable que los pacientes chagásicos mostraron menores porcentajes de disfunción aguda al injerto con una tasa de mortalidad por rechazo muy similar entre los grupos. En pacientes chagásicos fueron menos frecuentes otras causas de mortalidad como infecciones y coronariopatía aguda15,16.
En pacientes chagásicos la tendencia en el tratamiento es disminuir las dosis de los medicamentos inmunosupresores lo suficiente para evitar la aparición de reactivaciones y demás complicaciones inherentes a la terapia, sin que se aumenten las tasas de rechazo14. En un estudio donde se comparan dos grupos de pacientes chagásicos trasplantados, diferenciados por la disminución de la dosis de ciclosporina, se evidenció mayor supervivencia y menores tasas de neoplasias sin un aumento significativo de rechazo en ambos grupos13. El rechazo inmunológico al injerto, incluyendo los diversos tipos de rechazo, es una de las causas de morbimortalidad más importantes y frecuentes en pacientes con trasplante cardiaco. Si bien algunos resultados son contradictorios, en general en los pacientes chagásicos se han reportado menores tasas de tratamiento por rechazo agudo respecto a grupos control14.
Los datos obtenidos de los resultados de trasplante cardiaco en cardiopatía chagásica crónica indican que en estos pacientes podría existir un efecto inmuno-modulador, inducido por la exposición a los antígenos parasitarios, lo cual hace que la respuesta al injerto y al tratamiento inmunosupresor sea diferente y determinante en el pronóstico de la sobrevida del injerto y del paciente. Esto podría explicarse por la teoría de la disfunción celular inmune (linfocitaria), fenómeno que ya se ha establecido en los pacientes infectados de forma crónica.
Si bien el número de pacientes en los estudios no ha sido óptimo y además existen variables no controladas como las diferentes intervenciones pre y postrasplante en cada paciente, que pueden afectar el pronóstico, se ha logrado reconocer que el trasplante cardiaco es una excelente opción para los pacientes con cardiopatía chagásica crónica avanzada. En general, se considera que no es necesaria la profilaxis antiparasitaria ya que ésta no previene eficazmente la reactivación de la infección. Además, en la actualidad se considera que las reactivaciones son relativamente fáciles de diagnosticar y tratar13,14. También, las reactivaciones son una causa de mortalidad poco frecuente con reportes tan bajos como del 0,7%15. La reactivación del Trypanosoma cruzi, igualmente no se ha asociado con la aparición de lesiones prematuras en el injerto ni con mayores tasas de rechazo al trasplante14,15.
La disfunción celular en la cardiopatía chagásica crónica
Respuesta inmune mediada por linfocitos T
La actividad de los linfocitos T es dependiente de la presentación antigénica, la cual es realizada por células presentadoras de antígeno profesionales (CPA). Cuando un microorganismo rompe las barreras cutáneas o mucosas, éste puede ser reconocido mediante receptores de patrones moleculares (PAMP) y, dependiendo del tipo de célula, el antígeno es endocitado y procesado en los tejidos, como ocurre con los macrófagos y las células dendríticas (DC)17. Los antígenos son presentados por estas células en su superficie en el contexto de las moléculas HLA del complejo mayor de histocompatibilidad (CMH) para ser reconocidos e inducir la activación de linfocitos T específicos del antígeno. La activación del linfocito T requiere una alta afinidad entre el complejo CMH-antígeno con su contraparte el receptor de linfocitos T o TCR. El receptor TCR carece de cola citoplasmática, por ende, es incapaz de iniciar una cascada de señalización intracelular, de ahí que la señalización es iniciada por la molécula CD3. El complejo TCR-CD3 se considera la primera señal de estimulación, la cual es potenciada por la coestimulación de moléculas accesorias como CD80 (B7-1) y CD86 (B7-2). Todas estas señales conducen a una cascada de fosforilación intracelular que permite la activación de factores de trascripción nuclear (ERK, JNK, NF-kB, NFAT) los cuales se unen a regiones promotoras de genes que se desean transcribir, en el caso de los linfocitos T del gen promotor de la IL-2; igualmente, se promueve la expresión del receptor de membrana de IL-218. La función primordial de la activación del linfocito T es la producción de IL-2, que es el principal factor de crecimiento, desarrollo y diferenciación de linfocitos T. La activación de los linfocitos T conlleva la expansión de clonas específicas de antígeno que dan origen a células efectoras y células de memoria (fig. 1). Los linfocitos T CD4+ (ayudadores o Th) producen diversas citocinas que permiten diferenciar subpoblaciones como Th1 (producen primordialmente INF-y), Th2 (IL-4) y Th17 (Il-17), entre otras. Los linfocitos T CD8+ (citotóxicos) además de citocinas (INF-y TNF-α), secretan moléculas citotóxicas como granzimas y perforinas19. Una vez se elimina el microorganismo, la ausencia de estímulo antigénico promueve la apoptosis de las células efectoras, y algunas se convierten en células de memoria (fig. 1). Las células de memoria residen en mucosas y tejidos a la espera de encontrar a su antígeno en un futuro y así generar una respuesta más rápida y eficaz contra el agente agresor. Cuando el antígeno no es eliminado por completo y la infección se hace crónica, dicha persistencia puede inducir una respuesta alterada de los linfocitos T (disfunción celular). La disfunción es inducida y aprovechada por los microorganismos para asegurar su supervivencia. La mayoría de estudios sobre disfunción celular inmune han sido realizados en modelos de infección viral crónicos donde hay altas tasas de replicación viral. Por el contrario, en la infección por T. cruzi se presenta una parasitemia baja y la cantidad de antígenos circulantes es probablemente menor respecto a los virus20.
La alteración de la respuesta de los linfocitos T frente a un antígeno específico, puede deberse una presentación subóptima de antígeno al TCR, a una falta de activación dada por ausencia de señales de las moléculas coestimuladoras o a señales de inhibición mediadas por receptores presentes en la membrana del linfocito T, como CTLA-4 y PD-120 (fig. 1 y tabla 1). La disfunción celular incluye mecanismos aún no bien dilucidados como el agotamiento (exhaustion), la tolerancia, la anergia clonal, la ignorancia antigénica o la senescencia celular. Algunos de estos mecanismos se han identificado por medio de marcadores celulares (fenotipos) o en estudios de función celular21.
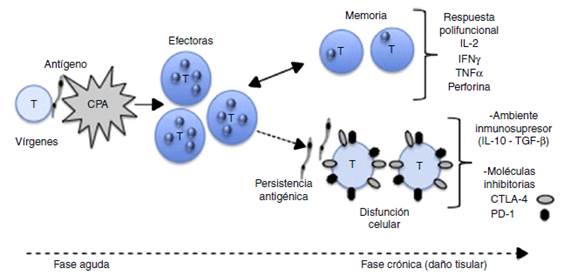
Figura 1 Modelo de diferenciación de linfocitos T. Las CPA presentan los antígenos parasitarios a los linfocitos T vírgenes. Se produce expansión clonal y se convierten en células efectoras. Con la disminución o eliminación del antígeno se reduce la población efectora y se generan células de memoria. Las células de memoria, al entrar en contacto con el antígeno, desencadenan una respuesta polifuncional con producción de citocinas y moléculas efectoras. Si el antígeno persiste se induce disfunción celular; las células cambian el patrón de secreción de citocinas, expresan marcadores de agotamiento clonal y no controlan la infección aunque producen daño tisular. CPA (células presentadoras de antígeno), CTLA-4 (proteína citotóxica asociada a los linfocitos T), IL-2 (interleucina 2), INF-y (interferón gamma), PD-1 (muerte celular programada tipo 1).
Tabla 1 Marcadores de función de los linfocitos T
| Función | Respuesta de memoria T polifuncional | Disfunción celular T |
| Moléculas estimuladoras CD28 | ↑↑ | ↓ |
| CD3 cadena | ↑↑↑ | ↓ |
| Citocinas IL-2 | ↑ | ↓ |
| TNF- | ↑↑ | ↓ |
| INF- | ↑↑↑ | ↓ |
| Marcadores de activación CD38 | ↑↑ | ↑↑↑ |
| HLA-DR | ↑↑ | ↑↑↑ |
| Moléculas inhibitorias CTLA-4 | ↓ | ↑↑↑ |
| PD-1 | ↓ | ↑↑↑ |
| TIM-3 | ↓ | ↑↑↑ |
| Funciones celulares Proliferación | ↑↑↑ | ↓ |
| Apoptosis | ↓ | ↑ |
| Citotoxicidad | ↑↑ | ↑ |
Comparación de la expresión, producción y función entre la respuesta de memoria polifuncional43 y la respuesta celular disfuncional36,44. ↑-expresión o actividad baja. ↑↑ -moderada. ↑↑↑ - alta. ↓-reducción de la expresión o actividad. CD (cluster of differentiation), CTLA-4 (proteína citotóxica asociada a los linfocitos T), HLA-DR (antígeno leucocitario humano - complejo mayor de histocompatibilidad clase II), PD-1 (muerte celular programada tipo 1), TIM-3 (proteína de membrana de célula T), TNF- α (factor de necrosis tumoral alfa), INF-y (interferón gamma), CD3 ξ (zeta).
Persistencia antigénica como inductor de disfunción celular en la enfermedad de Chagas
La cardiopatía chagásica crónica es básicamente una miocarditis cuya severidad histológica está dada por la cantidad y extensión del infiltrado inflamatorio que se puede correlacionar con la severidad clínica y el deterioro de la función del corazón22. En la fase aguda, la miocarditis presenta un infiltrado inflamatorio más denso, con presencia de linfocitos, macrófagos y eventualmente eosinófilos y neutrófilos; además es posible identificar nichos de parásitos intracelulares en el tejido22 (figs. 2A y 2B). Por
el contrario, en la fase crónica rara vez se observa el parásito en el tejido, a través del uso de métodos de diagnóstico histológico convencionales, y así mismo, el infiltrado celular es menor, más disperso y de predominio linfocitario23 (figs. 2C y 2D). No obstante, mediante técnicas inmuno-histológicas y moleculares más sensibles, se ha logrado detectar el parásito en circulación24, directamente en los tejidos afectados25 e incluso, en tejido cardiaco de pacientes seropositivos (fase indeterminada), que murieron por otras causas26. Algunos estudios correlacionan la cantidad del ADN parasitario detectado y el compromiso cardiaco27. En modelos animales se ha logrado disminuir la inflamación miocárdica y por consiguiente el deterioro cardiaco mediante el tratamiento antiparasitario con benznidazol28, pero no en humanos con cardiopatía crónica9. Esto permite sugerir que la persistencia antigénica en el tejido cardiaco condiciona la aparición del proceso inflamatorio y está implicada en la lesión tisular. Aunque la lesión del miocito puede ser causada directamente por el parásito, se considera que es la interacción entre el parásito y las células del sistema inmune uno de los factores determinantes para la inducción de miocitólisis29.
Respuesta inmune celular en la infección crónica por T. cruzi
En células mononucleares de sangre periférica (CMSP) de individuos sanos expuestos al parásito o a antígenos del mismo, se demostró una disminución de la proliferación celular aún en presencia de mitógenos y de IL-2 exógena, sin un incremento de la mortalidad celular30. Este fenómeno está dado por la disminución de la expresión del receptor para la IL-2 (IL-2R), demostrando que no hay alteración de la producción de la citocina como tal, pero sí un defecto en la vía de señalización del linfocito T31.
Las CPA pueden ser infectadas por el T. cruzi, lo cual puede conllevar cambios funcionales de estas células y en consecuencia una alteración en la activación de los linfocitos T32. La infección de monocitos disminuye la expresión de moléculas coestimuladoras como CD80 y CD86 especialmente en pacientes con cardiopatía chagásica crónica, en comparación con individuos en fase indeterminada e individuos sanos33. La presencia del parásito igualmente disminuye la expresión de marcadores como CD3, CD4 y CD8 en células activadas34, y más aún, es capaz de disminuir la expresión del TCR posterior a la activación35. De forma similar, los antígenos parasitarios alteran la cascada de señales mediadas por CD3 disminuyendo la expresión intracelular de la cadena CD3zeta (CD3ξ) en linfocitos T de pacientes chagásicos36.
Los linfocitos T de los individuos infectados crónicamente con el parásito expresan marcadores de activación como CD38 y HLA-DR, siendo mayor en individuos con cardiopatía chagásica. Este hallazgo sugiere que estas células ya han estado expuestas a los antígenos parasitarios. A pesar de que las células presentan un estado de ''hiperactivación'', sus funciones efectoras no son adecuadas24,36. De forma interesante, estos marcadores de activación revierten luego del tratamiento antiparasitario, indicando que son los antígenos parasitarios los inductores de estos cambios37.
En cuanto a la producción de citocinas, los pacientes chagásicos crónicos asintomáticos presentan un predominio de la repuesta de linfocitos productores de IFN-y (Th1) sobre linfocitos productores de IL-4 (Th2). En consecuencia, hay una diminución de citocinas antiinflamatorias como la IL-1011. Este patrón de secreción de citocinas favorece mecanismos que inducen inmunidad contra infecciones intracelulares como la infección por T. cruzi. Se ha establecido que la producción de IFN-y por parte de linfocitos T frente a los antígenos del parásito, disminuye con la progresión de la enfermedad cardiaca38-40. Sin embargo, algunos autores han demostrado un aumento de IFN-y en pacientes con cardiopatía avanzada y lo asocian a la lesión tisular41,42. A pesar de la disminución de la producción de citocinas por parte de los linfocitos T en la cardiopatía chagásica crónica, estas células presentan mayor función citotóxica relacionada con un incremento en la producción de perforina intracelular y mayores tasas de degranulación38,40,43,44. Este fenómeno de pérdida de las funciones efectoras citotóxicas, que también se ha descrito en infecciones virales crónicas, se conoce como agotamiento clonal21. La producción de otras citocinas proinflamatorias como el TNF-α y la actividad citotóxica, también se han asociado con el daño tisular en la cardiopatía chagásica24,44,45.
Además de las características de las alteraciones funcionales de los linfocitos T en los pacientes con cardiopatía chagásica crónica, se ha descrito un aumento de CTLA-446 y PD-129,46 como marcadores fenotípicos de agotamiento clonal. La presencia de estos marcadores inhibitorios se asocia con alteraciones de la proliferación de linfocitos T29,46,47.
Algunos cúmulos de células infiltrantes en el corazón de pacientes chagásicos presentan marcadores de estructuras linfoides terciarias (ELT). Estas estructuras han sido definidas como tejido linfoide ectópico y ayudan a montar una respuesta inmune local. Los ELT exhiben características conformacionales de un nódulo linfoide con zonas de linfocitos T, células dendríticas maduras y un centro germinal con células dendríticas foliculares y linfocitos B inmaduros, además de un endotelio especializado denominado endotelio venular alto o HEV. La presencia de ELT se ha descrito en enfermedades autoinmunes, infecciones virales y bacterianas persistentes, rechazo a injertos y en diferentes tipos de cáncer47. De manera interesante, la presencia de ELT se ha logrado correlacionar con la evolución de la enfermedad y el pronóstico de los pacientes o con la respuesta a los diferentes tratamientos como es el caso de algunos tumores47. En pacientes con cardiopatía chagásica crónica se ha demostrado que el infiltrado celular es predominantemente de linfocitos T CD8+48, e igualmente se encuentran linfocitos T CD4+ y células CD68+ aunque en menor proporción; este último marcador se usa para identificar macrófagos y células dendríticas en tejidos29. Aunque no se reporta presencia de ELT en cardiopatía chagásica, se han identificado células inflamatorias y citocinas como TNF-α, asociadas al mantenimiento de dichas estructuras29. En consecuencia, sería importante determinar la presencia de ELT en tejido cardiaco de pacientes con cardiopatía chagásica crónica, a través de marcadores específicos de endotelio venular alto, para determinar su rol en la patogénesis de la cardiopatía chagásica (fig. 2D).
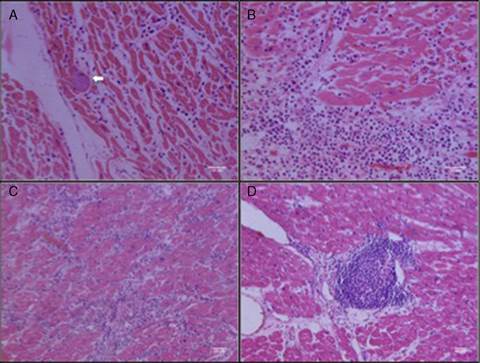
Figura 2 Infiltrado celular en tejidos cardiacos de pacientes con cardiopatía chagásica. A. Miocarditis aguda. Se observan fibras musculares separadas por un infiltrado inflamatorio difuso. Presencia de nicho de amastigotes en la fibra cardiaca (flecha blanca), B. Miocarditis aguda. Denso infiltrado inflamatorio de predominio mononuclear lesionando las fibras. Escasos polimorfonucleares (figuras A y B coloración con H & E, objetivo 40 x, marcador de escala 50 µm). C. Miocarditis crónica con infiltrado inflamatorio difuso entre las fibras y foco con presencia de eosinófilos. Pérdida de la continuidad de las fibras por presencia de células inflamatorias (miocitólisis). D. Miocarditis crónica. Patrón nodular (folicular) del infiltrado inflamatorio que podría simular un tejido linfoide terciario. Se observan linfocitos, plasmocitos y macrófagos (figuras C y D coloración con H & E, objetivo 20 x, marcador de escala 100 µm).
Conclusiones
Aunque la cardiopatía chagásica crónica es la complicación más frecuente de la fase crónica de la enfermedad, solo aparece en un tercio de los pacientes crónicamente infectados con T. cruzi. Esto ha llevado a indagar la interacción entre el parásito y el sistema inmune del hospedero como componente de la patogénesis. Si bien la falla cardiaca producida por la enfermedad de Chagas es de peor pronóstico que las cardiopatías por otras etiologías, el pronóstico de sobrevida y de algunas complicaciones posteriores al trasplante cardiaco, parecerían ser mejores. Esto indicaría que la modulación del sistema inmune del paciente trasplantado, inducida por el parásito, en este caso sería beneficiosa. En la fase crónica de la enfermedad no se visualizan los parásitos en el tejido, aunque se ha demostrado la persistencia de estos usando técnicas moleculares más sensibles. Los antígenos parasitarios inducen una alteración de la función de los linfocitos T con cambios en sus funciones efectoras que permiten la sobrevida del parásito y algunas de estas participan en el daño tisular. Esta alteración de los linfocitos T podría ser una de las causas que ayudarían a explicar los resultados pronósticos obtenidos en pacientes chagásicos con trasplante de corazón.














