Introducción
El paciente con infección asociada a dispositivo se considera de alto riesgo de complicación y de muerte. Ante esta infección se debe evaluar si existe: compromiso sistémico, signos de respuesta inflamatoria, presencia de abscesos, endocarditis o disfunción multiorgánica; condiciones que ponen en riesgo la vida de los pacientes1. La primera valoración debe hacerse por los médicos entrenados en manejo de infección de dispositivos, de tal forma que sean ellos quienes dirijan las intervenciones diagnósticas y terapéuticas a realizar1. Queremos hacer énfasis en el manejo de los pacientes con infección asociada a dispositivo sin endocarditis, definida como la presencia de cambios inflamatorios en el bolsillo (eritema, calor, rubor, dolor), y respuesta inflamatoria sistémica activa pero sin criterios de endocarditis2.
Una antigua práctica, tiene una nueva indicación en la electrofisiología. El uso de los sistemas de presión negativa (SPN), tiene varios reportes de éxito en el manejo de las infecciones asociadas al dispositivo sin endocarditis (IADSE) (3. El SPN tiene un funcionamiento complejo: está basado en las propiedades físicas del contacto de una espuma y el tejido4.
Esta terapia se ha evaluado de forma exitosa en múltiples escenarios clínicos, como: intervenciones en heridas abdominales y ortopédicas3,4.
Para la utilización del sistema, se debe introducir una espuma en el bolsillo vacío, posteriormente, un aislante fijado a la piel hace que el sistema quede cerrado; se conecta un tubo a la interfase espuma-tejido y a un sistema de succión que genera la presión negativa (Fig. 1). El material que se pone en contacto con la herida puede ser de dos tipos: éter de poliuretano (espuma negra) o polivinil alcohol (espuma blanca) (3),(4.
Materiales y métodos
Se presenta la experiencia de un hospital de cuarto nivel, en el uso de los SNP para el manejo de las IADSE. Durante el año 2015, los autores adoptamos el uso de los SPN en los pacientes con las IADSE, con la intención de disminuir los días de estancia hospitalaria y la necesidad de reintervenciones por sangrados. Esta se introdujo como complemento al protocolo previo que incluye: la extracción del dispositivo y los electrodos, la capsulectomía anterior, la posterior y el lavado de bolsillo con solución salina.
Todos los pacientes incluidos recibieron el mismo tratamiento, se realizó: el explante del dispositivo y la extracción manual. Se les implantó la espuma de éter de poliuretano (Granufoam®), con sello de la cavidad, se inició la terapia con el sistema de presión negativa continúa a 125 mmHg por 72 a 96 horas. Si el paciente se encontraba anticoagulado, se utilizó la presión negativa de 75 mmHg. La terapia se usó en promedio por 5 días y se obtuvieron en promedio drenajes de 18 cc/día. El retiro de la terapia se realizaba cuando el drenaje era claro, tenía secreción escasa y existía mejoría clínica. Adicionalmente, se debió retirar la terapia, si empeoraba la condición clínica o el paciente tenía indicación de otro tipo de tratamiento como: reintervención quirúrgica, cirugía de extracción abierta u otra conducta.
Resultados
Esta serie cuenta con cinco casos (cuatro hombres y una mujer, con edad mínima de 32 años y máxima de 96 años), todos con las IADSE (Tabla 1).
Tabla 1 Características de los pacientes tratados con terapia de presión negativa en enero y julio de 2015 (n = 5)
| Mediana o n | Rango o % | |
| Edad (años) | 40 | (28-96) |
| Sexo masculino | 4 | 80 |
| Estancia hospitalaria (días) | 24 | (9-28) |
| Días de tratamiento con presión negativa (días) | 6 | (2-9) |
| Drenaje (cc) | 11 | (5-35) |
| Aislamiento microbiológico | 2 | 40% |
A continuación se hará un reporte de lo más relevante de los pacientes: Paciente 1: hombre de 39 años de edad, portador de válvula mecánica en posición aórtica (Fig. 2). Dada la evidencia de las IADSE, se le realizó explante de dispositivo (explante quirúrgico, más tracción manual de los electrodos) y resección de tumoración pectoral, la cual no mostró malignidad. Este paciente recibió tratamiento con los SPN por 6 días, durante este tiempo estuvo anticoagulado con heparina sódica en infusión continúa. A pesar de que no se realizó aislamiento microbiológico en ninguna muestra, el paciente recibió antibioticoterapia en esquema de 21 días e implante posterior de marcapasos, sin presentar complicaciones relacionadas con el sangrado o la reintervención. La estancia hospitalaria fue de 28 días.
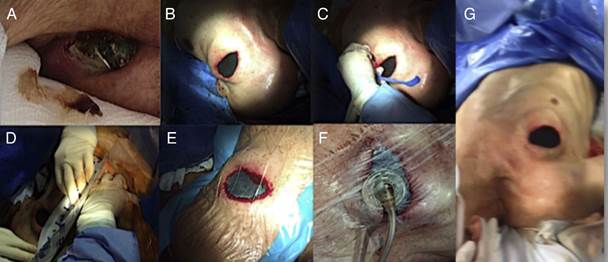
Figura 2 Paciente de 96 años con exposición del dispositivo, a quien se le implantó sistema de presión negativa. A. Imagen inicial con extrusión de dispositivo. B. Implante de espuma. C-D. Implante de membrana. E-F. Implante de succión negativa. G. Imagende posición de abordaje para implante de sistema de presión negativa.
Paciente 2: mujer de 32 años de edad, con infección asociada a marcapasos, a la que se le realizó extracción en dos tiempos: en un primer tiempo se le realizó extracción percutánea del dispositivo y tracción manual de los electrodos con fractura del electrodo auricular. Se inició la antibioticoterapia y la terapia de presión negativa. Dada la persistencia de los íntomas, se requirió abordaje quirúrgico por esternotomía para retiro de punta del electrodo fracturado. En el seguimiento no presentó aislamiento microbiológico en la sangre ni en material explantado.
La paciente no requirió nuevo implante, dado la ausencia de síntomas de disfunción sinusal, los cuales habían sido la indicación inicial de implante del dispositivo.
Paciente 3: hombre de 39 años de edad, con disfunción ventricular, cardiopatía dilatada deorigen chagásico, en quien se le realizó implante por prevención primaria de muerte súbita, requirió la extracción y uso de los SPN por 2 días, con posterior implante del dispositivo contralateral. -Pacientes con aislamiento microbiológico:
Paciente 4: hombre de 62 años de edad, con aislamiento en la sangre de Staphylococcus aureus. Este paciente tenía infección asociada al implante del cardiodesfibrilador. Se usó la terapia de presión negativa durante 9 días y recibió antibioticoterapia con un esquema de 14 días. Se reimplantó una vez terminado el tratamiento antibiótico, con una estancia hospitalaria de 25 días.
Paciente 5: hombre de 96 años de edad, portador de marcapasos bicameral, por bloqueo auriculoventricular completo, a quien se le aisló en la sangre la Pseudomona Aureginosa. Este individuo requirió implante de electrodo transitorio y un nuevo implante de marcapasos definitivo a los 13 días del explante (Fig. 3). Este paciente duro con los SPN 6 días y su hospitalización fue de 24 días.
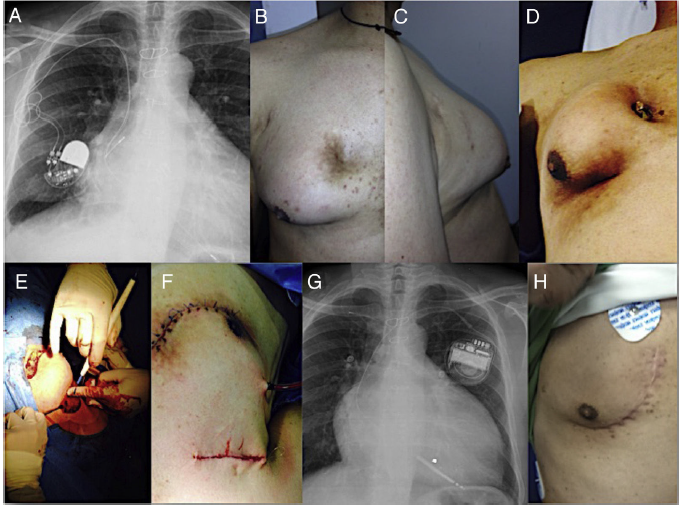
Figura 3 Paciente de 39 años con extrusión de dispositivo y ginecomastia. A. Posición incial de generador. B-C. Paciente 6 meses antes de presentar la extrusión del dispositivo. D. Extrusión de dispositivo en pectral derecho. E. Disección con explante de dispositivo. F. Resección de tumoración asociada a generador extruido e implante de terapia con presión negativa. G. Imagen con implante contralateral de generador. H. Herida de extracción y resección de masa pectoral curada 2 meses después de la intervención.
La evolución estética de la herida posterior al retiro de los SPN fue buena y aceptada por los pacientes, no existió cicatrización anormal en ninguno de los casos.
No existió mortalidad relacionada con el uso de los SPN, ni reinfección posterior a su retiro en el seguimiento a los 4 meses.
Discusión
Las indicaciones del explante en el manejo de la infección por los dispositivos de estimulación cardiaca incluyen: las IADSE, la infección asociada al generador cuando el riesgo de extracción de los cables no compromete la vida del paciente y la endocarditis asociada al dispositivo.
Este tipo de terapias requiere, además, antibioticoterapia especifica y dirigida a los gérmenes comunes3. En la serie de casos evaluada, los pacientes se llevaron al explante por infección asociada al generador y ninguno de ellos cumplía criterio de endocarditis asociada.
Reportamos el aislamiento microbiológico en 2 de 5 de los pacientes. En la literatura la prevalencia de la infección asociada a dispositivos llega hasta el 7%, con una incidencia de 1/1000 dispositivos implantados, con una mortalidad que está entre el 5 y el 60%3. En reportes del explante de dispositivos por infección; es más común el explante en pacientes portadores de marcapasos que en pacientes portadores de cardiodesfibriladores3,5. Hastael 78% de los aislamientos que se reportan son monobacterianos, 10% de los pacientes tienen crecimiento polibacteriano y hasta un 12% cultivos negativos3. El 45% de los aislamientos son de Staphylococcus aureus, 44% de estos se reportan como meticilino-resistentes y solo del 9 al 18% son gérmenes gram negativos3,6. Dentro de los factores de riesgo reportados para la endocarditis asociada a dispositivo, se mencionan: la edad mayor a 69 años, los antecedentes de diabetes, la enfermedad reumática cardiaca, la insuficiencia renal, la endocarditis previa o el reimplante en la misma hospitalización9.
Dentro de las complicaciones reportadas, posteriormente, al explante por infección se encuentran: el requerimiento de la UCI en un 17%, la falla renal aguda el 15%, el hematoma el 3.4%, el taponamiento cardiaco el 0.5% y la muerte intrahospitalaria en un 4.6%2,3.
El 57% de los pacientes con dispositivos explantados, requieren reimplante en la misma hospitalización y el 33% de los pacientes no requiere nuevo implante del dispositivo4,8,9.
En nuestra experiencia una paciente de cinco (20%) no requirió nuevamente implante deldispositivo. El uso de los SPN en infecciones no complicadas ha sido amplio, desde su lanzamiento como terapia para el manejo de infecciones, se estima que con diversas aplicaciones su uso oscila alrededor de 300 millones de usuarios en el mundo y se ha demostrado que es una terapia segura, aun en heridas no complicadas y en los pacientes con respuesta inflamatoria sistémica y sepsis5,7.
Los SPN como parte de un protocolo de manejo de las IADSE que incluya la extracción temprana de material infectado, resulta ser una terapia novedosa, segura y que acelera el proceso de curación de los pacientes, disminuye la necesidad de nuevas intervenciones lo cual es una ventaja sobre el manejo convencional de este tipo de infecciones4,9.
En una serie de pacientes, en donde se evaluó el uso de dispositivo de presión negativa para el manejo de infección asociada al generador, se encontró que la media de estancia hospitalaria fue de 34 días, con un caso de reinfección posterior a la terapia con presión negativa en el día 69 de seguimiento9. En nuestros pacientes, no existieron casos de reinfección posterior al retiro de la terapia de presión negativa, esto puede deberse a la intervención que proponemos como protocolo para las infecciones no complicadas que comprende: la extracción completa, la capsulectomía anterior y posterior, el lavado y el implante de la terapia de presión negativa.
La mediana de la estancia de nuestros pacientes fue de 24 días (con un rango de 9 a 28 días), en contraste con lo reportado en la serie más grande con una mediana de 11 días (rango de 2 a 43 días) (5. Esto probablemente sea explicable por la complejidad de nuestros pacientes, la necesidad de tratamientos antibióticos prolongados y la limitación a la atención médica ambulatoria en nuestros pacientes.
¿Cómo usar los SPN en infecciones asociadas a dispositivos sin evidencia de endocarditis?
Se propone el uso inicial de la terapia con los SPN, continúa por 48 horas, con posterior activación de ciclos de 2 minutos de succión y descanso de 3 minutos, con presión inicial de menos de 125 mmHg de presión. Si el paciente se encuentra anticoagulado y no es posible diferir la terapia anticoagulante se propone el uso de la presión negativa continúa con menos de 75 mmHg4,5,10. La espuma se debe poner en contacto con el tejido y cerrar el circuito de la presión negativa.
Esta espuma y el sistema debe cambiarse cada 3 días. Según la literatura actual, es razonable realizar un reimplante contralateral al sitio del explante una vez la infección esté controlada4,5,10.
¿Cuándo no usar los SPN en infecciones asociadas a dispositivos sin endocarditis?
Se mencionan como contraindicaciones: la presencia de tejido necrótico, las escaras, la osteomielitis sin tratamiento, las fistulas no tratadas, las heridas por malignidad, la exposición de la vasculatura, los nervios expuestos u órganos expuestos6,10. Son ejemplos los pacientes con osteomielitis esternal o clavicular, pacientes con postoperatorios de cirugía ortopédica, pacientes con fistulas crónicas activas de tejido vecino a los bolsillos y pacientes con escoriaciones o úlceras complejas en la piel circundante a sitio de implante.
¿Cuál es la utilidad de la terapia?
El uso de esta terapia novedosa, incluye procedimientos en pacientes con las IADSE, especialmente, a los que se les realiza capsulectomía completa y extracción manual o que presenten heridas grandes con afrontamiento difícil que requerirían múltiples intervenciones antes de su afrontamiento final.
Es una intervención que ahorra costos. En nuestra experiencia en el pasado el no uso de los SPN era reemplazado con lavados múltiples, hasta que la herida permitiera el cierre. Esto aumentaba el número de procedimientos posteriores: lavados adicionales, anestesia a repetición, sumándole el dolorcausado al paciente por múltiples intervenciones. El costo aproximado en nuestro medio de un procedimiento de extracción manual en donde, además, se implanten los SPN es de $ 1′400.000. Resulta ser menor que una extracción complicada que requiere múltiples intervenciones posteriores. Costos evitados por el uso de los SPN.
Conclusiones
El uso de los sistemas de presión negativa es una antigua herramienta con un uso novedoso en el campo de la electrofisiología.
El uso de los sistemas de presión negativa dentro de un protocolo que incluya: la extracción completa, la capsulectomía, el lavado, la antibioticoterapia sistémica, hace parte del protocolo que proponemos para el manejo agresivo de las IADSE, permitiendo al intervencionista en dispositivos, minimizar las reintervenciones por infección.
Solamente uno de los cinco pacientes descritos requirió reintervención, no obstante, esta fue para extracción de punta del electrodo fracturado y nunca hubo aislamiento microbiológico.
Comparativamente, las series publicadas muestran una mediana de hospitalización menor, pero, con un rango más amplio de los días de hospitalización que lo encontrado en nuestra serie de los pacientes, aunque no se demostró una menor duración de la hospitalización que lo reportado si encontramos ausencia de mortalidad relacionada con SPN y disminución del número de intervenciones posteriores por sangrado del sitio operatorio.















