Introducción
Las enfermedades cardiovasculares debido a la aterosclerosis y la trombosis son la causa más importante de la mortalidad prematura y la pérdida de años de vida por discapacidad a nivel mundial. Las principales entidades son: la enfermedad coronaria, el accidente cerebrovascular y la enfermedad arterial periférica. Las causas de estas condiciones son multifactoriales y algunos de estos factores son modificables como: la hipertensión, la diabetes y la dislipidemia 1. Los niveles altos de lipoproteínas de baja densidad han sido consistentemente asociados con el aumento del riesgo de enfermedades cardiovasculares, por lo tanto, la optimización del perfil lipídico es una herramienta fundamental para disminuir la incidencia de eventos coronarios. Por ejemplo: una reducción de 40 mg/dL de las lipoproteínas de baja densidad se traduce en una disminución de eventos coronarios del 40%2.
Las guías de la prácticas clínicas internacionales recomiendan a las estatinas como la terapia de elección para el manejo de la dislipidemia2)-(5. Sin embargo, pese a la evidencia contundente acerca de la importancia del manejo de esta condición, existe un porcentaje significativo de adultos que no logran metas en los lípidos con las estatinas.
En el año 2003 Seidah y Cols., identificaron el noveno miembro de la familia de las paraproteínas convertasas, este descubrimiento permitió entender al rol de la paraproteína convertasa subtilisina kexina tipo 9 en la regulación del metabolismo del colesterol. Inicialmente se reconocieron dos mutaciones con ganancia de función en el gen de la paraproteína convertasa subtilisina kexina tipo 9 en dos familias francesas con el diagnóstico clínico de hipercolesterolemia autosómica dominante sin mutación previamente establecida. Posteriormente, distintos estudios genéticos determinaron que las mutaciones con pérdida de función y polimorfismos de la paraproteína convertasa subtilisina kexina tipo 9 se asociaban con la disminución de las concentraciones plasmáticas de las lipoproteínas de baja densidad. Las primeras mutaciones identificadas con la pérdida de la función de la paraproteína convertasa subtililina kexina tipo 9 se describieron en el año 2005 y fueron la Y142x y la C679X. Lo anterior ha estimulado el desarrollo de los tratamientos alternativos, incluyendo los anticuerpos monocolonales que inactivan la paraproteína convertasa subtilisina/kexina tipo 9. Tanto la agencia para la administración de drogas y alimentos de Estados Unidos y la agencia europea de medicamentos aprobaron en el año 2015 los dos anticuerpos monoclonales como adyuvantes a la dieta y a las dosis máximas toleradas de la estatina para la hipercolesterolemia familiar o aterosclerosis clínica en pacientes que requieren disminución adicional de las lipoproteínas de baja densidad6),(7. Actualmente, estos medicamentos están sometidos a evaluación en Colombia por el instituto nacional de vigilancia de medicamentos y alimentos. En este artículo realizaremos un estado del arte con la evidencia actual acerca del mecanismo de acción de los anticuerpos de la antiparaproteína convertasa subtilisina/kexina tipo 9, la evidencia clínica y las indicaciones actuales con el objetivo de optimizar el tratamiento clínico de los pacientes con dislipidemias.
Mecanismo de acción
La paraproteína convertasa subtilisina/kexina tipo 9 humana está localizada en el cromosoma 1p32.3 que codifica una glicoproteína inactiva de 692 aminoácidos. La paraproteína convertasa subtilisina/kexina tipo 9 se expresa en varios órganos, en particular en: el hígado, el intestino y el riñón. Inicialmente, la glicoproteína inactiva (preproparaproteína convertasa subtilisina/kexina tipo 9) es clivada y posteriormente, en el retículo endoplasmático se convierte en paraproteína convertasa subtilisina/kexina tipo 9. Una vez sale del retículo endoplasmático, la paraproteína convertasa subtilisina/kexina tipo 9 atraviesa una última modificación en donde su dominio C-Terminal es alterado para poder ser secretada7),(8.
La principal función de la paraproteína convertasa subtilisina/ kexina tipo 9 es la degradación del receptor de las lipoproteínas de baja densidad. Una vez es secretado, la paraproteína convertasa subtilisina/kexina tipo 9 se une directamente con el receptor de las lipoproteínas de baja densidad en el hígado o ingresa a la circulación sistémica. El complejo de la paraproteína convertasa subtilisina/kexina tipo 9/receptor de las lipoproteínas de baja densidad es internalizado dentro de un lisosoma para ser degradado. La presencia de la paraproteína convertasa subtilisina/kexina tipo 9, entonces, tiene como resultado final un aumento en la degradación del receptor de las lipoproteínas de baja densidad produciendo un menor número de receptores en la superficie de la célula (Fig. 1). El aumento de la concentración de la paraproteína convertasa subtilisina/kexina tipo 9 en el plasma produce un incremento en la concentración total de las lipoproteínas de baja densidad ya que la recaptación de este último se encuentra reducida por el bajo número de receptores en la superficie celular. Por el contrario, cuando la actividad de la paraproteína convertasa subtilisina/kexina tipo 9 es inhibida, hay una menor degradación del receptor de las lipoproteínas de baja densidad lo que ocasiona una mayor concentración de estos hacia la superficie celular y, asimismo, una recaptación más eficiente del colesterol de las lipoproteínas de baja densidad desde el torrente sanguíneo (Fig. 2) (8.

Figura 1 Mecanismo de acción de la paraproteína convertasa subtilisina/kexina tipo 9. El complejo de la paraproteína convertasa subtilisina/kexina tipo 9/y el receptor de las lipoproteínas de baja densidad es internalizado dentro de un lisosoma para ser degradado llevando a una disminución en el número del receptor de las lipoproteínas de baja densidad en la superficie celular, la disminución de la captación de las lipoproteínas de baja densidad y el aumento de sus concentraciones sanguíneas.

Figura 2 Mecanismo de acción de los inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9. Cuando la actividad de la paraproteína convertasa subtilisina/kexina tipo 9 es inhibido por un anticuerpo, un número importante de receptores de las lipoproteínas de baja densidad retornan a la superficie celular y no son degradados por los lisosomas, en consecuencia aumenta la captación de las lipoproteínas de baja densidad circulante y disminuye la concentración sanguínea de las lipoproteínas de baja densidad.
Evidencia clínica
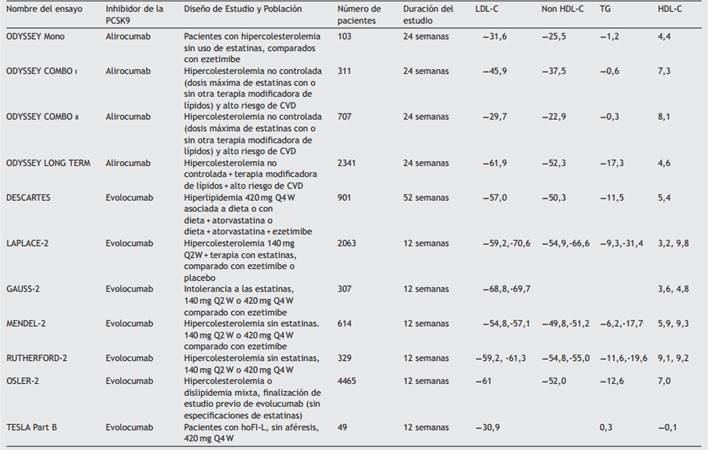
Los inhibidores de la paraproteína convertasa subtilisina/ kexina tipo 9 son una clase nueva de medicamentos que han demostrado una disminución de los niveles de las lipoproteínas de baja densidad del 50 a 70% como monoterapia o en tratamiento previo con las estatinas. Además, los inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9 son un excelente ejemplo del desarrollo de los nuevos medicamentos, en el cual el descubrimiento de las mutaciones genéticas específicas ha estimulado la conducción de estudios clínicos9. En la Tabla 1 se describen los inhibidores de la paraproteína convertasa subtilisina/kexina en desarrollo10.
En la Tabla 2 se resumen todos los estudios publicados de los inhibidores de la paraproteína convertasa subtilisina/ kexina tipo 9 versus comparador activo o placebo. Se observa que estos anticuerpos reducen significativamente los niveles de las lipoproteínas de baja densidad independientemente de: la edad, el género, el índice de masa corporal, la etnia o las concentraciones de las lipoproteínas de baja densidad. Los inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9 se pueden administrar en los pacientes que venían recibiendo las estatinas. En este caso el efecto de la disminución de las lipoproteínas de baja densidad es independiente a la dosis de la estatina suministrada11. La frecuencia de la administración parenteral puede ser cada 2 o 4 semanas, no obstante, la administración de alirocumab cada 4 semanas produjo una fluctuación mayor en las concentraciones de las lipoproteínas de baja densidad12.
En términos de seguridad, el 35 a 76% de los pacientes con inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9 presentaron eventos adversos y el 2 a 6% presentaron eventos adversos serios. Estos datos son similares al grupo de comparación. Las elevaciones superiores a 3 veces el nivel normal de las transaminasas se presentó en menos del 2% de los pacientes. Asimismo, la elevación de la creatina quinasa fue poco frecuente13)-(15. Otro efecto adverso que se puede presentar es la reacción en el sitio de la punción (aproximadamente 5%), pero el porcentaje de los pacientes que suspenden el medicamento por este efecto es menor del 1%. En los estudios clínicos aproximadamente el 85% de los pacientes continuaban al año con el inhibidor de la paraproteína convertasa subtilisina/kexina tipo 9 o placebo, indicando una buena tolerabilidad de estos medicamentos pese a ser parenterales15.
Un reciente metaanálisis que incluyo 17 estudios clínicos controlados comparando los inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9 versus el tratamiento estándar para las hiperlipidemias primarias, evidenció una disminución del 57% (p < 0,001) en las concentraciones de las lipoproteínas de baja densidad. Adicionalmente, estos anticuerpos redujeron la mortalidad por todas las causas en el 43% (p < 0,01) y presentaron un aumento de los eventos adversos cognitivos. En la actualidad se están desarrollando estudios en la fase 3 que buscan evaluar el efecto de esta terapia y aclarar los posibles efectos adversos cognitivos16.
Pacientes candidatos a inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9
Hipercolesterolemia familiar: La hipercolesterolemia familiar heterocigota es una de las enfermedades genéticas más frecuentes (prevalencia 1/200-1/500) y se caracteriza por los niveles elevados de las lipoproteínas de baja densidad y el desarrollo temprano de la enfermedad cardiovascular ateroesclerótica (42 a 46 años en los hombres y 51-52 años en las mujeres). La hipercolesterolemia familiar homocigota es más severa con el desarrollo de la enfermedad ateroesclerótica alrededor de los 20 años. El objetivo de las lipoproteínas de
baja densidad en estos pacientes es menor a 70 mg/dl; no obstante, alrededor del 80% de estos pacientes no alcanzan las lipoproteínas de baja densidad menor de 100 mg/dl17), (18.
Pacientes en tratamiento con las estatinas de alta intensidad a dosis máximas que no alcanzan metas.
Pacientes en tratamiento con las estatinas y efectos adversos no tolerados.
En los últimos dos grupos de pacientes, según las últimas guías europeas para el manejo de las dislipidemias se podría utilizar ezetimibe, inhibidores de la absorción de los ácidos biliares o fibratos (no genfibrozil) antes de considerar inhibidores de la paraproteína convertasa subtilisina/kexina tipo 919, aunque recientemente el estudio GAUSS-320, en pacientes intolerantes a las estatinas, evolocumab versus ezetimibe durante 24 semanas, confirmó el efecto sobre la disminución en las concentraciones de las lipoproteínas de baja densidad (53% versus el 17%, respectivamente) de estudios clínicos previos con cada una de las moléculas por separado.
Conclusiones
Las enfermedades cardiovasculares debido a la aterosclerosis y la trombosis son la causa más importante de mortalidad prematura y pérdida de años de vida por discapacidad a nivel mundial. Las causas de estas condiciones son multifactoriales y algunos de estos factores son modificables. La llamada dislipidemia aterogénica es uno de los principales factores de riesgo modificables, en especial los niveles elevados de las lipoproteínas de baja densidad. Las recomendaciones actuales de las guías de manejo de la dislipidemia y el riesgo cardiovascular basadas en los desenlaces de los estudios clínicos, se centran principalmente en la reducción de las lipoproteínas de baja densidad.
Pese a la instauración de un adecuado tratamiento de esta patología existe un porcentaje significativo de adultos que no logran las metas de las lipoproteínas de baja densidad con las estatinas de alta intensidad, esto ha estimulado el desarrollo de los tratamientos alternativos como los inhibidores de la paraproteína convertasa subtilisina/ kexina tipo 9, estos medicamentos son una alternativa eficaz y segura para aquellos pacientes que son intolerantes a las estatinas o quienes no alcanzan los objetivos de las lipoproteínas de baja densidad con dosis máximas de las estatinas de alta intensidad. Lo anterior es más frecuente en los pacientes con: hipercolesterolemia familiar homocigota o heterocigota. Están pendientes aún los resultados sobre la disminución en eventos cardiovasculares, los cuales fortalecerán el uso de estos medicamentos con el fin de optimizar el manejo hipolipemiante en los pacientes con riesgo residual importante.
Por último, no podemos olvidar que el tratamiento de estos pacientes empieza con las recomendaciones acerca de la dieta, el ejercicio y los estilos de vida saludables.