Introducción
La falla cardíaca es una entidad rara en la edad pediátrica, pero requiere de reconocimiento temprano y terapia agresiva. La incidencia reportada es de 0,34 -0,87 casos por cada 100.000 personas. El 52% de éstos ocurre en el primer año de vida1,2 y aunque es poco frecuente, su mortalidad a los 5 años es alta; en algunos reportes llega al 80% en la edad pediátrica3. En adultos la mortalidad de la falla cardiaca es del 40 al 50% en ese mismo período de tiempo4-6, en tanto que la mortalidad de pacientes hospitalizados por falla cardiaca se estima en 7,3% (6,9-8%), con estancias prolongadas en promedio de 19 días7.
Entre el 5 y el 20% de los pacientes con cardiopatía congénita pueden presentar falla cardíaca, pero en pacientes pediátricos que han tenido cirugía tipo Fontan llega hasta un 20% y se incrementa hasta un 50% en aquellos que alcanzan la vida adulta8,9.
Definición
Pese a que existen varias acepciones para falla cardíaca, la mayoría coincide en que se trata de un síndrome progresivo con características clínicas y fisiopatológicas, causado por alteraciones cardiovasculares y no cardiovasculares, que se asocian a alteraciones neurohormonales o circulatorias y cambios moleculares que producen deterioro progresivo del corazón y muerte prematura de células miocárdicas10,11.
En 2013, el American College of Cardiology y la American Heart Association definieron la falla cardíaca como un síndrome clínico complejo, que es el resultado de cualquier lesión estructural o funcional que produzca incapacidad para el llenado o eyección ventricular de sangre12,13.
Entre tanto, en 2014, la Sociedad internacional de trasplante de corazón y pulmón la definió como como: “La falla cardíaca en un síndrome clínico y patofisiológico que es el resultado de una disfunción ventricular, sobrecarga de presión o volumen, solos o en combinación, que lleva a signos y síntomas característicos tales como retraso del crecimiento, trastornos de la alimentación, intolerancia al ejercicio y fatiga. Está asociado con anormalidades circulatorias, neurohormonales y moleculares. La falla cardíaca tiene muchas etiologías, que son consecuencia de alteraciones cardíacas o no cardíacas que pueden ser congénitas o adquiridas” 14.
Podría decirse que tantas definiciones hablan de la complejidad del problema.
Etiología
En niños la etiología de la falla cardíaca es muy diversa y como primer grupo está la secundaria a cardiopatías congénitas corregidas o no, en tanto que el segundo gran grupo corresponde a las cardiopatías adquiridas. Las enfermedades de depósito o secundarias a defectos genéticos son poco frecuentes.
En general la falla cardíaca puede ser secundaria a alguno de estos cuatro mecanismos13:
Disfunción sistólica.
Disfunción diastólica.
Sobrecirculación pulmonar con mala perfusión sistémica.
Mezcla inadecuada de sangre.
En la tabla 1 se enumeran las diferentes causas de falla cardíaca aguda en niños de acuerdo con los diferentes grupos etarios.
Tabla 1 Etiología de la falla cardíaca aguda de acuerdo con los grupos etarios
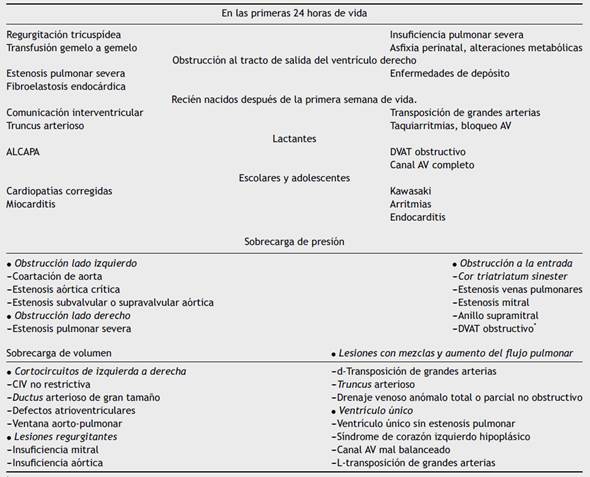
* DVAT: Drenaje venoso anómalo total.
Causas de falla cardíaca en pacientes con cardiopatías congénitas (tabla 1 A y B)
Sobrecarga de volumen por cortocircuitos de izquierda y derecha o regurgitación valvular
Sobrecarga de presión por enfermedades valvulares o lesiones obstructivas
Falla ventricular por disfunción miocárdica intrínseca
Hipertensión pulmonar secundaria a cardiopatía congénita, disfunción ventricular o comorbilidades como apneas obstructivas del sueño
Hipertensión arterial sistémica secundaria a coartación de aorta, enfermedad renal, hipertensión arterial primaria o arteriosclerosis
Enfermedad coronaria secundaria a cardiopatías congénitas, arteriosclerosis o a diabetes mellitus
Cianosis
Arritmias auriculares intratables8
En la mayoría de los casos, las causas de falla cardíaca crónica se encuentran asociadas a miocardiopatía dilatada; dentro de este grupo la miocarditis es la causa más frecuente15. Otras causas son, la agudización de miocardiopatías crónicas de diferentes etiologías, la presencia de arritmias como taquicardias incesantes o bloqueo AV completo que pueden llevar a disfunción miocárdica progresiva (tabla 2A y B).
Fisiopatología
A diferencia de los adultos en quienes la falla cardíaca es secundaria a una pérdida de miocitos por enfermedad isquémica en la mayoría de los casos, en niños lo más frecuente es la sobrecarga de volumen por los cortocircuitos, siendo menos común la secundaria a lesiones isquémicas o inflamatorias. Hasta en el 30% de los casos el compromiso de la función diastólica es la causa de la falla cardíaca, pero en general pasa inadvertida. La sístole auricular y ventricular corresponde a menos del 25% del ciclo cardíaco auricular o ventricular; el resto corresponde a la diástole. Patologías que dañen la diástole auricular o ventricular comprometen gran parte del ciclo cardiaco. En la edad pediátrica las patologías que comprometen la relajación del ventrículo derecho son frecuentes y se asocian a cardiopatías congénitas con obstrucción a la salida del ventrículo derecho corregidas o no, e hipertensión pulmonar de diversas etiologías.
La adaptación inadecuada de los miocitos cardíacos al incremento en la tensión de la pared para mantener un gasto cardíaco adecuado es uno de los eventos precipitantes de la falla cardíaca en casos de lesiones obstructivas al tracto de salida del ventrículo derecho o izquierdo.
Los factores que pueden conducir a falla cardíaca son variados y pueden resumirse en cinco grandes categorías:
Disminución de la función contráctil.
Sobrecarga de volumen.
Sobrecarga de presión.
Disfunción diastólica.
Cambios en el sistema vascular periférico.
Disminución de la función contráctil: puede ser secundaria a pérdida de sarcómeras, infarto e isquemia o alteración de la función de la sarcómera. Esta disminución de la contractilidad se manifiesta por una reducción en la capacidad de generar fuerza contráctil, así como disminución en el acortamiento y en la velocidad de acortamiento de la fibra miocárdica. Asociado a esto se puede ver una alteración en los niveles del ATP de la miosina que ocasionalmente puede ser la causa de la alteración en la contractilidad.
Sobrecarga de volumen: existe diferencia entre sobrecarga de volumen y sobrecarga de presión en el corazón en falla. La sobrecarga de volumen se halla en los grandes cortocircuitos de izquierda a derecha, como la comunicación interventricular y el ductus arterioso grande, que potencialmente causarán dilatación biventricular y aumento de la tensión transmural, alterando la relación de suministro-consumo de oxígeno miocárdico al disminuir la capacidad contráctil. Eventualmente esto eleva la presión diastólica limitando la precarga, y como consecuencia se genera disfunción diastólica.
Sobrecarga de presión: se genera usualmente por una obstrucción al flujo de sangre, ya sea estenosis pulmonar, aórtica, coartación de aorta, interrupción del arco aórtico o hipertensión pulmonar severa, que tienen un efecto muy deletéreo sobre la función contráctil. Al estar un ventrículo sometido a una sobrecarga de presión continua se produce hipertrofia e incremento en el espesor de la pared lo que conlleva caída del gasto cardíaco con alteración en el suministro de oxígeno sistémico.
Disfunción diastólica: produce una alteración en la relajación, eleva las presiones de llenado y altera el llenado ventricular en diástole. Esto genera una caída del volumen latido y, en consecuencia, caída del gasto cardíaco. Un mecanismo compensador inicial es el aumento de la frecuencia cardíaca, pero esta limita el llenado ventricular empeorando el ya comprometido gasto cardíaco. Este fenómeno se aprecia especialmente en ventrículos hipertróficos.
Cambios en el sistema vascular periférico: este es el último factor que puede llevar a falla cardíaca. Siempre en los cuadros de falla cardíaca avanzada se produce vasoconstricción periférica, secundaria a incremento en las catecolaminas y aminas presoras. También este fenómeno en falla cardíaca se debe a alteraciones del endotelio que impide la vasodilatación arterial en respuesta a estímulos, aún al óxido nítrico.
Los mecanismos adaptativos más importantes para el corazón en falla son16:
Mecanismo de Frank-Starling: es la habilidad del corazón de cambiar su contractilidad con base en el grado de retorno venoso. En el corazón en falla el aumentar la precarga puede llevar a un incremento en el volumen latido para mantener el gasto cardíaco17.
Activación del sistema neurohumoral: hay aumento en la actividad del sistema simpático, sistema renina-angiotensina-aldosterona, liberación de vasopresina y péptidos natriuréticos para mantener la tensión arterial y perfusión de órganos terminales18,19.
La liberación de péptidos natriuréticos en falla causa vasodilatación periférica, disminuye la producción de aldosterona y el tono de la arteria renal aferente, aumenta el tono de la arteria renal eferente, el flujo sanguíneo renal, la filtración glomerular y la excreción de sodio y agua. Cualquiera que sea el mecanismo precipitante el resultado es la caída del gasto cardíaco, la cual estimula el sistema neuroendocrino y hace que el organismo retenga líquidos y aumente la resistencia vascular sistémica para mantener la presión arterial. Ese intento por mantener una tensión arterial normal trata de proteger la perfusión coronaria, renal y cerebral, pero el aumento de la postcarga causado por el aumento de la resistencia vascular sistémica es deletéreo para la función de un miocardio en falla. Siempre habrá retención de líquidos que producirá disnea, edemas y fatiga, así como aumento de la precarga de un ventrículo que trabaja en el límite máximo del estiramiento de la fibra miocárdica1,20-23.
Como respuesta a la caída de la tensión arterial y del gasto cardíaco se produce incremento en los niveles de norepinefrina circulante24, el cual es un factor de mal pronóstico en la falla cardíaca, que se asocia a un incremento de la apoptosis a través de la estimulación de genes específicos25,26. La apoptosis es reconocida como uno de los mecanismos que contribuyen a la progresión de la falla cardíaca en pacientes crónicos27.
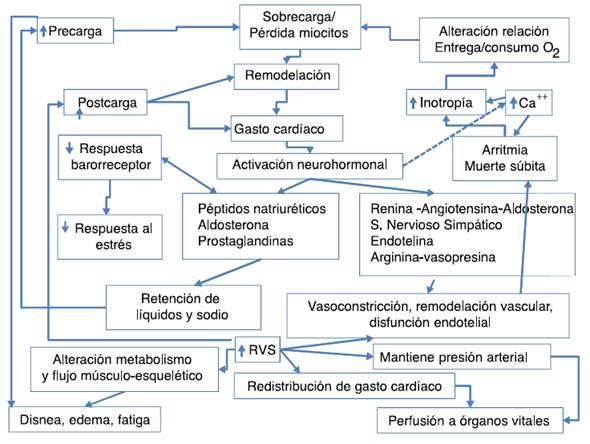
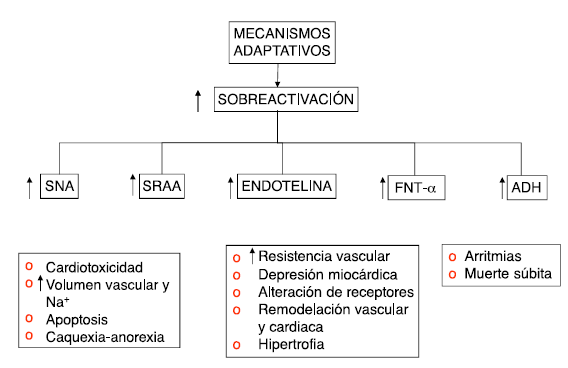
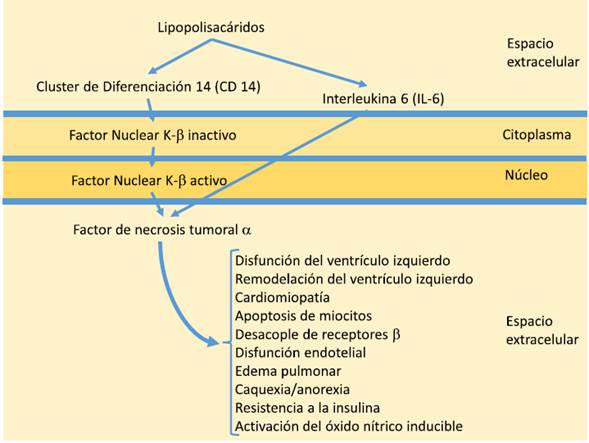
Es el compromiso de la función contráctil el mecanismo disparador de la falla, pero son los mecanismos compensatorios sobreestimulados los responsables de la perpetuación y cronicidad del cuadro clínico. La respuesta inicial es mantener la tensión arterial y la perfusión de órganos vitales, lo cual se logra a través de la activación del sistema nervioso autónomo, el sistema renina-angiotensina-aldosterona, los péptidos natriuréticos, el factor de necrosis tumoral alfa, la endotelina y la hormona antidiurética. No obstante, la sobreestimulación de estos mecanismos compensadores causa cardiotoxicidad, retención de sodio y agua, incremento de la resistencia vascular periférica, caquexia-anorexia, depresión miocárdica, alteración de receptores, remodelación vascular y miocárdica, arritmias y muerte. En falla cardíaca es imperativo alcanzar un balance entre los mediadores que producen vasoconstricción y aquellos que causan vasodilatación. En la figura 1 se muestran los mecanismos fisiopatológicos que se desencadenan después del daño inicial. Los mecanismos neurohormonales envueltos en la falla cardíaca son en muchos casos los responsables de la perpetuación de la falla cardíaca, que conduce a falla cardíaca crónica; estos se resumen en la figura 2.23 Otro mecanismo involucrado en la perpetuación de la falla cardíaca es secundario a la activación de la inmunidad innata (receptores Toll). La hipoperfusión producida por la caída del gasto cardíaco lleva a un incremento en la translocación bacteriana intestinal favoreciendo que lipopolisacáridos presentes en bacterias gram negativas sean reconocidos por receptores Toll (TLR-4) que estimulan la producción y liberación de mediadores de la inflamación por macrófagos que a su vez pueden inducir disfunción endotelial, remodelamiento del ventrículo izquierdo, desacople de receptores, caquexia, anorexia, resistencia a la insulina y apoptosis de células miocárdicas28(fig. 3).
Reconocimiento de la falla cardíaca en niños
Los cuadros clínicos se relacionan con los mecanismos compensatorios o sobre compensatorios que el organismo utiliza para suplir el suministro inadecuado de oxígeno a los tejidos21.
Todo niño en falla cardíaca tiene sobrecarga de volumen, y en niños pequeños puede manifestarse como un incremento en la frecuencia cardíaca y respiratoria y en trabajo respiratorio. Los síntomas gastrointestinales y el hallazgo de hepatomegalia son frecuentes, mientras que los edemas periféricos no lo son tanto.
Evaluación
La siguiente es la valoración que se recomienda para un paciente nuevo con diagnóstico de falla cardíaca, además de la historia clínica y del examen físico29.
En la tabla 4 encuentra los signos y síntomas más comunes en niños con falla cardíaca.
Ecocardiografía
El examen diagnóstico por excelencia es el ecocardiograma transtorácico bidimensional con doppler color.
Cuando se está en presencia de un paciente pediátrico en falla cardíaca con cardiomegalia, los hallazgos ecocardiográficos caerán dentro de una de las siguientes cinco categorías que determinarán su manejo subsiguiente:
Defecto cardíaco congénito con cortocircuito de izquierda a derecha.
Defecto cardíaco congénito con obstrucción al tracto de salida del ventrículo izquierdo o derecho
Corazón con función normal y cavidades dilatadas, especialmente ventrículo y aurícula derecha, por lo general secundaria a fístulas arterio-venosas extracardíacas (usualmente cerebrales o hepáticas). La anemia crónica también se puede presentar con el mismo cuadro ecocardiográfico.
Derrame pericárdico con taponamiento.
Corazón dilatado con función pobre.
Con excepción del ecocardiograma para la evaluación de la fracción de eyección ventricular y la resonancia magnética de imágenes,30 todos los demás exámenes paraclínicos son inespecíficos y pueden ser normales aún en presencia de falla cardíaca. La disfunción diastólica es una causa común de falla cardíaca en niños, pero es difícil de valorar dada la frecuencia cardíaca de muchos pacientes.
Biomarcadores para falla cardíaca
Existe una prueba diagnóstica que puede ayudar a diferenciar los cuadros de falla cardíaca de otras patologías que pueden asemejarse a este cuadro y es la cuantificación del péptido natriurético cerebral (NT-proBNP y BNP).
La familia de los péptidos natriuréticos consta de cuatro miembros hasta el momento: el péptido natriurético atrial (ANP), el péptido natriurético cerebral (BNP), el péptido natriurético tipo C (CNP) y el dendroaspis péptido natriurético (DNP)31. El primero de ellos, el ANP, es producido principalmente en las aurículas; al parecer los incrementos en el volumen intravascular y de la tensión de pared son los estímulos principales para su liberación. Los estímulos hormonales, neurotransmisores, endotelina o catecolaminas también favorecen su liberación31-33. El BNP en humanos es secretado por los ventrículos cardíacos cuando aumenta la tensión de la pared muscular. El péptido natriurético C es producido por el endotelio y las células vasculares del músculo liso, y parece tener actividad autocrina o paracrina.
En la actualidad es recomendable emplear los niveles séricos de NT-proBNP o BNP para el diagnóstico rápido de la falla cardíaca cuando hay dudas en el diagnóstico inicial29,34-36. Con el empleo de este tipo de examen se pueden evitar hospitalizaciones innecesarias y reducir el número de exámenes complementarios.
Los niveles de pro-BNP también se usan para el seguimiento de pacientes con falla cardíaca crónica e hipertensión pulmonar37.
En una revisión de la literatura se concluyó que el BNP y el BNP-NT pueden usarse como marcadores coadyuvantes dentro de muestreo para el diagnóstico, seguimiento y manejo de niños con falla cardíaca secundaria a enfermedades adquiridas o congénitas de diversas etiologías38.
En los últimos años han aparecido nuevos marcadores de falla cardíaca, los microARN (miARN), que aparentan tener mayor sensibilidad y especificidad que los péptidos natriuréticos.
Los microARN (aproximadamente de 22 nucleótidos de largo) están envueltos en variedades de procesos celulares al reprimir la transcripción del ARN mensajero (mARN); por tanto, modulan la expresión génica postranscripcional. En el desarrollo del corazón, los miARN son necesarios para la formación del tejido cardíaco normal; además se ha descubierto que gran variedad de miARN son reguladores importantes en varias fases del desarrollo cardíaco.
Se han detectado un sinnúmero de miARN cuyos valores pueden estar elevados o disminuidos en cuadros de falla cardíaca; también pueden predecir qué pacientes mejorarán con las diferentes terapias.
Los estudios funcionales iniciales de los miARN han reportado que una variedad de éstos desempeñan un papel importante en mecanismos patogénicos que conducen a falla cardíaca, tales como remodelación, hipertrofia, apoptosis y respuesta a la hipoxia.
Su papel y función en la circulación todavía no están resueltos así como tampoco lo están el de las terapias dirigidos hacia ellos39.
Estos nuevos biomarcadores no podrán ser empleados en la práctica clínica hasta que no se estandaricen los valores normales para cada uno de los más importantes, en cada situación.
Estudios complementarios
En todo paciente que se presente con cuadro de falla cardíaca asociado a miocardiopatía dilatada, el estudio, además de ecocardiograma y electrocardiograma, debe incluir investigación para descartar miocarditis; la resonancia magnética de imágenes puede mostrar áreas de realce tardío que sugieran miocarditis. En un estudio se demostró que la reacción en cadena de polimerasa (PCR) del aspirado traqueal en pacientes intubados, tenía buena correlación con los hallazgos de la biopsia endomiocárdica para eco y adenovirus si el paciente está intubado40. Además de los estudios anteriores, ante la sospecha de miocarditis se recomiendan estudios de serología para rubéola, Citomegalovirus, Parvovirus, Micoplasma, VIH, enfermedad de Chagas y dengue (para los que proceden de zonas endémicas). También es preciso descartar enfermedades autoinmunes con Anti-Ro, Anti-La, estudio completo para lupus, factor reumatoideo y estudios mitocondriales para descartar anomalías secundarias a trastornos de la carnitina, ciclo de la urea y lactato.
Se recomienda hacer una biopsia de músculo esquelético si hay sospecha de enfermedad mitocondrial41.
Estratificación de la falla cardíaca
En niños es más compleja que en adultos por la variedad de etiologías y mecanismos subyacentes. En lactantes con grandes cortocircuitos de izquierda a derecha los síntomas se presentan por aumento excesivo de la circulación pulmonar. Éstos pueden parecerse a los secundarios a la falla ventricular izquierda, aunque la función sistólica izquierda esté conservada. En recién nacidos, lactantes y preescolares es poco frecuente encontrar hallazgos clínicos específicos al examen físico. Hallar estertores en los campos pulmonares es poco raro y solo aparecen en los cuadros de edema pulmonar establecido. Los signos más comunes son la taquipnea y la hepatomegalia. La pobre perfusión periférica se presenta con cuadros avanzados de falla cardíaca o de choque cardiogénico1,42-45. Hay varias tablas que intentan clasificar de manera objetiva la falla cardíaca en niños de acuerdo con la edad22; una de éstas fue desarrollada por la universidad de Nueva York y tiene en cuenta factores como signos y síntomas, medicaciones que recibe el paciente y fisiología (tabla 5). En esta tabla los valores van desde cero (no-falla cardíaca) hasta 30 (falla cardíaca severa). Existe también un score clínico de severidad de falla cardíaca publicado por Ross et al. en 1992 y actualizada en 2012, en el que se tienen en cuenta los diferentes grupos etarios (tablas 5 A-F)42,46.
Este score evalúa 5 puntos, cada uno con un mínimo de 0 y un máximo de 2 puntos. El mayor puntaje es 12 y la meta del tratamiento es llevar al paciente a 0 puntos en la escala. Este tipo de score es poco conocido y sirve para evaluar la respuesta del paciente al tratamiento que recibe. Existen modificaciones a la tabla anterior (tabla 6) para lactantes, en las que se mide la cantidad en mililitros de tetero por toma y el tiempo que tarde el paciente para ingerir ese volumen, la presencia de galope y la perfusión periférica41. Ninguna de las tablas anteriores es útil para predecir mortalidad en los diferentes grupos, pero sí lo son para evaluar el manejo.
También está la clasificación de la NYHA (New York Heart Association) aceptada universalmente, que para niños tiene un par de modificaciones para poder clasificar lactantes y preescolares, así como para escolares. Los adolescentes se clasifican de acuerdo con las escalas para adultos. La clasificación para lactantes, preescolares y escolares se resume en las tablas 7 y 8, respectivamente15,42.
Estas tablas fueron diseñadas para pacientes con enfermedad cardíaca, así que el paciente asintomático al que se refiere la clase I se trata de un paciente con enfermedad cardíaca pero asintomático.
Una de las limitantes de la tabla es la utilización de la diaforesis como parte de la sintomatología y es frecuente encontrar niños diaforéticos sin falla cardíaca.
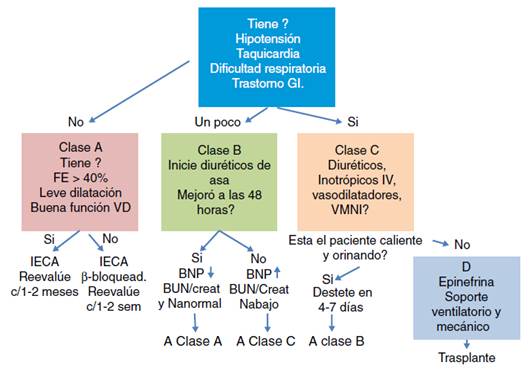
Las guías de práctica clínica para el manejo de la falla cardíaca en niños publican una nueva manera para seguimiento y control de pacientes, que evalúa el riesgo de desarrollo de la falla cardíaca. En la figura 4 se encuentran las cuatro etapas de la A, B, C y D. En las etapas A y B los pacientes son asintomáticos, mientras que en las etapas C y D son sintomáticos47. En la etapa A se encuentran aquellos sin lesión estructural cardíaca, pero con historia familiar o personal de hipercolesterolemia, hipertensión arterial, diabetes tipo I, enfermedad de Kawasaki, obesidad, etc. En ellos se deben controlar los factores de riesgo y deben ser evaluados periódicamente por su pediatra.
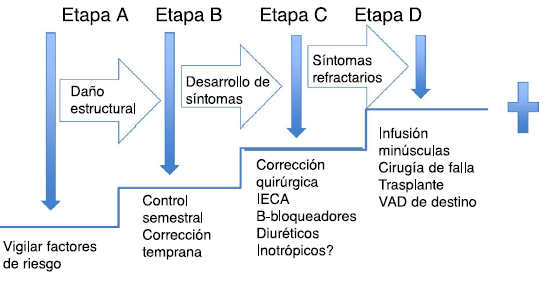
Tratamiento de la falla cardíaca de acuerdo con las etapas de riesgo. La secuencia muestra el manejo médico inicial de acuerdo con la etapa en que se presenten.
En la etapa B se encuentran pacientes que pueden tener lesión estructural cardíaca o compromiso de la función pero no han presentado signos o síntomas de falla cardíaca. En este grupo de pacientes se incluyen niños con insuficiencia aórtica con dilatación ventricular izquierda, asintomáticos. Estos pacientes deben ser controlados por cardiólogo pediatra semestralmente y realizar su corrección quirúrgica de forma temprana.
En la etapa C se encuentra el grupo de pacientes que han tenido o tienen signos o síntomas de falla cardíaca; aquí se incluyen aquellos que han tenido corrección quirúrgica o intervensionista para corregir una cardiopatía. Este grupo de pacientes debe recibir inhibidores de la enzima convertidora de angiotensina, diuréticos, betabloqueadores y, en algunos casos, inotrópicos, además se les debe corregir cualquier defecto residual o completar la corrección quirúrgica.
En el grupo D están los pacientes con falla cardíaca refractaria al manejo médico convencional y que son sintomáticos en reposo.
Este grupo requiere el empleo de infusiones de inotrópicos intermitentes además del manejo convencional y permanecen en lista para cirugía de falla cardíaca o trasplante.
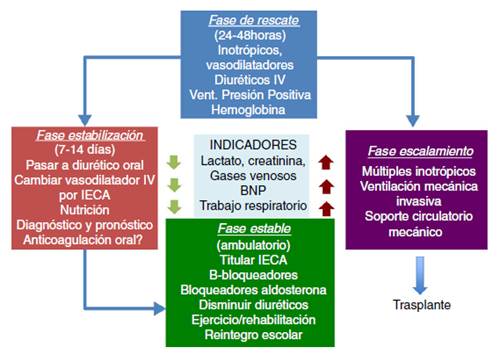
Emplear la estratificación de riesgo por etapas de desarrollo de la falla cardíaca sirve para hacer el enfoque inicial del paciente en falla (figs. 5 y 6)48.
El enfoque del niño con falla cardíaca dependerá de la causa original. El primer paso es el manejo médico de la falla aguda, en algunos pacientes la corrección de la cardiopatía, el control de la arritmia, la corrección de la anemia o del defecto metabólico o el manejo de la miocarditis.
El manejo médico tiene algunas limitaciones en pacientes pediátricos con defectos cardíacos estructurales, porque para la mayoría de ellos existe algún tipo de corrección quirúrgica como tratamiento.