Introducción
La falla cardiaca es el estadio final de la mayoría de formas de enfermedad cardiovascular. Pese a avances en el manejo farmacológico o quirúrgico los resultados en el paciente son pobres y las tasas de reingreso hospitalario son altas1,2. Es una patología común, que va en aumento en casi todas las regiones del mundo y afecta aproximadamente a 26 millones de personas a un costo estimado de US$108 billones al año2, cifras que crecerán en un tiempo cercano debido a la expansión de la industrialización y el aumento de la esperanza de vida. El diagnóstico de falla cardiaca indica un incremento importante en la morbimortalidad del paciente, combinado con disminución marcada de su calidad de vida. La evolución de la enfermedad es variable dada la interacción de factores clínicos y demográficos que afectan el pronóstico, entre ellos la deficiencia de hierro y la anemia, o ambos3,4.
La deficiencia de hierro está ampliamente ligada a la insuficiencia cardíaca. Los mecanismos implicados pueden variar desde depleción en las reservas de hierro, insuficiencia dietaria y malabsorción intestinal, hasta interacciones farmacológicas o alteraciones en los niveles de hepcidina, los cuales disminuyen con la progresión de la falla cardiaca5,6. Esta deficiencia puede tener consecuencias clínicas con o sin la presencia de anemia7. La anemia es una comorbilidad frecuente en la falla cardiaca que reduce considerablemente la capacidad funcional y la calidad de vida ya afectadas por la enfermedad de base. Su prevalencia es de 4% a 55% y varía ampliamente por los puntos de corte de hemoglobina usados en la población de estudio. Si bien la anemia es una entidad multifactorial, la causa más común es la deficiencia de hierro5,8.
Los avances actuales en los tratamientos farmacológico y quirúrgico de la falla cardiaca han permitido ralentizar la evolución de la enfermedad y controlar la sintomatología; sin embargo, la calidad de vida de los pacientes, la tolerancia al ejercicio, su propia percepción de bienestar y su capacidad funcional cuantificada con la escala de la New York Heart Association (NYHA), se ven ampliamente afectadas, y a pesar del manejo farmacológico tradicional tienden a empeorar9.
Evidencia reciente sugiere que la deficiencia de hierro en pacientes con falla cardiaca se asocia con disminución de la capacidad de ejercicio, aumento en la severidad de la enfermedad y pobre pronóstico. De la misma manera, se ha encontrado que la corrección de la deficiencia de hierro mejora a corto plazo la calidad de vida, la clase funcional y otros parámetros de la enfermedad como la fracción de eyección del ventrículo izquierdo, posicionándose como una opción terapéutica esperanzadora5,9. Por lo anterior, la presente investigación tuvo como objetivo efectuar una revisión sistemática de la literatura que evaluara la eficacia y la seguridad del uso de hierro en el tratamiento de la falla cardiaca.
Metodología
Registro
Se siguieron los lineamientos de la guía Prefered Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) para el desarrollo de revisiones sistemáticas y metaanálisis10.
Criterios de elegibilidad
Se seleccionaron ensayos clínicos que evaluaran el uso de hierro en administración intravenosa u oral vs. placebo en el contexto de pacientes con falla cardiaca, definida por una clase funcional New York Heart Association (NYHA) > II, y fracción de eyección (FE) o fracción de eyección del ventrículo izquierdo (FEVI) menor o igual al 45%. A su vez, se seleccionaron pacientes que concomitantemente sufrieran anemia ferropénica, definida por al menos uno de los siguientes criterios: Ferritina <100 mg/ml y/o porcentaje de saturación de transferrina (TSAT) <20%. Además, se tuvo en cuenta el reporte de alguno de los siguientes resultados: cambio en la clase funcional, algún tipo de valoración global, resultados en pruebas de esfuerzo, cambios en los patrones paraclínicos de base, hospitalizaciones o muertes asociadas y efectos adversos con la prescripción de hierro. Se excluyeron estudios que evaluaran el uso de estimulantes de la eritropoyetina o uso simultáneo con terapia férrica. Se descartaron estudios de cohorte, casos y controles, reportes de casos y resúmenes de congresos.
Fuente de información
Para la búsqueda se incluyeron las bases de datos de MEDLINE (PubMed), Embase, Cochrane Central Register of Clinical trials (CENTRAL), Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS) y Western Pacific Region Index Medicus (WPRIM). La búsqueda se hizo entre el 10 de julio de 2016 hasta el 27 de julio de 2016. En caso de ampliar alguna información se intentó contactar a los autores.
Búsqueda
Se usaron como criterios de búsqueda: (Cardiac failure OR heart decompensation OR heart failure OR myocardial failure OR congestive heart failure) AND (iron OR ferrous fumarate OR ferrous sulfate OR ferrous gluconate OR iron dextran OR ferric gluconate OR iron sucrose OR carboxymaltose ferric). No hubo restricción de tiempo ni de idioma.
Selección de estudios
Los registros arrojados por cada base de datos fueron revisados por dos autores de manera independiente, y en caso de haber alguna discrepancia se consultó a un tercer revisor. Se obtuvo en primera medida el título y el resumen de los manuscritos de pacientes con falla cardiaca y terapia férrica. Los resultados obtenidos fueron consignados en una base de datos. Posteriormente, se realizó la búsqueda de los artículos in extenso para verificar los criterios de inclusión y exclusión de la revisión sistemática.
Proceso de extracción de datos
De los estudios escogidos se evaluaron las siguientes variables: método diagnóstico de falla cardiaca y de anemia, tipo de estudio, medida de aplicación del hierro y su comparación, y resultados primarios y secundarios. La evaluación de sesgos se realizó según los lineamientos presentados por Higgins en el manual de desarrollo de revisiones sistemáticas y meta-análisis de la colaboración Cochrane11.
Análisis
Después de evaluar los estudios encontrados, se observó gran discrepancia en aspectos como el tipo de tratamiento con hierro, su manera de administración y parámetros a tener en cuenta como resultados primarios o secundarios, por lo cual, no se contó con la validez para hacer un análisis de tipo estadístico o metaanálisis. Por consiguiente, la información fue analizada de manera cualitativa, teniendo en cuenta las características metodológicas de los estudios y los resultados reportados por cada uno de ellos. Los estudios se agruparon según el tipo de hierro administrado: sacarosa de hierro, carboximaltosa férrica y hierro oral.
Resultados
Selección de estudios
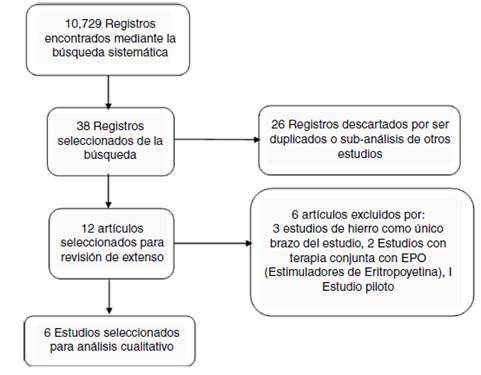
Se obtuvieron 10.729 registros provenientes de la búsqueda en las bases de datos. Varios de estos se descartaron en la primera selección y tan solo 38 estudios se extrajeron de la búsqueda. Se descartaron 26 manuscritos por tratarse duplicados o por ser subanálisis de estudios previos como el Iron Deficiency and Chronic Heart Failure (FAIR-HF), Ferric Carboxymaltose evaluation on performance in patients with Iron deficiency in combination with chronic Heart Faliure (CONFIRM-HF), Ferri-HF y el Iron-HF12-15. Se analizaron 12 estudios en extenso; sin embargo, al revisar su texto se descartaron 6 de estos por las siguientes causas: Reed et al., Bolger et al. y Gaber et al., realizaron investigaciones en las que evaluaron el uso de hierro en un único brazo de estudio, sin tener algún grupo de comparación, tan solo un antes y después de la terapia16-18. Toblli et al., en 2007 publicaron resultados preliminares de un estudio piloto realizado; sin embargo, el estudio completo fue publicado posteriormente19. Silverber et al. y Freire et al., emplearon análogos de la eritropoyetina20,21. Finalmente, se analizaron 6 estudios en esta revisión (fig. 1).
Características de los estudios
De los 6 estudios seleccionados12-15,22,23, las investigaciones de Okonko et al. fueron simple ciego y Manjunath et al. fue un estudio abierto, las demás investigaciones fueron ensayos clínicos aleatorizados, doble ciego15,23. El estudio de Toblli et al. incluyó dentro de su población a pacientes con falla cardiaca, con o sin anemia y enfermedad renal crónica, los demás estudios sólo incluyeron pacientes con falla cardiaca y con o sin anemia22. Toblli et al., Okonko et al. y Beck da Silva et al., realizaron sus estudios con sacarosa de hierro intravenoso13,15,22. Ponikowski et al. y Anker et al. emplearon carboximaltosa férrica intravenosa12,14. Manjunath y Beck da Silva, emplearon hierro oral mediante sulfato ferroso13,23. Por otro lado, como placebo se usó solución salina en los estudios de Toblli et al., Ponikowski et al. y Anker et al. (12,14,22 mientras Okonko et al. y Manjunath et al. solo compararon a los pacientes con terapia convencional de falla cardiaca15,23. En total los 6 estudios incluyen 835 pacientes, de los cuales 520 fueron tratados con alguna terapia férrica y 315 con placebo o terapia convencional de falla cardiaca. Los demás aspectos metodológicos de los estudios se pueden consultar en la tabla 1.
Tabla 1 Resumen de las características de los estudios seleccionados
| Autor / año / lugar | Tipo de estudio | Criterios de inclusión | Criterios de exclusión | Intervención (presentación y dosis hierro) | Comparación | Seguimiento | Grupo de hierro | Grupo placebo | ||||||
| Diagnóstico de falla cardiaca | Diagnóstico de anemia | TOTAL / MASCULINO (%) | Edad | TOTAL / MASCULINO (%) | Edad | |||||||||
| Tobilli (2015) Buenos Aires, Argentina | Ensayo clínico doble ciego, controlado, aleatorizado | FEVI <35%, NYHA II a IV. Enfermedad renal crónica (CrCl< 90 ml/min) | Hb <12.5 g/dl (hombres) o <11.5 (mujeres), Ferritina <100 ng/ml y/o TSAT <20% | Pacientes en hemodiálisis, Anemia no relacionada con deficiencia de hierro, historia médica de alergia a suplementos de hierro, infecciones bacterianas agudas, parasitosis o neoplasias en las últimas 4 semanas, enfermedades digestivas crónicas, hipotiroidismo, cardiopatías congénitas, terapia previa con hierro o eritropoyetina en las últimas 4 semanas, historia de hospitalización en las últimas 4 semanas | 200 mg / 200 ml Hierro Sacarosa IV cada semana por 5 semanas | 200 ml de SSN | Desde la 5( semana al 6(mes, se hizo mensual seguimiento con examen físico, evaluación de síntomas (NYHA) y paraclínicos (Hb, Ferritina, TSAT, Cuadro hemático, Creatinina sérica y NT-pro-BNP), y PCR cada 3 meses | 30 / 14 (46%) | 75.4 ± 6 | 30 / 13 (43%) | 74.7 ± 7 | |||
| Ponikowski (2015) 41 centros en 9 países europeos | Ensayo multicéntrico, doble ciego, controlado | FEVI <45%, NYHA II o III, BNP >100 pg/mL y/o (NT-proBNP) >400 pg/mL | Ferritina <100 ng/ml o entre 100 y 300 si la TSAT <20% y Hb <15 g/dl | Hipertensión no controlada, infección, evidencia clínica de malignidad o función renal o hepática significativamente comprometida | Carboximaltosa férrica como bolo IV (10-20 ml, equivalentes a 500 o 1000 mg de hierro) en menos de 1 minuto en las semanas 1, 6, 12,24, 36 | 10-20 ml de SSN | Medición de 6 MWT, Escala de fatiga (1 a 10), NYHA, Evaluación global y el cuestionario de cardiomiopatía de Kansas (KCCQ), Y cuestionario europeo sobre calidad de vida 5 dimensiones (EQ-5D) en las semanas 6, 12, 24, 36 y 52 | 150 / 83 (55%) | 68.8 ± 9.5 | 151 / 77 (51%) | 69.5 ± 9.3 | |||
| Beck-da-Silva (2013) Brasil | Ensayo clínico aleatorizado, controlado Multicéntrico, prospectivo, doble ciego | Por historia clínica de al menos 3 meses antes en seguimientos por clínicas de 3 er nivel, NYHA II-IV, FEVI <40% en los últimos 6 meses, Terapia para FC adecuada sin cambiar dosis por 3 meses | Hb <12 y >9 mg/dl, (TSAT) <20% y transferrina <500 mcg/L | <18 años, Cualquier sangrado clínico activo (gastrointestinal, hipermenorrea, historia de úlcera péptica o enfermedad inflamatoria intestinal en curación), Hipotiroidismo no corregido, otra enfermedad neoplásica, inflamatoria o infecciosa, CrS >1.5mg/dl, Intolerancia a hierro elemental oral, FC debida a cardiomiopatía alcohólica, actual bebedor de bebidas alcohólicas, historia de FC periparto. Reciente hospitalización por FC descompensada, Revascularización cardiaca en los últimos 3 meses, IAM-ATI-ACV en los 3 meses previos, paciente en lista de trasplante, embarazo o lactante, premenopáusicas que no usan métodos anticonceptivos, pacientes en rehabilitación cardiovascular, pacientes con marcapasos o desfibrilador implantado | Grupo 1: Hierro Sacarosa 200 mg IV, una vez por semana infusión de 30 minutos por 5 semanas y placebo 3 veces al día por 8 semanas | Placebo VO, 3 veces al día por 8 semanas y placebo IV semanal por 5 semanas | Espirometría, Hb, (TSAT) y ferritina a los 90 días de terminar terapia | Hierro IV: 10 / 7 (70%) | 66.9 ± 8.3 | 6 / 4 (66%) | 68.9 ± 10.1 | |||
| GRUPO 2: Sulfato ferroso 200 mg VO, 3 veces al día por 8 semanas y placebo IV cada semana por 5 semanas | Hierro VO: 7 / 5 (71%) | 63.5 ± 16.2 | ||||||||||||
| Anker (2009) 75 centros en 11 países europeos | Estudio Multicéntrico, aleatorizado, doble ciego | FEVI <40%, NYHA II-III | Hb 95-135 g/l, Ferritina <100 mcg/l o 100-299 si la TSAT es <20% | Hipertensión no controlada, otras enfermedades cardiacas significativas, inflamación o compromiso renal o hepático significativo | Carboximaltosa férrica 4 ml bolo (200 mg de hierro) IV semanalmente hasta la repleción de hierro, luego mensualmente hasta las 24 semanas | SSN | Se midió la valoración global del paciente (PGA), NYHA, 6 MWT, KCCQ, EQ-5D y escala análoga de fatiga en semanas 4, 12 y 24 | 304 / 145 (48%) | 67.8 ± 10.3 | 155 / 70 (45%) | 67.4 ± 11.1 | |||
| Okonko (2007) Reino Unido y Polonia | Ensayo multicéntrico aleatorizado, controlado y observador-ciego, | NYHA II o III, VO2 máx /kg 18 ml/kg/min, FEVI <20% | Hb <12.5 g/dl. Ferritina <100 mcg/l o entre 100 y 300 con TSAT <20% | Hipertensos no controlados, Causas de anemia no relacionadas con deficiencia de hierro, uso de EPO, Transfusión en los últimos 30 días, historia de sobrecarga de hierro adquirida o hemocromatosis, hipersensibilidad a hierro parenteral o historia de alergias, infección activa, sangrado, malignidad o anemia hemolítica, presencia de cualquier condición que no permita la prueba de ejercicio como falla cardiaca descompensada, enfermedad músculo esquelética significante, angina inestable, cardiomiopatía obstructiva, enfermedad valvular severa no corregida o bradi-taquiarritmias no controladas, terapia inmunosupresora o de reemplazo renal, y enfermedad hepática crónica | Hierro Sacarosa IV ampollas de 5 ml (20 mg hierro/ml) semanal hasta alcanzar ferritina >500 ng/ml, luego a las 4, 8, 12 y 16 semanas, dosis calculada según peso y nivel de Hb + Tratamiento de base de FC | Tratamiento de base de FC | Examen clínico (NYHA) en prueba de ejercicio, Cuestionario de calidad de vida con falla cardiaca de Minnesota (MLHFQ), Escala de fatiga, espirometría, paraclínicos (Hb, Urea, CrS, ALT, PRC, Fe sérico, Ferritina, Transferrina cálculo TSAT). En las semanas 1, 4, 8, 12, 16, y 18 | 24 / 17 (71%) | 64 ± 14 | 11 / 8 (73%) | 62 ± 11 | |||
| Manjunath (2013) Haryana, India | Estudio prospectivo controlado, abierto y comparativo | NYHA II y III, 6 MWT <375 metros, FEVI <40% | Hb 8-11g/dl | <18 años, Infección severa en el mes previo, enfermedad valvular no corregida, miocarditis activa o pericarditis constrictiva, historia de IAM o taquicardia o fibrilación en el último año, angina inestable, revascularización cardiaca, historia de ACV, historia de alergia al hierro y PAS <85 o >160 mm Hg, PAD >89 mm Hg | Sulfato ferroso VO 100 mg 2 veces al día por 3 meses + tratamiento estándar para FV | Tratamiento estándar para FC | Cuestionario de calidad de vida con FC de Minnesota (MLHFQ), Escala de Borge para disnea y fatiga, clínica de anemia, cuadro hemático antes del tratamiento y en los días 15, 45 y 90 | 30 / 23 (76%) | 55.63 ± 1.73 | 30 / 22 (73%) | 57.73 ± 2.38 | |||
Calidad de los estudios
Los sesgos de los estudios se evaluaron siguiendo los lineamientos de la colaboración Cochrane; el estudio de Manjunath et al., presenta varios elementos de posibles sesgos en su metodología, debido a la omisión de mención de secuencias de aleatorización23. Los estudios de Anker et al. y Ponikowski et al. presentan sus resultados con métodos estadísticos que no facilitan la comparación temporal de la intervención, pues tan solo muestran los promedios de cambio entre los puntos de cohorte inicial y final12,14. Los demás posibles sesgos están representados en la figura 2.
Resultados
La información concluida por los diferentes estudios fue agrupada por principio activo de la siguiente manera:
Sacarosa de hierro
El estudio Okonko et al. (15 no presenta diferencias importantes en las características demográficas de su población de estudio. La dosis administrada en promedio fue de 1433±365 mg. Su resultado principal fue el cambio de consumo máximo de oxígeno VO2 máx. (ml/min) a las 18 semanas, al cabo de lo cual se observó una mejoría importante en los puntos de corte al periodo de seguimiento (p 0,08), al igual que en la escala de valoración funcional de la NYHA (p 0,007); sin embargo, las valoraciones de fatiga y la puntuación en escalas de calidad de vida en el periodo de seguimiento no presentaron cambios significativos. Dentro de los parámetros paraclínicos, la transferrina y el porcentaje de saturación de transferrina (TSAT) tuvieron elevaciones importantes en el grupo al que le fue administrado hierro (p<0,001 y p 0,001 respectivamente); pese a haber ascendido en el grupo de hierro, la hemoglobina no presentó diferencia relevante con el grupo placebo (p 0,87); la fracción de eyección del ventrículo izquierdo (FEVI) no mostró una diferencia significativa (p 0,66). Los efectos adversos reportados más comunes con la terapia fueron el dolor abdominal y síntomas de rinitis en 2 pacientes.
Por otra parte, Beck da Silva et al.13, realizaron su estudio con tres grupos de pacientes, a los que les administraron sacarosa de hierro intravenoso, hierro oral (descrito más adelante) y placebo respectivamente. No hubo diferencias significativas en las características de los pacientes. La dosis total fue de 1.000 mg de hierro en 5 semanas para el grupo de sacarosa de hierro. Su resultado principal fue el consumo máximo de oxígeno (VO2 máx.), el cual tuvo mejores resultados en el grupo de hierro intravenoso (p 0,339). La escala de la NYHA no presentó cambios significativos y los parámetros bioquímicos tuvieron variaciones hacia la mejoría con el uso de hierro, representado en los resultados de ferritina y el porcentaje de saturación de transferrina (TSAT) (p 0,005 y p 0,018, respectivamente). En este estudio no hubo reporte de efectos adversos.
Toblli et al.22, por su parte, realizaron un estudio que incluyó a pacientes con enfermedad renal crónica sin terapia dialítica, a quienes se les administró una dosis promedio de 1.000 mg de hierro en 5 semanas. Su resultado principal fue el cambio en la FEVI, la cual mostró mejoría significativa (p 0,001), similar al diámetro de ventrículo izquierdo durante la sístole y la diástole, siendo igualmente estadísticamente significativos. La escala de la NYHA también presentó una reducción significativa (p 0,001). La hemoglobina, la ferritina y el porcentaje de saturación de transferrina (TSAT) aumentaron de manera considerable; los pacientes no tuvieron hospitalizaciones asociadas a la falla cardiaca comparados con el placebo. Los efectos adversos fueron mínimos; tan solo un paciente refirió cefalea, rash y náuseas.
Carboximaltosa férrica
El ensayo de Ponikowski et al.12, fue uno de los estudios con mayor cantidad de pacientes, pues incluyó 150 en el grupo de hierro. Emplearon inyecciones de 10-20 ml de carboximaltosa férrica equivalentes a 500 a 1.000 mg de hierro, siguiendo protocolos hasta corregir valores de hemoglobina y continuando con dosis de mantenimiento. Su resultado principal fue el aumento significativo de la distancia en la prueba de caminata de 6 minutos (p 0,002) en el grupo que utilizó hierro; la valoración global subjetiva mejoró, igual que la escala funcional de la NYHA, y la percepción de fatiga y de calidad de vida. Dentro de los parámetros paraclínicos, la hemoglobina, la ferritina y el porcentaje de saturación de transferrina (TSAT) aumentaron en la terapia de corrección. Por otra parte, hubo una reducción en el riesgo de hospitalización [HR 0,53 IC 95% (0,30-0,95) p 0,03)]. La mortalidad de los pacientes con la terapia de hierro fue del 8,9% comparado con un 9,9% de pacientes con placebo. Varios pacientes desarrollaron efectos adversos con la terapia, sin embargo, el más común se asocia con problemas en el sitio de administración.
Anker et al.14, llevaron a cabo el estudio con mayor cantidad de pacientes que se encontró en la revisión, con 304 para el grupo de pacientes tratados con hierro y 155 con placebo. Se administraron 4 ml de carboximaltosa férrica, es decir 200 mg de hierro, siguiendo protocolos de dosis inicial de corrección de hemoglobina con posterior mantenimiento. El resultado principal fue la evaluación global subjetiva, la cual presentó una mejoría significativa en los pacientes tratados con hierro, resultado similar al hallado en la escala funcional de la NYHA. Otros parámetros, como la distancia media de caminata a los 6 minutos y la calidad de vida, también tuvieron mejoría. Los parámetros de ferritina, el porcentaje de saturación de transferrina (TSAT) y la hemoglobina aumentaron en pacientes con suplemento férrico. En cuanto a hospitalizaciones y mortalidad no hubo diferencias importantes entre los grupos. El efecto adverso más reportado en el grupo de hierro fue la agudización de trastornos cardíacos, seguido de problemas en el sitio de administración.
Hierro oral
Manjunath et al.23 evaluaron el uso de sulfato ferroso en dosis de 200 mg día durante tres meses. Su resultado principal fue el cambio en la puntuación de calidad de vida mediante el cuestionario de Minnesota, el cual mejoró a los 90 días del tratamiento de manera estadísticamente significativa (p<0,01) en el grupo intervenido. Por otro lado, valoró el grado de disnea con la escala de Borg presentando igualmente una mejoría importante (p<0,01). Pese a ello, no se observaron cambios en la hemoglobina o el volumen corpuscular. Los efectos adversos reportados no son exactos y tan solo mencionan náuseas y diarrea.
Beck da Silva et al.13, en uno de sus grupos de estudio, evaluaron la administración de hierro oral con sulfato ferroso 600 mg al día por 8 semanas. Contrario a los demás hallazgos, el consumo máximo de oxígeno VO2máx. reportado como el resultado principal, presentó reducción en este grupo. Dentro de las variables de laboratorio, la hemoglobina, la ferritina y el porcentaje de saturación de transferrina reportaron mejoría; similar a esto, se encontraron más pacientes con evolución favorable en la escala funcional de la NYHA. No se reportaron efectos adversos relacionados con el uso de hierro oral.
Discusión
Este estudio recopiló todos los ensayos clínicos que evaluaran el uso de hierro en administración intravenosa u oral vs. placebo en el contexto de pacientes con insuficiencia cardiaca y deficiencia de hierro, comprobando que la implementación de la terapia férrica como parte del tratamiento de esta enfermedad tiende a mejorar la capacidad funcional, reduce síntomas que expresan deterioro de la capacidad de tolerancia al ejercicio y mejora parámetros paraclínicos. No fue posible hacer un metaanálisis, dada la heterogeneidad significativa entre cada uno de los ensayos clínicos analizados.
Esta revisión sistemática muestra que la terapia farmacológica con hierro se asocia con una mejoría de parámetros como: valoración global o calidad de vida; clase funcional, medida a través de la escala de la NYHA, consumo máximo de oxígeno VO2máx. (ml/min) y pruebas de caminata de 6 minutos; cambios en las reservas de hierro, evidenciadas por los niveles de ferritina y porcentaje de saturación de transferrina (TSAT) para todos los pacientes, independientemente de un cambio o no en los niveles de hemoglobina en la mayoría de ellos. Sin embargo, aunque se han observado cambios positivos en todos los parámetros evaluados en los ensayos clínicos recopilados, no todos ellos alcanzaron una significancia estadística.
La administración de sacarosa de hierro intravenosa, evidenció como resultado principal el cambio del consumo máximo de oxígeno VO2 máx. (ml/min) a las 18 semanas, seguido del aumento de parámetros paraclínicos como transferrina, porcentaje de saturación de transferrina (TSAT) y en último lugar, hemoglobina. Por otro lado, la escala de valoración funcional de la NYHA tuvo mejoría significativa (p 0,007) en los estudios de Okonko et al. y Toblii et al. (p 0,001).
El uso de carboximaltosa férrica se aplicó a estudios con mayor número de pacientes como el de Ponikowski et al. y Anker et al.12. Los resultados principales fueron la mejoría significativa de la distancia en la prueba de caminata de 6 minutos (p 0,002) en el grupo que utilizó hierro; la autoevaluación global subjetiva, igual que la escala funcional de la NYHA, y la percepción de fatiga y calidad de vida. Dentro de los parámetros paraclínicos, la hemoglobina, la ferritina y el porcentaje de saturación de transferrina (TSAT) aumentaron en la terapia de corrección, dado que en los pacientes hospitalizados con o sin anemia, la deficiencia de hierro atenúa el desempeño aeróbico y se acompaña de estados de fatiga e intolerancia al ejercicio24, e igualmente deteriora la capacidad oxidante y oxidativa del oxígeno, traduciéndose en disminución del consumo máximo de oxígeno y capacidad para soportar el esfuerzo submáximo25. Estudios como el Iron Deficiency and Chronic Heart Failure FAIR-HF demostraron que en pacientes ambulatorios estables, sintomáticos, con insuficiencia cardiaca crónica, fracción de eyección ventricular izquierda debilitada y deficiencia de hierro, el tratamiento con carboximaltosa férrica durante 24 semanas mejora los síntomas, el rendimiento físico y la calidad de vida14.
El hierro oral es más económico, más fácil de administrar y puede ser más seguro. Sin embargo, la absorción de hierro puede verse afectada debido a una posible enfermedad en el tracto gastrointestinal y la fisiopatología de la anemia en falla cardiaca congestiva es en parte similar a una condición inflamatoria crónica, lo cual resulta en la expresión de un péptido regulador, la hepcidina, que puede bloquear la absorción de hierro y el plomo a un estado de eritropoyesis restringida por hierro26. Acerca del tipo de preparación de hierro, de los 6 ensayos incluidos, se administraron 2 con sacarosa de hierro, 2 con carboximaltosa férrica administrada, 1 con hierro oral y 1 que fue conjunto entre hierro oral y sacarosa de hierro.
Al comparar los parámetros evaluados en los estudios con uso de terapia férrica, vale la pena resaltar que los resultados de las pruebas de caminata demostraron evolución favorable a través de la medición de ítems como el aumento del tiempo en segundos de duración del ejercicio por 18 semanas (Okonko: 45 ± 84 vs. -15 ± 109 placebo), con administración de sacarosa férrica, y duración del recorrido en metros durante 24 semanas (Ponikowski: (19 vs. -14) p 0,001)) y (Anker (313±7 vs. 277±10) p<0,001) con administración de carboximaltosa férrica. Aunque los tres estudios son concluyentes, debe tenerse en cuenta que aquellos que administraron carboximaltosa férrica tienen mayor significancia frente al uso de sacarosa o de hierro oral, además tuvieron mayor duración de semanas de estudio.
En cuanto a los eventos adversos, aquellos evidenciados en los pacientes con terapia de hierro oral estuvieron asociados con alteraciones gastrointestinales y cefalea, mientras que los ensayos con terapia de hierro intravenoso, específicamente la carboximaltosa férrica, tuvieron efectos asociados a reacciones cutáneas en el sitio de administración del medicamento, rash, cefalea, eventos neurológicos, cardíacos y vasculares por cuanto debe aclararse que no es muy clara la comparación de efectos adversos entre la carboximaltosa y la sacarosa de hierro debido a que los tamaños de las muestras de población intervenidos en cada estudio no son los mismos. En general, el uso de hierro influye sobre la sensación de fatiga de los pacientes; no obstante, existe mejoría en la calidad de vida, a un plazo de 6 meses con terapias intravenosas y una reducción de la clase funcional de la NYHA con cualesquiera de las terapias.
Una vez planteados los beneficios de la terapia férrica en el manejo de la falla cardiaca, se hará énfasis principalmente en el tratamiento con carboximaltosa férrica, ya que mejora los síntomas, el rendimiento físico y la calidad de vida, y aunque tiene efectos secundarios como alteraciones neurológicas, cardíacas y vasculares y efectos adversos tales como descompensación de la falla cardiaca, tiene mejores tasas de efectividad comparadas con el uso de placebo u otras terapias férricas, además de beneficios tanto en pacientes con anemia como en aquellos sin ésta14,27, y adicionalmente es útil para una rápida reposición de las reservas de hierro agotadas en tiempos relativamente cortos (6, 12, 24 semanas)28 y reduce las consultas de emergencia, así como las admisiones hospitalarias por descompensación aguda de la falla cardíaca en el seguimiento a mediano plazo29.
La guía de la Sociedad Europea de Cardiología considera la administración intravenosa de carboximaltosa férrica a los pacientes sintomáticos con insuficiencia cardiaca con fracción de eyección reducida y déficit de hierro (ferritina sérica < 100 (g/l o de 100-299 (g/l con saturación de transferrina <20%) para aliviar los síntomas de IC y mejorar la capacidad de ejercicio y la calidad de vida, como una recomendación con nivel de evidencia30; por el momento se deja a deliberación de los clínicos el uso o no de la terapia férrica.
Esta revisión sistemática proporciona una base sólida para el uso de hierro en sus diferentes presentaciones en pacientes con falla cardiaca y anemia, tiene en cuenta las comorbilidades presentadas por los pacientes, parámetros de importancia como calidad de vida, aumento de función cardiaca (disnea, fatiga) y de igual forma mejoría en paraclínicos como hemoglobina, transferrina y FEVI. Sin embargo, las limitaciones del estudio se relacionan principalmente con la falta de claridad metodológica y la heterogeneidad de los estudios seleccionados en cuanto a la posología, efectos secundarios, reacciones adversas y tiempo se seguimiento en la administración de hierro ya sea oral o intravenoso.
Se sugiere llevar a cabo investigaciones con ensayos clínicos controlados aleatorizados, que evalúen gran cantidad de pacientes con falla cardiaca y anemia, y comparen la administración de hierro intravenoso vs. oral, teniendo en cuenta una mayor rigurosidad en la posología de administración del hierro, mayor vigilancia de los efectos adversos presentes y mayor seguimiento a corto, mediano y largo plazo de los parámetros clínicos tanto de falla cardiaca como de anemia, de tal manera que se pueda evaluar a largo plazo el impacto del manejo de la falla cardiaca con la terapia férrica.
Conclusión
Con base en los estudios revisados y los resultados anteriores, la terapia férrica en el manejo de la falla cardiaca tiene alta eficacia y seguridad en el paciente anémico o no; tiende a mejorar la calidad de vida y la funcionalidad y mejora parámetros paraclínicos. Por consiguiente, el tratamiento de los pacientes con falla cardiaca que tengan anemia por deficiencia de hierro, debe ser considerado dentro del manejo estándar el uso de hierro intravenoso.