Introducción
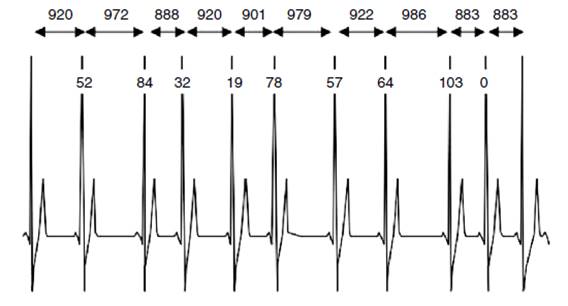
La variabilidad de la frecuencia cardiaca es la variación en el tiempo que transcurre en milésimas de segundos entre los intervalos R y R medidos en un electrocardiograma, y demuestra la interacción entre el sistema nervioso autónomo y la frecuencia cardiaca (fig. 1)1,2. El aumento o la disminución de la variabilidad de la frecuencia cardiaca están relacionados con la respuesta del sistema simpático y parasimpático; en otras palabras, la variación de tiempo en milisegundos que se da entre latido y latido está producida por la interacción del sistema nervioso autónomo con el sistema cardiovascular2,3. Como está bien documentado, en estado de reposo hay un predominio parasimpático importante que mantiene una perfusión ventricular izquierda adecuada y favorece la ausencia de microisquemias, hecho que también se asocia con distensibilidad aórtica apropiada y baja resistencia vascular sistémica4,5.
Relación de la variabilidad de la frecuencia cardiaca y las enfermedades cardiovasculares
Las enfermedades cardiovasculares son un conjunto de afecciones que involucran el corazón y los vasos sanguíneos y existen diferentes factores de riesgo que determinan la predisposición a padecerlas6. Las más prevalentes son la cardiopatía coronaria, asociada a aterosclerosis7 y la enfermedad cerebrovascular. Estas han incrementado en un 41% en las últimas dos décadas, dando así lugar a 17.3 millones de muertes al año8. Adicionalmente, sobresalen las cardiopatías congénitas, que tienen una incidencia de 8/1.000 nacidos vivos por año9 y la trombosis venosa profunda en miembros inferiores con una incidencia de 1 a 2 por 1.000 personas10.
La Organización Panamericana de Salud (OPS) junto con la Organización Mundial de la Salud (OMS), realizaron un estudio en 2013 sobre la morbilidad y mortalidad presentes en el continente americano, en el que se concluyó que las enfermedades cardiovasculares fueron las de mayor prevalencia, con un 37,6% y dentro de estas las miocardiopatías y las enfermedades cerebrovasculares fueron las más frecuentes. En Colombia y la región Surcolombiana el comportamiento es similar según los informes periódicos del Departamento Administrativo Nacional de Estadística (DANE) y el boletín epidemiológico de la Secretaría de salud departamental del Huila11,12.
De otra parte, los factores de riesgo para enfermedades cardiovasculares se dividen en modificables y no modificables. En los primeros se incluyen: hipertensión arterial, obesidad, sedentarismo, dislipidemia, entre otros12-15. En tal sentido, la hipertensión arterial (HTA) se mantiene como uno de los principales factores de riesgo modificables para desarrollar enfermedad cerebrovascular16,17 según la Guía de Hipertensión de la Asociación americana del corazón 201718,19. Esta se encuentra en un 49% de los casos de falla cardiaca y en un 35% del total de eventos cardiovasculares ateroscleróticos20,21. Por otro lado, el sedentarismo es responsable del aumento de enfermedades metabólicas, cardiovasculares y degenerativas. La actividad física es una de las principales recomendaciones para la prevención de enfermedades como la hipertensión, ya que un ejercicio físico de intensidad moderada contribuye a su disminución y aumenta los parámetros de variabilidad de la frecuencia cardiaca22.
Entre los factores de riesgo no modificables, figuran edad, sexo, lipoproteína -A y factores genéticos23. A medida que pasa el tiempo el sistema parasimpático pierde dominio sobre el sistema cardiovascular, lo cual se asocia con mayores frecuencias cardiacas y disminución de la variabilidad de la frecuencia cardiaca, acompañada de menor distensibilidad aórtica y perfusión coronaria disminuida13. En las mujeres premenopáusicas la producción de estrógenos como el estradiol tiene un papel cardioprotector al inhibir las catecolaminas, fenómeno que disminuye la frecuencia cardiaca y la presión arterial; por consiguiente, tienen menor probabilidad de desarrollar enfermedades cardiovasculares respecto a las mujeres postmenopáusicas y a los hombres, quienes se relacionan con bajas cantidades de estrógenos y generalmente una variabilidad de la frecuencia cardiaca más baja y frecuencias cardiacas más altas24. Adicionalmente, mayores descargas de adrenalina y noradrenalina relacionada con la testosterona se asocian con variabilidad de la frecuencia cardiaca más baja13. Finalmente, entre los factores genéticos se halla la diabetes mellitus tipo I por neuropatías diabéticas que generan un aumento del tono simpático de un 20 a un 40%, y dan origen a hipertensión y variabilidad de la frecuencia cardiaca disminuida25,26.
El diagnóstico temprano de las enfermedades cardiovasculares es decisivo para disminuir la mortalidad y la morbilidad, así como la identificación de factores de riesgo que pueden alertar de manera más oportuna. Se han utilizado algunos biomarcadores para determinar la correlación de la insuficiencia cardíaca con la fracción de eyección preservada o reducida; los más relevantes son el péptido natriurético tipo B pro N-terminal o péptido natriurético cerebral, la troponina T o I de alta sensibilidad, la proteína C-reactiva, el índice de albúmina urinaria-creatinina, la relación entre renina y aldosterona, el dímero D, el fibrinógeno, el supresor soluble de tumorigenicidad, la galectina-3, la cistatina C, el inhibidor del activador del plasminógeno y la interleucina 6; sin embargo, la variabilidad de la frecuencia cardiaca se ha utilizado solo como parámetro investigativo y podría también emplearse como parámetro de diagnóstico temprano, si se desarrollan estudios poblacionales que apoyen su uso clínico27-29.
Efecto del sistema nervioso autónomo en el sistema cardiovascular que impacta en la variabilidad de la frecuencia cardiaca
Existen varios factores que inciden sobre la variabilidad de la frecuencia cardiaca y en general sobre el inotropismo y el cronotropismo cardiaco; tal es el caso del sistema nervioso autónomo (SNA), que modifica factores cardiovasculares como la frecuencia cardiaca, la fuerza contráctil, el redireccionamiento del flujo sanguíneo a zonas de mayor demanda vascular y el control de la presión arterial a corto plazo a través de diferentes receptores tanto simpáticos como parasimpáticos30. La estimulación simpática en general debería aumentar la frecuencia cardiaca y disminuir la variabilidad de la misma; no obstante, esta modulación no es lineal, ya que se ha visto que la frecuencia cardiaca tiene influencia poderosa en el valor clínico de la variabilidad de la misma. Pese a ello, esta influencia puede ser modificada efectivamente por una simple manipulación matemática, dejando a la variabilidad de la frecuencia cardiaca como predictor de eventos no cardiacos31. Dicha estimulación simpática de receptores adrenérgicos (1, (2 y (3 que por lo general son más sensibles a la adrenalina y un poco menos a la noradrenalina, genera aumentos de la concentración de adenosín monofosfato cíclico intracelular (↑ [AMPc]i) que concluye en diferentes efectos; los (1 en el corazón aumentan el gasto cardíaco ya que activan la proteína G heterotrimérica Gs y estimulan a la adenilato-ciclasa, lo cual antagoniza los efectos de los receptores muscarínicos y aumenta el Ca++ intracelular en el citosol, principalmente a través de proteína quinasa dependiente del cAMP, que desencadena la fosforilación de los canales de Ca2 ++ tipo L dependientes de voltaje (I Ca++L ), e incrementa así la respuesta de Ca2 ++ inducido por Ca2 ++ y las corrientes If del nódulo sinusal. Adicionalmente, eleva la velocidad de repolarización a través de la salida activa de potasio de los canales rectificados de potasio I Ks e I Kr , así como también la fosforilación de la proteína reguladora fosfolamban, con el aumento consecuente de la efectividad de la acción de la bomba sarcolémica de calcio (SERCA1). Esta influencia está presente en la etapa cuatro de potencial de acción, la cual se acorta y genera disminución de la etapa lenta de la despolarización diastólica espontánea (DDE) de las células excitables no contráctiles del sistema eléctrico cardiaco32-34. Algunas sustancias antagonistas (1 son antihipertensivos de utilidad; los (2 están en concentraciones altas en el músculo bronquial y los (3 en los adipocitos.
Los receptores (1 predominan en los vasos sanguíneos y los (2 en los terminales presinápticos, y son más sensibles a la noradrenalina que a la noradrenalina. La estimulación de los receptores (1 adrenérgicos genera estimulación de la proteína G y efectos de las subunidades ( activadas, que a su vez estimulan la gosfolipasa C; esta enzima convierte el PIP2 en inositol trifosfato (IP3) y diacilglicerol (DAG), y ambos generan vasocontricción vascular secundaria al estímulo de receptores de IP3 en el retículo sarcoplasmático que permiten la salida efectiva de Ca2 ++, mientras que el DAG activa la fosfoquinasa C (PKC). Los medicamentos agonistas (1 son eficaces como descongestivos nasales y los antagonistas (2 se han usado para tratar la impotencia. La médula suprarrenal también tiene influencia sobre el inotropismo y cronotropismo ya que es una adaptación especial de la división simpática, homóloga a la neurona simpática posganglionar que libera adrenalina al torrente sanguíneo. Este componente neuroendocrino de la salida simpática potencia la capacidad de la división simpática para difundir su mensaje y disminuye la variabilidad de la frecuencia cardiaca.
El SNP a diferencia del SNS disminuye la frecuencia cardiaca y bloquea los efectos simpáticos sobre el corazón34. La acetilcolina (ACh) es un neurotransmisor segregado por ramas del nervio vago, el cual estimula los receptores muscarínicos M1, M2, M3 y M5 sensibles a ACh, que a su vez están acoplados a proteínas Gs. La estimulación de los M2 cardiacos bloqua la acción simpática disminuyendo la concentracion de [AMPc]i y adicionalmente estimula la salida de potasio ocasionando repolarización a través de receptores rectificados de potasio dependientes de acetilcolina (IK ACh ), que son compatibles con acciones inotrópicas y cronotrópicas negativas, que tienden a aumentar el tiempo de la variabilidad de la frecuencia cardiaca ya que incrementan el tiempo de despolarización lenta en la etapa cuatro del potencial de acción de respuesta lenta. La predominancia del parasimpático en estado de reposo favorece la irrigación coronaria ya que permite que la diástole sea más prolongada y que el ventrículo izquierdo esté sometido a periodos más cortos de hipoxia32,35.
Medición de la variabilidad de la frecuencia cardiaca
La frecuencia cardiaca y variabilidad de la frecuencia cardiaca son inversamente proporcionales, además en el análisis de esta variación pueden influir distintos factores como edad, género, temperatura, hora del día, estado de actividad (activo o en reposo), carga de trabajo, consumo de alcohol o tabaco, entre muchos otros36. Para medir la variabilidad de la frecuencia cardiaca se utilizan distintos métodos; entre ellos el más común es el electrocardiograma de 24 horas. Esta técnica muestra gráficamente cada una de las ondas R que se generan con cada latido, permitiendo el análisis del tiempo en milisegundos que hay entre los intervalos R-R y las pequeñas variaciones que se pueden detectar entre intervalos consecutivos. Se lleva a cabo mediante un monitor Holter que registra el ritmo cardíaco de la persona durante 24 horas mientras esta realiza sus actividades habituales36. Otra forma de medir la variabilidad de la frecuencia cardiaca es mediante los aparatos portátiles POLAR, generalmente usados por deportistas, ya que permiten cuantificar los intervalos R-R mientras la persona practica ejercicio físico36. Este sistema también se utiliza en personas sometidas a ambientes especiales, como pilotos, astronautas y deportistas náuticos. Con la ayuda de algunas técnicas como exponer a un paciente a estrés físico o administración de inotrópicos, se pueden hacer mediciones de laboratorio cortas de 2-5 minutos que permiten comparar la variabilidad de la frecuencia cardiaca de una persona antes y después de exponerlo a los estimuladores del sistema nervioso autónomo36. En la actualidad se han utilizado diversos software en estudios de variabilidad de la frecuencia cardiaca, como el programa Kubios y SinusCor, que ofrecen el análisis de dominio de tiempo y frecuencia, y han demostrado tener buena correlación en condiciones de reposo y actividad; además, sus interpretaciones están relacionadas con el pronóstico clínico y la información de diagnóstico. Los parámetros estadísticos y geométricos, la transformación rápida de Fourier y los diagramas periódicos basados en auto-regresión son enfoques utilizados comúnmente para la evaluación de señales de intervalos RR en estado de reposo37-39. Los parámetros que se verifican están divididos en dos grandes grupos: métodos en el dominio del tiempo, que incluyen los métodos estadísticos y geométricos, y métodos en el dominio de frecuencia. Los parámetros para el análisis de dominio de tiempo según las Guías de práctica clínica de la Sociedad Española de Cardiología en la monitorización ambulatoria del electrocardiograma y presión arterial son: intervalo RR promedio >900 ms, desviación estándar de todos los intervalos RR (SDNN) de 141 ± 39 ms, desviación estándar de la media de los intervalos RR medidos cada 5 min durante todo el registro (SDANN) de 127 ± 35 ms, raíz cuadrada de la media de la suma de las diferencias entre intervalos RR elevados al cuadrado (RMSSD) de 27 ± 12 ms, RR50 dividido por el número total de intervalos RR (PNN50%) es del 3%. Los métodos geométricos incluyen el índice triangular de variabilidad de la frecuencia cardiaca o el número total de intervalos RR dividido por la altura del histograma de todos los intervalos RR medidos en una escala discreta con bins de 78.125 ms (índice SDRR) 37 ± 15 ms. Las medidas en el dominio de la frecuencia, aunque relevantes desde el punto de vista investigativo, usualmente no aparecen en el reporte del Holter tradicional, así que tienen uso clínico restringido29.
La variabilidad de la frecuencia cardiaca tiene distintos usos, entre los cuales está evaluar la función autonómica cardiaca. Existen pocas evidencias acerca de la relación que hay entre la variabilidad de la frecuencia cardiaca y la enfermedad cardiovascular; sin embargo, la disminución de esa variabilidad se ha asociado con distintas enfermedades como hipertensión arterial, diabetes, hipercolesterolemia y malos hábitos de vida como el sedentarismo y el consumo de tabaco40,41.
Aplicaciones de la variabilidad de la frecuencia cardiaca en la práctica clínica
El análisis de la frecuencia cardiaca se ha estudiado desde hace varias décadas. Se ha encontrado una asociación con la enfermedad cardiovascular en hombres y mujeres, que fue independiente de los factores de riesgo cardiovascular asociados. Los eventos coronarios también aumentaron cuando la frecuencia cardiaca previa fue más elevada13. Se considera la variabilidad de la frecuencia cardiaca como una herramienta de evaluación de las condiciones cardiacas autónomas capaz de predecir el riesgo cardiovascular. Algunos valores de corte sugeridos para determinar el riesgo, establecen parámetros que según los resultados pueden dar un riesgo alto, moderado o bajo: Intervalo RR < 750 ms riesgo alto, RR 750-900 ms riesgo moderado, RR. > 900 ms riesgo bajo, SDRR < 50 ms riesgo alto, SDRR 50-100 ms riesgo moderado, SDRR >100 ms R riesgo bajo, pRR50 < 3% R riesgo alto, pRR50 > 3% R riesgo bajo, SDARR < 8 ms riesgo alto, SDARR 8-12 ms riesgo moderado, SDARR > 12 ms riesgo bajo, índice SDRR < 25 ms riesgo alto, índice SDRR = 25-40 ms R riesgo moderado, índice SDRR >40 ms R riesgo bajo28,42.
El análisis de la variabilidad de la frecuencia cardiaca ha llevado a algunos investigadores a asociarla con accidente cerebrovascular isquémico y a concluir que es contraria al grosor del músculo liso de las arterias coronarias dado que la distensibilidad arterial es inversamente proporcional a la presión que se genera en los vasos40. Mediante relaciones como estas, claramente se pueden establecer pronósticos y tratamientos ante problemas cardiovasculares. La medición de la variabilidad de la frecuencia cardiaca también ha sido usada por los profesionales en el ámbito deportivo, ya que ayuda a evaluar el estado de salud de los deportistas durante el entrenamiento, y de este modo les permite fijar variaciones en el ejercicio según la adaptación que tienen a la actividad física40,43,44. Otros estudios han demostrado que la eliminación del impacto de la frecuencia cardiaca sobre la variabilidad de la frecuencia cardiaca hace que la variabilidad de la frecuencia cardiaca sea más predictiva de muerte no cardíaca. Sin embargo, el cálculo de este impacto hace que la variabilidad de la frecuencia cardiaca sea un mejor predictor de mortalidad cardiovascular25.
En el estudio de Sacha et al., se hicieron modificaciones matemáticas a fin de observar su influencia sobre la repetibilidad en los análisis de la variabilidad de la frecuencia cardiaca31. En este participaron 24 pacientes (14 hombres y 10 mujeres) a quienes se les registró la frecuencia cardiaca dos veces al día a la misma hora, mañana y noche, durante 30 días; se obtuvieron 1.121 muestras y 512 intervalos RR. Dentro de los resultados se pudo observar cómo la frecuencia cardiaca no solo genera una ayuda en el poder predictivo de la variabilidad de la frecuencia cardiaca, sino también su influencia en la repetibilidad31.
El uso de variabilidad de la frecuencia cardiaca para predecir muerte súbita ha venido relegándose dada la dificultad del proceso en el campo clínico, pese a lo cual en los Estados Unidos se estima que al año se presentan 400.000 fallecimientos debido a muerte súbita. Una de las medidas profilácticas adoptadas para esta situación es la implantación del cardiodesfibrilador o cardioversor, que lamentablemente es una opción costosa y con riesgos en la implantación. La evaluación de la variabilidad de la frecuencia cardiaca permite identificar pacientes con bajo riesgo cardiaco en quienes no sea necesario el uso de cardiodesfibrilador ya que la variabilidad de la frecuencia cardiaca actúa como un medio pronóstico para aquellos con miocardiopatía dilatada no isquémica45. Rashba et al. hicieron un seguimiento para estudiar la morbilidad y mortalidad de dos grupos de pacientes con falla cardiaca (n=458), en uno de los cuales administraron medicamentos clásicos como tratamiento y en otro, adicional a los medicamentos, usaron el cardiodesfibrilador. Se observó que los pacientes con cardiopatía dilatada no isquémica que tenían estable la SDNN tenían mejor pronóstico y no requerían implante de cardiodesfibrilador, mientras que la disminución de la SDNN se asoció con mayor mortalidad45.
El estudio de Yadav RL et al. en el departamento de fisiología del BP Koirala Institute of Health Sciences en Nepal y publicado en 2017, comparó la actividad cardiaca autónoma entre personas obesas y de peso normal a través del análisis de índices como la relación cintura-cadera e índice de masa corporal y por medio de la correlación de Spearman hicieron una relación con la variabilidad de la frecuencia cardiaca. Para ello tuvieron en cuenta medidas de baja y alta frecuencia (0.04-0.15 Hz y 0.15-0.4 Hz, respectivamente) y variables de dominio de tiempo como: SDNN, RMSSD y pNN50%, las cuales fueron mucho menores en el grupo de personas obesas que en las de peso normal (p <0.05) (46. Entre tanto, en el estudio de Ong MEH et al. llevado a cabo en el Hospital General de Singapur, se aplicó una escala que incluía la variabilidad de la frecuencia cardiaca y los signos vitales, con el fin de observar cuál era su poder predictivo en menos de 72 horas en pacientes con dolor torácico compatible con síndrome coronario agudo. Para la variabilidad de la frecuencia cardiaca, los valores tomados fueron métodos del dominio de frecuencia: 0.01 a 0.04 Hz muy baja frecuencia, 0.04 a 0.15 baja frecuencia cardiaca y 0.15 a 0.4 alta frecuencia. El estudio concluye que esta escala posee mejor capacidad predictiva en menos de 72 horas en comparación con alteraciones del segmento ST en el EKG y a la alteración de las troponinas, gracias a su alta sensibilidad47.
En conclusión, puede decirse que la variabilidad de la frecuencia cardiaca es una herramienta para establecer un pronóstico temprano del desarrollo de enfermedades cardiovasculares, pero aún requiere mayor reproductibilidad en el área clínica para generar facilidades en el análisis y predecir las alteraciones de manera más oportuna. Se precisan, así mismo, estudios en nuestra comunidad teniendo en cuenta la situación epidemiológica y los recursos limitados con los que cuentan Latinoamérica, y específicamente Colombia.