La probabilidad de nuevos eventos cardiovasculares mayores (ECVM) en pacientes luego de un infarto agudo del miocardio depende de diferentes variables, como el tiempo que haya pasado después del primer evento, el escenario de presentación (síndrome coronario agudo con/sin elevación del ST) y los factores de riesgo asociados. Dichos eventos se han relacionado con la respuesta proinflamatoria persistente1, la actividad plaquetaria y la actividad de la trombina2. La llegada de medicamentos con actividad antitrombótica más potente y específica en puntos clave del proceso trombótico ha permitido evaluar su efecto en el escenario de la prevención secundaria antitrombótica intensiva luego del primer año de un infarto del miocardio3.
En este tipo de prevención se han propuesto diferentes estrategias terapéuticas, entre ellas se ha extendiendo la doble terapia antiplaquetaria (DTA) (4, iniciando terapias antiplaquetarias adicionales5, o usando dosis bajas de anticoagulantes directos más aspirina6. Sin embargo, las características similares y, a su vez, heterogéneas en esta población, generan dudas de cuándo, en quiénes y cómo usar este tipo de terapia.
¿Cuándo?
Después del primer año luego de un infarto del miocardio continuar la DTA puede reducir significativamente el riesgo de nuevos ECVM, con un seguimiento promedio de 31 meses, independientemente del tipo de inhibidor de P2Y12 (IP2Y12)4. Este tipo de manejo podría continuarse e incluso, si se ha suspendido, podría reiniciarse manteniendo su efecto benéfico, ya que en el subanálisis del estudio PEGASUS (Prevention of Cardiovascular Events in Patients with Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin-Thrombolysis in Myocardial Infarction 54) se observó mayor beneficio en pacientes que continuaron sin interrupción, o que interrumpieron por un corto periodo de tiempo el ticagrelor (menos de un año, idealmente menos de treinta días)7.
Recientemente, el estudio COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies) evaluó la prevención secundaria antitrombótica intensiva en pacientes con enfermedad coronaria usando dosis de rivaroxabán 2,5 mg/12 h más aspirina. Un 68% de los pacientes había tenido un infarto del miocardio antes de la aleatorización y un 77% de estos infartos había ocurrido hacía más de dos años. En el análisis de subgrupos, según el tiempo transcurrido luego del infarto, el beneficio fue consistente en todos los grupos; sin embargo, se observó tendencia a un mayor efecto en el grupo de más de cinco años8. Por lo anterior, esta estrategia parece ser una opción en un periodo más tardío y para los que hayan suspendido la DTA por un tiempo prolongado tras el infarto.
¿En quiénes?
En el estudio PEGASUS se incluyeron pacientes mayores de 50 años, que habían tenido infarto del miocardio uno a tres años antes de la aleatorización y contaban al menos con uno o más de los siguientes factores de riesgo: edad mayor a 65 años, diabetes mellitus en tratamiento farmacológico, un segundo infarto en los últimos tres años, enfermedad coronaria multivaso y enfermedad renal crónica con tasa de filtración glomerular menor a 60 ml/min. Al 83% de estos se les realizó algún tipo de intervención coronaria percutánea, que, en su mayoría, requirió implantación de stent (96,5%). El porcentaje de pacientes con enfermedad arterial periférica fue bajo (5,3%). Se excluyeron aquellos con antecedente de ataque cerebrovascular isquémico (ACV), trastornos de la coagulación, hemorragia intracerebral, tumor o malformación vascular en el sistema nervioso central, sangrado gastrointestinal en los últimos seis meses y cirugía mayor en los últimos treinta días, condiciones consideradas de alto riesgo de sangrado9. En estudios como el DAPT (Twelve or 30 months of Dual AntiPlatelet Therapy after drug-eluting stents) el porcentaje de pacientes con infarto del miocardio previo fue de aproximadamente 26%, y a todos les fue implantado un stent medicado de diferente generación10. En la actualidad existen algunos puntajes que ayudan a determinar la necesidad o no de continuar la DTA, balanceando el riesgo isquémico y de sangrado (puntaje DAPT: Dual AntiPlatelet Therapy), y otros que determinan el riesgo de sangrado para decidir continuar con la DTA (puntaje PRECISE-DAPT: PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy)11,12. Una de las limitaciones importantes del puntaje DAPT es que el estudio en el que está basado utilizó un porcentaje significativo de stents de primera generación, por lo que usar los criterios de inclusión del PEGASUS podría ser más apropiado9,13.
Por su parte, en el estudio COMPASS se incluyeron pacientes mayores de 65 años con enfermedad coronaria dada por infarto del miocardio en los últimos veinte años, o enfermedad coronaria multivaso, o intervención coronaria percutánea previa, o enfermedad multivaso llevados a revascularización miocárdica quirúrgica. Se incluyeron menores de 65 años que tuvieran compromiso de otro territorio vascular diferente al coronario, o dos factores de riesgo adicionales: fumador activo, diabetes mellitus, enfermedad renal crónica con tasa de filtración glomerular menor a 60 ml/min, falla cardiaca, o ACV no lacunar6. Al 60% se le había realizado intervención coronaria percutánea y el 20% tenía enfermedad arterial periférica. Uno de los criterios de exclusión fue el alto riesgo de sangrado, el cual fue la segunda causa más frecuente de exclusion8. En la actualidad no existen puntajes aditivos para determinar el uso de la estrategia de rivaroxabán más aspirina.
Al analizar estos datos la terapia con ticagrelor más aspirina parece ser la ideal en mayores de 50 años con al menos un factor de riesgo, sin antecedente de ACV, evaluando el riesgo isquémico y de sangrado para definir el uso de otro IP2Y12 menos potente. Por su parte, la estrategia con rivaroxabán (dosis COMPASS) más aspirina podría indicarse en mayores de 50 años con factores de riesgo cardiovascular pero que además tengan el antecedente de enfermedad arterial periférica y ACV, o ambas.
¿Cómo?
La dosis de ticagrelor de 60 mg cada 12 horas más aspirina demostró reducir de manera significativa los EVCM comparado con la aspirina (7,7% vs. 9,9%; p 0,004), con un aumento del sangrado mayor determinado por la escala TIMI (Thrombolysis in Myocardial Infarction) (2,3% vs. 1,06%, p < 0,001), pero sin diferencia significativa de sangrados fatales o hemorragia intracerebral (0,71% vs. 0,60%, p 0,47)7. La dosis de rivaroxabán 2,5 mg cada 12 horas más aspirina, comparada con la aspirina, también demostró una reducción significativa de ECVM (4,0% vs. 6,0%; p < 0,0001), con un incremento de los eventos de sangrado mayor por la escala ISTH (International Society of Thrombosis and Hemostasis) (2%vs. 1%; p < 0,0001), sin diferencia significativa en sangrados fatales o hemorragia intracerebral (< 1% vs. <1%; p 0,54)8).
Al responder estas preguntas y analizar los datos se propone una ruta para decidir tanto el tipo como el momento del inicio de la terapia de prevención secundaria antitrombótica intensiva tardía en pacientes que han padecido un infarto del miocardio (fig. 1). En esta se incluye una valoración adicional del riesgo de sangrado basada en los criterios de exclusión de los estudios y condiciones propias de los pacientes, ya que, con el paso del tiempo, la revaloración de estos factores podría ser clave para decidir o no el uso de esta terapia. De igual manera, evaluar las metas de algunos factores de riesgo cardiovascular es de suma importancia, dado que, a pesar de que en los estudios estas no se describen de manera exacta, el éxito del tratamiento depende al final de la suma del control de todas estas condiciones. Adicionalmente, podrían analizarse ciertas consideraciones de la anatomía coronaria que aumenten el riesgo isquémico del paciente.
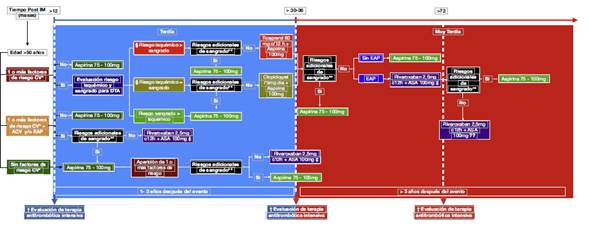
Figura 1. Prevención secundaria intensiva tardía con terapia antitrombótica. IM: Infarto del miocardio. CV: Cardiovascular. ACV: Ataque cerebrovascular isquémico. EAP: Enfermedad arterial periférica. DTA: Doble terapia antiplaquetaria. *Factores de riesgo CV: Diabetes Mellitus en tratamiento farmacológico; Hipertensión arterial; Dislipidemia; Enfermedad renal crónica tasa de filtración glomerular (TFG) <60mL/min, más de 1 IM previo, enfermedad multivaso. † Revisar control óptimo de factores de riesgo CV, y TFG. § Consideraciones anatómicas: Stent >60 mm, stent en oclusión total crónica, stenting complejo en bifurcaciones. **Riesgos adicionales de sangrado: Trastornos de la coagulación, tumor o malformación vascular en el sistema nervioso central, sangrado en los últimos 6 meses, fragilidad/edad avanzada > 75 años, enfermedad oncológica activa. ‡ No se recomienda para enfermedad renal crónica TFG <30mL/min, Fracción de eyección <30%, o antecedente de ACV no lacunar o hemorrágico. ?? Actualmente no se conoce por cuánto tiempo debe continuar este tipo de terapia luego de dos años.
Se considera, entonces, que sin duda existe un beneficio de este tipo de terapias en la prevención secundaria de nuevos eventos trombóticos después de un año de haber sufrido un infarto del miocardio, por lo que se recomienda su uso. Sin embargo, tanto el proceso de selección del paciente como el tipo de terapia deben ser individualizados.
Aún quedan muchos interrogantes, como la duración de este tipo de terapia, si el control de la inflamación o los factores de riesgo determinarán esta duración, la costo-efectividad según el país o región y por cuánto tiempo estará la aspirina presente en la prevención secundaria.
Por ahora se intenta aclarar un poco para qué tipo de pacientes se debe usar este tipo de prevención, la cual ha sido denominada intensiva por la potencia antitrombótica adicional que dan estos medicamentos a la aspirina, y a la que denominamos tardía por darse después del primer año de un infarto del miocardio.











 text in
text in 


