Introducción
Las pandemias son tan antiguas como la humanidad misma. El término cuarentena nace en 1374 en el apogeo de la peste negra; durante este periodo, los barcos debían atracar cerca al puerto sin permitir que la tripulación llegara a tierra (1. Teniendo en cuenta la rápida propagación de la infección por el coronavirus SARS-CoV-2, que produce la enfermedad conocida como COVID-19, (2 esta revisión recopila la evidencia actual de la asociación de la enfermedad y el sistema cardiovascular.
En diciembre de 2019, en Wuhan, provincia de Hubei en China, se reportó un grupo de 27 pacientes con neumonía de etiología desconocida, vinculados con exposición al mercado de mariscos, pescado y animales vivos. (3,4 El 7 de enero de 2020, se identificó una nueva sepa de coronavirus aislada en estos pacientes (SARS-CoV-2). (5 Posterior a ello y dado el aumento exponencial de la cifra de pacientes infectados, el 11 de marzo de 2020 la Organización Mundial de la Salud (OMS) decreta que esta infección cumple el comportamiento de pandemia. Para esa fecha, el número de casos era de 118.000, con 4.291 pacientes fallecidos en 114 países (6.
Durante las etapas iniciales de la pandemia y dados los pocos estudios publicados al respecto, se creía que este coronavirus causaba síntomas netamente respiratorios; no obstante, a medida que el número de pacientes aumentó, se observó que la enfermedad cardiovascular tenía un papel fundamental en el desarrollo y pronóstico de la infección. Los pacientes con antecedentes cardiovasculares conforman el grupo de mayor riesgo de morbilidad y mortalidad; sin embargo, los individuos sanos que cursan con infección grave también pueden tener compromiso cardiovascular agudo7,8.
Contexto global
Al finalizar esta revisión, se registraban 634.835 casos confirmados, 29.957 muertes en 196 países9; los datos más precisos son tomados de los estudios publicados de la población China que experimentó la primoinfección10,11. En los primeros 72.314 casos, se observó que el 87% tenía entre 30 a 79 años, el 81% cursó con infección leve, con una mortalidad total de 2.3%, pero en el grupo de pacientes que eran considerados críticos se documentó una mortalidad cercana al 50%.12 En otra cohorte de Wuhan, el requerimiento de unidad de cuidado intensivo (UCI) fue del 26%; por síndrome de dificultad respiratoria aguda (SDRA) el 60%, 40% por arritmias y 30% debido a choque10. Adicionalmente, se describe que la población médica afectada representó el 3.8% del total de infectados y de estos el 15% se definieron como infección grave (12.
Factores de riesgo
En el informe del centro de control y prevención de enfermedades de China, que incluyó 72.314 casos confirmados, el principal factor de riesgo para mortalidad fue la edad mayor de 80 años. En esta población específica el porcentaje de muertes informado fue de 14.8%; otros grupos de riesgo con mortalidad elevada fueron: presencia de enfermedad cardiovascular (10.5%), diabetes (7.3%), enfermedad pulmonar crónica (6.3%), hipertensión arterial (6%) e historia de cáncer (5.6%) (12.
Estructura del virus SARS-CoV-2
El coronavirus es un virus ARN positivo de cadena simple con envoltura; 2/3 del material genético traducen a 16 proteínas no estructurales y 1/3 corresponde a 4 proteínas estructurales: proteína S, que presenta una subunidad S1 la cual interviene en la afinidad del virus por la enzima convertidora de angiotensina 2 (ECA2); la subunidad S2, que facilita la fusión de la membrana celular; la proteína M, que permite la liberación del ARN a la célula huésped; y las proteínas N y E, las cuales son proteínas estructurales encargadas de interactuar con la inmunidad innata del huésped (13.
Interacción con el sistema renina-angiotensina-aldosterona (RAA)
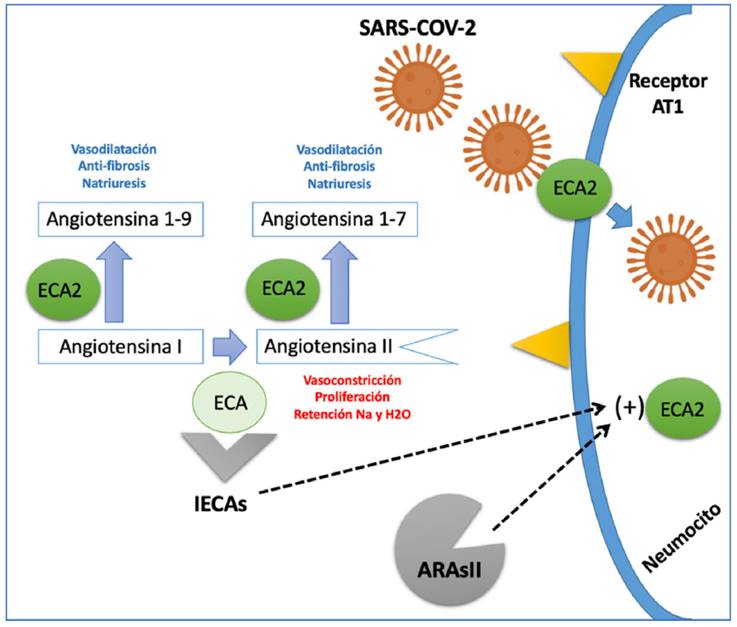
La enzima convertidora de angiotensina (ECA) es una ectoenzima que favorece la conversión de angiotensina I a angiotensina II, y se encuentra predominantemente a nivel pulmonar y en el endotelio vascular, aunque está presente en casi todos los tejidos del cuerpo (14. En estudios experimentales, la administración de inhibidores de la ECA (IECA) o bloqueadores del receptor de angiotensina II (ARAII) favorecía una mayor expresión de ECA y ECA2; esta última enzima es la encargada de convertir la angiotensina II en angiotensina I-7 (Ag1-7) y de angiotensina I en angiotensina 1-9 (Ag1-9), las cuales tienen efectos vasodilatadores, anti-proliferativos y natriuréticos contrarios a la angiotensina II (15; además, la ECA2 se considera el sitio de entrada del SARS-CoV-2 a la célula (fig. 1) (16.
La ECA (enzima convertidora de angiotensina) cumple la función de convertir la AG1 (angiotensina I) en AgII (angiotensina II) una proteína con acción vasoconstrictora, proliferativa y pro-fibrótica. La ECA2 (enzima convertidora de angiotensina 2) genera el paso de AnGI en AGI-9 y la AGII en AGI-7; estas dos proteínas resultantes tienen un efecto vasodilatador, anti-fibrótico y natriurético contrario al de la angiotensina II. La ECA2, además funciona como proteína de membrana que permite la entrada del SARS-CoV-2 a la célula. Los IECA (inhibidores de la enzima convertidora de angiotensina) y los ARAII (antagonistas del receptor de angiotensina II) aumentan la expresión de la ECA2; sin embargo, aún no está claro si su efecto puede ser deletéreo o benéfico en pacientes con infección por SARS-CoV-2.
La información obtenida de estos modelos experimentales podría sugerir que los pacientes que reciben IECA o ARAII para el tratamiento de enfermedades cardiovasculares crónicas, como hipertensión arterial, insuficiencia cardíaca o enfermedad coronaria, pueden ser susceptibles a un mayor impacto de la infección por SARS-CoV-2, esto asociado a la sobreexpresión de ECA2. Esta hipótesis explicaría el aumento de mortalidad documentada en pacientes cardiópatas infectados. Sin embargo, el incremento en las concentraciones de Ag 1-7 y Ag 1-9, también generado por estos bloqueadores del eje RAA, podría tener un probable efecto benéfico (fig. 1). (17 En un modelo animal con ratones infectados con SARS-CoV-1, el bloqueo del eje RAA se tradujo en una disminución de la aparición de edema pulmonar y síndrome de dificultad respiratoria aguda (SDRA). Estos experimentos fueron realizados con SARS-CoV-1 y aún no se han confirmado en infección por SARS-CoV-2. (18
Las sociedades científicas se han pronunciado sobre la conducta de continuar o no IECA y ARAII en estos pacientes. La Sociedad Europea de Cardiología (ESCARDIO) y el Colegio Americano de Cardiología (ACC), establecen que estos medicamentos previamente han demostrado en ensayos clínicos la disminución de la mortalidad y otros desenlaces fuertes en enfermedad cardiovascular. Hasta ahora no se dispone de evidencia contundente que indique la necesidad de suspender estos fármacos en pacientes con COVID-19 (19,20.
COVID-19 y biomarcadores cardíacos
El incremento en los niveles de troponina es común en pacientes con infecciones respiratorias agudas severas (21; la infección por SARS-CoV-2 no es la excepción. La lesión miocárdica se documentó en 5 de los primeros 41 pacientes diagnosticados con COVID-19 en Wuhan (22. En un reporte de la comisión nacional de salud de China se confirmó elevación de troponina y paro cardíaco en el 12% de los pacientes hospitalizados sin enfermedad cardiovascular previa (8. La cohorte de 138 pacientes reportada por Wang et al. (10, que definió lesión cardíaca como troponina I de alta sensibilidad positiva o cambios electrocardiográficos o ecocardiográficos nuevos, encontró este hallazgo en 7.2% de los pacientes y en 22% de aquellos que requirieron UCI (10. Los niveles de creatina-quinasa (CK-MB) también son significativamente mayores en pacientes con requerimiento de UCI frente a aquellos tratados en otros servicios (10. Estos hallazgos sugieren correlación entre la severidad de la infección y el grado de compromiso miocárdico.
Aunque la hipoxemia severa secundaria a disfunción respiratoria por sí misma puede explicar la lesión miocárdica, se proponen mecanismos adicionales. Una hipótesis vincula la ECA2; esta vía de señalización podría tener un papel en los mecanismos de daño miocárdico directo (8. Otro mecanismo sugerido implica la tormenta de citoquinas desencadenada por el desequilibrio entre la respuesta tipo 1 y 2 de los linfocitos T ayudadores (23.
Los péptidos natriuréticos BNP (péptido natriurético cerebral) y NT-proBNP (pro péptido natriurético cerebral) son biomarcadores de estrés miocárdico y se elevan en pacientes con enfermedades respiratorias agudas severas, típicamente sin que exista elevación de las presiones de llenado ventricular o signos y síntomas de insuficiencia cardíaca (24. Al igual que la troponina, su elevación sugiere un peor pronóstico en pacientes con SDRA (25,26. Los individuos que presentan infección severa por SARS-CoV-2 frecuentemente tienen niveles elevados de BNP y NT-proBNP (27. Se analizó el valor pronóstico de los niveles de NT-proBNP en 54 pacientes con neumonía severa por COVID-19, y se encontró que valores mayores a 88.6 pg/ml se asocian con mayor riesgo de muerte intrahospitalaria; después de ajustar por sexo y edad (HR de 1.32, IC% 95%; 1.11-1.56, p 0,001), los pacientes con COVID-19 y NT-proBNP elevado tenían con mayor frecuencia hipertensión arterial y enfermedad coronaria (27. Es claro el valor pronóstico de estos biomarcadores, aunque dada la alta frecuencia de valores positivos y poca especificidad, algunos autores sugieren que la medición de troponina y péptidos natriuréticos debería ser realizada solo a pacientes con COVID-19 que tengan signos y síntomas sugestivos de infarto agudo del miocardio o insuficiencia cardíaca (25,28.
El incremento del dímero-D y de lactato deshidrogenasa (LDH) se considera factor de riesgo para el desarrollo de SDRA y su progresión a muerte en pacientes con COVID-1911. En el análisis de 201 pacientes publicado por Wu et al. (12 la concentración de dímero-D se correlacionó directamente con la mortalidad, lo cual sugiere que, posiblemente, la coagulación intravascular diseminada es uno de los mecanismos de muerte en estos pacientes. (11 Un análisis retrospectivo que incluyó 191 pacientes hospitalizados por COVID-19, informó los factores de riesgo más importantes relacionados con mortalidad intrahospitalaria: edad (OR, 1.1; IC 95%, 1.03-1.17), puntaje SOFA -Sequential Organ Failure Assesment- (OR, 5.6; IC 95%, 2.6.12.2) y dímero-D (OR, 18,4; IC 95%, 2.64.128.5) (2. El dímero-D junto y los demás biomarcadores descritos ayuda a identificar pacientes con COVID-19 y riesgo incrementado de mortalidad intrahospitalaria.
Síndrome coronario agudo y COVID-19
En la publicación de Kwong (29 de 2018 se estableció un aumento en el riesgo de infarto agudo de miocardio en pacientes con enfermedad respiratoria aguda por influenza, con una tasa de incidencia de 6.1 (IC 95%, 3.9-9.5) frente a otras infecciones respiratorias de origen viral que incluían especies de coronavirus (tasa de incidencia 2.8, IC 95%, 1.2-6.2) (29. Se ha postulado que la respuesta inflamatoria y los cambios hemodinámicos asociados, son los probables desencadenantes del aumento en la incidencia de síndrome coronario agudo en aquellos pacientes con placas ateroescleróticas susceptibles de ruptura. (30 Algunos de estos casos pueden presentarse con sintomatología superpuesta. Se ha reportado dolor torácico y cambios electrocardiográficos típicos en pacientes con arterias coronarias epicárdicas sin lesiones significativas, que fueron positivos para COVID-19 (31.
Chor-Cheung et al. (32 describieron el impacto del brote de COVID-19 en pacientes con infarto agudo del miocardio con elevación del ST (IAMCEST) que se sometieron a intervención coronaria percutánea (ICP) en un único centro, comparando los tiempos de intervención con un grupo control del año anterior. Documentaron un aumento del tiempo desde el inicio de los síntomas y el contacto con el médico; también reportaron retraso en la atención y en el diagnóstico de los pacientes después de la llegada al hospital. Sugieren como principales factores el temor por parte del paciente o del personal de salud de adquirir la infección por SARS-CoV-2 y el tiempo necesario para la instauración de las medidas de protección y bioseguridad del equipo de cardiología intervencionista (32. Las recomendaciones más recientes sobre la atención y el manejo de pacientes con COVID-19 en el laboratorio de cateterismo cardíaco se reúnen en el consenso del Colegio Americano de Cardiología (ACC) y la Sociedad de Angiografía e Intervención Cardiovascular (SCAI) (33.
La utilización de estudios complementarios, como ecocardiograma y arteriografía coronaria, en pacientes con COVID-19 y lesión miocárdica o elevación de péptidos natriuréticos debería ser reservada para aquellos en quienes se considere que estos procedimientos modificarán significativamente la conducta clínica y el pronóstico (28. Dado que el escenario clínico de pacientes con COVID-19 e infarto agudo del miocardio es altamente probable, se han desarrollado recomendaciones para su atención (34.
El tratamiento del síndrome coronario agudo en pacientes con COVID-19 debe ser individualizado. Un reciente protocolo sugerido por Zeng y Jianxin, (34 el cual aplica para atención en fase epidemiológica de mitigación en la que se presume transmisión comunitaria (35, indica como paso inicial la toma de muestras para confirmar infección por SARS-CoV-2. En términos generales, se considera que hay beneficio en mortalidad cuando se comparan pacientes sometidos a ICP primaria frente a pacientes que reciben trombólisis (36. Sin embargo, este beneficio se debe balancear con el riesgo de exposición del personal de salud, por lo que la implementación de pruebas rápidas en pacientes sintomáticos respiratorios es fundamental (34. Tanto el caso sospechoso como el confirmado se abordan de la misma manera, evaluando la presencia de neumonía severa (37; en este escenario se propone un manejo médico conservador. En los pacientes estables con IAMCEST y COVID-19 en las primeras 12 horas de inicio de los síntomas y sin contraindicaciones para trombólisis, debe realizarse esta estrategia de reperfusión (34. Si el tiempo de evolución es mayor a 12 horas o existe contraindicación para trombólisis, se debe evaluar el riesgo y beneficio de realizar ICP de forma individualizada. La ICP primaria es una opción siempre y cuando se garantice el equipo de protección personal adecuado en la sala de cateterismo y se evalúen los riesgos de contagio (34. En la fase inicial de contención (ausencia de transmisión comunitaria) la intervención de pacientes con IAMCEST y baja probabilidad clínica para COVID-19 se basará en las recomendaciones de protocolos institucionales vigentes previos a la pandemia (figs. 2 y figs. 3) 36.
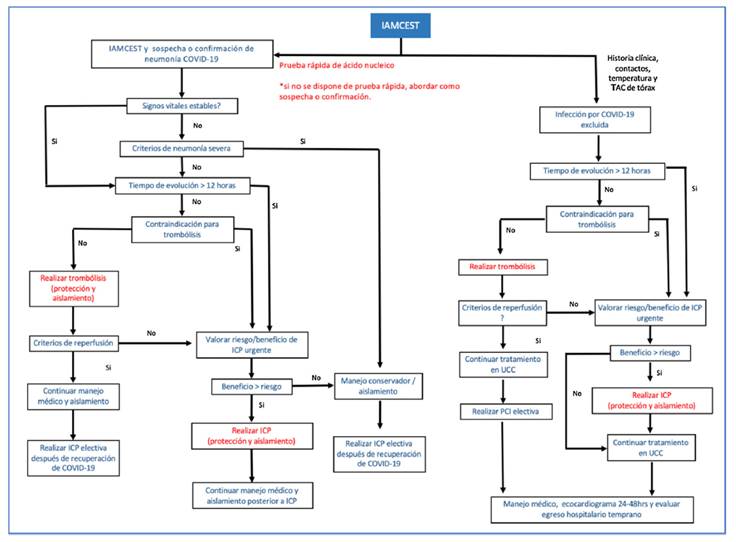
Figura 2 Algoritmo de tratamiento en pacientes con IAMCEST y COVID-19. IAMCEST: infarto agudo del miocardio con elevación del segmento ST, ICP: intervención coronaria percutánea, UCC: unidad de cuidado coronario, TAC: tomografía axial computarizada. Modificada de Zeng et al. (34.
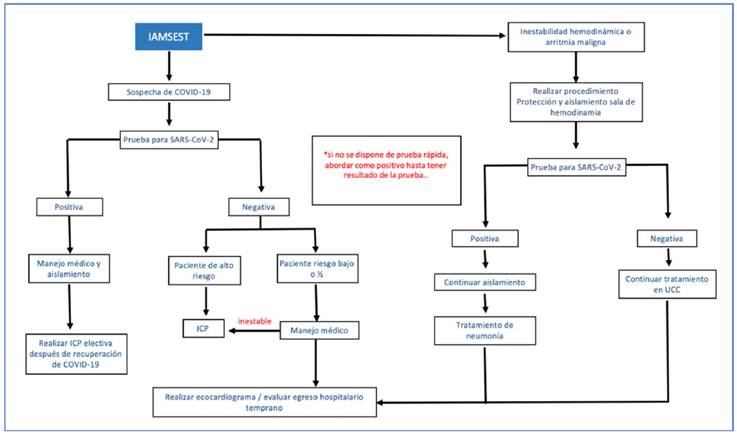
Figura 3 Algoritmo de tratamiento en pacientes con IAMSEST y COVID-19. IAMSEST: infarto agudo del miocardio sin elevación del segmento ST, ICP: intervención coronaria percutánea, UCC: unidad de cuidado coronario. Modificada de Zeng et al. (34
A menos de que se confirme un infarto tipo 1 (30, o exista otra indicación diferente a la condición cardíaca, no hay evidencia para indicar antiagregantes o anticoagulantes en pacientes con infección por SARS-CoV2 y lesión miocárdica aguda (28.
Miocarditis y COVID-19
En epidemias previas, como en el caso de la infección por influenza, se reconoce a la miocarditis aguda como una complicación cardiovascular que contribuye al impacto en la morbimortalidad (7,38. Se han presentado reportes de casos en la literatura de pacientes con miocarditis aguda y fulminante debido a coronavirus (39,40. El grupo del departamento de Cardiología del Hospital West China reportó el caso de un paciente de 37 años que ingresó al hospital el 14 de enero de 2020 con dolor torácico y disnea de tres días de evolución en relación con deposiciones diarreicas e hipotensión; presentaba cambios electrocardiográficos tipo elevación del segmento ST y angiografía coronaria sin evidencia de enfermedad epicárdica, y adicionalmente valores elevados de marcadores de lesión miocárdica: troponina, CK-MB y BNP. El tratamiento reportado fue metilprednisolona para suprimir la inflamación (200mg/día, 4 días) e inmunoglobulina humana para regular la repuesta inmunológica (20g/día, 4 días), soporte vasopresor e inotrópico, terapia diurética y antibióticos. Al seguimiento, el paciente presentó mejoría en la cardiomegalia, evaluada por radiografía de tórax y retorno a la normalidad del tamaño y de la función sistólica ventricular por ecocardiografía transtorácica; entre tanto, los marcadores de lesión miocárdica se normalizaron a la tercera semana. Los autores de este reporte de caso sugieren que la terapia antiiinflamatoria con glucocorticoides e inmunoglobulina es útil en este tipo de pacientes (40.
El departamento de cardiología del Hospital Universitario King Khalid en Arabia Saudita hizo un reporte de caso adicional en 2016 (39. Se trató de un paciente masculino de 60 años, quien debutó con síndrome respiratorio del Oriente Medio por coronavirus (MERS-CoV) con síntomas y signos de insuficiencia cardíaca congestiva y neumonía; presentaba niveles elevados de troponina, proBNP y disfunción sistólica global izquierda en el ecocardiograma, con leve derrame pericárdico. Los hallazgos electrocardiográficos correspondían a taquicardia sinusal e inversión difusa de la onda T. La muestra de esputo fue positiva para MERS-CoV. El paciente requirió ingreso y manejo en la UCI, donde recibió antibióticos y furosemida. La resonancia nuclear magnética (RNM) cardíaca reveló en las imágenes del realce tardío de gadolinio (LGE: late gadolinium enhancement) un patrón lineal de señal incrementada en regiones subepicárdicas de la pared inferior y lateral del ventrículo izquierdo, que fue compatible con miocarditis aguda (39. Al seguimiento a los tres meses en el control ecocardiográfico no hubo mejoría en la función sistólica del ventrículo izquierdo.
Se han publicado otros reportes en los que se sugiere que las dosis altas de glucocorticoides pueden no ser benéficas en estos pacientes, particularmente en aquellos con daño pulmonar (41. Debido a que los niveles de interleucina 6 (IL 6) están elevados en pacientes con neumonía por COVID-19 semejando una tormenta de citoquinas, se ha propuesto la investigación con tocilizumab (antagonista de IL 6) (42. La última y más reciente publicación del Instituto de Cardiología de la Universidad de Brescia en Italia, hecha por Metra et al. (43, resalta el caso de una paciente previamente sana, de 53 años, con síntomas de infección respiratoria alta, sin fiebre ni dolor torácico, con deterioro de la clase funcional e hipotensión arterial. El electrocardiograma mostró elevación difusa del segmento ST y biomarcadores incrementados, y se confirmó infección por SARS-CoV-2. La RNM cardíaca mostró engrosamiento de la pared con hipoquinesia biventricular, especialmente en los segmentos apicales y disfunción ventricular izquierda (fracción de eyección del ventrículo izquierdo de 35%) junto con la presencia de LGE difuso en ambos ventrículos. El tratamiento instaurado fue lopinavir/ritonavir, glucocorticoides, cloroquina y tratamiento médico para la insuficiencia cardíaca con evolución satisfactoria. Este caso resalta el compromiso cardíaco sin la presencia de neumonía intersticial en pacientes con COVID-19 (43.
El pronóstico de los pacientes con COVID-19 y choque no ha sido reportado sistemáticamente. En un estudio de 150 pacientes de dos hospitales en Wuhan, el estado de choque fue la causa de muerte en el 40% de los casos, y podría deberse a miocarditis fulminante (44,45.
Arritmias y COVID-19
Durante esta pandemia, los estudios de seguimiento institucionales han descrito que las complicaciones mayores durante la hospitalización incluyen SDRA, arritmias y choque (2,11,22. En el estudio de Wang et al. (10 de 138 pacientes con diagnóstico confirmado de COVID-19, 46 pacientes presentaron algún tipo de arritmia, aunque no se especificó el porcentaje de fibrilación auricular o arritmias ventriculares (10. El potencial arrítmico no solo se debe a la infección por coronavirus, también está relacionado con los tratamientos necesarios para el manejo del choque circulatorio. Una revisión sistemática del 2016 publicada en Cochrane, con seis ensayos clínicos aleatorizados (n=1400), comparó noradrenalina y dopamina en pacientes con choque. Los resultados no mostraron diferencia significativa en mortalidad por todas las causas, pero sí un riesgo aumentado de arritmias (RR 2.34, 95% CI 1.46-3.78) en el brazo de dopamina (45,46.
Cloroquina/hidroxicloroquina, azitromicina y lopinavir/ritonavir tienen varios efectos adversos, que incluyen: prolongación del intervalo QT, torsión de puntas, hepatitis, pancreatitis aguda, neutropenia y anafilaxia (47. Considerando que la mayoría de los pacientes que han fallecido por COVID-19 eran adultos mayores con comorbilidades cardíacas, el uso de estos medicamentos pudo potencialmente incrementar el riesgo de muerte súbita inducida por drogas (47-49.
Se ha incluido dentro de las recomendaciones de tratamiento de COVID-19 como primera línea la hidroxicloroquina a dosis de 400mg vía oral cada 12 horas, el primer día; seguido de 200mg vía oral cada 12 horas por 5 a 10 días (50. Se recomienda antes y durante el tratamiento, la monitorización del intervalo QT, el cual debe corregirse (Bazett)51. Adicionalmente, se deben solicitar electrolitos (calcio, magnesio y potasio) y evaluación de medicamentos de uso crónico que pudieran prolongar el QTc (https://crediblemeds.org/). (52 En la (fig 4) se explican las recomendaciones de seguimiento del QTc en la población con COVID-19 que recibe estos medicamentos47.
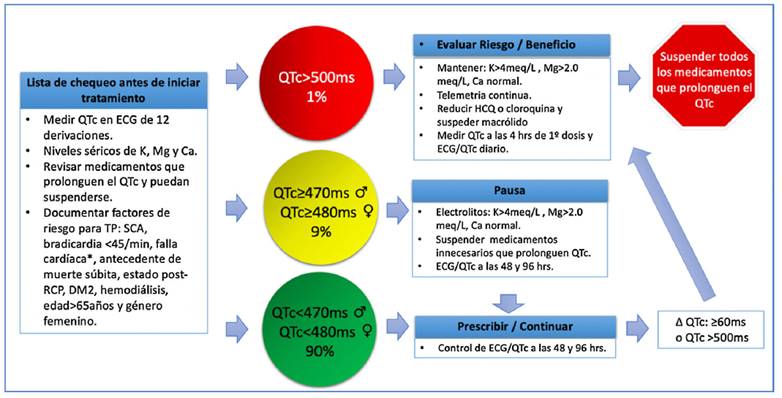
Figura 4 Valoración de QTc en pacientes adultos que reciben tratamiento farmacológico para COVID-19. QTc: intervalo QT corregido, ♀: mujer, ♂: hombre, ECG: electrocardiograma, K: potasio, Ca: calcio, Mg: magnesio, (: cambio, TP: torsión de puntas, SCA: síndrome coronario agudo, ms: milisegundos, RCP reanimación cardiopulmonar, HCQ: hidroxicloroquina, *falla cardiaca con FEVI (fracción de eyección) <40%. (Adaptada de Giudicessi et al. (47).
Conclusiones
El conocimiento acerca del COVID-19, su prevención, diagnóstico, tratamiento y pronóstico, está creciendo rápidamente. Ya se sabe que la infección por sí misma o su tratamiento podrían tener manifestaciones cardiovasculares, como insuficiencia cardíaca, lesión miocárdica, isquemia o prolongación del QTc. Por estas razones, debemos estar atentos a la evidencia disponible, debido a que un mayor conocimiento en las manifestaciones clínicas, en la interpretación de las diferentes pruebas diagnósticas y en las consecuencias cardiovasculares de los tratamientos utilizados para esta enfermedad, permitirá mitigar el caos generado por esta pandemia y obtener mejores resultados para los pacientes comprometidos por esta infección.