Introducción
En el mundo, la principal causa de mortalidad es la enfermedad cardíaca, que ocasiona 17.3 millones de muertes por año en hombres y mujeres, ya sea la forma heredada o adquirida. De ahí nace el interés de los investigadores por mejorar las terapias existentes y buscar un mejor entendimiento, planteando diversos modelos del desarrollo del corazón, con el propósito de identificar nuevos tratamientos farmacológicos y enfoques de bioingeniería basados en células madre para reemplazar el tejido cardíaco dañado1. Esta revisión se enfocará en las bradiarritmias [hoy se define bradicardia la existencia de una frecuencia sinusal < 50 lpm y / o una pausa sinusal > 3 segundos como componentes potenciales de las definiciones de disfunción del nódulo sinusal (DNS)]2.
Este hallazgo clínico frecuente, incluye varios trastornos del ritmo, como la disfunción del nódulo sinusal y las alteraciones de la conducción auriculoventricular. Clínicamente puede presentarse de forma asintomática y ser un hallazgo electrocardiográfico incidental (por ejemplo en un examen médico ordinario) o expresarse con una amplia gama de síntomas, como los de insuficiencia cardiaca, presíncope o síncope, del sistema nervioso central o inespecíficos y crónicos, como mareo o fatiga3.
La prevalencia de la disfunción del nódulo sinusal está alrededor de 0,03% y aumenta con la edad. El bloqueo aurículo-ventricular (AV) denota una conducción defectuosa del sistema de conducción AV, puede ser progresivo y en los grados más altos tiene un peor pronóstico. La prevalencia del bloqueo de la conducción AV es cercana al 0,04% y es más alta en los ancianos y en los hombres4.
Por otra parte, se sabe que el proceso de envejecimiento se correlaciona con una pérdida de hasta 20 millones/año de cardiomiocitos (como referencia el ventrículo izquierdo está conformado por 2 a 4 mil millones de cardiomiocitos) y en una situación clínica aguda, como un infarto miocárdico, se pierden millones de células, alcanzando en algunos casos el 25% de la masa cardíaca total. Si se tiene en cuenta que la regeneración de los cardiomiocitos endógenos es limitada, la compensación de esta pérdida de células se logra mediante la formación de tejido cicatricial fibrótico que altera la contractilidad del corazón. No hace mucho tiempo atrás se pensaba que el corazón era un órgano completamente diferenciado incapaz de regenerarse. No obstante, investigaciones recientes han demostrado que a la edad de 20 años la tasa de renovación de los cardiomiocitos alcanza el 1% y que a los 70 disminuye hasta el 0,4% por año5.
Breve historia del marcapasos electrónico
Los marcapasos electrónicos son la base de la terapia para los ritmos cardíacos lentos (bradicardia) debido a enfermedad del sistema de conducción cardíaco7. Albert S. Hyman diseñó el primer marcapasos cardíaco experimental en 1932 y fue allí donde primero introdujo el término “marcapasos artificial” y lo comparó con el marcapasos natural del corazón, el nodo sinoatrial6.
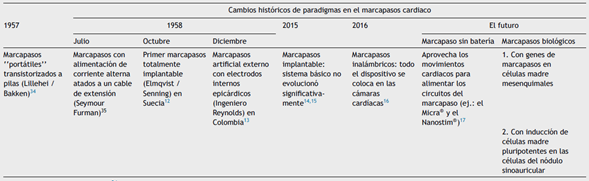
Desde el descubrimiento del electrocardiograma por Einthoven en 1902 y el de la estimulación cardiaca por Zoll en 19527 se reconocen varios hitos en la historia8,9 (tabla 1). Según las estadísticas, en el mundo cada año se implantan 1 millón de nuevos marcapasos, de los cuales una cuarta parte se implantan en los Estados Unidos para bradiarritmias y bloqueos cardíacos10.
Problemas del marcapasos artificial
Las tecnologías de marcapasos electrónico continúan evolucionando; sin embargo, los marcapasos electrónicos tienen limitaciones, como la duración de la batería, la falla del sistema, la incapacidad de proporcionar una respuesta autónoma verdadera y las infecciones relacionadas con los dispositivos11.
Métodos
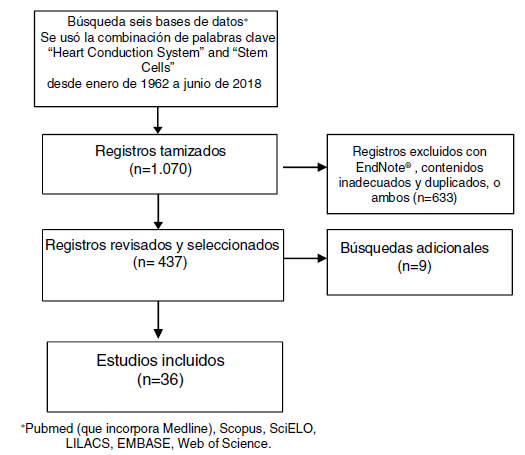
Búsqueda sistemática de la literatura acerca de las células madre y su uso en el sistema cardionector (fig. 1).
Resultados
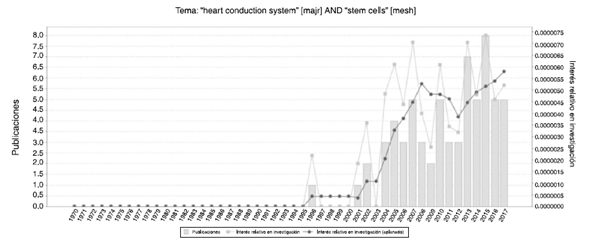
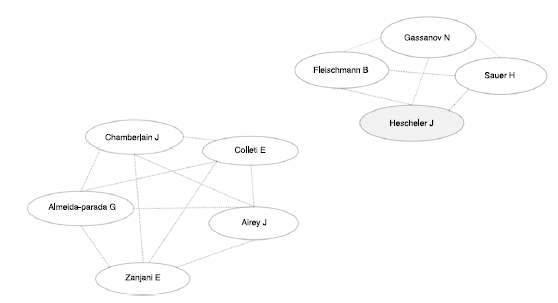
De acuerdo con una búsqueda realizada en mayo de 2018 en GoPubmed el número de publicaciones se ha ido incrementando año tras año (fig. 2) y los países donde más se realizan investigaciones acerca de las células madre y el sistema cardionector, son Estados Unidos, Alemania, China, Israel, Japón, entre otros, y el autor con mayor número de artículos en el tema es Hescheler (fig. 3).
El sistema de conducción cardíaca
Es una forma amplia de referirse a una colección de diferentes tejidos musculares especializados dentro del corazón, encargados de coordinar la tasa y el ritmo de las contracciones del músculo cardíaco.
El sistema de conducción cardiaca se puede dividir desde el punto de vista fisiológico en: a) nodos de conducción lenta, que incluyen el nodo sinoauricular y el nodo aurículo-ventricular y b) el sistema de conducción ventricular de conducción rápida, que incluye el haz aurículo-ventricular, las ramas del haz derecho e izquierdo y la red de fibras de Purkinje. El nodo sinoauricular es el marcapasos dominante del corazón y controla su tasa de contracción. Desde el punto de vista anatómico, está ubicado en la unión de la aurícula derecha y la vena cava superior, cerca de la cresta terminal12.
Gracias a las investigaciones sobre el desarrollo del sistema de conducción cardiaca, los factores identificados se han implementado para dirigir la diferenciación de células madre hacia los destinos de las células del sistema de conducción cardiaca o para imponer propiedades parecidas a las de los marcapasos en las células cardíacas o no cardíacas12.
Nodo sinoauricular adulto
Es una estructura en forma de coma, de 2 a 3 cm de longitud, situada en la unión de la vena cava superior y la aurícula derecha, cuya función es generar los impulsos eléctricos cardíacos13.
Para replicar la funcionalidad del nodo sinoauricular es importante tener en cuenta su heterogeneidad, lo cual convierte en un reto el desarrollo de una población celular homogénea, que, junto con las conexiones al tejido auricular circundante, constituye un punto crítico para el comportamiento sincitial del nodo sinoauricular in vivo. Adicionalmente, hay diferencias en la región nodal en cuanto al tamaño de las células, la densidad de las corrientes iónicas, la expresión de la conexina (Cx) y otros marcadores moleculares que pueden afectar la función14. El desarrollo del sistema de conducción cardiaca involucra redes complejas que actúan según su estadio, tejido y dosis-dependencia, y los hallazgos recientes indican que la actividad de estas redes es sensible a variantes genéticas comunes asociadas con arritmias cardíacas15.
Origen del desarrollo del nodo sinoauricular
En 1882 Gaskell propuso su teoría acerca del origen miogénico del latido del corazón y además identificó el nódulo sinusal como la región desde la cual comienzan las contracciones y se propagan al nodo aurículo-ventricular y luego al ventrículo14.
Arthur Keith fue el primero en identificar una estructura en el corazón humano, hoy en día conocida como nodo sinoauricular, y cambió el enfoque a este “remanente notable de fibras primitivas que persisten en la unión sinoauricular”, el cual se demostró corresponde a la ubicación de la excitación cardíaca inicial.
Una perspectiva integral de las células que conforman el sistema cardionector desde su origen embrionario brinda mayor claridad de aspectos importantes empleados en la medicina regenerativa utilizada en la práctica clínica, que constituye abordajes terapéuticos para el manejo de enfermedades como las arritmias cardiacas16.
El nodo sinoauricular contiene aproximadamente 10.000 células marcapaso especializadas y se requirieron varias décadas de investigación básica en los mecanismos electrofisiológicos implicados en la automaticidad de las células marcapaso, hecho que finalmente trajo como resultado la identificación y clonación de las estructuras moleculares de las corrientes iónicas de las células marcapaso críticas. Existe una línea de investigación en curso cuyo objetivo es transformar las áreas normalmente inactivas del corazón en marcapasos biológicos basados en que se cuenta con la capacidad de introducir material genético exógeno en células humanas in vitro e in vivo13.
Cada latido del corazón es el resultado del impulso eléctrico generado por un estímulo de las células marcapaso gracias a que exhiben automaticidad. Los componentes críticos de la maquinaria eléctrica en las células marcapaso incluyen el intercambiador de sodio-calcio, los canales de calcio regulados por voltaje, los canales de iones cíclicos activados por nucleótidos activados por hiperpolarización (por su sigla en inglés “Hcn”) y la liberación espontánea de calcio del retículo sarcoplasmático. Los Hcn y otros canales median la respuesta autónoma a través de su sensibilidad a los cambios en el adenosín monofosfato (AMP) cíclico causado por el estímulo vagal y simpático directo. De los canales tipo Hcn, el Hcn4 es el más expresado en las células marcapaso y cuando está mutado produce bradicardia sinusal familiar13.
Tipos de marcapasos biológico
Marcapasos biológico genético: los tres enfoques iniciales consistieron en: sobreexpresión de los receptores ß-adrenérgicos, regulación negativa de la corriente hiperpolarizante externa IK1 y sobreexpresión de la corriente despolarizante interna17.
Marcapasos biológico basado en células madre: las estrategias para su construcción involucran la inyección de un grupo de células no excitables que expresan una corriente interna que despolariza las células contiguas a su umbral de potencial de acción o la inyección de un grupo de células excitables con la capacidad de generar potenciales de acción espontáneos. En el primer caso se requieren al menos dos células (donante + huésped) para crear una unidad de estimulación; en este último, las células administradas son los marcapasos biológicos. Ambas estrategias suponen que la integración de las células liberadas se producirá mediante la formación de uniones estrechas entre las propias células del donante y las células diana17.
Actualmente, en la medicina regenerativa cardíaca se explotan dos categorías principales de células madre (CM): a) CM adultas multipotentes y b) CM embrionarias pluripotentes (CMEP) y CM pluripotentes inducidas (CMPi), en las que se exploran derivados diferenciados para trasplante o las células se diferencian in situ después del trasplante. Como potencial terapéutico, ambos grupos tienen ciertas ventajas y desventajas5.
Para la reparación y regeneración del corazón se ha propuesto la terapia con células madre; sin embargo, se desconocen los mecanismos exactos de reparación cardíaca por células trasplantadas. Existen dos hipótesis principales: a) diferenciación cardiomiogénica / vasculogénica directa, y b) estimulación indirecta de la respuesta reparadora a través de efectos paracrinos. Se están evaluando diferentes tipos de células respecto a su potencial regenerativo18.
Los principales desafíos de la terapia celular, independientemente del tipo de célula, siguen siendo la pobre retención del total de células y el alto grado de muerte celular después del trasplante. Por esta razón es probable que nunca se aproveche todo el potencial de la terapia celular hasta que se superen estos problemas18.
Puede decirse que somos el resultado de las células madre embrionarias humanas dentro del blastocito y estas nos mantienen jóvenes al repararnos endógenamente según las necesidades. Fueron los trabajos pioneros de Wilmut et al. y Thomson et al. acerca de la clonación y la identificación de células madre embrionarias humanas los que iniciaron una nueva era para la investigación en biología molecular de células madre que conduce al potencial terapéutico19.
Células madre pluripotentes inducidas y su uso potencial en arritmias
El síndrome de QT largo (SQTL) ha sido uno de los primeros modelos de enfermedad basado en CMPi, en el que la prolongación del período de despolarización se asocia con mayor riesgo de arritmias ventriculares letales. Al respecto se tienen estudios basados en CMPi de las variantes genéticas LQTS1, LQTS2 y LQTS320.
Para el tratamiento de la disfunción del nódulo sinusal hay optimismo por investigaciones recientes sobre el uso del trasplante celular y transferencia de genes. Sin embargo, ni la transferencia génica ni el trasplante celular en esta etapa pueden recapitular la función normal de los nodos sinusales nativos, a excepción de ser un paliativo en el síndrome del seno enfermo. Por otra parte, todavía se necesita avanzar en asuntos como la transitoriedad en la expresión transgénica y la relocalización celular trasplantada. En respuesta a esta necesidad ha surgido el marcapasos cardíaco de ingeniería tisular (MCIT), el cual ha evitado efectivamente los problemas anteriores. Los MCIT como tejidos de latido espontáneo pueden fabricarse sembrando células marcapasos en andamios apropiados in vitro21.
No obstante, el desarrollo de la ingeniería tisular se ha visto retrasado por la falta de una vasculatura eficiente de los tejidos modificados. Es así como recientemente se investigó la vascularización del MCIT mediante el cocultivo con células progenitoras endoteliales (CPE) lo cual puede ayudar a resolver el cuello de botella de la ingeniería de tejidos para mejorar el suministro de oxígeno y la nutrición en todos los tejidos de ingeniería. El MCIT puede tener el potencial de actuar como marcapasos biológicos prácticos en la terapia de la arritmia o el síndrome del seno enfermo21.
Vale la pena destacar que hoy día, para la transformación biológica de células marcapaso, las células madre mesenquimales óseas parecen ser las células madre óptimas. En cuanto a la formación del nódulo sinoauricular es esencial el factor de transcripción específico para el corazón, la proteína T-Box 18 (TBX18), particularmente la formación de la zona que genera los impulsos eléctricos que inducen la contracción cardíaca situada en la cabeza nodal. Por esta razón, representa una posible alternativa terapéutica a los dispositivos electrónicos. No obstante, se debe evaluar su seguridad por medio de su aplicación a largo plazo en animales grandes antes de su uso en pacientes con disfunción sinusal22.
Los avances recientes en las técnicas de investigación relacionadas con la biología molecular, la investigación con células madre y la ingeniería de tejidos han generado nuevos métodos terapéuticos para una variedad de trastornos cardiovasculares. Adicionalmente, se están desarrollando nuevos métodos de reparación y tratamiento miocárdico de una variedad de enfermedades cardiovasculares gracias a las terapias basadas en células y genes23.
Estudios de prueba de concepto
De tiempo atrás con el propósito de mejorar la automaticidad cardiaca se vienen abordando diferentes enfoques biológicos. El objetivo común es generar una región ectópica de automaticidad en el corazón que pueda funcionar como un sustituto del nódulo sinoauricular. Para tal fin se vienen desarrollando investigaciones con enfoques basados en genes y también en células para generar marcapasos biológicos11.
Estudios clínicos
Desde el punto de vista de algunos hitos en la historia de la medicina de las células madre, la reparación de tejidos que utiliza principios de cultivo celular existe desde finales de la década de 1930 y el uso clínico de células madre derivadas de médula ósea o hematopoyéticas para el tratamiento de trastornos hematológicos existe desde fines de la década de 195024. Sin embargo, en lo relativo a la investigación en cardiología, un paradigma en los tratamientos para la enfermedad cardiovascular se debe al punto de vista de que el corazón es un órgano terminalmente diferenciado con poca o ninguna capacidad regenerativa. Este paradigma cambió después de la identificación de una pequeña población residente de células madre cardiacas multipotentes, redefiniendo al corazón como un órgano con la capacidad de autorrenovación. Ahora se entiende que, aunque son células diferenciadas terminalmente, hay un recambio de cardiomiocitos del 1 al 2% por año en la edad adulta25.
Desde los primeros ensayos en humanos, hasta grandes ensayos clínicos multicéntricos, las lecciones de más de 200 ensayos clínicos y de alrededor de 50 metaanálisis han dado forma a la comprensión de cómo las células madre pueden mejorar la función cardíaca y han guiado la búsqueda del enfoque más eficaz. Sin embargo, a pesar de dos décadas de arduo trabajo, la transición desde la investigación a la práctica clínica todavía es controversial25.
La terapia celular para promover la regeneración y reparación cardíaca es segura y potencialmente prometedora según la investigación actual; no obstante, hasta la fecha no se ha realizado ningún ensayo con suficiente poder estadístico para demostrar la eficacia de la terapia celular para reducir la mortalidad, pero sí se han investigado múltiples tipos de células para una variedad de afecciones cardíacas (insuficiencia cardiaca, angina refractaria, infarto agudo de miocardio, miocardiopatía isquémica crónica, cardiopatía dilatada no isquémica), y se han aprendido importantes lecciones sobre el diseño de ensayos. Esta experiencia está guiando la primera cohorte de ensayos en curso de fase III en estas enfermedades25 y actualmente se están realizando estudios clínicos en la Universidad de Johns Hopkins con células madre para el tratamiento de las arritmias cardiacas hereditarias en humanos, como se menciona en el identificador NCT02413450 en la base de datos clinicaltrials.gov.
Discusión
En los últimos diez años la terapia basada en células madre ha ganado una atención creciente, enfocada principalmente en la reparación cardíaca después de un infarto de miocardio. Una revisión de 2012, que agrupó 50 estudios que incluyeron 2.625 pacientes con cardiopatía isquémica, demostró una mejoría significativa a largo plazo en los parámetros cardíacos (fracción de eyección ventricular izquierda, tamaño del infarto, diámetro diastólico final y diámetro sistólico final) y una posible disminución de la mortalidad cardíaca en pacientes tratados con células madre derivadas de la médula ósea. Por otra parte, la terapia basada en células madre para el tratamiento de arritmias o trastornos de la conducción todavía está en sus inicios y nunca se ha probado en humanos. Varios estudios realizados in vitro y en grandes modelos animales han proporcionado pruebas de que, tanto las terapias basadas en genes, como las basadas en células, son plataformas eficaces para crear un marcapasos biológico. No obstante, ninguna de estas estrategias ha cumplido con los altos requisitos de seguridad y calidad necesarios para la traducción clínica17.
Con base en la información anterior puede decirse que si los enfoques actuales para la estimulación biológica exhiben éxito a largo plazo en modelos animales relevantes, quedan obstáculos significativos antes de que esta tecnología pueda ser ampliamente adoptada para tratar pacientes con bradicardia sintomática. Varios de estos obstáculos han sido materia de debate actual, incluido el desarrollo de mejores métodos de administración de genes y células para áreas objetivo, así como la posibilidad de efectos proarrítmicos de marcapasos biológicos y efectos no deseados u oncogénicos de terapias basadas en células madre y factores de transcripción. Además, puede haber factores genéticos que predisponen a los pacientes, especialmente a los más jóvenes, a la disfunción de las células marcapaso. En tales casos la reprogramación con las propias células del paciente podría traducirse en células marcapaso disfuncionales y resultados subóptimos.
Si bien es cierto que todas estas nuevas tecnologías lucen prometedoras, el mayor obstáculo que enfrentan será definir su nicho clínico. Los pacientes con enfermedad del sistema de conducción suelen estar bien atendidos por marcapasos electrónicos, por lo que un marcapasos biológico tendría que cumplir con un alto estándar de rendimiento para suplantar la tecnología existente.
En todo caso ya se visualizan algunas funciones clínicas importantes para la estimulación biológica. Por ejemplo, hay pacientes que requieren la eliminación de la maquinaria del marcapasos del cuerpo para someterse a un intervalo sin dispositivo, como aquellos con infecciones endovasculares activas para antibioticoterapia. Otro caso tiene que ver con los pacientes que requieren procedimientos asociados con una morbilidad significativa, como los ocasionados por marcapasos transvenosos temporales (el nivel de cuidado actual), en los que una tecnología como la reprogramación somática basada en Tbx18 podría proporcionar estimulación de respaldo temporal durante intervalos libres del dispositivo. Existe otra aplicación clínica potencial en niños con bradicardia severa que enfrentan una vida con maquinaria permanente, cambios de batería y revisiones de los cables, para quienes un marcapasos biológico autosostenible que proporcione estimulación fisiológica a largo plazo sería transformador13. Sin olvidar que si bien los resultados de la sobreexpresión viral de Tbx18 son interesantes y altamente alentadores para el objetivo de desarrollar un marcapasos biológico, ahora hay evidencia de que podría haber riesgo de enfermedades cardíacas como resultado de la expresión ectópica de Tbx1826.
Los recientes avances en la reprogramación celular pueden ofrecer nuevas oportunidades para el nódulo sinoauricular inducido (NSAi) que pueden llevar a cabo dispositivos electrónicos de maneras clínicamente importantes, incluida la capacidad de acoplarse con el sistema nervioso autónomo del paciente. Así tenemos que tratar el bloqueo AV y el bloqueo infrahisiano también puede ser factible utilizando enfoques biológicos:
Bloqueo AV: en el futuro podrían desarrollarse células de reprogramación de la vía AV lenta, que tienen una entrada separada al haz de His, para aumentar la automaticidad.
Bloqueo infrahisiano: podría considerarse la reprogramación de miocitos ventriculares a un fenotipo de conducción rápida o estrategias para trasplantar tractos de conducción eléctrica diseñados. Las pruebas de enfoques más nuevos requerirán un diseño cuidadoso de modelos experimentales que recapitulen de cerca una fisiopatología clínica bien descrita y utilicen una terapia biológica dirigida, mínimamente invasiva y permanente27.
Algunos ejemplos de estrategias celulares y genéticas empleadas en la regeneración cardíaca son:
Células madre mesenquimales (CMM): son una de las más atractivas y pueden aislarse fácilmente de diferentes tejidos, incluidos la médula ósea, la sangre periférica, el cordón umbilical y el tejido adiposo; por ejemplo, las células derivadas de tejido adiposo marrón se diferencian de las células del sistema de conducción cardiaca y son similares a las células marcapaso in vitro e in vivo28.
Gen Shox2: su aplicación clínica en el campo de los marcapasos biológicos de seguro fomentará ideas sobre nuevos métodos terapéuticos29,30.
Otras estrategias, como células genéticamente modificadas para expresar canales Na + , podrían ser útiles para el desarrollo de estrategias terapéuticas tanto para bradiarritmias como para taquiarritmias31.
Requisitos y desafíos para su aplicación clínica
Mientras que el marcapasos electrónico es solo un paliativo, la anhelada posibilidad de una “cura” se basa actualmente en el potencial para la expresión duradera de los genes transfectados en las células madre mesenquimales humanas y la actividad espontánea en las células madre pluripotentes diferenciadas por un linaje cardíaco. La terapia basada en genes ha sido una prueba maravillosa de principios y demostró que la manipulación genética basada en la comprensión de los fundamentos biofísicos de la actividad de los marcapasos y ha sido una estrategia eficaz para construir bloques; sin embargo, para competir con los dispositivos electrónicos, los marcapasos biológicos tendrán que cumplir estándares de seguridad y calidad más altos que los que se han logrado hasta ahora (tabla 2)17.
Tabla 2 Requisitos mínimos de los marcapasos biológicos para ensayos clínicos

Adaptada de: Chauveau S.17
Luego de revisar la literatura actual se plantean las siguientes limitaciones a manera de interrogantes, pues un desarrollo completo de esta tecnología podría revertir la patología subyacente de la enfermedad del sistema de conducción. Por ejemplo, en pacientes con disfunción incipiente del nodo sinusal, ¿sería posible entregar factores de reprogramación directamente a las áreas afectadas en el nodo sinoauricular, bloquear la pérdida de células madre relacionada con la enfermedad y restablecer la correspondencia entre el origen y el receptor? ¿Se podría rejuvenecer un nodo sinoauricular enfermo y retrasar o prevenir la necesidad de un marcapasos electrónico? Se espera que futuras investigaciones aborden estas preguntas. De superar los desafíos ya delineados esta terapia constituiría un verdadero cambio de paradigma en el tratamiento de la bradicardia13,32-34.
Conclusiones
Han transcurrido más de veinte años desde que se realizó el primer experimento de trasplante de células para la regeneración cardíaca. Desde entonces, se han concebido y comenzado varios ensayos clínicos. Sin embargo, es difícil emitir conclusiones porque la mayoría de ensayos aún se encuentran en las fases iniciales. Los marcapasos biológicos modifican los miocitos “no marcapasos” para proporcionar automaticidad mediante tecnologías de terapia génica, o agregan sincitios de marcapasos al corazón a través de terapias con células madre adultas o embrionarias. Los marcapasos biológicos se hallan en las primeras etapas de desarrollo y los desafíos actuales incluyen dificultad para garantizar el injerto a largo plazo y el potencial de proarritmias.