Introducción
La prevalencia de las cardiopatías congénitas en Bogotá es de 15.1 por 10.000 nacidos vivos según un estudio realizado en el periodo entre 2001 y 2014, el cual mostró valores superiores durante los últimos 3 años de seguimiento (20 por 10.000 nacidos vivos). En total, el 2.03% de los nacimientos tuvieron algún tipo de malformación y el 12.07% corresponden a cardiopatías complejas1.
El doble tracto de salida del ventrículo derecho (DSVD) es una cardiopatía de origen conal que se define como una conexión ventriculoarterial en la cual las grandes arterias emergen totalmente o de manera predominante del ventrículo anatómicamente derecho2. La coexistencia de DSVD, comunicación interventricular (CIV) no relacionada y malposición de grandes vasos es infrecuente; produce una alteración en la fisiología cardiaca usual y supone un desafío quirúrgico y clínico. El objetivo de este reporte es mostrar el abordaje terapéutico de un caso de cardiopatía congénita atípica sin alteración genética aparente que fue llevado a un cerclaje pulmonar con el fin de restablecer una fisiología cardiaca compatible con la vida.
Caso clínico
Prequirúrgico
Paciente de 4 meses, perteneciente a una comunidad indígena colombiana, fruto de primera gestación de binomio sin relación consanguínea aparente, con escasos controles prenatales y parto domiciliario. Cuenta con familiares en segundo grado de consanguinidad con cardiopatía no clara, en quienes se ha hecho necesaria intervención quirúrgica.
Acude a los 3 meses de edad a un centro de atención primaria con cuadro respiratorio agudo, donde se documenta un soplo holosistólico IV/VI y se le realiza un ecocardiograma que reporta cardiopatía compleja. Por lo anterior, se remite a una institución de cuarto nivel donde se inicia antibioticoterapia y soporte nutricional por desnutrición grave asociada. Se realiza un ecocardiograma que evidencia situs solitus en dextrocardia, doble salida del ventrículo derecho con vasos malpuestos, con comunicación interventricular (CIV) del tracto de entrada grande de 8 mm no relacionada, ventrículo derecho hipoplásico con overriding de la tricúspide, hipertensión pulmonar grave, cavidades izquierdas dilatadas con signos de sobrecarga de volumen y función ventricular izquierda conservada (fracción de eyección del 70%) (Fig. 1).
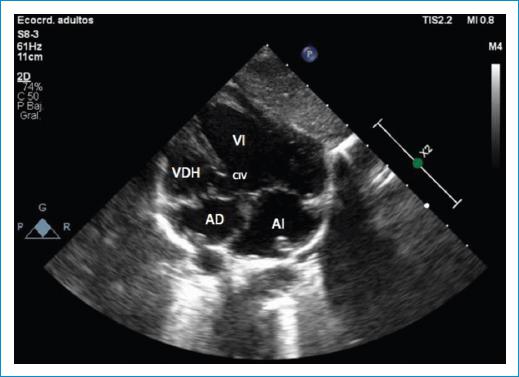
Figura 1 Dextrocardia con situs solitus asociado a ventrículo derecho hipoplásico con una comunicación interventricular (CIV) no relacionada y primordial de la válvula tricúspide. AD: aurícula derecha; AI: aurícula izquierda; VDH: ventrículo derecho hipoplásico; VI: ventrículo izquierdo.
Ante este hallazgo y la necesidad de medir variables hemodinámicas, se realiza cateterismo cardiaco que evidencia fisiología univentricular de hiperflujo sin estenosis pulmonar, hipertensión pulmonar grave hipercinética 3 unidades Wood y resistencias pulmonares móviles y bajas al test de hiperoxia (Figs. 2-3). Adicionalmente muestra el seno coronario drenando solo a vena vertical e innominada. Por lo anterior, se consideró que el paciente no era candidato a cirugía correctora biventricular y se decide llevar a una primera aproximación quirúrgica con cerclaje de la arteria pulmonar.
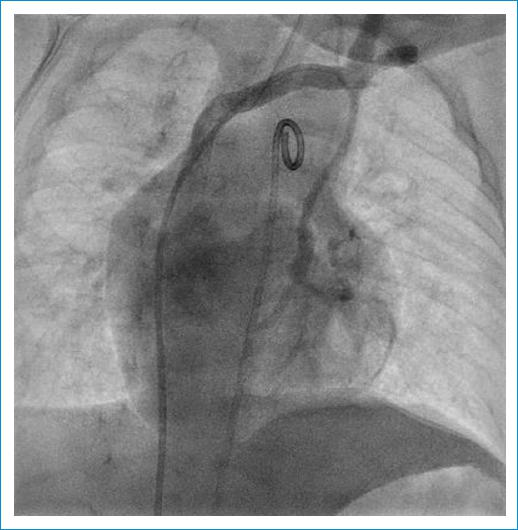
Figura 2 Cateterismo cardiaco que evidencia una vía venosa llegando a la vena cava superior izquierda que se conecta con el seno coronario, el cual termina en fondo ciego, por lo que drena retrógradamente por la vena cava superior izquierda a una vena innominada.
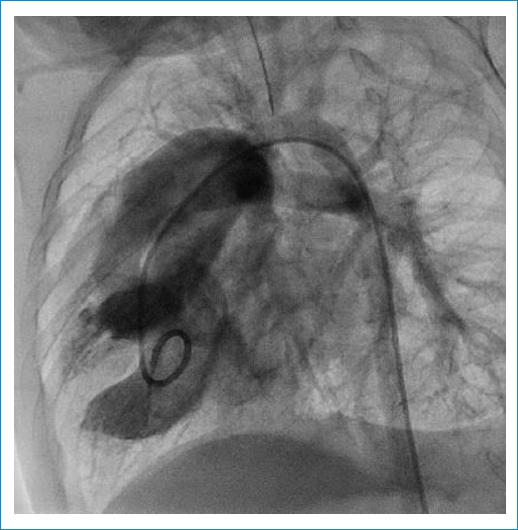
Figura 3 Cateterismo cardiaco que evidencia un ventrículo posterior e inferior de morfología izquierda y cámara rudimentaria anterior y superior de morfología derecha, donde emergen los vasos, estando la pulmonar derecha marcadamente dilatada y la aorta izquierda y anterior.
Fue valorado por el servicio de genética médica, quienes encontraron en la exploración física múltiples anomalías menores, como turricefalia, telecanto, lóbulos auriculares adheridos, antihélix prominente, cuello corto, retrognatia e hipertelorismo mamario. Por lo anterior, se solicita un cariotipo con bandeo G, cuyo resultado es normal.
Intraquirúrgico
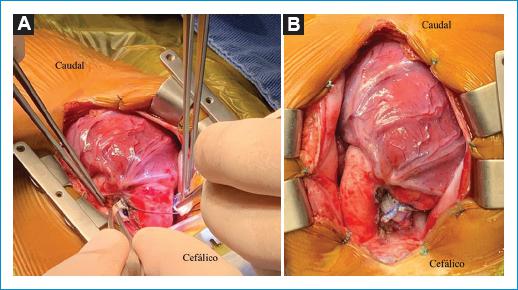
El paciente fue llevado a cirugía y se encontró el tronco de la arteria pulmonar de ubicación derecha y posterior, y se midió de forma directa una presión pulmonar prebandeo de 58/14 mmHg. Se realizó cerclaje con una banda de un segmento de un injerto de dacrón de 8 mm, con la cual se hicieron múltiples pruebas progresivas de oclusión con hemoclips hasta lograr un aumento de 10 mmHg de la presión sistólica y una reducción del 15% de la saturación de oxígeno. Se repitió la medición directa de la presión pulmonar posbandeo, que fue de 33/13 mmHg, y se fijó el segmento de injerto con puntos separados de monofilamento no absorbible 6-0 (Fig. 4). Se terminó el procedimiento sin complicaciones y el paciente fue llevado a la unidad de cuidado intensivo pediátrico.
Posquirúrgico
El paciente continúa con ventilación mecánica, con saturaciones entre el 75% y el 85%, y bajo sedoanalgesia para disminuir el consumo de oxígeno (VO2). Durante el posoperatorio cursó con episodios de desaturación, hipotensión e hipoperfusión relacionadas al despertar sugestivas de crisis de hipertensión pulmonar, por lo que se inició soporte inotrópico, vasopresor, balanceo de circulación y transfusión de glóbulos rojos debido a anemia (hemoglobina: 8.9), con lo que presentó una mejoría de su estado hemodinámico. Posteriormente el paciente tolera el descenso progresivo de la fracción inspiratoria de oxígeno en el aire inspirado (FiO2) y se intenta realizar la extubación, pero no la tolera por crisis de hipertensión pulmonar asociada a bradicardia y pobre esfuerzo respiratorio, por lo que requiere nuevamente soporte ventilatorio invasivo. Se realizó un ecocardiograma (Fig. 5) que reportó disfunción sistólica con fracción de eyección del 50% y un gradiente a través del bandeo protector de 40 mmHg, ante lo cual se instauró manejo antifalla con enalapril y furosemida. El paciente presenta una evolución clínica favorable y se realiza extubación programada, manteniendo las saturaciones de oxígeno esperadas por su patología con cánula nasal de alto flujo y luego con cánula nasal convencional, con adecuada tolerancia a la suspensión de soportes, por lo que es trasladado a hospitalización en piso.
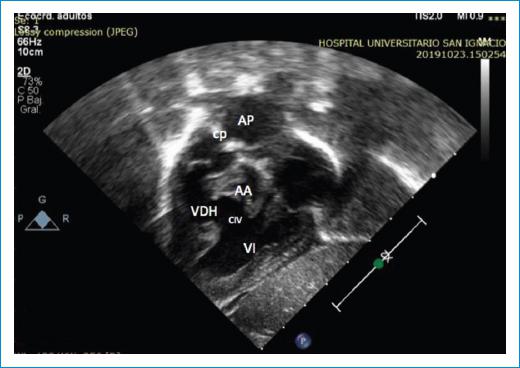
Figura 5 Doble tracto de salida del ventrículo derecho hipoplásico; adicionalmente, se evidencia el cerclaje de la arteria pulmonar. AA: arteria aorta; AP: arteria pulmonar; CIV: comunicación interventricular; cp: cerclaje de la arteria pulmonar; VDH: ventrículo derecho hipoplásico; VI: ventrículo izquierdo.
Durante su estancia se indicó manejo conjunto con nutrición, fonoaudiología, psicología y terapia física y ocupacional, con el fin de brindar una rehabilitación integral del paciente crítico. Además, trabajo social inició los trámites administrativos de remisión a una institución de salud para continuar el manejo intrahospitalario cerca de su lugar de procedencia. El paciente cursó con aumento del esfuerzo respiratorio secundario a sobrecarga hídrica, por lo que se decidió ajustar la dosis de furosemida, con posterior resolución. Finalmente, el paciente presentó una evolución hacia la mejoría hasta que se logró la remisión al hospital en su lugar de origen. Se dio egreso con manejo antifalla, profilaxis antibiótica para endocarditis y analgesia. También se entregaron órdenes para cita de control con cardiología pediátrica y cirugía cardiovascular. Se estableció un plan de controles en su lugar de origen y una vez complete el periodo estimado para un segundo tiempo quirúrgico (cirugía de Glenn) se ordenó remitir.
Discusión
El DSVD representa un complejo espectro de polimorfismos anatómicos con distintas manifestaciones clínicas y abordajes quirúrgicos. Existen diversas clasificaciones, pero la más utilizada es la descrita por Lev, et al.3, que consta de cuatro tipos de acuerdo con el defecto del tabique ventricular en relación con las grandes arterias.
El primer tipo es el DSVD con CIV subaórtica, que es el más frecuente y se presenta hasta en un 50% de los casos2. Puede comportarse como una fisiología de CIV aislada, en caso de no tener obstrucción del tracto de salida pulmonar, o con una fisiología de tetralogía de Fallot en caso de tenerla. El segundo tipo es el DSVD con CIV subpulmonar, también llamado malformación de Taussig-Bing cuando no tiene obstrucción del tracto de salida pulmonar2, el cual se reporta hasta en un 30% en las series quirúrgicas de DSVD4 y presenta una fisiología de transposición de grandes vasos, ya que la posición de la CIV favorece el flujo del ventrículo izquierdo hacia la circulación pulmonar. El tercer tipo es el DSVD con CIV doblemente relacionada, en la que el defecto del tabique se encuentra superior a la trabécula septomarginal y debajo de las valvas semilunares2. Ocurre hasta en un 10% de los pacientes con DSVD y debido a la ausencia de tabique interventricular la sangre fluirá libremente a las arterias aorta y pulmonar. Por último está el DSVD con CIV no relacionada, que corresponde a un defecto del tabique ventricular inusual, en general posterior, que se encuentra a una distancia considerable de las válvulas pulmonar y aórtica5.
Adicionalmente, el DSVD también se ha clasificado según la relación entre las grandes arterias en tres grupos: grandes arterias ligeramente entrecruzadas, paralelas en el plano frontal (lado a lado) y con aorta anterior y arteria pulmonar posterior; este último grupo tiene a su vez tres variantes anatómicas: aorta anterior derecha con arteria pulmonar posterior izquierda, aorta anterior con pulmonar posterior y aorta anterior izquierda con pulmonar posterior derecha, siendo esta última la malposición de grandes vasos que presenta el paciente descrito, la cual se ha reportado en un 3.3% en las series de casos6.
Por otra parte, la dextrocardia y la hipoplasia del ventrículo derecho son otras alteraciones que se han reportado de forma atípica en algunos casos descritos en la literatura7, que se asocian en este caso a un tipo poco frecuente de DSVD.
Con respecto al manejo, dependiendo de la relación de las grandes arterias, la obstrucción del tracto de salida del ventrículo derecho y la disposición del defecto septal frente a la aorta, se evalúa la posibilidad de crear un túnel intracardiaco protésico para hacer una reparación biventricular. Sin embargo, en algunos casos, como el aquí descrito, la localización de la CIV con respecto a la válvula aórtica imposibilita esta opción, por lo que es necesario recurrir a una fisiología distinta que permita ser compatible con la vida, como puede ser una reparación univentricular con las cirugías de Glenn y Fontan, respectivamente.
La hipertensión pulmonar hipercinética se asocia al DSVD secundario a un hiperflujo pulmonar por la diferencia de resistencias entre las circulaciones pulmonar y sistémica8, lo que puede generar desenlaces negativos en la cirugía de Fontan9. Por esta razón, en el presente caso se optó por un manejo paliativo univentricular iniciando con un cerclaje de arteria pulmonar para limitar el flujo sanguíneo y evitar el desarrollo de una enfermedad vascular y de disfunción ventricular por sobrecarga crónica de volumen, que conllevan pobres resultados quirúrgicos en las cirugías de fisiología univentricular9.
El cerclaje de arteria pulmonar se ha asociado a diversas complicaciones, como tensión insuficiente de la banda que favorece su migración y genera estenosis de las ramas de la arteria pulmonar, sobre todo la derecha porque surge más proximal al tronco arterial y, por tanto, tiene mayor riesgo de obstrucción10. También se ha asociado a erosión del lumen del vaso con posterior dilatación del tronco pulmonar y fragilidad de la pared arterial, predisponiendo a la formación de pseudoaneurismas11. Además, puede generar insuficiencia pulmonar secundaria a la dilatación del anillo pulmonar o a la distorsión de las valvas10. Sin embargo, en este caso fue posible llevar a cabo un tratamiento individualizado de forma exitosa, obteniendo un adecuado gradiente a través del cerclaje que proporcionará al paciente una calidad de vida aceptable hasta que sea llevado a la corrección quirúrgica definitiva12.
Por otro lado, en diversos estudios se ha identificado que alrededor del 30% de los pacientes con cardiopatía congénita presentan un síndrome genético o una asociación con anomalías cardiacas o extracardiacas13. Sin embargo, la coexistencia de múltiples anomalías encontradas en el presente caso no corresponde a un síndrome genético conocido.
La frecuencia del diagnóstico genético en fetos con cardiopatías congénitas graves fue estimada en un estudio reciente en el que, después de excluir los casos con aneuploidías, se logró realizar en un 15.7% de los casos14. En los países desarrollados, el análisis de paneles de genes en el cuidado estándar del feto permite alcanzar estas cifras, pero en nuestro medio, en casos como el presente, el diagnóstico queda incierto por la falta de recursos para realizar estas pruebas. A pesar de contar con un cariotipo normal, hacer un panel de genes habría permitido explorar alteraciones genéticas específicas. Ejemplo de ello es el gen PITX2, conocido como el gen maestro de la lateralidad izquierda presente en la embriogénesis cardiaca. Sus alteraciones han condicionado anomalías de lateralidad como dextrocardia, defectos del tabique ventricular y auricular, doble salida del ventrículo derecho, defectos del tracto de salida como transposición de grandes vasos o estenosis pulmonar, y arritmias cardiacas como la fibrilación auricular. En particular, en un estudio se encontró una sustitución de adenina por guanina en la codificación del nucleótido 441 del gen PITX2c en un paciente con doble salida del ventrículo derecho en combinación con un defecto del tabique ventricular15.
La coexistencia de múltiples malformaciones cardiacas congénitas atípicas que producen una alteración importante en la fisiología cardiaca supone un reto terapéutico por la dificultad que representa el restablecimiento de una fisiología distinta que sea compatible con la vida. Sin embargo, en este paciente se realizó un abordaje individualizado y se logró de forma exitosa un cerclaje de la arteria pulmonar que proporcionará una calidad de vida aceptable hasta que pueda ser llevado a una corrección quirúrgica definitiva. Se presentaron limitaciones importantes en el seguimiento del paciente a largo plazo por ser habitante de un área rural.