Introducción
La resonancia magnética cardiaca (RMC) se ha convertido en una herramienta diagnóstica no invasiva importante en la evaluación de las patologías cardiacas. Esta permite una valoración integral del corazón, siendo el método de referencia en la evaluación de la función de ambos ventrículos; provee información anatómica multiplanar y tridimensional (3D), útil en la evaluación de malformaciones congénitas cardiacas, patología pericárdica y tumoral; y adicionalmente valora la perfusión miocárdica en reposo y con estrés. Uno de los frentes de desarrollo más importantes de la RMC en los últimos años es la caracterización tisular, permitiendo la posibilidad de detectar de manera no invasiva la fibrosis, el edema, la hemorragia y los trastornos infiltrativos y de depósito del miocardio (amiloidosis, enfermedad de Anderson Fabry y hemosiderosis, entre otras), a través de diferentes técnicas como las secuencias de realce tardío (RT) bidimensional (2D) y 3D, las secuencias T2 y el mapeo T1, T2 y T2*. Los avances descritos han permitido un incremento exponencial de las aplicaciones clínicas de la RMC en la actualidad1. En el Global Cardiovascular Magnetic Resonance Registry de la Society for Cardiovascular Magnetic Resonance, en el año 2017, las tres principales indicaciones clínicas para realizar una RMC en 44.486 pacientes fueron la evaluación de isquemia y viabilidad miocárdica en el 32% de los casos, la evaluación de miocardiopatías en el 21% e indicaciones en el campo de la electrofisiología en el 15%2.
El RT se define como el área de incremento de la intensidad de la señal del miocardio en las secuencias T1 con inversión de la recuperación que se adquieren después de 5 minutos de la inyección intravenosa de un medio de contraste basado en gadolinio; este, por su composición molecular, tiene una distribución netamente extracelular bajo condiciones normales. El aumento de la distribución del medio de contraste en determinada área miocárdica acorta el tiempo de relación T1 en esta zona por sus propiedades paramagnéticas, aumentando de esta manera la intensidad de la señal (zona más hiperintensa o más blanca). El aumento de la intensidad de la señal en las secuencias RT se explica por una mayor distribución del medio de contraste en áreas de aumento del espacio extracelular miocárdico en pacientes con fibrosis o con trastornos infiltrativos, o en los procesos agudos (miocarditis o infarto agudo de miocardio) con necrosis miocárdica por una alteración de la integridad de la membrana celular, facilitando el acceso intracelular del medio de contraste con el consecuente aumento de la intensidad de la señal en la zona necrótica. La secuencia de RT es considerada en la actualidad el método de referencia para la detección no invasiva de fibrosis miocárdica en las miocardiopatías, tanto isquémicas3 como no isquémicas4.
La forma convencional para evaluar la fibrosis miocárdica por RMC en las secuencias de RT es con secuencias 2D; también se encuentra disponible la secuencia de RT-3D, la cual permite evaluar todo el corazón con una excelente resolución espacial (resolución isotrópica: 1.4 × 1.4 × 1.4 mm con resonador de 3 Tesla) (Fig. 1), durante la respiración libre del paciente, brindando ventajas importantes, como una disminución en la posibilidad de que zonas del miocardio del ventrículo izquierdo (VI) no sean evaluadas, y poder evaluar ambos ventrículos y ambas aurículas en cualquier plano. Además, la secuencia de RT-3D permite una caracterización precisa del detalle tridimensional de la fibrosis miocárdica del VI, facilitando de esta manera la evaluación del sustrato arritmogénico con mejor desempeño diagnóstico que la secuencia RT-2D de acuerdo con estudios recientes5-7.
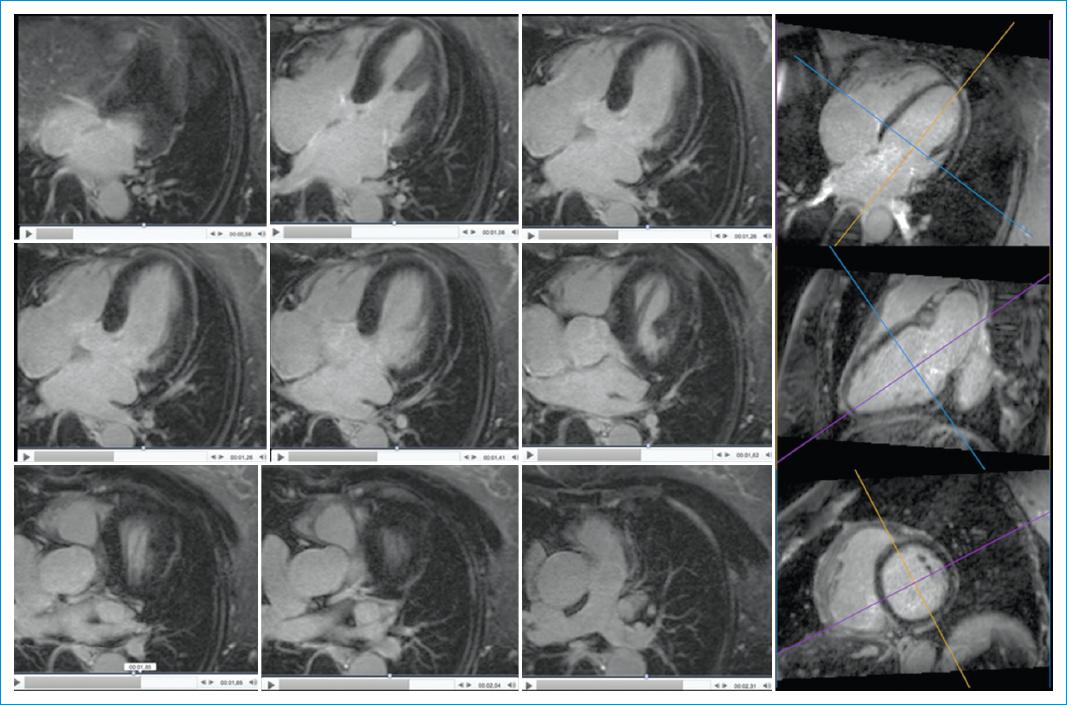
Figura 1 Secuencia de realce tardío 3D (RT-3D) en un individuo sano. Panel izquierdo: nueve imágenes originales de la secuencia RT-3D para resaltar la evaluación completa del corazón, cubriendo la totalidad de los dos ventrículos y las dos aurículas. Se evidencia una excelente resolución espacial que permite evaluar el origen de la arteria coronaria izquierda y el tronco de la arteria pulmonar con sus ramas (tres imágenes inferiores). Panel derecho: reconstrucciones multiplanares realizadas a partir del volumen 3D: longitudinal 4 cámaras (superior), longitudinal 2 cámaras (central) y eje corto (inferior). La secuencia se realiza con respiración libre del paciente y tarda entre 6 y 11 minutos. El miocardio normal es hipointenso (negro) y homogéneo.
El posproceso para evaluar la fibrosis del VI con la secuencia RT-3D se realiza con un programa específico para esta secuencia, denominado ADAS 3D (Galgo Medical S.L., Barcelona, España). Inicialmente se segmenta el miocardio del VI delimitando sus bordes endocárdico y epicárdico con un algoritmo de segmentación semiautomático. Se crean nueve capas concéntricas del miocardio desde el endocardio hasta el epicardio (capas del 10% al 90%). La información de cada capa se proyecta en una matriz utilizando una interpolación trilineal y formando mapas 3D de intensidad de la señal de píxeles, y se asignan colores correspondientes a la intensidad de la señal del miocardio normal, de la fibrosis compacta y de la fibrosis limítrofe/heterogénea. Utilizando los umbrales establecidos en un estudio pionero en este campo realizado por el grupo de electrofisiología del Hospital Clínico de Barcelona, España8, para diferenciar la fibrosis compacta de la zona de fibrosis limítrofe y del tejido miocárdico normal, la zona de fibrosis limítrofe (fibrosis heterogénea) presenta una intensidad de la señal entre el 40% y el 60% de la escala de la intensidad de la señal, la fibrosis compacta entre el 60% y el 100%, y el tejido miocárdico normal entre el 0% y el 40%. La escala de colores es similar a la utilizada en los mapas electroanatómicos de voltaje de los procedimientos electrofisiológicos, de la siguiente manera: color fucsia para el miocardio normal, verde-amarillo para la fibrosis limítrofe (heterogénea) y rojo para la fibrosis compacta (Fig. 2).
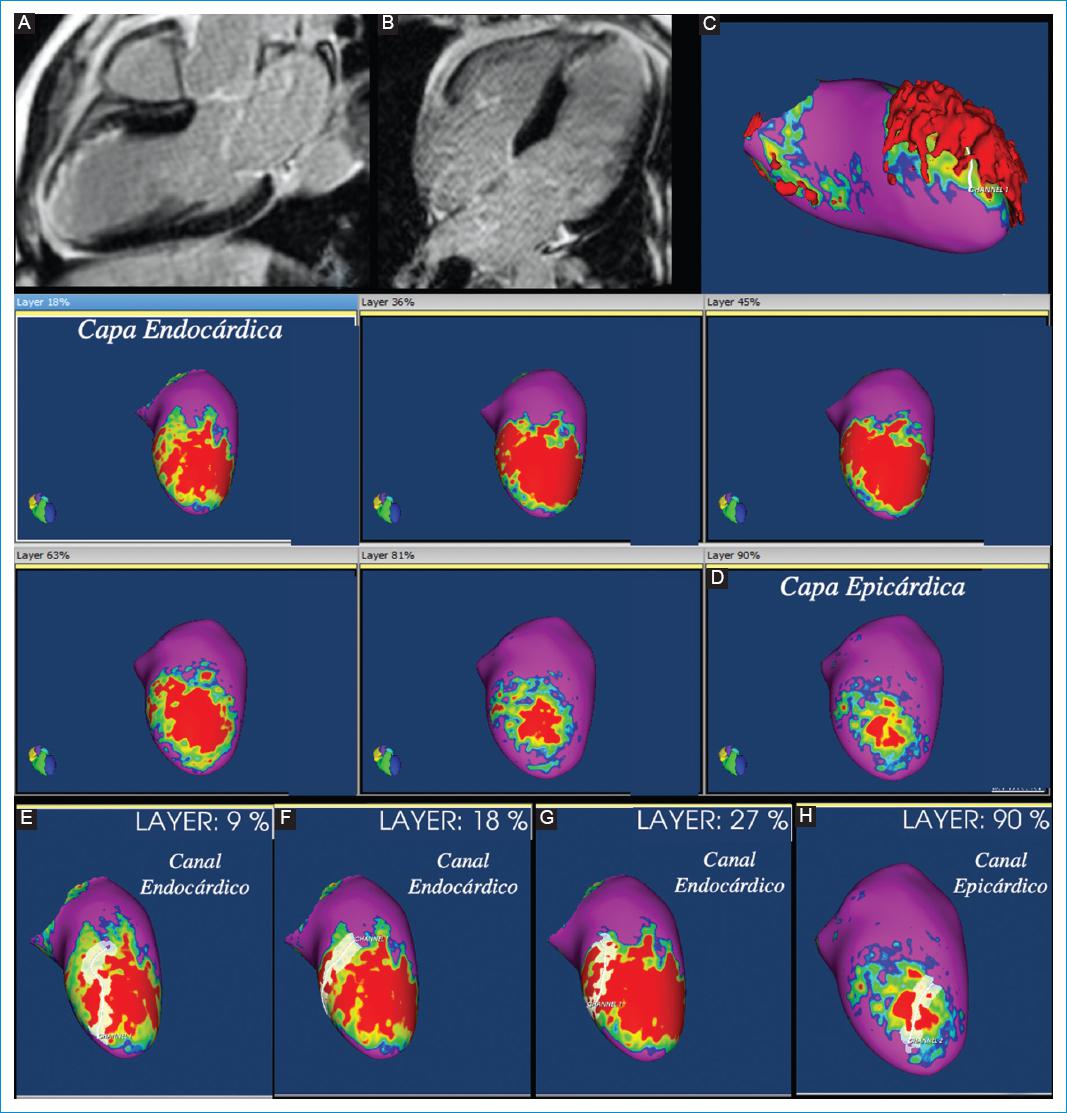
Figura 2 Varón de 60 años con historia de infarto de miocardio y taquicardia ventricular. Imágenes superiores: secuencia de realce tardío (RT) 2D en eje largo. A: 3 cámaras. B: 4 cámaras. Se observa RT con patrón isquémico por infarto de miocardio anteroseptal antiguo en el territorio de la arteria descendente anterior. C: imagen de reconstrucción 3D en proyección lateral del ventrículo izquierdo, donde se resalta la arquitectura 3D de los infartos con configuración piramidal de la fibrosis compacta, definiéndose un mayor compromiso endocárdico que epicárdico. D: mapas 3D de intensidad de la señal de los píxeles producto del posproceso con el software ADAS 3D de la secuencia de RT-3D. Se observan reconstrucciones 3D del ventrículo izquierdo en proyección anterior-superior; cada imagen corresponde a una capa del miocardio, desde la más endocárdica (imagen superior izquierda) hasta la más epicárdica (imagen inferior derecha). Se evidencian extenso infarto de miocardio anteroseptal con fibrosis compacta (en rojo), con fibrosis limítrofe periférica (en color verde-amarillo) y miocardio normal (en fucsia). Se observa mayor extensión de la fibrosis en las capas endocárdicas en comparación con las capas epicárdicas. E-G: capas endocárdica del miocardio. H: capa más epicárdica. En el posproceso con el programa ADAS 3D se detectan los canales de fibrosis limítrofe (CFL) a partir de la secuencia RT-3D como corredores blancos dentro de la fibrosis compacta (en rojo). E-G: se evidencia un CFL complejo endocárdico. H: el paciente también presenta un CFL en la capa más epicárdica.
Utilidad de la secuencia RT-3D en electrofisiología
Guía en la terapia de ablación del ventrículo izquierdo
La ablación del sustrato arritmogénico de la taquicardia ventricular (TV) es un tratamiento efectivo en pacientes con episodios recurrentes de TV dependiente de fibrosis miocárdica9; sin embargo, la recurrencia de la TV después de la ablación sigue siendo alta10 y el procedimiento continúa resultando desafiante y prolongado, a pesar de la tendencia en la última década de basar la ablación en el mapeo en el sustrato arritmogénico como técnica de elección11.
Algunos autores han demostrado que en los pacientes con miocardiopatía isquémica y TV sostenida documentada se identifican con frecuencia con la secuencia de RT-3D de RMC los que se denominan como canales (corredores) de fibrosis limítrofe/heterogénea (CFL), que se correlacionan con canales de bajo voltaje (conducción lenta) en el mapeo electroanatómico de voltaje y que se localizan en el interior de las zonas de fibrosis compacta del infarto de miocardio o entre la fibrosis compacta y el anillo mitral12. Los CFL corresponden a tejido miocárdico heterogéneo que contiene células miocárdicas normales intercaladas con tejido fibrótico no viable y favorecen la formación de circuitos de reentrada, y frecuentemente coinciden con los puntos de origen (istmos) de las TV. Estos CFL suelen presentarse en infartos con gran extensión transmural y en general tienen localización subendocárdica13. Con la secuencia RT-3D y el posproceso con el software ADAS 3D se pueden identificar de manera no invasiva los CFL y su localización en los 17 segmentos y en las capas del miocardio, ya sea endocárdica o epicárdica14.
La localización endocárdica o epicárdica de la fibrosis y de los CFL permite determinar la vía de abordaje (endocárdica, epicárdica o mixta) de los procedimientos de ablación del VI de manera no invasiva, información que tiene un mayor valor práctico en los pacientes con miocardiopatía no isquémica, en quienes la localización de los CFL es más impredecible y con frecuencia tienen localización epicárdica15. En un estudio se reporta que los pacientes con infarto transmural usualmente requieren un abordaje mixto de la ablación, endocárdico y epicárdico, pues tienen una incidencia de un 87.5% de sustrato arritmogénico epicárdico16.
La información y los mapas 3D obtenidos por la secuencia RT-3D de RMC se pueden integrar (importar) a los mapas electrofisiológicos tanto con la plataforma CARTO como con la plataforma ENSITE, y de esta manera los mapas 3D generados por RMC están disponibles durante los procedimientos de ablación y sirven para guiar estos procedimientos en tiempo real, permitiendo al electrofisiólogo enfocar sus esfuerzos de mapeo a las zonas de interés definidas por la RMC (Fig. 3).
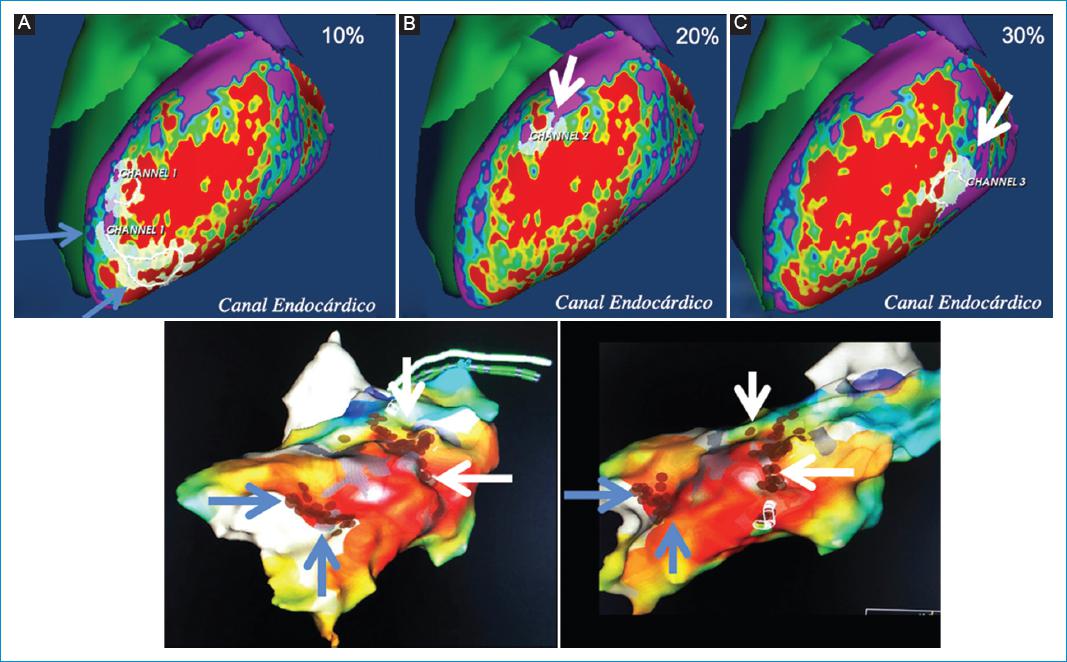
Figura 3 Varón de 65 años con historia de infarto de miocardio y episodios de taquicardia ventricular en monitoreo Holter. Con infarto de miocardio anterolateral antiguo extenso. Panel superior: información de la fibrosis del ventrículo izquierdo con la secuencia de RT-3D. A-C: con mapas 3D en proyecciones laterales. Capas endocárdicas del 10% al 30%, demostrando canales de fibrosis limítrofe (CFL) endocárdicos: uno apical en la pared lateral (flechas azules en A) y dos en la unión de los tercios medio y basal de la pared lateral (flechas blancas en B y C). Panel inferior: mapas electroanatómicos de voltaje endocárdicos en proyecciones laterales. Se observa una excelente correlación en la localización de los CFL detectados por RMC (panel superior) y las líneas de ablación en los mapas electroanatómicos de voltaje endocárdicos (puntos rojos en panel inferior), tanto del CFL apical (flechas azules) como de los CFL de la unión de los tercio basal y medio de la pared lateral (flechas blancas).
Recientemente, algunos autores17,18 han reportado cómo los procedimientos de ablación de TV en los cuales se tuvo en cuenta la información de RT-3D para la planeación requirieron menor energía de radiofrecuencia y mejoraron la sobrevida sin recurrencia de la TV de los pacientes. La precisión de la secuencia RT-3D para la caracterización y la delimitación de la fibrosis en todo el grosor del miocardio13, como también su capacidad para identificar más sustrato arritmogénico (CFL) en comparación con los mapas electroanatómicos de voltaje endocárdicos o epicárdicos utilizados de manera aislada17, sugieren una mejor evolución de los pacientes. Sin embargo, en estos estudios la selección de los puntos de ablación se definió por los hallazgos de los mapas electroanatómicos de voltaje, y no por los mapas de la secuencia de RT-3D de la RMC.
Soto-Iglesias, et al.19 realizaron un estudio para comparar los resultados de la ablación del sustrato arritmogénico del VI en pacientes con TV monomórfica en tres grupos de pacientes. En el primero, la ablación se realizó de la manera convencional sin incluir RMC; en el segundo, la ablación se realizó utilizando los mapas 3D de la secuencia de RT-3D de RMC como ayuda para el procedimiento, pero la selección de los sitios de ablación se definió por el mapa electroanatómico de voltaje; y en el tercer grupo, el procedimiento de ablación fue guiado por completo con los mapas 3D generados de la secuencia de RT-3D de RMC. Estos autores encontraron que la ablación guiada totalmente por los mapas generados en la secuencia de RT-3D de RMC es factible y segura, disminuyendo de manera significativa los tiempos del procedimiento, de fluoroscopia y de radiofrecuencia, y además con un mayor porcentaje de no inducibilidad al terminar los procedimientos y una menor recurrencia de la TV en comparación con los otros dos grupos, lo que sugiere una mejor identificación del sustrato arritmogénico.
La posibilidad que brinda la RMC con secuencia de RT-3D de evaluar las arterias coronarias proximales en un 76% de los pacientes, de acuerdo con Zuluaga, et al.20, pudiera ayudar a definir la relación de las áreas de fibrosis epicárdica con el trayecto de las arterias coronarias proximales de manera no invasiva, sin necesidad de realizar una angiotomografía coronaria contrastada adicional y brindando información importante para definir la viabilidad del abordaje epicárdico de la ablación, principalmente en áreas de difícil acceso, como por ejemplo el summit ventricular izquierdo (Fig. 4).
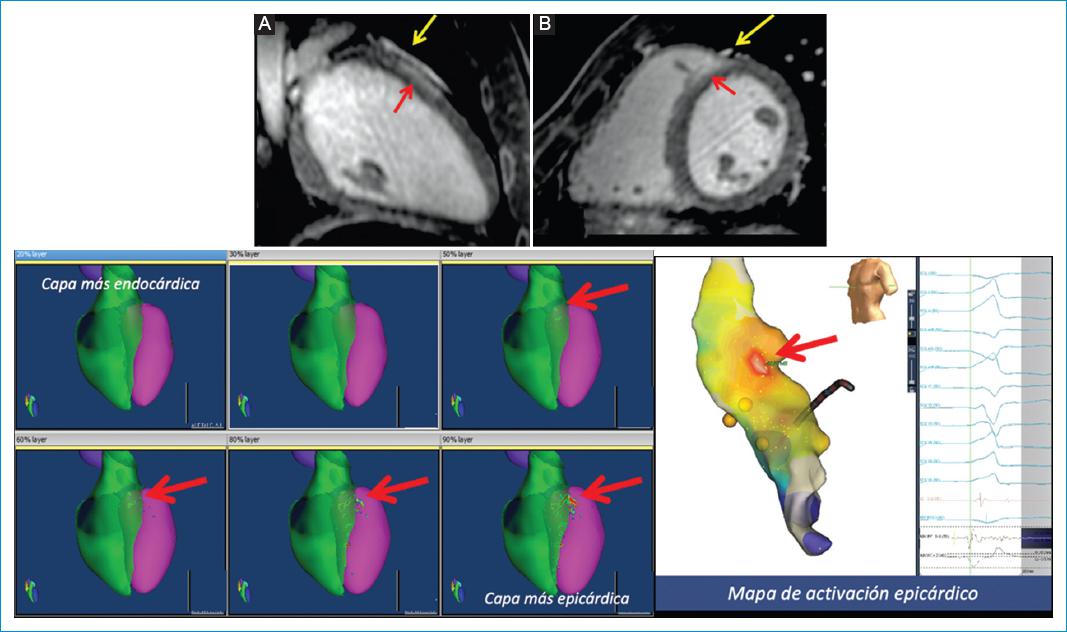
Figura 4 Joven de 16 años con episodios repetidos de taquicardia ventricular con el ejercicio, asociados a síncope. Panel superior: reconstrucciones multiplanares obtenidas de la secuencia de RT-3D, A: longitudinal sagital del ventrículo izquierdo siguiendo el trayecto de la arteria descendente anterior. B: eje corto. Panel inferior: a la izquierda, mapas 3D de intensidad de la señal de los píxeles (mapas 3D PSI) proyecciones anterosuperiores e imagen, y a la derecha, mapa de activación epicárdica del mismo paciente en proyección anterosuperior. En la secuencia de RT-3D, tanto en las reconstrucciones multiplanares como en los mapas 3D PSI, se identifica un foco de fibrosis epicárdica localizada a nivel de la pared anteroseptal basal (flechas rojas) inmediatamente subyacente al trayecto proximal de la arteria descendente anterior en el summit del ventrículo izquierdo. Se evidencia la muy buena correlación de la localización del foco de fibrosis epicárdica de la pared anteroseptal basal por RMC y el istmo (sitio de origen) de la taquicardia ventricular en el mapa de activación durante la inducción de taquicardia ventricular epicárdica.
Es importante anotar que un alto porcentaje de los pacientes en quienes está indicado un procedimiento ablación del VI tienen un cardiodesfibrilador implantable (CDI), lo que hasta hace unos años era contraindicación absoluta para la realización de una RMC. En términos de seguridad, hay amplia evidencia de que, con protocolos adecuados de planeación, monitoreo y reprogramación de los dispositivos durante la RMC por un equipo multidisciplinario idóneo, la RMC es segura en un gran porcentaje de estos pacientes21-23. Sin embargo, con frecuencia los artificios en la RMC secundarios a los dispositivos afectan la calidad de los exámenes, limitando la evaluación completa del VI y la información diagnóstica de los estudios. Los artificios son causados por una desviación de la frecuencia de multi-KHz de los tejidos localizados a 5-10 cm del generador del dispositivo, lo que produce una inversión inadecuada de la señal, manifestándose por áreas falsamente hiperintensas que simulan fibrosis o por áreas no visibles24. Recientemente se han desarrollado técnicas de RMC de RT-3D de banda amplia (wideband) que atenúan los artificios y permiten una mejor evaluación del miocardio del VI21,25-27.
Guía en la terapia de ablación de la aurícula izquierda según el sustrato arritmogénico (fibrosis) y seguimiento postablación de venas pulmonares para detectar líneas discontinuas de ablación
Tradicionalmente, la ablación de la aurícula izquierda en pacientes con fibrilación auricular se ha planeado de acuerdo con el tipo de presentación clínica de esta, pero en fecha reciente se ha propuesto un nuevo abordaje terapéutico de la ablación de la aurícula izquierda guiado por el sustrato, es decir, por el sitio de localización de la fibrosis (terapia individualizada). La localización de la fibrosis puede estar dada de manera indirecta a través de los mapas de activación, los mapas de rotores o criterios electrofisiológicos como la presencia de electrogramas auriculares fraccionados, o por localización directa de la fibrosis por el mapa de voltaje en procedimientos electrofisiológicos, o por la detección de la fibrosis auricular en la secuencia de RT-3D de RMC y el posproceso con el software ADAS 3D generando mapas 3D de intensidad de la señal28.
En un estudio multicéntrico, Marrouche, et al.29 reportan que los pacientes con un porcentaje de fibrosis de la aurícula izquierda > 30% no se benefician de la ablación y tienen una tasa de recidiva de fibrilación auricular después de la ablación de un 69.4% (Fig. 5). Estos resultados no han sido replicados por otros grupos. Es de anotar que la secuencia de RT-3D de RMC y el posproceso para obtener mapas 3D de la fibrosis primaria de la aurícula izquierda en pacientes con fibrilación auricular previa a los procedimientos de ablación son complejos, pues hay unas diferencias mínimas en la intensidad de la señal entre las áreas de fibrosis y la pared auricular normal.
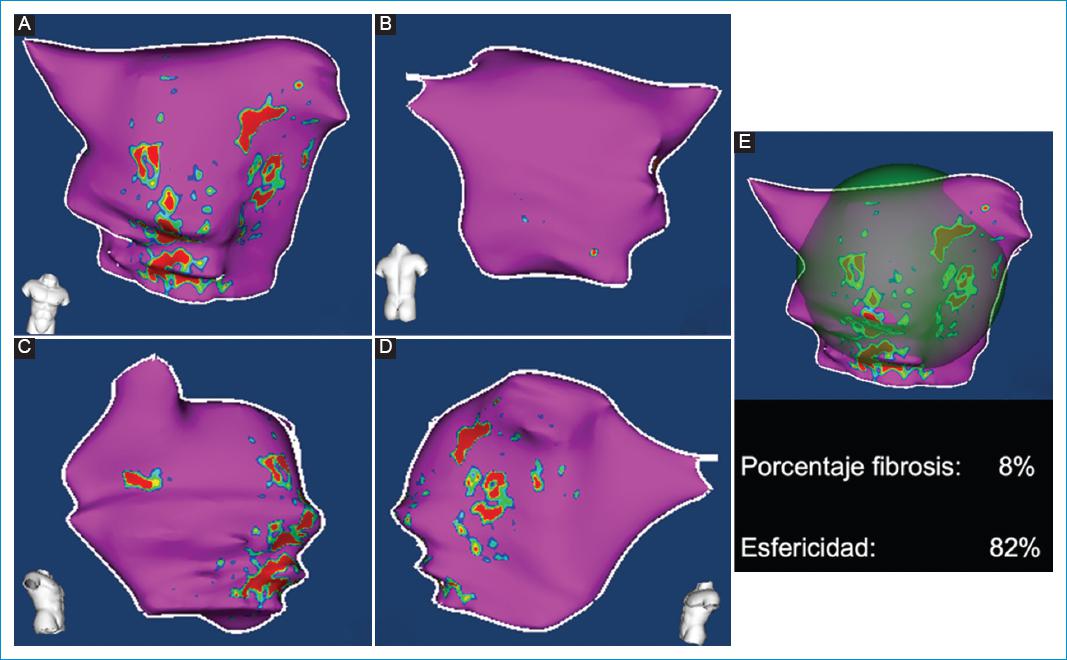
Figura 5 Mujer de 50 años con fibrilación auricular paroxística. Mapas 3D de intensidad de la señal de los píxeles (mapas 3D PSI) de la aurícula izquierda obtenidos a partir de la secuencia de RT-3D de RMC con el posproceso ADAS 3D. A: proyección anterior. B: proyección posterior. C: proyecciones laterales derecha. D: izquierda. E: reconstrucción 3D de esfericidad. Se observa la presencia de discreta cantidad de fibrosis (8%) localizada en la pared anterosuperior y un valor de esfericidad limítrofe del 82%.
Otros autores recomiendan la secuencia de RT-3D de RMC en pacientes con recurrencia de la fibrilación auricular después de los procedimientos de ablación para definir áreas de reconexión en sitios donde las líneas de ablación están incompletas (gaps)30 (Fig. 6). La detección de la fibrosis secundaria a los procedimientos de ablación se facilita, pues suele tener mayor intensidad de la señal que la fibrosis auricular primaria; esta diferencia favorece el posproceso de la secuencia RT-3D en los pacientes con procedimientos de ablación previa y facilita la evaluación de los pacientes con recurrencia de la fibrilación auricular, para detectar líneas de ablación incompletas.
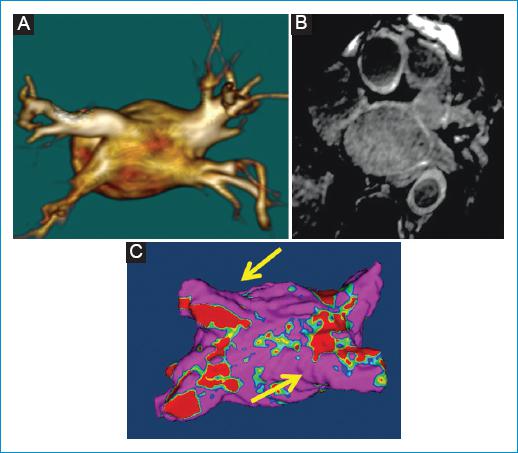
Figura 6 Varón de 60 años con recurrencia de fibrilación auricular 4 meses posablación. A: reconstrucción 3D de la aurícula izquierda a partir de la secuencia de angiorresonancia contrastada multifase (proyección posterior). B: imagen axial cruda de la secuencia de RT-3D enfocada en la aurícula izquierda. C: mapa 3D de intensidad de la señal de los píxeles (mapa 3D PSI) de la aurícula izquierda obtenido a partir de la secuencia de RT-3D con el posproceso ADAS-3D, proyección posterior. A: se observan cambios posablación en los ostia de las venas pulmonares en la secuencia de angiorresonancia, con discreta remodelación del contorno. C: se identifican líneas discontinuas de ablación (gaps) (flechas amarillas) en el aspecto superior del ostium de la vena pulmonar superior izquierda y en el aspecto posteroinferior de la vena pulmonar superior derecha.
Guía en la terapia de resincronización cardiaca
El conocimiento de la anatomía venosa coronaria es fundamental para la realización de la terapia de resincronización cardiaca (TRC). Definir con detalle la anatomía venosa coronaria no solo agiliza los procedimientos, sino que también aumenta el porcentaje de éxito de estos31,32.
La TRC es considerada en la actualidad un tratamiento establecido para la falla cardiaca con complejos QRS amplios33. Requiere la implantación de un electrodo en el VI, en una de las ramas del sistema venoso coronario, usualmente utilizando una vía a través del seno coronario. Sin embargo, el procedimiento para implantar el electrodo en el VI no es exitoso en un 5-12% de los pacientes por varias razones, incluyendo el acceso difícil a través del seno coronario o la ausencia de vena propicia para implantar el electrodo34.
Hay pocos estudios reportados en la literatura utilizando RMC para evaluar la anatomía venosa coronaria, y en todos ellos la valoración anatómica se hace mediante secuencias de angiorresonancia35,36.
Hay menor respuesta a la TRC en los casos en que el porcentaje de fibrosis del VI es > 15%37, cuando la vena donde se va a implantar el electrodo del VI está en contacto con un área de fibrosis transmural o epicárdica del VI, y en los pacientes con grandes infartos de miocardio inferolaterales transmurales38.
El electrodo ventricular derecho idealmente se debe localizar en el septo interventricular. En los pacientes con un porcentaje de fibrosis del septo interventricular > 40%37 hay una mala respuesta a la TRC.
En un estudio con 138 pacientes en los que se realizó RMC con secuencia de RT-3D con resonancia magnética de 3 Teslas20 se pudo evaluar la anatomía venosa coronaria en el 76.08% de los casos, con la ventaja adicional de poder realizar una valoración integral de la información necesaria antes de la TRC, pues se definen la presencia de fibrosis y la localización de esta en los segmentos definidos por la American Heart Association (AHA) y en las capas miocárdicas (epicárdica, intramiocárdica, endocárdica o transmural), estableciendo el porcentaje de fibrosis, y además permite evaluar la relación de la fibrosis con el probable sitio de implantación de los electrodos, ya sea el derecho en el septo interventricular o el izquierdo en las venas ventriculares izquierdas (Fig. 7).
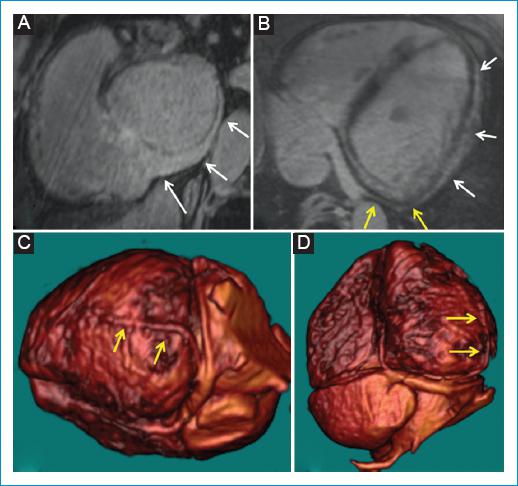
Figura 7 Paciente con miocardiopatía dilatada no isquémica secundaria a miocarditis crónica. Reconstrucciones multiplanares obtenidas de la secuencia de RT-3D de RMC. A: imagen en eje corto a nivel de las aurículas siguiendo el trayecto del seno coronario. B: imagen en 4 cámaras caudal con énfasis en el seno coronario. C-D: reconstrucciones 3D de la secuencia de RT-3D. C: en proyección lateral izquierda. D: proyección inferior. Se observa el detalle anatómico del ostium y del aspecto distal del seno coronario (flechas blancas en A), definiéndose un calibre normal del seno coronario y sin alteraciones en el ostium. Se identifica una vena marginal del ventrículo izquierdo (VI) de buen calibre (flechas amarillas en B-D). Se observa extensa fibrosis epicárdica de toda la pared lateral del VI (flechas blancas en B). Adicionalmente, el trayecto de la vena marginal esta inmediatamente adyacente a la fibrosis epicárdica de la pared lateral del VI (B), lo que muy probablemente limitaría el impacto terapéutico de un electrodo izquierdo de terapia de resincronización implantado en esta vena.
Abordaje diagnóstico de las miocardiopatías isquémicas y no isquémicas
Para el manejo de los pacientes con arritmias es fundamental definir el diagnóstico específico de la patología cardiaca de base. En este aspecto, la secuencia de RT-3D ofrece ventajas en comparación con la secuencia convencional RT-2D, como se describirá brevemente.
La secuencia de RT-3D, al evaluar de forma completa el VI, facilita una mejor caracterización de la localización y la extensión del RT y la fibrosis del VI en los 17 segmentos definidos por la AHA en comparación con la secuencia RT-2D, con una mejor definición de la transmuralidad de la fibrosis y del patrón del RT: endocárdico, intramiocárdico, epicárdico o mixto. Así, facilita la diferenciación de la miocardiopatía isquémica de la no isquémica, y en los pacientes con miocardiopatía no isquémica brinda la posibilidad de clasificarlos en categorías diagnóstica más específicas (Fig. 8).
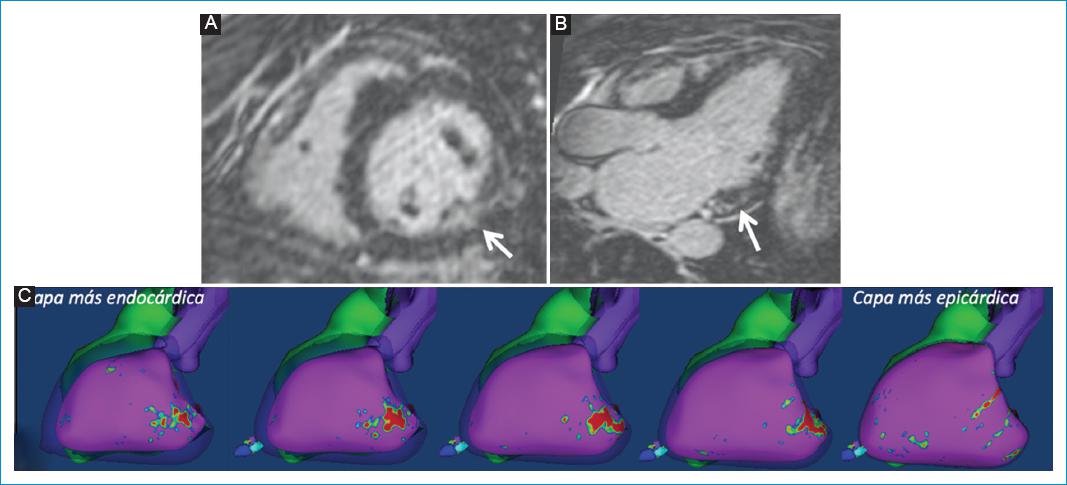
Figura 8 Mujer 50 años con diagnóstico de enfermedad de Anderson-Fabry y aumento del automatismo ventricular. Reconstrucciones multiplanares de la secuencia de RT-3D. A: eje corto basal. B: longitudinal 3 cámaras. C: mapas 3D de intensidad de la señal de los píxeles (mapas 3D PSI), proyecciones laterales desde la capa más endocárdica izquierda hasta la más epicárdica derecha. Se evidencia patrón de realce tardío característico de los pacientes con enfermedad de Anderson-Fabry, definiéndose realce central del miocardio en el tercio basal de la pared inferolateral del ventrículo izquierdo (flechas blancas en A-B). C: fibrosis compacta (color rojo) en los mapas 3D PSI, comprometiendo principalmente las capas miocárdicas centrales del panel inferior.
Recientemente se resalta además el valor de la secuencia de RT-3D en comparación con la secuencia convencional de RT-2D en la detección y la caracterización de los patrones de fibrosis miocárdica (patrones de RT), de manera específica en una cohorte de 172 pacientes con MINOCA (myocardial infarction with nonobstructive coronary arteries). En este grupo de pacientes, la realización de la secuencia de RT-3D cambió en un 26% (p < 0.001) de los casos el diagnóstico definitivo, en comparación con el diagnóstico inicial definido por la información obtenida con la secuencia convencional de RT-2D39.
En los pacientes con miocardiopatías que no solo comprometen el VI, sino también el ventrículo derecho y las aurículas, como por ejemplo aquellos con sarcoidosis cardiaca, las secuencias de RT-3D permiten evaluar con mayor detalle el compromiso asociado del ventrículo derecho y de ambas aurículas en comparación con la secuencia de RT-2D (Fig. 9).
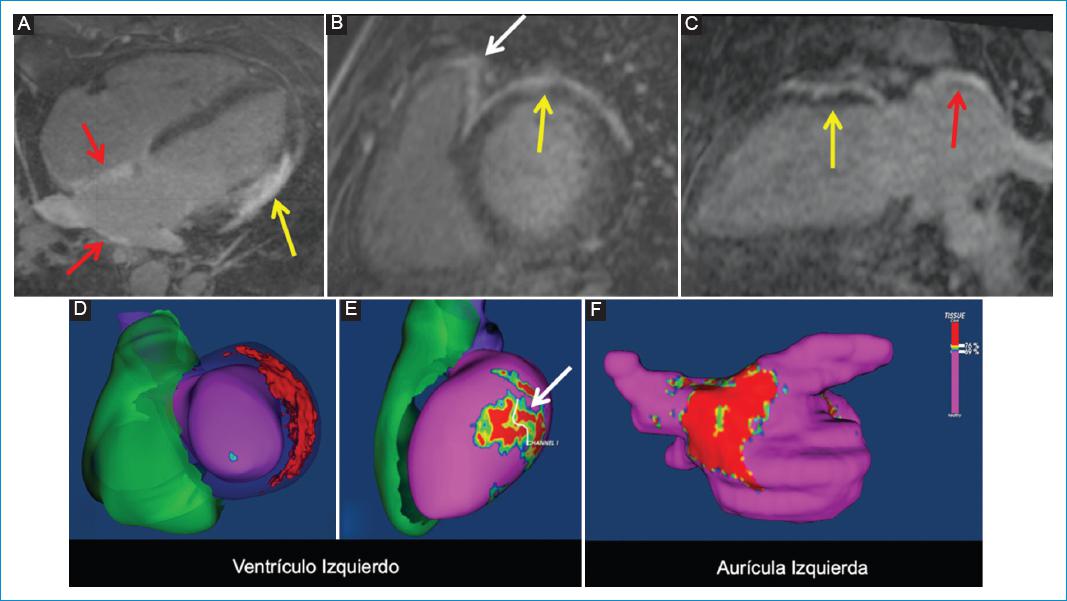
Figura 9 Varón de 50 años con historia de sarcoidosis abdominal y palpitaciones. Presencia de taquicardia ventricular monomórfica en el estudio de Holter. Reconstrucciones multiplanares de la secuencia RT-3D. A: longitudinal 4 cámaras. B: Eje corto. C: longitudinal 2 cámaras. Se identifica realce tardío epicárdico en la pared anterolateral de los tercios basal y medio del ventrículo izquierdo (flechas amarillas en A-C). También se observan realce tardío en la pared superior del ventrículo derecho (flecha blanca en B) y realce tardío difuso de las paredes de la aurícula izquierda, comprometiendo principalmente las paredes posterior y superior, y el septo (flechas rojas en a y c). Reconstrucciones 3D con posproceso ADAS-3D (D-F). D-E: se identifica un patrón de realce tardío epicárdico anterolateral. Adicionalmente, en e se observa un canal de fibrosis limítrofe de localización epicárdica en la pared lateral del tercio medio del ventrículo izquierdo (flecha blanca). F: finalmente, en la reconstrucción 3D con el programa ADAS 3D de la aurícula izquierda se identifica extensa fibrosis de las paredes posterior y superior.
Definir el pronóstico y guiar el implante de un cardiodesfibrilador en pacientes con miocardiopatías según la presencia de fibrosis miocárdica
La presencia de fibrosis miocárdica es un factor importante de mal pronóstico en las diferentes miocardiopatías, independientemente de su etiología, aumentando el riesgo de muerte súbita y de eventos cardiacos adversos mayores, como se reporta en diferentes patologías, como la miocardiopatía dilatada no isquémica40, la miocarditis aguda41, la miocardiopatía hipertrófica asimétrica42 y la sarcoidosis43.
Actualmente, los parámetros utilizados en las guías vigentes para definir los pacientes que requieren el implante de un CDI como prevención primaria son la fracción de eyección del ventrículo izquierdo (FEVI) y la clase funcional; sin embargo, estos parámetros tienen baja especificidad, pues menos de la tercera parte de los pacientes a quienes se ha implantado un CDI tienen una descarga apropiada44, y baja sensibilidad, pues la mayoría de los pacientes con muerte súbita de origen cardiaco tienen una FEVI normal.
Los resultados del estudio DANISH45 hacen cuestionar la eficacia de la implantación de un CDI en pacientes con miocardiopatía dilatada de origen no isquémico, pues en su cohorte no se encontró un cambio significativo en la mortalidad por cualquier causa después de la implantación de un CDI. Estos resultados cuestionan la especificidad de los parámetros (FEVI y clase funcional) de la guías vigentes para definir la implantación de un CDI como prevención primaria en pacientes con falla cardiaca sistólica no isquémica, y además resaltan la importancia de encontrar nuevos marcadores para mejorar la estratificación del riesgo en esta población, incluyendo la detección de la presencia y la extensión (porcentaje) de fibrosis miocárdica por RMC46, una mejor definición del riesgo de muerte de origen no cardiaco antes de la implantación del CDI (evaluar la comorbilidad y la expectativa de vida) y una mejor categorización de los pacientes de acuerdo con la etiología de la miocardiopatía dilatada no isquémica, incluyendo pruebas genéticas.
En el estudio GAUDI CRT se evaluaron prospectivamente 217 pacientes (39.6% con patología isquémica) con indicación de clase I de TRC. Antes del implante del dispositivo, a todos los pacientes se les realizó una RMC con secuencia de RT-3D y con posproceso con ADAS 3D para detectar fibrosis y cuantificar el porcentaje de fibrosis total, compacta y heterogénea (limítrofe), así como la presencia y el número de CFL. Los pacientes se siguieron un tiempo promedio de 35.5 meses para definir la incidencia de muerte súbita de origen cardiaco o la terapia apropiada del desfibrilador. El desenlace primario compuesto se presentó en un 25% de los pacientes y todos ellos tuvieron fibrosis en la secuencia de RT-3D de RMC. La presencia y la extensión de la fibrosis total y limítrofe (heterogénea), y el número de CFL, fueron predictores independientes de muerte súbita de origen cardiaco en los pacientes con TRC y de terapias apropiadas en los pacientes con TRC con desfibrilador. El estudio señala la importancia de la detección de fibrosis de manera no invasiva con la secuencia de RT-3D como factor predictor de muerte súbita de origen cardiaco (Fig. 10)47. Otro aspecto para destacar del estudio GAUDI es el hecho de que ninguno de los modelos de análisis multivariado demostró en esta cohorte que la FEVI fuera un factor predictor independiente de muerte súbita de origen cardiaco o de terapia apropiada con el desfibrilador; esto concuerda con resultados previos que reportan que la FEVI carece de sensibilidad y especificidad para predecir arritmias malignas48.
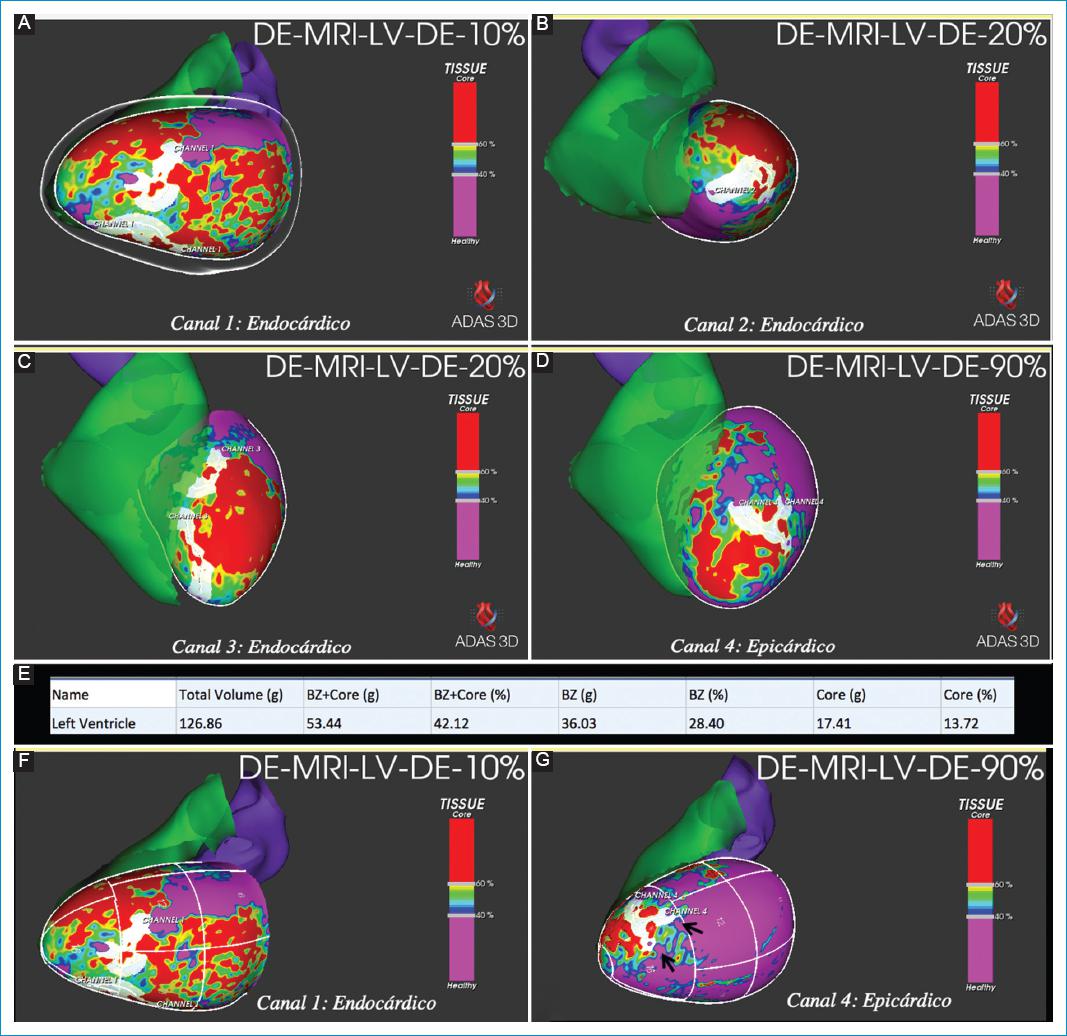
Figura 10 Varón de 65 años con miocardiopatía isquémica, con extensos infartos de miocardio antiguos en territorios vasculares de las arterias coronarias descendente anterior y circunfleja. Antecedente de taquicardia ventricular. Mapas 3D de intensidad de la señal de los píxeles de la secuencia de RT-3D y posproceso con ADAS-3D. A: proyección lateral endocárdica. B: proyección apical endocárdica. C: proyección superior endocárdica. D: proyección superior epicárdica. E: tabla de porcentajes y gramos de fibrosis total, fibrosis compacta y fibrosis limítrofe. En el posproceso de la secuencia RT-3D de RMC se identificaron cuatro canales de fibrosis limítrofe (CFL) que se observan como corredores blancos: tres endocárdicos y uno epicárdico. Con el posproceso de la secuencia de RT-3D también se pueden calcular los porcentajes y el peso en gramos de la fibrosis total, de la fibrosis compacta y de la fibrosis limítrofe, como se observa en la tabla (E). También se pueden obtener estos valores de cada capa del miocardio y el peso en gramos de cada CFL. Es importante anotar que estos mapas se pueden integrar a las plataformas CARTO y ENSITE para guiar los procedimientos de ablación del ventrículo izquierdo.
Aunque la disponibilidad de la secuencia de RT-3D y de su posproceso específico con ADAS 3D es limitada y su validación clínica se encuentra todavía en fases iniciales en pocos centros especializados del mundo, los primeros resultados son alentadores y su potencial aplicación en el campo de la electrofisiología es amplia.
Conclusiones
La secuencia de RT-3D con su posproceso específico permite la valoración del miocardio ventricular izquierdo con alta resolución espacial, brindando información detallada del sustrato arritmogénico, útil en la planeación, la guía y el seguimiento de la terapia de ablación ventricular. Igualmente se ha reportado el valor de la secuencia de RT-3D en la identificación de líneas discontinuas de ablación auricular en pacientes con recurrencia de fibrilación auricular. La posibilidad de evaluar en detalle la presencia, la localización y la extensión de la fibrosis miocárdica en la totalidad del VI con la secuencia de RT-3D es una ventaja importante, no solo para definir el diagnóstico diferencial de las miocardiopatías, sino también para establecer el pronóstico de los pacientes y eventualmente definir la necesidad de un CDI. La caracterización de la fibrosis del VI y su relación con respecto al septo ventricular y las estructuras venosas coronarias de la pared lateral e inferolateral del VI son parámetros importantes en la planeación de la TRC, potencialmente evaluables con la secuencia de RT-3D.














