Definición y epidemiología de la muerte súbita
De acuerdo con el American College of Cardiology (ACC), la American Heart Association (AHA) y la Heart Rhythm Society (HRS), la muerte súbita cardiaca (MSC) se define como un evento fatal, no esperado, no traumático, que ocurre dentro de 1 hora de haber iniciado los síntomas, o la ocurrida en un sujeto encontrado muerto dentro de las 24 horas de estar asintomático y presuntamente debida a arritmia o catástrofe hemodinámica1. Esta condición patológica puede ser secundaria a arritmias ventriculares o asistolia, así como a causas no arrítmicas. A pesar de la disminución en la mortalidad asociada a la enfermedad coronaria, de los avances en el tratamiento de insuficiencia cardiaca congestiva (ICC) y del uso de cardiodesfibriladores implantables (CDI) en los pacientes de alto riesgo en las últimas décadas, la prevalencia de la MSC sigue siendo elevada2.
La MSC es responsable de alrededor del 50% de las muertes de causa cardiovascular; la incidencia global puede estar en unos 5 millones de casos/año aproximadamente3. En Colombia, la muerte por causa cardiovascular se encuentra entre las 10 etiologías más frecuentes, siendo las enfermedades isquémicas del corazón el 17% del total de las defunciones4.
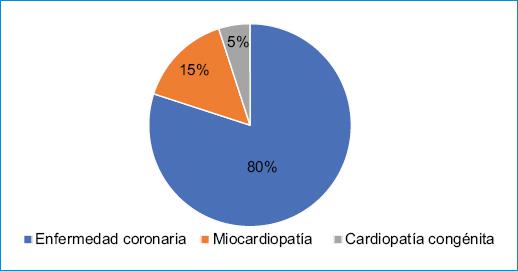
Existen dos picos de alta prevalencia para MSC según la edad. El primero es en el primer año de vida, conocida como muerte súbita del lactante, que se presenta con una incidencia de 1/50.000 por año; una autopsia negativa para la presencia de anomalías en la morfología cardiaca hace que la causa más común sea una arritmia ventricular primaria genéticamente determinada, en general asociada a canalopatías y cardiomiopatías5. El segundo pico inicia después de los 40 años, con una incidencia estimada de 0.09/1000 personas/año, en relación con la fase aguda del infarto agudo al miocardio o con una cardiomiopatía isquémica ya instaurada6. En este rango de edad, el 30-40% de las causas no relacionadas con isquemia tienen que ver con miocardiopatía dilatada, hipertrófica, infiltrativa o valvular7. La fibrilación ventricular (FV) y la taquicardia ventricular (TV) son las causas más frecuentes de MSC, y los factores de riesgo más comúnmente asociados son la cardiopatía isquémica en el contexto agudo o crónico, la hipertensión arterial, la cardiopatía dilatada y la ICC cuando la fracción de eyección del ventrículo izquierdo (FEVI) se encuentra por debajo del 35%7 (Fig. 1).
El cardiodesfibrilador implantable en la prevención primaria de la muerte súbita en cardiopatía isquémica y no isquémica
La cardiopatía isquémica es la principal causa de ICC en el mundo, y la terapia con CDI está indicada para la prevención primaria de arritmias ventriculares en este grupo de pacientes8. Diferentes estudios han demostrado su eficacia (Tabla 1) y respaldan las recomendaciones de las diferentes sociedades científicas.
Tabla 1 Estudios de prevención primaria con cardiodesfibrilador implantable
| Ensayo | Diseño | Criterios de inclusión | N.º pacientes | Seguimiento (meses) | Resultados |
|---|---|---|---|---|---|
| MADIT | Aleatorizados a CDI o tratamiento antiarrítmico | IM, FE < 35%, TVNS, TV inducible, no suprimible | 196 | 27 | Reducción de mortalidad 54% |
| CABG-Patch trial | RVM quirúrgica, con o sin CDI | Cardiopatía isquémica, RVM quirúrgica, ECG señal promedia anormal, IM, FE < 30% | 900 | 32 | No diferencias significativas entre ambos grupos |
| MADIT II | Tratamiento convencional vs. CDI | IM, FE<30% | 1232 | 20 | Reducción de mortalidad 31% |
| COMPANION | Tres grupos: tratamiento convencional, MP-TRC o CDI-TRC | FE < 35%, clase III o IV NYHA, QRS > 120 ms, isquémicos y no isquémicos | 903 | 16 | Reducción de objetivo combinado de muerte + hospitalización 34% (MP-TRC) y 40% (CDI-TRC) |
| DEFINITE | CDI vs. tratamiento convencional | FE < 35%, EV (10/h) o TVNS, no isquémicos | 458 | 29 | Reducción de muerte súbita y reducción no significativa de mortalidad total |
| SCD-HeFT | Tres grupos: convencional, amiodarona y CDI | FE < 35%, clase II NYHA, isquémicos y no isquémicos | 1676 | 48 | Reducción de mortalidad 23% |
| DINAMIT | CDI vs. convencional | IAM 6-40 días, FE < 35%, variabilidad de FC > 80 lat/min | 674 | 30 | No efecto favorable sobre mortalidad |
CDI: cardiodesfibrilador implantable; CDI-TRC: cardiodesfibrilador implantable-terapia de resincronización cardíaca; ECG: electrocardiograma; EV: extrasistolía ventricular; FC: frecuencia cardiaca; FE: fracción de eyección; IAM: infarto agudo de miocardio; IM: intramuscular; MP-TRC: marcapasos-terapia de resincronización cardíaca; NYHA: New York Heart Association; RVM: revascularización miocárdica; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida.
Adaptada de Alzueta-Rodríguez, et al.50.
En el ensayo MUSTT (Multicenter Unsustained Tachycardia Trial Investigators) se incluyeron pacientes con cardiopatía isquémica y FEVI reducida, quienes presentaron episodios de TV no sostenida (TVNS) asintomática. Aleatorizaron a los pacientes en dos grupos; los que tenían TV inducible los incluyeron en el grupo de tratamiento (CDI o medicamentos antiarrítmicos) y aquellos en los que la TV no era inducible recibían manejo médico usual. El seguimiento fue a 5 años y encontraron una reducción en la mortalidad del 31% a favor del grupo en que se instauró CDI9. El estudio MADIT II encontró una reducción del 31% en la mortalidad con la implantación del CDI, comparado con la terapia estándar. Gracias a estos hallazgos, la Food and Drug Administration aprobó el uso de CDI en pacientes con falla cardiaca crónica y fracción de eyección deprimida10.
Recientemente se ha publicado un metaanálisis comparando la terapia médica con el uso de CDI. En total fueron 8176 pacientes, con una mediana de seguimiento de 3.2 años, y se encontró una reducción en la mortalidad por cualquier causa del 28% en comparación con la terapia convencional, descenso impulsado por tasas reducidas de muerte súbita arrítmica11.
Cabe resaltar que no todos los estudios realizados han tenido resultados a favor del CDI. El CABG-PATCH evaluó desenlaces en pacientes que iban a ser llevados a revascularización a quienes, de manera profiláctica, independientemente de la FEVI, se les instauró de manera profiláctica un CDI, y luego de un seguimiento de 2 años no se encontró diferencia en cuanto a mortalidad. Por otro lado, el estudio DINAMIT incluyó pacientes en la fase precoz del infarto (primeros 40 días) para realizar un implante de CDI en comparación con manejo convencional, y como resultado no se obtuvo beneficio en cuanto a mortalidad global en este grupo de pacientes12.
En cuanto a la cardiomiopatía no isquémica (CMNI), la evidencia para el implante del CDI en prevención primaria de muerte súbita no se logró comprobar en seis ensayos clínicos8. El estudio SCD-HeFT, el cual incluyó un 52% de pacientes con cardiomiopatía isquémica y un 48% con CMNI, demostró que el implante de CDI se asoció con una disminución relativa del riesgo de muerte del 23% en la población global estudiada, pero no hubo diferencias significativas en el subgrupo de pacientes con CMNI9. Estos resultados son consistentes con los de un estudio recientemente publicado en el cual el seguimiento de los pacientes del SCD-HeFT hasta los 11 años demostró que el beneficio en cuanto a supervivencia a largo plazo fue más evidente para los pacientes con insuficiencia cardiaca isquémica y para aquellos con síntomas de clase funcional II de la New York Heart Association (NYHA)10. En 2004 se publicó un metaanálisis con ocho ensayos clínicos aleatorizados, en el que se demostró una reducción del 31% en la mortalidad con la instauración del CDI en comparación con la terapia convencional11.
En el estudio DANISH fueron incluidos pacientes sintomáticos en clase II o III de la NYHA (o clase IV si se planificaba el implante de terapia de resincronización cardíaca [TRC]), con FEVI < 35% y niveles aumentados de propéptido natriurético cerebral (proBNP), en quienes se había descartado la cardiopatía isquémica como etiología de la disfunción del ventrículo izquierdo. El resultado primario (muerte por cualquier causa) se presentó en el 21.6% en el grupo de CDI y en el 23.4% en el grupo control. Si bien estos datos indican que no hubo diferencias significativas respecto al punto final primario, en el análisis de subgrupos se observó una reducción en el riesgo de muerte súbita cardiaca del 50% en los pacientes del grupo de CDI12.
Los resultados de estos estudios han sido controvertidos, subrayando la heterogeneidad de los pacientes con CMNI y la eficacia del CDI, principalmente en pacientes jóvenes, en quienes la existencia de menos comorbilidad podría explicar el beneficio real del implante del CDI. Un metaanálisis publicado recientemente encontró que, en pacientes menores de 65 años, el número necesario a tratar para el uso de CDI es de 10, y por lo tanto el rol del CDI en los pacientes con CMNI debe ser evaluado según subgrupos específicos, como es el caso de la cardiomiopatía dilatada o hipertrófica8.
Las principales indicaciones para el implante de un CDI en esta población se resumen en las tablas 2 y 3.
Tabla 2 Recomendaciones seleccionadas para la terapia con cardiodesfibrilador implantable en pacientes con cardiopatía isquémica
| Recomendaciones | ACC/AHA | ESC |
|---|---|---|
| Prevención primaria | ||
| Se recomienda implante de CDI en pacientes con falla cardiaca sintomática (clase funcional II-III de la NYHA) y una FEVI<35%, para reducir el riesgo de muerte súbita en quienes no han tenido un IM en los últimos 40 días | I/A | I/A |
| Los pacientes no deben ser llevados a implante de CDI en los primeros 40 días tras un IM porque el implante en este periodo no mejora el pronóstico | III | |
| El implante de CDI no está indicado en pacientes sintomáticos con clase IV de la NYHA | ||
| Prevención secundaria | ||
| Se recomienda un CDI en pacientes que se han recuperado de una arritmia ventricular que causa inestabilidad hemodinámica, y en quienes se espera que tengan sobrevida>1 año con buen funcionamiento, para reducir el riesgo de muerte súbita | I/A | I/A |
| Se recomienda implante de CDI en pacientes con cardiopatía isquémica y síncope no explicado que han presentado un episodio de TV monomórfica sostenido en un estudio electrofisiológico | I/A | |
ACC: American College of Cardiology; AHA: American Heart Association;
CDI: cardiodesfibrilador implantable; ESC: European Society of Cardiology;
FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; NYHA: New York Heart Association; TV: taquicardia ventricular.
Tabla 3 Recomendaciones para el manejo de la cardiomiopatía no isquémica
| Recomendaciones | ACC/AHA | ESC |
|---|---|---|
| En pacientes con CMNI (dilatada e hipertrófica), falla cardiaca sintomática, clase II-III de la NYHA y FEVI≤35% o menos, a pesar de terapia medica dirigida por guías, se recomienda un CDI si la supervivencia es mayor de 1 año | I/A | I/A |
| En pacientes con CMNI (dilatada e hipertrófica) y evidencia de TV/FV hemodinámicamente no tolerada, se recomienda la instauración de CDI si la supervivencia es mayor de 1 año | I/A | I/A |
| Se debe considerar CDI en pacientes con CMNI y mutación del LMNA confirmada que causa la enfermedad y con presencia de factores de riesgo clínico (FEVI<45%, mutación missesense y sexo masculino) | IIa/B | Iia/B |
| En pacientes con cardiomiopatía hipertrófica y uno o más de los siguientes factores de riesgo se debe considerar el implante de CDI si la supervivencia esperada es mayor de 1 año: a. Grosor máximo de la pared del ventrículo izquierdo>30 mm b. MSC en uno o más familiares de primer grado con sospecha de cardiomiopatía hipertrófica con uno o más episodios de síncope no explicados en los últimos 6 meses |
Iia/B | Iia/B |
| En pacientes con cardiomiopatía hipertrófica que han tenido episodios de TVNS espontáneos o respuesta anormal de la presión arterial con el ejercicio que también tienen factores de riesgo para MSC un CDI es razonable si se espera que la supervivencia sea mayor de 1 año | Iia/B | |
| En pacientes con cardiomiopatía hipertrófica que han tenido episodios de TVNS espontáneos o respuesta anormal de la presión arterial con el ejercicio, pero no tienen factores de riesgo, se podría indicar un CDI, pero el beneficio es incierto | Iib/C |
ACC: American College of Cardiology; AHA: American Heart Association;
CDI: cardiodesfibrilador implantable; CMNI: cardiomiopatía no isquémica;
ESC: European Society of Cardiology; FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; MSC: muerte súbita cardiaca;
NYHA: New York Heart Association; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida.
Los registros muestran que solo una minoría de los pacientes con CMNI que experimentan un episodio de muerte súbita cumplen los criterios para implante de CDI8, y por esta razón es importante realizar una estratificación de acuerdo con la edad, los antecedentes, la etiología de la CMNI, los procedimientos de electrofisiología y las imágenes. La duración de la enfermedad, haber tenido un episodio no explicado de síncope y la historia familiar de MSC son predictores independientes de arritmias ventriculares mayores. En el electrocardiograma, los hallazgos con mayor evidencia para la predicción de arritmias de QRS largo, son: taquicardia ventricular no sostenida y extrasístoles ventriculares frecuentes (definidas como 1000 en 24 horas) y dupletas (> 50 en 24 horas), y en cuanto al ecocardiograma, el hallazgo de FEVI < 35% también es un factor predictor fuerte, pero este hallazgo se debe evaluar con precaución puesto que se ha encontrado que la FEVI en pacientes con CMNI se comporta de manera dinámica; por último, el hallazgo en estudios de electrofisiología de ondas T alternantes8. El uso de la resonancia magnética (RM) se abordará en el apartado dedicado a la cardiomiopatía dilatada.
En un estudio publicado en 2020 por Cánata, et al.13 se propone una estratificación personalizada basada en hallazgos ecocardiográficos, electrocardiográficos, de RM y estudios genéticos con un seguimiento en el tiempo a los pacientes, y se recomienda el implante de CDI en los pacientes con FEVI < 35% luego de 3 meses de manejo médico óptimo, y en aquellos con FEVI entre el 35% y el 45% con hallazgos anormales en la RM, especialmente se si asocia con antecedentes familiares, cambios electrocardiográficos y hallazgos anormales en los test electrofisiológicos8.
Impacto temprano del cardiodesfibrilador implantable posinfarto
A pesar de la incidencia de MSC posterior a un infarto agudo de miocardio, especialmente en los pacientes con FEVI reducida, la instauración de un CDI en los primeros 40 a 90 días del evento, en estudios grandes, hasta el momento no ha mostrado beneficio en cuanto a reducción de la mortalidad. El primer estudio en evaluar el beneficio de la instauración de un CDI, el DINAMIT, incluyó un total de 640 pacientes con fracción de eyección reducida (< 35%) y antecedente de infarto previo (6-40 días antes de ingresar al estudio), y el grupo de comparación recibió terapia médica convencional. Luego de un seguimiento de 30 meses, las muertes por cualquier causa (desenlace primario) fueron similares en los dos grupos, pero se encontró una ligera reducción en el subgrupo de muertes por causa arrítmica; sin embargo, no se encontró beneficio en la supervivencia global por el aumento de muertes por causas no arritmogénicas12. Resultados similares se encontraron en el estudio IRIS, publicado en el año 200914.
Los dos estudios que se mencionaron previamente soportan la no indicación del uso de CDI en prevención primaria en el periodo agudo posterior a un infarto agudo al miocardio, dado que la mortalidad por otras causas es mayor. Por otro lado, un estudio publicado en el año 2020 evalúo el implante de CDI entre los 30 y 60 días posteriores a la angioplastia. El estudio fue aleatorizado, prospectivo y patrocinado por la industria (Medtronic), y en total se reclutaron 262 pacientes con FEVI < 30%, clase Killip ≥ 2 o flujo TIMI (Thrombolysis in Myocardial Infarction) < 3 luego de la PCI primaria. En este estudio sí se encontró que el implante de CDI se asoció con una disminución relativa del riesgo del 42% en la mortalidad por cualquier causa a los 10 años de seguimiento, y sugiere que el implante profiláctico de CDI en pacientes con alto riesgo podría ser beneficioso, aunque es necesario tener estudios con un mayor número de pacientes15.
Hasta el momento, las guías de manejo son claras en la indicación en contra del uso de CDI en pacientes durante los primeros 40 a 90 días posteriores al infarto1,16.
Eficacia del chaleco desfibrilador
Se han realizado estudios para evaluar la utilidad del chaleco cardiodesfibrilador con el fin de evitar la MSC durante el periodo inmediato después del infarto y antes de que haya indicación de instauración de un CDI. En el año 2018 se publicó el estudio VEST para evaluar el uso del chaleco, en el cual se aleatorizaron 2302 pacientes que estuvieron hospitalizados por infarto agudo de miocardio y FEVI reducida. De estos, a 1524 se les instauró un CDI y los demás recibieron manejo médico guiado para falla cardiaca. El desenlace primario fue la MSC por taquiarritmias a los 90 días. No se encontró diferencia significativa en cuanto a muerte arrítmica entre el grupo de intervención y el grupo de control (1.6% en el grupo con dispositivo y 2.4% en el grupo control), y tampoco se encontró diferencia en la mortalidad total entre los grupos17.
Es de anotar que en el estudio VEST, a diferencia de los demás, el desenlace primario fue la muerte por arritmias y no la mortalidad por cualquier causa, y la primera es más difícil de atribuir que la segunda, lo que podría generar un sesgo por mala clasificación de la etiología de la muerte y explicar por qué no se encontraron diferencias significativas en la mortalidad en los dos grupos. Por otra parte, se encontró que la adherencia al uso del chaleco fue baja y los investigadores reportaron que por lo menos tres de cada cuatro pacientes que fallecieron no estaban utilizando el chaleco en el momento de la muerte, por lo que la adherencia al tratamiento puede ser una limitación grande del estudio y se requieren más investigaciones para poder definir la utilidad o no del chaleco desfibrilador18.
El cardiodesfibrilador implantable en la cardiomiopatía chagásica
La cardiomiopatía chagásica crónica es la causa más frecuente de falla cardiaca de etiología no isquémica en Latinoamérica. La miocarditis presente en estos pacientes es el sustrato anatómico que favorece un aumento en el automatismo y otras condiciones que producen fenómenos de reentrada y precipitan la presencia de arritmias ventriculares de alto riesgo y muerte súbita19.
La prevención de la MSC con un CDI es una terapia cada vez más utilizada en estos pacientes. El registro latinoamericano de CDI y enfermedad de Chagas, publicado en 2009, encontró que en el 91% de los casos se implantó el dispositivo como prevención secundaria. Después de un seguimiento promedio de 12 meses, el 42% de los pacientes recibieron una o más terapias apropiadas, y de estos, más de dos tercios fueron descargas asociadas a TV. Las tasas de intervención del CDI apropiadas fueron similares en los pacientes que presentaban muerte súbita (50%), TV con deterioro hemodinámico (50%) o síncope inexplicable (50%)20.
Recientemente se ha publicado un metaanálisis acerca del uso de CDI en esta población, con un total de 115 pacientes en el grupo de manejo médico con amiodarona y 483 pacientes en el grupo de CDI. No se encontraron diferencias en la mortalidad entre ambos grupos; tan solo un estudio publicado en 2014 logró demostrar una menor mortalidad asociada al uso de CDI más amiodarona en comparación con amiodarona en monoterapia, y en los pacientes con FEVI < 40% se obtuvo un mayor impacto de supervivencia con la terapia de CDI21.
Se han descrito algunos puntajes de riesgo para estimar la probabilidad de MSC en la cardiopatía chagásica. El más reconocido es el Rassi score, el cual utiliza seis variables, entre las cuales se combinan factores clínicos, paraclínicos y demográficos, para clasificar a los pacientes por riesgo de mortalidad a 10 años22.
En la actualidad, la implantación de un CDI está indicada en pacientes con cardiomiopatía chagásica crónica y TV sostenida, en pacientes que hayan sobrevivido a un episodio de muerte súbita (indicación de clase I) y en pacientes con disfunción ventricular izquierda, arritmias ventriculares complejas, que no han mejorado con ablación o con tratamiento farmacológico (indicación de clase IIA). El estudio CHAGASICS será el primer estudio aleatorizado que evalué el impacto del implante del CDI en prevención primaria22.
El cardiodesfibrilador implantable en la prevención de la muerte súbita en la miocardiopatía hipertrófica
La miocardiopatía hipertrófica es una enfermedad del músculo cardiaco de etiología genética, causada por mutaciones en uno de varios genes sarcoméricos que codifican componentes del aparato contráctil. La presencia de hipertrofia ventricular izquierda y arritmias ventriculares predispone a estos pacientes a sufrir MSC. Los factores de riesgo reconocidos para muerte súbita en la miocardiopatía hipertrófica se resumen en la tabla 4 23. El CDI ha mostrado ser efectivo en la prevención de la MSC en varios escenarios clínicos de la miocardiopatía hipertrófica, en prevención tanto primaria como secundaria24.
Tabla 4 Características clínicas principales asociadas con un mayor riesgo de muerte súbita cardiaca en pacientes con cardiomiopatía hipertrófica*
| Factores de riesgo establecidos |
|---|
| Supervivencia de un paro cardiaco debido a TV o FV |
| TV sostenida espontánea que causa síncope o compromiso hemodinámico |
| Antecedentes familiares de MSC asociados con CMH |
| Grosor de pared del VI > 30 mm |
| Síncope inexplicable en los últimos 6 meses |
| Episodios de TVNS |
| Respuesta anormal de la presión arterial durante el ejercicio† |
| Potenciales modificadores del riesgo‡ |
| < 30 años |
| Realce tardío en la RM cardiaca |
| Obstrucción del TSVI |
| Síncope en los últimos 5 años |
| Subconjunto de alto riesgo |
| Aneurisma del VI |
| FEVI<50% |
*Se caracteriza por un aumento del grosor de la pared del ventrículo izquierdo que no se explica únicamente por condiciones anormales de carga.
†Respuesta anormal de la presión arterial durante el ejercicio: Aumento de la presión arterial tanto sistólica como diastólica durante el ejercicio.
‡Modificadores del riesgo para muerte súbita cardíaca.
CMH: cardiomiopatía hipertrófica; FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; MSC: muerte súbita cardiaca; RM: resonancia magnética; TSVI: tracto de salida del ventrículo izquierdo; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida; VI: ventrículo izquierdo.
Una revisión sistemática y metaanálisis publicada en el año 2017 reportó una mortalidad cardiaca en el seguimiento del 0.9% por año, y la tasa de intervención apropiada fue del 4.8%, lo cual demuestra una baja tasa de mortalidad cardiaca asociada al uso del CDI25. Un estudio multicéntrico que incluyó 506 pacientes con miocardiopatía hipertrófica y CDI reportó que en un 35% de los pacientes que en prevención primaria recibieron la descarga apropiada del dispositivo se había implantado el CDI con solo un factor de riesgo reconocido para MSC, y no se observaron diferencias significativas entre los pacientes con uno, dos o más factores de riesgo, lo cual demuestra la importancia que tiene la identificación precoz de cualquier factor de riesgo en esta población26.
Los modelos de predicción ofrecen la oportunidad de tener una estimación del riesgo más precisa para ofrecer intervenciones apropiadas. Estos scores han sido validados en múltiples poblaciones, como en el estudio EVIDENCE-HCM, con más de 2000 pacientes en cuatro continentes y un seguimiento a 5 años. Entre los pacientes con alto riesgo (≥ 6%), la incidencia de MSC fue significativamente mayor (8.9%) que en los pacientes con nivel intermedio (4-6%) o bajo (< 4%)27. En la práctica clínica se utiliza ampliamente el HCM Risk-SCD Calculator (https://doc2do.com/hcm/webHCM.html), el cual ha sido validado en diferentes poblaciones con resultados similares28,29. Sin embargo, en el año 2018 se publicó una cohorte de 288 pacientes en la cual se compararon el HCM Risk-SCD Calculator y un algoritmo basado en factores de riesgo convencionales del ACC/AHA. Este estudio demostró una mayor especificidad con el score europeo en los pacientes de bajo riesgo que no se beneficiaban de la terapia con CDI, pero la mayor sensibilidad para detectar pacientes de alto riesgo y prevenir la MSC se logró con el algoritmo americano30.
En la actualidad, en los pacientes que han sobrevivido a una MSC debida a TV o FV, la presencia de TV sostenida espontánea que causa síncope o compromiso hemodinámico, miocardiopatía hipertróficay un factor de riesgo de MSC son las principales características para el implante de CDI en la miocardiopatía hipertrófica1.
El cardiodesfibrilador implantable en la prevención de la muerte súbita en la cardiomiopatía dilatada
La cardiomiopatía dilatada es una enfermedad del músculo cardiaco no isquémica, de etiología genética, mixta o adquirida, la cual se caracteriza por la presencia de anomalías miocárdicas tanto estructurales como funcionales, que conllevan complicaciones como las arritmias ventriculares, las cuales se asocian a desenlaces adversos como la MSC. La prevención de la MSC es uno de los objetivos en el tratamiento de estos pacientes31,32.
En los años 2002 y 2003 se publicaron dos estudios bajo la hipótesis de que en los pacientes con cardiomiopatía dilatada y grave compromiso de la FEVI (< 30-35%) el implante de un CDI disminuiría la mortalidad en comparación con los pacientes que reciben terapia medica óptima (TMO) y terapia antiarrítmica con amiodarona. El resultado de estos dos ensayos no encontró un beneficio estadísticamente significativo a favor de la terapia con CDI en el punto final primario evaluado, que fue la mortalidad. Ambos ensayos estuvieron limitados por el bajo número de pacientes33,34.
En vista de estos resultados, y aun sin resolver esta hipótesis, fue publicado el estudio DEFINITE, que incluyó 458 pacientes con cardiomiopatía dilatada, FEVI reducida y presencia de complejos ventriculares prematuros o TVNS, los cuales fueron aleatorizados a TMO sola o TMO + CDI unicameral. Se observó una reducción en el punto final primario de mortalidad por todas las causas en los pacientes tratados con un CDI (7.9 vs. 14.1%) en comparación con la TMO sola, con una reducción significativa en el subconjunto de pacientes en clase funcional III de la NYHA35. Dos metaanálisis demostraron el beneficio del CDI en la reducción de la mortalidad por todas las causas, del 19% al 24%, cuando se compara con solo tratamiento médico36,37.
La FEVI medida por ecocardiografía ha sido utilizada como principal factor de riesgo para el desarrollo de arritmias ventriculares de alto riesgo y MSC, pero en los últimos años la RM cardiaca ha demostrado ser un importante predictor de riesgo de arritmias ventriculares mediante la identificación del realce tardío de gadolinio. Recientemente se ha publicado un estudio que reclutó 452 pacientes con CMNI, ICC, clase II-III de la NYHA y FEVI < 35%, a quienes se había implantado un CDI en prevención primaria. Se realizó una estratificación del riesgo de mortalidad según la presencia o no de cicatriz del ventrículo izquierdo, demostrada por la presencia de realce tardío de gadolinio. En pacientes con cicatriz del ventrículo izquierdo, el implante de un CDI se asoció con una menor mortalidad, comparados con los pacientes sin cicatriz documentada en la RM cardiaca38. Adicionalmente, recientes publicaciones han demostrado el mayor beneficio en la prevención de la MSC que la RM y el realce tardío de gadolinio podrían tener en pacientes con riesgo bajo o intermedio para MSC, y en aquellos pacientes con una extensión del realce tardío de gadolinio > 10%39. Estos hallazgos se correlacionan con los resultados de un metaanálisis y revisión sistemática, en el cual el análisis de subgrupos reveló que el realce tardío de gadolinio pudo estratificar el riesgo de arritmia ventricular sostenida, intervención apropiada del DCI o MSC de los pacientes, con FEVI tanto preservada como reducida40.
El cardiodesfibrilador implantable en Latinoamérica
La evidencia en la disminución de la mortalidad con el uso del CDI por FV o TV no solo se ha demostrado en los países del Primer Mundo. En Latinoamérica se realizó el registro CDI-LABOR (Latin American Bioelectronic Ongoing Registry), que incluyó pacientes en prevención secundaria de muerte súbita. El objetivo principal fue evaluar el impacto en la mortalidad por todas las causas y los objetivos secundarios fueron la MSC y la muerte por ICC. Los factores de riesgo independientes asociados a mayor mortalidad en esta población fueron la edad > 70 años, el sexo masculino, la clase III-IV de la NYHA y la FEVI < 30%. No hubo diferencias en la mortalidad según la etiología de la ICC. Estos hallazgos coinciden con lo reportado en los registros mundiales41.
En el año 2018 se publicó un estudio que evaluó el impacto pronóstico de las descargas del CDI en una cohorte colombiana. El objetivo principal de este estudio fue la asociación entre las terapia apropiadas e inapropiadas del CDI y la mortalidad en estos pacientes. Un total de 530 pacientes de diferentes centros hospitalarios de la ciudad de Medellín fueron evaluados de manera prospectiva. Se encontró una mortalidad del 12.8%, mayormente representada por pacientes con etiología isquémica, los cuales tuvieron un riesgo 1.8 veces mayor que los pacientes con CMNI. En total, el 14% de los pacientes recibieron descargas apropiadas del CDI y aproximadamente el 13% de los pacientes recibieron descargas inapropiadas; hubo un 65% más de probabilidad de presentar terapia apropiada en los pacientes con cardiopatía isquémica. La hipertensión arterial, la edad > 60 años y la FEVI < 35% fueron factores de riesgo asociados a la mortalidad. La frecuencia de las terapias apropiadas del CDI fue inferior que en informes previos, probablemente relacionado con una mejor TMO y mayores controles del dispositivo en la población estudiada42.
Situaciones especiales
Implante de CDI en pacientes con enfermedad renal crónica
Las muertes de causa cardiovascular representan aproximadamente el 40% de todas las muertes de los pacientes con enfermedad renal crónica, en particular de aquellos en diálisis, dado que estos tienen un alto riesgo de arritmias ventriculares. Las guías de manejo indican que el uso de CDI se reserva para pacientes con expectativa de vida mayor de 1 año y que en general la hemodiálisis se asocia a un alto riesgo de mortalidad43, por lo cual no hay una indicación clara para el uso de CDI en este grupo de pacientes1,16 y la decisión de implantar o no un CDI se deja a juicio clínico44.
Implante de CDI en pacientes octogenarios
La muerte súbita en los pacientes mayores de 80 años está relacionada con la presencia de arritmias ventriculares malignas secundarias en un alto porcentaje a cardiopatía isquémica o cardiomiopatía dilatada. Sin embargo, en esta población las causas de muerte no cardiovasculares se incrementan respecto a los pacientes de menor edad45. Los principales ensayos clínicos de la terapia con CDI han excluido a esta población y solo se ha visto representada en un 15-20% en estos estudios. Por ello, en esta población, el implante de CDI en prevención tanto primaria como secundaria aún es controvertido46. En prevención primaria los resultados han sido contradictorios: mientras algunos estudios demuestran que tiene un efecto beneficioso similar al de la población más joven, y las descargas apropiadas del dispositivo fueron similares para los diferentes grupos de edad, otros metaanálisis no han podido demostrar una mejoría significativa en la supervivencia en estos pacientes2. Para los pacientes que han sobrevivido a una MSC secundaria a FV o TV, la decisión de implementar este tipo de terapias debería ser más sencilla; sin embargo, se deben evaluar la presencia de comorbilidad y su estado, y las condiciones psicosociales y funcionales, para definir el real beneficio. Se ha recomendado una valoración geriátrica integral para definir el real estado funcional y establecer un pronóstico en la supervivencia general. En la actualidad, y a falta de estudios contundentes que avalen el implante de CDI, en pacientes seleccionados mayores de 80 años que tengan alto riesgo de muerte por causa arrítmica y poca comorbilidad, el implante de CDI puede reducir la mortalidad y ser una terapia aceptada en esta población45.
Cardiodesfibriladores implantables subcutáneos
Los CDI usualmente son posicionados en la región infraclavicular izquierda y tienen uno o más electrodos que conectan el generador con el endocardio mediante cables por vía transvenosa. Los avances de estos dispositivos, tanto en las técnicas como en los materiales, hacen que sea un procedimiento seguro en la mayoría de los casos; sin embargo, al ser un procedimiento invasivo no está exento de complicaciones precoces (perforación de cámara cardiaca, derrame y taponamiento pericárdico, hemotórax, neumotórax) y tardías, como son las infecciones (incidencia de 9 por 1000 dispositivos/año) y la falla de los electrodos47. Con el fin de disminuir este tipo de complicaciones, en los últimos años ha venido en aumento en el uso de los CDI subcutáneos, los cuales han demostrado su efectividad en pacientes seleccionados1 (Tabla 5).
Tabla 5 Indicaciones y contraindicaciones del cardiodesfibrilador implantable subcutáneo
| Indicaciones | Contraindicaciones |
|---|---|
| Paciente joven (CMH, canalopatías) | Bradiarrtimias |
| Necesidad de CDI sin estimulación | TV respondedora a ATP |
| Alto riesgo de bacteriemia | Necesidad de resincronización |
| Deficientes accesos vasculares |
ATP: terapia de estimulación ventricular antitaquicardia; CDI: cardiodesfibrilador implantable; CMH: cardiomiopatía hipertrófica; TV: taquicardia ventricular.
Adaptada de Al-Khatib, et al.1.
Los CDI subcutáneos son dispositivos en los cuales la detección de la arritmia ventricular y la desfibrilación se producen mediante un cable que se ubica fuera del tórax, en el tejido subcutáneo, y con esto se disminuyen las complicaciones vasculares de los CDI tradicionales. Como se mencionó anteriormente, la ventaja que ofrecen es disminuir las complicaciones vasculares e infecciosas del implante convencional. La limitación principal de este dispositivo es la imposibilidad de ofrecer terapia de estimulación permanente (función de marcapasos), terapia de resincronización y terapia de estimulación ventricular antitaquicardia47.
El PRAETORIAN fue un ensayo de no inferioridad, aleatorizado y controlado, que incluyó 423 pacientes en un grupo de CDI convencional y 426 en otro grupo con CDI subcutáneo para evaluar como objetivo primario la no inferioridad en un compuesto de complicaciones asociadas con el dispositivo y descargas inapropiadas. A los 48 meses, la incidencia acumulada estimada de Kaplan-Meier del punto final primario fue del 15.1% en el grupo de CDI subcutáneo y del 15.7% en el grupo de CDI transvenoso (índice de riesgo: 0.99; intervalo de confianza del 95%: 0.71-1.39; p = 0.01 para no inferioridad). Por lo tanto, no se encontraron diferencias estadísticamente significativas entre los dos grupos en cuanto al desenlace primario, pero las complicaciones relacionadas con el dispositivo fueron mayores en el grupo de CDI convencional48.
Si bien hasta la fecha no existen claras indicaciones para la selección de un CDI subcutáneo sobre un CDI convencional, el conocimiento de algunas características clínicas de los pacientes y de las limitaciones de estos dispositivos podría mejorar la selección de pacientes para esta terapia.
Terapia médica dirigida por guías para falla cardiaca previa a la instauración de un cardiodesfibrilador implantable
Las guías de manejo recomiendan el uso de TMO al menos 3 meses antes de la instauración del CDI, dado que esta intervención podría evitar la instauración de dispositivos en algunos pacientes, y además es bien conocido que la no adherencia aumenta la mortalidad49. Medicamentos como los betabloqueadores, los antagonistas de los receptores de la angiotensina, los antagonistas de los receptores de mineralocorticoides y el inhibidor de la neprilisina ivabradina hacen parte del arsenal terapéutico con que se cuenta para el manejo de estos pacientes. Los CDI deben ser considerados en pacientes seleccionados, que cumplan con el algoritmo de manejo médico previo al implante del dispositivo, dado que algunos estudios han demostrado que tan solo el 60% de los pacientes cumplen con la TMO y menos del 30% son constantes en la adherencia a este manejo, lo cual tiene un impacto negativo en los desenlaces mayores y disminuye la efectividad de los CDI en cuanto a prevención de la mortalidad47. Si bien el implante de CDI es una terapia costo-efectiva, inclusive en nuestro sistema de salud50,51 se deben establecer sistemas de atención que agilicen los tratamientos dirigidos y mejoren la adherencia a la medicación del paciente para así maximizar la salud de este, mejorar la supervivencia y prevenir la utilización innecesaria de la atención médica49.
Recomendaciones de las guías
Las guías de la AHA/ACC y de la European Society of Cardiology (ESC) para el manejo de pacientes con arritmias ventriculares y prevención primaria de MSC fueron publicadas en 2017 y 2015, respectivamente; en las tablas 2, 3, 6 y 7 se muestran las indicaciones para el implante de CDI de acuerdo con estas guías1,16.
Tabla 6 Enfermedad de chagas
| Recomendación | ACC/AHA | ESC |
|---|---|---|
| Se debe considerar implante de CDI en pacientes con miocardiopatía chagásica y FEVI del 40% cuando se espera que la supervivencia sea mayor de 1 año | No hay recomendación | IIa/C |
ACC: American College of Cardiology; AHA: American Heart Association;
CDI: cardiodesfibrilador implantable; ESC: European Society of Cardiology;
FEVI: fracción de eyección del ventrículo izquierdo.
Tabla 7 Recomendaciones para el implante de cardiodesfibrilador implantable en pacientes con canalopatías
| Recomendaciones | ACC/AHA | ESC |
|---|---|---|
| Síndrome de QT largo | ||
| En pacientes de alto riesgo con síndrome de QT largo sintomático en los que un betabloqueador es ineficaz o no se tolera, se recomienda la intensificación de la terapia con denervación simpática cardiaca izquierda y/o un CDI | I/B | I/B |
| El implante de CDI, además del manejo con betabloqueadores, debe considerarse en pacientes que experimentaron síncope y/o TV a pesar de recibir una dosis adecuada de betabloqueadores | IIa/B | |
| El implante de CDI, además del manejo con betabloqueadores, debe considerarse en portadores asintomáticos de una mutación en KCNH2 o SCN5A cuando el QTc es > 500 ms | IIb/C | |
| Síndrome de QT corto | ||
| Se recomienda la implantación de CDI en pacientes que: a) Son sobrevivientes de un paro cardiaco y/o b) Tienen documentado un episodio de TV sostenida |
I/B | I/C |
| Síndrome de Brugada | ||
| En pacientes con TV sostenida o historia reciente de síncope presumiblemente debido a AV, se recomienda un CDI si se espera una supervivencia significativa de más de 1 año | I/B | |
| Se recomienda la implantación de CDI en pacientes que: a) Son sobrevivientes de un paro cardiaco b) Tienen documentado un episodio de TV sostenida |
I/C | |
| Se debe considerar el implante de CDI en pacientes con patrón ECG tipo I y que han presentado un episodio sincopal presumiblemente por una AV | IIa/C | |
| Se debe considerar el implante de CDI en pacientes que desarrollan FV durante una estimulación ventricular programada con dos o tres estímulos en dos sitios diferentes | IIb/C | |
| Taquicardia ventricular polimórfica catecolaminérgica | ||
| En pacientes con TV sostenida recurrente o síncope, mientras reciben la cantidad adecuada o máxima de betabloqueador tolerada, se recomienda la denervación y/o un CDI | I/B | I/C |
| Síndrome de repolarización temprana | ||
| En pacientes con repolarización temprana, paro cardiaco o evidencia de AV sostenida se recomienda implante de CDI | I/B | No hay evidencia para hacer una recomendación |
| TV/FV idiopática | ||
| En pacientes sobrevivientes de MSC debida a TV polimórfica idiopática o FV se recomienda implante de CDI si se espera una supervivencia significativa mayor de 1 año | I/B | I/B |
ACC: American College of Cardiology; AHA: American Heart Association; AV: arritmia ventricular; CDI: cardiodesfibrilador implantable; ECG: electrocardiograma;
ESC: European Society of Cardiology; FV: fibrilación ventricular; MSC: muerte súbita cardiaca; TV: taquicardia ventricular;