Introducción
La menopausia se considera como la etapa en la que finaliza la vida reproductiva de la mujer, y se define como la ausencia de menstruación durante un período de 12 meses consecutivos. La etapa de transición hacia la menopausia puede ocurrir años antes y se caracteriza por la aparición de diferentes síntomas; los más frecuentes son sequedad vaginal y síntomas vasomotores. La duración y la intensidad de estos síntomas varían en cuanto a gravedad y frecuencia, y actualmente se consideran una indicación para recibir terapia hormonal1.
La transición a la menopausia se asocia con un aumento del riesgo de enfermedad cardiovascular (ECV), atribuido principalmente a la desregulación del metabolismo de los lípidos y la glucosa, así como a la redistribución de la grasa corporal. De hecho, la evidencia epidemiológica sugiere que tanto la menopausia precoz (definida como su inicio entre los 40 y los 45 años) como la insuficiencia ovárica prematura (definida como la edad de la menopausia < 40 años) se asocian con un aumento de 1.5 a 2 veces en el riesgo de ECV2.
La ECV sigue siendo la principal causa de muerte y morbilidad en todo el mundo, y aunque las tasas generales de su incidencia disminuyeron en ambos sexos entre 1999 y 2007, los datos específicos por edad sugieren que los factores de riesgo coronario están en ascenso entre las mujeres. Lo que es aún más importante es que, durante la menopausia, cuando la incidencia de ECV aumenta al igual que en los hombres, se ha observado una mayor mortalidad en el sexo femenino después de un infarto de miocardio, lo cual puede ser explicado por su mayor probabilidad de acaecer con síntomas atípicos3,4. Las mujeres tienen menos incidencia de enfermedad obstructiva anatómica (enfermedad que involucra vasos proximales más grandes) y es más probable que presenten ECV asociada a una función ventricular izquierda conservada. El aumento de la susceptibilidad a la erosión o rotura de placas pequeñas, la microembolización distal y la disfunción microvascular pueden contribuir a estas diferencias5.
Tomando específicamente la población femenina, se ha visto que la ECV constituye la principal causa de mortalidad, lo cual explica aproximadamente el 35% de las muertes; incluso, durante el año 2019 cerca de 275 millones de mujeres fueron diagnosticadas con esta enfermedad y 8.9 millones murieron por esta causa6.
El incremento de este riesgo se asocia, en gran parte, con la mayor prevalencia de factores de riesgo para ECV; por ejemplo, la hipertensión después de los 45 años comienza a presentar un incremento notable en cuanto a prevalencia, que incluso llega a superar al de la población masculina7.
La hipertensión arterial constituye un factor de riesgo para ECV. Con frecuencia se diagnostica en la perimenopausia y la posmenopausia, y es común que no se le de la importancia adecuada. Se estima que entre un 30% y un 50% de las mujeres desarrollan hipertensión antes de los 60 años, y esta se puede manifestar con síntomas similares a los vasomotores, cefalea, dolor torácico, astenia, fatiga y trastornos del sueño; todos estos síntomas, a menudo, son atribuidos a la menopausia y no a la hipertensión arterial como tal, lo cual minimiza las implicaciones que tiene el no realizar un diagnóstico temprano de hipertensión arterial. La PA sistólica elevada se asocia con mayor rigidez vascular y miocárdica en las mujeres que en los hombres, lo cual es un factor importante que explica por qué la insuficiencia cardíaca con fracción de eyección preservada predomina en las mujeres mayores8.
Los estrógenos pueden explicar, en parte, el rol protector frente al desarrollo de la ECV en las mujeres durante la edad fértil, y su déficit en la menopausia y la posmenopausia explicaría el aumento considerable de dichas enfermedades en esta población8.
Efectos de los estrógenos y los progestágenos en el endotelio y la inflamación
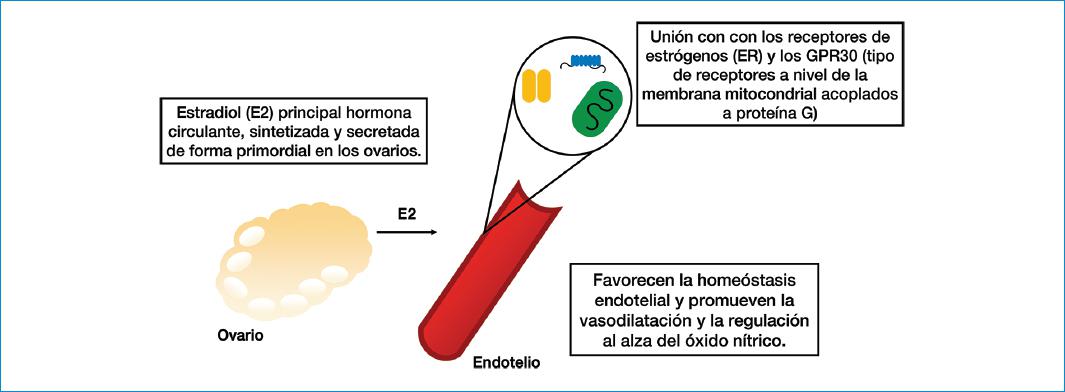
La principal hormona circulante en el cuerpo de la mujer es el estradiol, también llamado estrógeno (E2)9. Este es sintetizado y secretado de forma primordial en los ovarios, en el periodo premenopáusico, pero existen otros tejidos, como el adiposo, el cerebral, el óseo y el endotelial, que poseen la capacidad de producir E2, aunque en menor cantidad, a partir de andrógenos y estrona10. La diferencia en el sitio de producción de E2 radica en la función; el que se produce en los ovarios posee la capacidad de actuar distalmente en diferentes tejidos, mientras que el producido de forma extragonadal está limitado a una actividad paracrina en el mismo tejido que lo produce; adicionalmente, este último, en el periodo de la posmenopausia, se posiciona como la única fuente de E2 endógeno en el organismo de la mujer10.
El endotelio desempeña un papel fundamental en el mantenimiento del tono vascular y el flujo sanguíneo. Cuando se presenta una alteración endotelial que lleva a su disfunción, se desencadena una cascada inflamatoria, con producción de factores protrombóticos y vasoconstricción. La suma de estos tres factores incrementa el riesgo de presentar una ECV9. Esta estructura vascular parece ser un objetivo importante de los estrógenos. La evidencia muestra que el E2, a través de su unión con los receptores de estrógenos (ER) y los GPR30 (tipo de receptores en la membrana mitocondrial acoplados a proteína G), favorece la homeostasis endotelial y promueve la vasodilatación mediada por la óxido nítrico sintasa endotelial y la regulación al alza del óxido nítrico, mediante vías genómicas y no genómicas9-11.
El estradiol tiene un efecto antimitogénico probado en el músculo liso que se encuentra mediado por la MAP cinasa, y adicionalmente estimula el factor de crecimiento endotelial vascular, favoreciendo así la proliferación celular9.
La homeostasis mitocondrial permite el mantenimiento de un equilibrio en el metabolismo energético, las vías de apoptosis y la producción de especies reactivas de oxígeno (EROS); en la membrana de esta célula se pueden encontrar receptores tipo ER y GPR30 que, cuando son activados por el E2, pueden desarrollar cambios transcripcionales en los genes que modifican la función mitocondrial y la supervivencia celular, y que se relacionan con la cardioprotección10. En la figura 1 se ilustra el efecto estrogénico en el endotelio vascular.
Los receptores asociados a la proteína G, previamente mencionados, tienen un papel preponderante en el mecanismo antiinflamatorio y cardioprotector. Se ha evidenciado que frente a la deleción de este tipo de receptores se produce un notable incremento en el proceso aterosclerótico, un aumento en los niveles de colesterol, de lipoproteínas de baja densidad y de marcadores inflamatorios, y una menor respuesta vascular frente al óxido nítrico9.
Adicionalmente, el E2 genera un efecto cardioprotector mediado por la potenciación de la función mitocondrial, que hace que se reduzcan los EROS y disminuya el daño secundario al fenómeno de isquemia-reperfusión; de igual forma, protege contra el estrés oxidativo a través de la producción de antioxidantes, como la superóxido dismutasa y el ácido sulfúrico10. Aunque se está en un ambiente proinflamatorio, el estradiol muestra una capacidad inhibitoria frente a la producción de prostanoides vasoconstrictores a nivel endotelial, mecanismo que se encuentra mediado por los receptores acoplados a la proteína G9.
Los estudios realizados sobre la etapa de la menopausia muestran una reducción progresiva de la función endotelial a medida que avanzan los cambios derivados de este proceso. La declinación hormonal que acompaña a la menopausia hace que todos esos efectos positivos del óxido nítrico que potencia el E2 se reduzcan, y se genere una menor biodisponibilidad de este producto, lo que a su vez conlleva una disfunción endotelial aguda y va de la mano con una reducción de la dilatación mediada por flujo12.
La hipoestrogenemia durante la menopausia se asocia con una reducción del gasto energético; los niveles más bajos de estrógeno se relacionan con alteración de las conductas alimentarias, lo que promueve la hiperfagia y la obesidad; al mismo tiempo, la obesidad se asocia con depresión, que incrementa la ingesta de alimentos, los trastornos de sueño y el sedentarismo, que empeoran de nuevo la salud cardiovascular13,14.
Antecedente histórico
El tratamiento con terapia hormonal de la menopausia (THM) ha experimentado cambios importantes durante las últimas décadas; antes del año 2000, la THM se usaba ampliamente para tratar los síntomas de la menopausia. A continuación, se analizarán los estudios históricos más relevantes en la terapia hormonal15.
El estudio PEPI, publicado en 1995, enmarca el inicio de la propuesta sobre la utilidad de la THM para reducir el riesgo cardiovascular. Incluyó 875 mujeres posmenopáusicas sanas entre 45 y 64 años de edad, que no tenían ninguna contraindicación para la terapia hormonal, y se las asignó a cinco posibles grupos: 1) placebo; 2) estrógenos equinos conjugados (EEC) 0,625 mg/día; 3) EEC 0,625 mg/día con acetato de medroxiprogesterona cíclico (MPA) 10 mg/d, durante 12 días al mes; 4) EEC 0,625 mg/día más MPA consecutivo 2,5 mg/día; o 5) EEC 0,625 mg/d más progesterona micronizada cíclica (MP) 200 mg/día, durante 12 días al mes. Los resultados del estudio permitieron concluir que el estrógeno solo o en combinación con una progestina mejora las lipoproteínas y reduce los niveles de fibrinógeno sin efectos sobre la insulina ni la presión arterial. Concluyen así que el estrógeno sin oposición es el régimen óptimo para la elevación de los valores del colesterol ligado a lipoproteínas de alta densidad (HDL), pero la alta tasa de hiperplasia endometrial restringe su uso solo en mujeres sin útero; en mujeres con útero, los EEC con MP cíclica proporcionan el efecto más favorable sobre el colesterol HDL, sin aumentar el riesgo de presentar hiperplasia endometrial16.
Otro estudio de relevancia es el ensayo clínico HERS, publicado en 1998, el cual buscaba determinar si la terapia con estrógeno más progestina altera el riesgo de eventos de cardiopatía coronaria en mujeres posmenopáusicas con enfermedad coronaria establecida. Fue realizado en 20 centros de los Estados Unidos de América. La intervención fue 0,625 mg de EEC más 2,5 mg de MPA en una tableta al día (n = 1380) o un placebo de apariencia idéntica (n = 1383). Durante un seguimiento promedio de 4.1 años, el tratamiento con EEC oral más MPA no redujo la tasa general de eventos de cardiopatía coronaria en mujeres posmenopáusicas con enfermedad coronaria establecida. El tratamiento incrementó la tasa de eventos tromboembólicos. Con base en el hallazgo de ningún beneficio cardiovascular general y un patrón de aumento temprano en el riesgo de eventos de cardiopatía coronaria, el estudio no recomendó este tratamiento con el propósito de prevención secundaria de cardiopatía coronaria; sin embargo, los autores anotan que, dado al patrón favorable de eventos de cardiopatía coronaria después de varios años de terapia, podría ser apropiado que las mujeres que ya reciben este tratamiento lo continúen17.
Posteriormente, a finales de la década de 1990, se llevó a cabo el ensayo Womens Health Initiative (WHI) para determinar si la THM brindaba protección contra algunas enfermedades crónicas. Los análisis provisionales plantearon inquietudes acerca de los resultados adversos asociados, principalmente mayor riesgo de cáncer de mama en el grupo que recibió el esquema de THM combinada con estrógeno y progestina, y un mayor riesgo de accidente cerebrovascular en el grupo de estrógeno solo18,19. En ese entonces, el grupo de investigadores concluyó que el uso de THM no tenía utilidad para la prevención primaria de enfermedades crónicas y el estudio se terminó. Posterior a esto, hubo una intensa cobertura mediática que condujo a una disminución drástica y persistente en el uso de THM en el mundo. A raíz de esto, se llevaron a cabo análisis exhaustivos a cargo del WHI, que generaron dudas sobre la validez de las conclusiones iniciales, ya que los datos estratificados por edad indicaron que la mortalidad por todas las causas fue baja en las mujeres de 50 a 59 años al inicio del tratamiento y que los beneficios en este grupo de edad se mantuvieron durante un seguimiento acumulado de 18 años. Por el contrario, no se observaron efectos positivos en mujeres de 60 a 69 años y de 70 a 79 años al inicio del tratamiento20.
Con base en lo anterior, es preciso mencionar que durante el año 2016 dos investigadores del WHI realizaron una publicación en la literatura médica: «la renuencia a tratar los síntomas de la menopausia ha descarrilado y fragmentado la atención clínica de las mujeres de mediana edad, creando una gran e innecesaria carga de sufrimiento. Los médicos que se mantienen actualizados respecto a los tratamientos hormonales y no hormonales pueden volver a encarrilar el control de la menopausia ayudando a las mujeres a tomar decisiones de tratamiento informadas. Además, debemos capacitar y equipar a la próxima generación de proveedores de atención médica con las habilidades para abordar las necesidades actuales y futuras de esta población de pacientes»21. El objetivo de dicha publicación fue contrarrestar la confusión causada por los hallazgos de los ensayos del WHI.
Es por esto que, durante los últimos años, la literatura médica ha ido enfatizando en realizar actualizaciones de las pautas de manejo para la elección de las pacientes que son candidatas a recibir terapia hormonal. Existe un gran acuerdo en que hay una relación riesgo/beneficio favorable para las pacientes que inician el tratamiento entre los 50 y los 59 años de edad o dentro de los 10 años del inicio de la menopausia, teniendo como base que el principal objetivo es aliviar los síntomas vasomotores y urogenitales. Respecto al riesgo cardiovascular, también hay evidencia de que administrar THM a una edad más temprana (menos de 60 años) puede proteger contra la mortalidad de origen cardíaco o los episodios de enfermedad coronaria; esto se corrobora mediante una revisión sistemática reciente que examinó la «hipótesis del momento oportuno», en la que se hace énfasis en el inicio temprano de esta (antes de los 60 años)21. Sin embargo, a pesar de la evidencia acumulada y del apoyo generalizado para el uso de THM en mujeres menopáusicas sintomáticas más jóvenes, la comunidad médica ha respondido con lentitud y ha hecho pocos o ningún cambio en las prácticas de prescripción22.
Ventana de oportunidad o hipótesis del tiempo
Uno de los paradigmas en evolución más importantes que resultan de la investigación de la THM hasta la fecha ha sido la llamada «hipótesis del tiempo», que se refiere a los diferentes efectos de la suplementación hormonal en el sistema cardiovascular en diferentes edades y etapas17.
Se establece que el riesgo de mortalidad por causa cardiovascular se reduce en un 48%, el de mortalidad total un 30% y el de enfermedad de arterias coronarias un 28% a 32% si la THM se inicia dentro de los primeros 10 años de posmenopausia o antes de los 60 años de edad, pero no cuando se inicia después de los 60 años o 10 años o más después de la menopausia; evidencia que ha sido apoyada por múltiples metaanálisis existentes en la literatura científica23,24.
Otros dos ensayos clínicos que abordan la hipótesis del tiempo son el Kronos Early Estrogen Prevention Study (KEEPS) y el Early versus Late Intervention Trial (ELITE).
El estudio ELITE es un ensayo clínico aleatorizado de un solo sitio en el que participaron 643 mujeres sin antecedentes de ECV, diseñado específicamente para estudiar la hipótesis del tiempo utilizando la aterosclerosis subclínica medida por el grosor de la íntima-media carotídea como resultado primario. Los resultados de la totalidad de los datos muestran que la THM disminuye la cardiopatía coronaria y la mortalidad general cuando se inicia en mujeres menores de 60 años o con menos de 10 años de menopausia, lo que brinda una «ventana de oportunidad»25.
Por su parte, el KEEPS es un estudio de nueve centros en los Estados Unidos de América que involucró a 727 mujeres recientemente menopáusicas, de 42 años de edad, y buscaba evaluar la progresión de la aterosclerosis y los factores de riesgo de ECV después de la THM iniciada en la menopausia precoz. Se realizó asignación al azar a tres grupos: 1) 0,45 mg de EEC por vía oral más 100 mg de progesterona micronizada; 2) 50 mg de 17-beta estradiol transdérmico más 100 mg de progesterona micronizada; o 3) placebo. Los resultados del ensayo, después de 4 años de asignación al azar, arrojan que no hubo diferencias significativas en la progresión de las puntuaciones de calcio de la arteria carótida, la aterosclerosis subclínica medida por el grosor de la íntima-media carotídea ni la presión arterial entre los grupos del estudio. Se concluye que 4 años de THM precoz no afectaron la progresión de la aterosclerosis y mejoraron algunos marcadores de riesgo de ECV26.
Ambos estudios constituyen peso científico a favor de la recomendación actual de emplear terapia de reemplazo hormonal (TRH) y su asociación con la mejoría del riesgo cardiovascular, teniendo en cuenta la edad menor de 60 años y haber transcurrido menos de 10 años de menopausia.
Elección de la terapia
El manejo eficaz de los síntomas vasomotores con la THM puede impactar positivamente no solo el riesgo cardiovascular, sino también evitar las alteraciones metabólicas y la depresión y sus consecuencias, como el sedentarismo, que pueden potenciar el desarrollo de ECV. Las mujeres que padecen síntomas menopáusicos graves tienen un riesgo ocho veces mayor de sufrir una discapacidad laboral, lo que conduce a una menor productividad, más ausentismo, una terminación más temprana de la participación laboral y un aumento en los costos del empleador y de la comunidad de atención médica. La mejoría en la calidad de vida que se da al manejar adecuadamente los síntomas vasomotores de la menopausia evita de forma importante lo mencionado antes27.
Es primordial que durante esta etapa se brinde asesoría a la paciente sobre la realización de ejercicio físico regular, pues este, por sí solo, tiene un efecto beneficioso sobre los síntomas vasomotores y la calidad de vida28.
Según lo anterior, se avala de manera científica que la TRH ejerce un efecto favorable sobre los factores de riesgo de ECV con diferencias sutiles en cuanto a dosis de estrógenos, vía de administración, monoterapia o combinación con progestágeno y tipo de progestágeno. En cuanto a la morbilidad y la mortalidad por ECV, la mayoría de los estudios han demostrado un efecto beneficioso de la terapia hormonal en las mujeres durante la edad menopáusica temprana (< 10 años desde el último período menstrual) o menores de 60 años, y se hace especial énfasis en mujeres con menopausia precoz y falla ovárica prematura, ya que, si no se tratan, tienen un gran riesgo de desarrollar complicaciones del hipoestrogenismo, como son la osteoporosis y la enfermedad cardiovascular; además, tienen un riesgo incrementado de debutar con otros desenlaces adversos, como demencia, depresión y muerte prematura. Las pacientes que se encuentran en la perimenopausia y en la posmenopausia inmediata también se benefician de ser suplementadas con hormonas; estas tienen un perfil beneficio/riesgo favorable, siempre que no exista un riesgo elevado de ECV según la evaluación de las herramientas de cálculo de 10 años1.
Una estrategia que se podría considerar útil es la estratificación del riesgo cardiovascular de las pacientes, ya que permite no solo establecer recomendaciones sobre estilos de vida, sino que también podría emplearse como una herramienta para seleccionar la población para la elección de candidatas a THM. Las escalas de predicción permiten establecer el riesgo cardiovascular durante un período específico de tiempo, empleando factores de riesgo y medidas antropométricas; no obstante, es importante establecer que estas escalas deberían ser individualizadas y validadas en la población concreta en la que se desean emplear29.
La THM puede darse como estrógenos solos en pacientes con ausencia de útero y como estrógenos con progesterona en pacientes con útero intacto. Las presentaciones pueden variar: implantes, parches transdérmicos o crema vaginal. Respecto a las progesteronas, una revisión que analizó sus estructuras químicas, relaciones estructura-función, metabolismo, parámetros farmacocinéticos, mecanismos intracelulares, potencia, eficacia y efectos biológicos y clínicos, determinó, respecto a la evaluación del riesgo trombótico y tromboembólico, que la progesterona puede tener un riesgo cardiovascular reducido en comparación con otros progestágenos1. Las propiedades de cada progestágeno deben evaluarse cuidadosamente de forma individual para determinar su utilidad en la terapia hormonal posmenopáusica30.
Los estrógenos transdérmicos tienen un riesgo menor de trombosis en comparación con los regímenes orales. En cuanto a los progestágenos, la progesterona natural y la didrogesterona tienen un efecto neutro sobre los factores de riesgo de ECV. En cualquier caso, la decisión de recibir THM debe ser individualizada, adaptada a los síntomas, la preferencia de la paciente y el riesgo de ECV, de episodios trombóticos y de cáncer de mama2.
El esquema puede darse de forma continua o cíclica. Las tablas 1 y 2 resumen las opciones de gestágenos y estrógenos disponibles actualmente en Colombia, mientras que la tabla 3 evidencia los regímenes de tratamiento continuo disponibles; en el momento no se cuenta en el país con regímenes cíclicos en una sola píldora, por lo cual, en caso de que se elija la opción cíclica, deben combinarse las opciones disponibles de estrógenos y gestágenos. La paciente debe recibir información sobre las opciones de tratamiento que existen de acuerdo con su riesgo individual, y sobre las consecuencias de recibir o no terapia hormonal, recordando siempre que el objetivo inicial que menciona la literatura médica para su implementación es el manejo de los síntomas vasomotores de la menopausia y la mejoría de la atrofia vulvovaginal, con el objetivo de mejorar la calidad de vida e impactar en la mejoría del riesgo cardiovascular según sea el escenario de la paciente.
Tabla 1 Presentaciones de estrógenos disponibles en Colombia
| Compuesto hormonal | Presentación |
|---|---|
| Estrógenos conjugados | Oral – Tableta ranurada 0.625 mg (caja × 28) Tópica –Crema vaginal 0.625 mg/g (tubo 26 g con aplicador) – Crema vaginal 0.625 mg/g (tubo 40 g con 4 aplicadores) |
| Valerato de estradiol | Oral – Gragea 2 mg (caja × 28). |
| Estradiol | Tópica – Solución para pulverización transdérmica. 1.53 mg/dosis. Para dos aplicaciones diarias – Parches transdérmicos de 17 β–estradiol de aplicación semanal (50 µg en 24 horas, caja × 4) – Gel percutáneo – gel 0.06% (fco × 60 dosis de 0.06% de gel equivalente a 0,75 mg de 17 β–estradiol). Dosis diaria 1 o 2 puff |
| Estriol | Vaginal – Óvulo 0.5 mg (caja×15) – Óvulo vaginal de liberación sostenida 3.5 mg (caja × 6). Cada 100 g contienen estriol 0,1 g (tubo × 20 g con 5 aplicadores |
Tabla 2 Presentaciones de gestágenos disponibles en Colombia
| Compuesto hormonal | Presentación |
|---|---|
| Acetato de medroxiprogesterona | Tabletas orales de 5 mg (caja × 30) y 10 mg (caja × 28) |
| Progesterona natural micronizada | Cápsula uso oral o vaginal 100 mg y 200 mg |
| Didrogesterona | Comprimidos orales 10 mg |
Tabla 3 Compuestos hormonales combinados recomendados en la menopausia
| Compuesto hormonal | Presentación | Características |
|---|---|---|
| Estradiol 1 mg + | – Drospirenona 2 mg caja × 28 – Didrogesterona 5 mg caja × 28 – Dienogest 2 mg, caja × 28 |
Todas las presentaciones de terapia continua de estrógenos + gestágeno diaria, se utiliza 1 comprimido al día sin interrumpir |
| Estradiol 2 mg + | Dienogest 2 mg, caja × 28 |
Terapia de reemplazo hormonal en situaciones especiales
La TRH en las pacientes con una comorbilidad como la diabetes es un punto álgido en la literatura. El hecho de que esta enfermedad sea considerada un equivalente de riesgo cardiovascular hace que exista temor en la formulación de THM para dicha población. Las diferentes guías internacionales no tienen un consenso establecido al respecto: mientras unas no tienen en consideración este escenario, otras establecen algunos puntos, como que esta puede considerarse siempre y cuando se tenga en cuenta el resto de la comorbilidad de la paciente y la decisión sea tomada por un profesional31.
Se establece que, posterior a la evaluación del riesgo cardiovascular de la paciente y una vez establecido que es candidata a la terapia, se prefiera el uso de estrógenos transdérmicos y progesterona micronizada u otros preparados de progestágenos menos activos desde el punto de vista metabólico. Diferentes estudios sugieren que la THM podría mejorar el control glucémico en las pacientes diabéticas durante el período de la posmenopausia, con un mayor beneficio sobre los valores de glucemia en ayunas31,32.
La evaluación de los beneficios de la THM en mujeres con obesidad arroja información respecto a efectos positivos en la mejoría de la esteatosis hepática y del sobrepeso. A pesar de esto, no se tienen recomendaciones puntuales para el uso de THM en mujeres con obesidad; por el contrario, se enfatiza en las recomendaciones generales que aplican a todas las mujeres en la menopausia33:
– Mantener un peso corporal adecuado.
– Realizar actividad física de manera frecuente.
– Llevar una dieta saludable, como la mediterránea, para controlar el peso y obtener los beneficios cardiovasculares de la misma.
– Evitar el tabaquismo y la ingesta de alcohol.
– Incrementar el aporte de vitamina D y de calcio.
Adicionalmente, destacan que el sobrepeso y la obesidad están asociados con una mayor posibilidad de síntomas vasomotores, y los mismos se reducirían con la pérdida de peso33.
La hipertensión arterial es considerada un factor de riesgo cardiovascular mayor en las mujeres posmenopáusicas. Posterior a la publicación del WHI se creó una alarma frente a la preocupación por encontrar que la THM estaba asociada con un incremento en la probabilidad de desarrollar hipertensión. No obstante, lo que muestra actualmente la literatura es que la THM está asociada con una disminución de la presión arterial, no cambios o un sutil incremento en la misma en comparación con el placebo34.
Respecto al uso de estrógenos solos, se encontró una disminución de la presión arterial, tanto sistólica como diastólica, en mujeres posmenopáusicas con y sin hipertensión, siendo más notoria en el grupo de mujeres hipertensas. Cuando se evaluaron los estrógenos junto con progestinas en esta misma población, se describe en algunos estudios que, junto con didrogesterona, puede presentarse un incremento entre 6.8 y 8.6 mmHg en la presión sistólica y diastólica, respectivamente. Por otra parte, cuando se estudió el uso de progestinas, como drospirenona, se encontró una reducción significativa de la presión arterial tanto en el consultorio como en el promedio de 24 horas35.
En cuanto al cáncer endometrial, la evidencia actual sugiere que la recurrencia y la tasa de muerte tienen valores similares en la población con antecedente de cáncer en etapas iniciales y de bajo riesgo (grados 1 y 2, subtipos endometrioides negativos para receptores hormonales), mientras que en etapas avanzadas no se recomienda el uso de THM. Para el cáncer de ovario, la información no está tan clara; no se ha visto un incremento en el riesgo de recurrencia o de muerte, pero existe preocupación en caso de antecedentes de tumores que podrían contener receptores hormonales, como carcinomas serosos de bajo grado, de las células de la granulosa, entre otros36.
Conclusiones
La ECV constituye la principal causa de muerte en el mundo. Las mujeres, durante la menopausia, experimentan un riesgo aumentado de muerte por ECV. El efecto protector de los estrógenos cae en esta etapa de la vida y hace que las mujeres estén predispuestas no solo a una mayor mortalidad por esta causa, sino también a presentar otras enfermedades o condiciones que incrementan de forma adicional el riesgo cardiovascular, como obesidad, sedentarismo, trastornos psicológicos, estrés, ansiedad y trastornos del sueño. El manejo correcto de los síntomas vasomotores durante la menopausia con TRH ha permitido impactar de manera positiva sobre estos desenlaces, ya que ha mejorado la calidad de vida y ha reducido las complicaciones propias de esta etapa de la vida. Se deben elegir adecuadamente las pacientes que se beneficiarán de recibir terapia hormonal, recordando que su indicación es la mejoría de los síntomas vasomotores; se invita a tener presente el concepto de «ventana de oportunidad» para su uso.
Adicionalmente, es importante que el personal de salud de atención primaria esté preparado para brindar asesoría y tratamiento a estas pacientes, fortalecer las estrategias para mejorar la calidad en la atención a las mujeres durante la menopausia, tanto por medicina general como por diversas especialidades (como cardiología, ginecología y endocrinología), y recomendar tener un estilo de vida saludable para mejorar su salud cardiovascular durante esta etapa de la vida.