Introducción
La terapia antiplaquetaria dual con aspirina y clopidogrel con miras a inhibir la agregación plaquetaria y prevenir eventos isquémicos es efectiva cuando se administra a pacientes con síndrome coronario agudo (SCA) o a aquellos sometidos a intervención coronaria percutánea1. El mecanismo de acción de la aspirina (ácido acetilsalicílico) es bloquear de manera irreversible la ciclooxigenasa (COX), enzima presenta dos isoformas: la COX-1, que es una enzima constitutiva presente en la mayoría de las células, y la COX-2, que se expresa únicamente en respuesta a estímulos inflamatorios. Esta inhibición bloquea la producción de tromboxano A2 y, por ende, la agregación plaquetaria inducida por esta vía2. Por otro lado, el clopidogrel es una tienopiridina que inhibe en forma selectiva e irreversible el receptor plaquetario del adenosín difosfato, lo que bloquea la activación de la glucoproteína IIb/IIIa (GpIIb-IIIa) y la agregación de las plaquetas3.
Varios estudios han mostrado una respuesta reducida o «resistencia» a estos medicamentos4. En términos clínicos, se refiere a pacientes que presentan eventos isquémicos, a pesar de recibir el antiagregante en la dosis indicada. Desde el punto de vista del laboratorio, se refiere a quienes no logran un adecuado grado de inhibición plaquetaria posterior a la administración del medicamento, con lo que se desencadena un estadio de hiperreactividad plaquetaria, con una prevalencia que va desde el 0.4% hasta el 57% en el caso de la aspirina y desde el 4% hasta el 30% para el clopidogrel.
Para definir la hiperreactividad plaquetaria en el laboratorio se utilizan técnicas como la agregometría plaquetaria, a través de diferentes tipos de agregómetros que se clasifican de acuerdo con la tecnología empleada para evaluar la respuesta plaquetaria.
Dos de las principales enfermedades que presentan como comorbilidad los pacientes que serán sometidos a intervención coronaria percutánea son la diabetes mellitus y la hipertensión arterial. La primera se define como una enfermedad crónica, con una fisiopatología dada por una deficiencia en la producción de insulina por parte de las células beta del páncreas, o cuando no se utiliza eficazmente esta enzima5, y la segunda consiste en presiones arteriales persistentes iguales o superiores a 140/90 mmHg6. Se ha documentado que cursar con diabetes mellitus aumenta la probabilidad de formar placa aterosclerótica, lo que suele estar asociado con un estado protrombótico dado por disfunción endotelial, alteración de la fibrinólisis, aumento de los factores de coagulación y función plaquetaria alterada, que disminuye la respuesta a los agentes antiplaquetarios7. La hipertensión arterial, por su parte, se asocia con disfunción endotelial e interacciones deterioradas entre las plaquetas y el revestimiento endotelial de la luz arterial, lo que causa una disminución en la respuesta a los agentes antiagregantes.
Todo esto debe ser evaluado al momento de elegir la terapia antiagregante adecuada para el paciente, ya que se ha demostrado que la hiperreactividad plaquetaria está asociada con un alto riesgo de eventos cardiovasculares adversos mayores después de una intervención coronaria percutánea8. Muchos estudios han probado que los cambios en la terapia de los pacientes que cursan con hiperreactividad plaquetaria, como el aumento de la dosis tradicionalmente utilizada para clopidogrel de 300 a 600 mg antes de la intervención coronaria percutánea, tiene un impacto positivo ya que reduce los eventos cardiovasculares adversos mayores9, aunque también nuevas combinaciones con otro tipo de antiagregantes, como el ticagrelor, podrían tener un impacto positivo10. Por ello, la terapia personalizada, la asociación entre comorbilidad y la posible presencia de hiperreactividad plaquetaria han cobrado relevancia en dicho abordaje; en concordancia con lo anterior, la respuesta correcta a los antiagregantes utilizados es fundamental para el éxito de la terapia.
En consecuencia, se planteó realizar un metaanálisis de la frecuencia de hiperreactividad plaquetaria para aspirina y clopidogrel con diferentes agregómetros, en pacientes con diabetes mellitus e hipertensión arterial, sometidos a intervención coronaria percutánea.
Método
Revisión sistemática de la literatura científica con metaanálisis, que basó su protocolo de búsqueda y selección de estudios en la guía PRISMA. Se realizó una búsqueda en tres bases de datos interdisciplinarias: PubMed, SciELO y ScienceDirect. Para ello se emplearon los términos determinados por la técnica de cosecha de perlas: VerifyNow, Rotem, PFA, Light Transmission Aggregometry, Multiple Electrode Platelet Aggregometry, Cardiac Surgery, Thoracic Surgery, Heart Surgery, Cardiac Surgical Procedures, Heart Surgical Procedures, Cardiopulmonary Bypass, Open Heart Surgery y Coronary Intervention.
Se incluyeron los artículos que contenían los términos de búsqueda en el título, el resumen o las palabras clave, y se eliminaron los títulos duplicados. Posteriormente, se aplicaron como criterios de inclusión que fueran estudios en español, inglés o portugués, que estuvieran asociados al tema de interés (la intervención coronaria percutánea) y que fueran artículos originales y estuvieran disponibles en las bases de datos bibliográficas.
Se excluyeron los artículos que evaluaban condiciones preanalíticas, la función plaquetaria en términos de sangrado y aquellos que presentaban información incompleta, dado que no mostraban el número de pacientes que tenían hiperreactividad plaquetaria, diabetes mellitus e hipertensión.
La caracterización de los estudios se realizó con extracción de las variables: título, autores, tipo de estudio, tema principal del estudio, revista, año de publicación, primer autor, país de estudio, número de pacientes evaluados, frecuencia de la hiperreactividad plaquetaria, pacientes diabéticos o no y su frecuencia de hiperreactividad plaquetaria, pacientes hipertensos o no y su frecuencia de hiperreactividad plaquetaria, agregómetro utilizado, condiciones de toma de muestra y valor de corte utilizado.
Se evaluó la reproducibilidad de la búsqueda de estudios y la extracción de la información por parte de dos investigadores entre el 30 de mayo y el 30 de octubre de 2020, que aplicaron el protocolo de manera independiente, resolviendo las discrepancias por consenso. La calidad metodológica de los estudios incluidos se determinó con la guía STROBE.
Para el análisis de la información se hizo una descripción general de los estudios y posteriormente se determinó la frecuencia de hiperreactividad plaquetaria en pacientes con y sin diabetes mellitus y en pacientes con y sin hipertensión; finalmente, se comparó la hiperreactividad plaquetaria en pacientes con y sin diabetes mellitus y en pacientes con y sin hipertensión por medio de metaanálisis y razón de disparidad, ya que se considera como una medida epidemiológica robusta para hacer comparaciones entre casos y controles11. En todos los metaanálisis se evaluaron la heterogeneidad con el gráfico de Galbraith, Dersimonian y Laird (estadístico Q con distribución de ji al cuadrado) y el coeficiente RI; el sesgo de publicación con el estadístico de Begg y funnel plot; y el análisis de sensibilidad con un gráfico de influencias. Los resultados finales de los metaanálisis se presentan como forest plot, para lo cual se utilizó el software Epidat con un intervalo de confianza del 95%.
Resultados
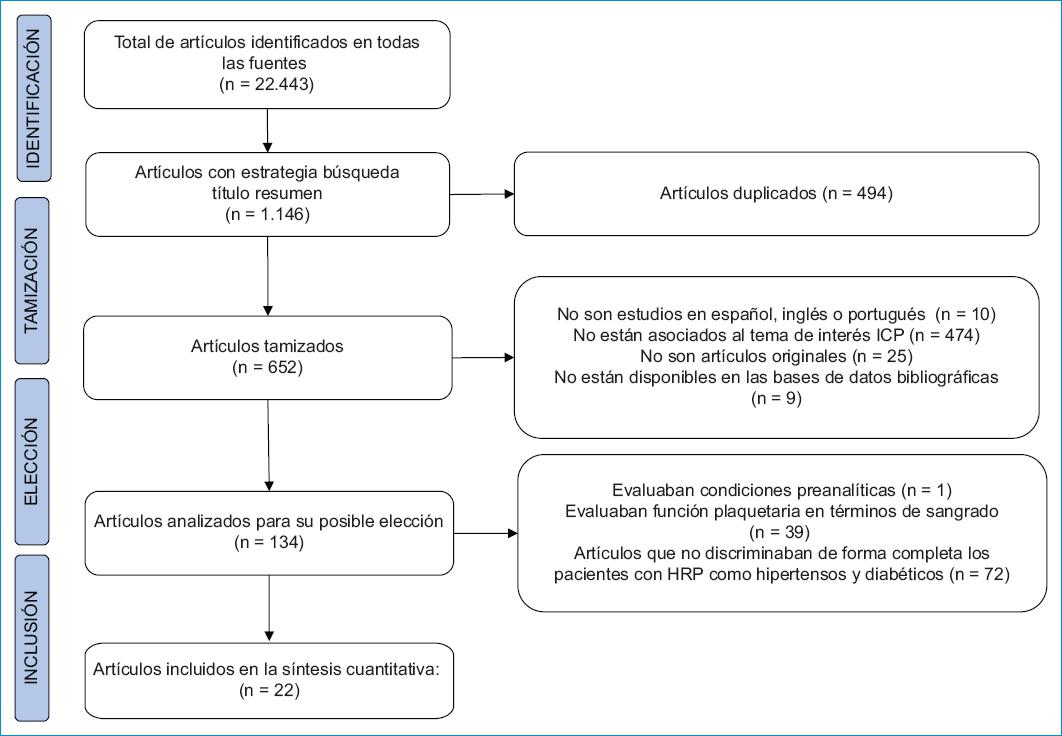
Se obtuvieron 22,443 estudios sin la aplicación de límites, los cuales se restringieron a 1146 resultados con la búsqueda en el título, el resumen y las palabras clave. De estos, se eliminaron 494 artículos duplicados, 518 que no cumplían los criterios de inclusión y 112 que cumplían los criterios de exclusión. Finalmente, se tomaron 22 estudios para la síntesis cuantitativa de la información (Fig. 1).
Los estudios se publicaron entre 2005 y 2019 (Tabla 1). Los países con mayor número de estudios fueron Italia (n = 8) y Corea (n = 5). El análisis por continentes muestra que el mayor número de estudios provienen de Europa, con el 59%, y Asia, con el 32%, seguidos de América y África, con un 4.5% cada uno, todos ellos en pacientes sometidos a intervención coronaria percutánea.
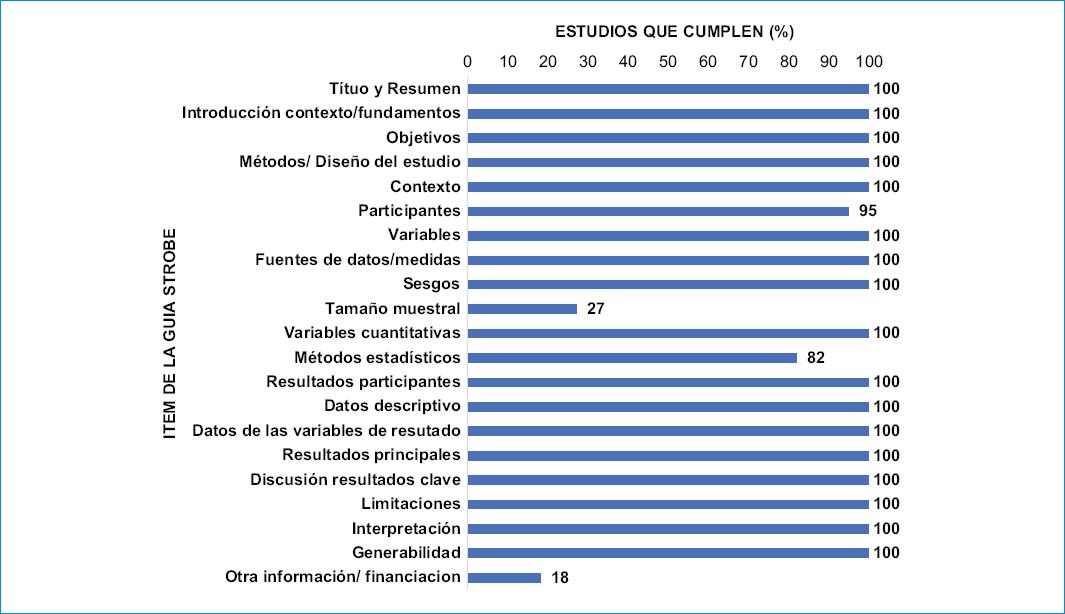
La evaluación de la calidad metodológica de los estudios incluidos mostró que el porcentaje de cumplimiento fue superior al 80% (Tabla 2) de los criterios de acuerdo con la guía STROBE. Los criterios que presentaron menor porcentaje de cumplimiento fueron la explicación del tamaño de la muestra, la indicación de la fuente de financiación del estudio y la explicación en el tratamiento de datos ausentes (Fig. 2).
Tabla 1 Descripción de los artículos incluidos
| Estudio | Año | País | Antiagregante evaluado | Agregómetro | Punto de corte para hiperreactividad plaquetaria | Momento en que se toma la muestra |
|---|---|---|---|---|---|---|
| Aradi et al.29 | 2010 | Hungría | Clopidogrel | LTA | Agregabilidad máxima > 34% | Después de ICP |
| Salah et al.30 | 2015 | Egipto | Aspirina | LTA | Agregabilidad media > 20% | Después de ICP |
| Sibbing et al.31 | 2010 | Alemania | Clopidogrel | MEA | 416 AU | Antes de ICP |
| Siller Matula et al.32 | 2013 | Austria | Clopidogrel y aspirina | MEA | ≥ 480 AU | Después de ICP |
| Wand et al.33 | 2018 | Alemania | Aspirina | MEA | ≥ 400 AU | Después de ICP |
| Gianetti et al.34 | 2006 | Italia | Aspirina | PFA 100 | CT<190s | Después de ICP |
| Gianetti et al.35 | 2007 | Italia | Aspirina | PFA 100 | CT<190s | Después de ICP |
| Chen et al.36 | 2005 | China | Aspirina | VerifyNow | ≥ 550 ARU | Antes de ICP |
| Price et al.37 | 2008 | USA | Clopidogrel | VerifyNow | PRU≥235 | Después de ICP |
| Marcucci et al.38 | 2009 | Italia | Clopidogrel | VerifyNow | PRU≥240 | Después de ICP |
| Mangiacapra et al.39 | 2010 | Italia | Clopidogrel | VerifyNow | PRU≥240 | Después de ICP |
| Kim et al.40 | 2010 | Corea | Clopidogrel | VerifyNow | PRU≥240 | Después de ICP |
| Mangiacapra et al.41 | 2012 | Italia | Clopidogrel | VerifyNow | PRU≥240 | Después de ICP |
| Ahn et al.42 | 2012 | Corea | Clopidogrel | VerifyNow | PRU≥72 | Después de ICP |
| Jin et al.43 | 2013 | Corea | Clopidogrel | VerifyNow | PRU≥282 | Después de ICP |
| Park et al.44 | 2013 | Corea | Clopidogrel | VerifyNow | PRU≥235 | Después de ICP |
| Mangiacapra et al.45 | 2014 | Italia | Clopidogrel | VerifyNow | PRU≥240 | Antes de ICP |
| Capranzano et al.46 | 2016 | Italia | Clopidogrel | VerifyNow | PRU≥208 | Después de ICP |
| Mangiacapra et al.47 | 2018 | Italia | Clopidogrel | VerifyNow | PRU≥240 | Antes de ICP |
| Fadhil et al.48 | 2019 | Irak | Clopidogrel | VerifyNow | PRU≥208 | Antes de ICP |
| Lee et al.49 | 2019 | Corea | Clopidogrel | VerifyNow | PRU≥208 | Después de ICP |
| Lattuca et al.50 | 2019 | Francia | Clopidogrel | VerifyNow | PRU≥235 | Antes de ICP |
ICP: intervención coronaria percutánea.
Tabla 2 Porcentaje de cumplimiento según la guía STROBE
| Estudio | Porcentaje cumplimiento según STROBE |
|---|---|
| Chen et al.36, 2005 | 84.85 |
| Gianetti et al.34, 2006 | 93.94 |
| Gianetti et al.35, 2007 | 93.94 |
| Price et al.37, 2008 | 100 |
| Sibbing et al.31, 2009 | 90.91 |
| Marcucci et al.38, 2009 | 90.91 |
| Mangiacapra et al.39, 2010 | 96.97 |
| Aradi et al.29, 2010 | 89.19 |
| Kim et al.40, 2010 | 90.91 |
| Mangiacapra et al.41, 2012 | 93.94 |
| Ahn et al.42, 2012 | 93.94 |
| Siller-Matula et al.32, 2013 | 100 |
| Jin et al.43, 2013 | 93.94 |
| Park et al.44, 2013 | 96.97 |
| Mangiacapra et al.45, 2014 | 93.94 |
| Salah et al.30, 2015 | 90.91 |
| Capranzano et al.46, 2016 | 90.91 |
| Mangiacapra et al.47, 2018 | 90.91 |
| Wand et al.33, 2018 | 96.97 |
| Fadhil et al.48, 2019 | 90.91 |
| Lee et al.49, 2019 | 93.94 |
| Lattuca et al.50, 2019 | 100 |
Un dato importante que se observa en los artículos seleccionados es la heterogeneidad en la frecuencia de hiperreactividad plaquetaria; en el caso de la aspirina, va desde el 18.8% hasta el 81.8% (Tabla 3), y para el clopidogrel desde el 18.2% hasta el 71.3%. Dicha heterogeneidad se puede observar también cuando se compara entre agregómetros, e incluso cuando se usa el mismo agregómetro (VerifyNow), pero con valores de referencia o puntos de corte diferentes. La frecuencia de hiperreactividad plaquetaria en los pacientes diabéticos varió desde el 21% hasta el 78.7% (Tabla 4), y en los pacientes hipertensos desde el 17.6% hasta el 76.8% (Tabla 5).
Tabla 3 Frecuencia de hiperreactividad plaquetaria por estudio en toda la población
| Estudio | Antiagregante evaluado | Agregómetro | n | Pacientes con hiperreactividad plaquetaria | Pacientes sin hiperreactividad plaquetaria | Frecuencia de hiperreactividad plaquetaria % (IC95%) |
|---|---|---|---|---|---|---|
| Aradi et al.29, 2010 | Clopidogrel | LTA | 202 | 85 | 117 | 42 (35-49.1) |
| Salah et al.30, 2015 | Aspirina | LTA | 50 | 24 | 26 | 48 (33.1-62.8) |
| Sibbing et al.31, 2009 | Clopidogrel | MEA | 1608 | 323 | 1285 | 20 (18-22) |
| Siller-Matula et al.32, 2013 | Clopidogrel | MEA | 403 | 75 | 328 | 18.6 (14.6-22.5) |
| Siller-Matula et al.32, 2013 | Aspirina | MEA | 394 | 100 | 294 | 25.3 (20.9-29.8) |
| Wand et al.33, 2018 | Aspirina | MEA | 364 | 298 | 66 | 81.8 (77.7-85.9) |
| Gianetti et al.34, 2006 | Aspirina | PFA 100 | 175 | 75 | 100 | 42.8 (35.2-50.5) |
| Gianetti et al.35, 2007 | Aspirina | PFA 100 | 256 | 109 | 147 | 37.7 (31.9-43.4) |
| Chen et al.36, 2005 | Aspirina | VerifyNow | 117 | 22 | 95 | 18.8 (11.3-26.3) |
| Price et al.37, 2008 | Clopidogrel | VerifyNow | 380 | 122 | 258 | 32.1 (27.3-36.9) |
| Marcucci et al.38, 2009 | Clopidogrel | VerifyNow | 683 | 219 | 464 | 32 (28.5-35.6) |
| Mangiacapra et al.39, 2010 | Clopidogrel | VerifyNow | 250 | 78 | 172 | 31.2 (25.2-37.1) |
| Kim et al.40, 2010 | Clopidogrel | VerifyNow | 1058 | 546 | 512 | 51.6 (48.5-54.6) |
| Mangiacapra et al.41, 2012 | Clopidogrel | VerifyNow | 732 | 240 | 492 | 19.6 (17.4-21.9) |
| Ahn et al.42, 2012 | Clopidogrel | VerifyNow | 1226 | 410 | 816 | 33.4 (30.7-36.1) |
| Jin et al.43, 2013 | Clopidogrel | VerifyNow | 181 | 54 | 127 | 29.8 (22.8-36.7) |
| Park et al.44, 2013 | Clopidogrel | VerifyNow | 2424 | 1498 | 926 | 61.8 (59.8-63.7) |
| Mangiacapra et al.45, 2014 | Clopidogrel | VerifyNow | 640 | 190 | 450 | 29.7 (26-33.3) |
| Capranzano et al.46 2016 | Clopidogrel | VerifyNow | 164 | 117 | 47 | 71.3 (64.1-78.5) |
| Mangiacapra et al.47, 2018 | Clopidogrel | VerifyNow | 500 | 170 | 330 | 34 (29.7-38.2) |
| Fadhil et al.48,2019 | Clopidogrel | VerifyNow | 115 | 21 | 94 | 18.2 (10.7-25.7) |
| Lee et al.49, 2019 | Clopidogrel | VerifyNow | 814 | 484 | 330 | 59.4 (56-62.8) |
| Lattuca et al.50, 2019 | Clopidogrel | VerifyNow | 1175 | 419 | 756 | 35.6 (32.8-38.4) |
IC95%: intervalo de confianza del 95%.
Tabla 4 Frecuencia de hiperreactividad plaquetaria por estudio en los pacientes diabéticos y no diabéticos
| Estudio | Frecuencia de diabéticos con hiperreactividad plaquetaria % (IC95%) | Frecuencia de no diabéticos con hiperreactividad plaquetaria % (IC95%) |
|---|---|---|
| Aradi et al.29, 2010 | 41 (27.3-54.8) | 42.4 (34.1-50.8) |
| Salah et al.30, 2015 | 44 (22.5-65.4) | 52 (30.4-73.5) |
| Sibbing et al.31, 2009 | 23.8 (19.8-27.8) | 18.5 (16.2-20.8) |
| Siller-Matula et al.32, 2013 | 24 (16.2-31.8) | 16 (11.5-20.5) |
| Siller-Matula et al.32, 2013 | 31.7 (23.3-40.2) | 22.2 (17-27.4) |
| Wand et al.33, 2018 | 78.7 (71.4-86.1) | 83.6 (78.6-88.6) |
| Gianetti et al.34, 2006 | 47.6 (31.3-63.9) | 41.3 (32.6-50) |
| Gianetti et al.35, 2007 | 47.7 (34.7-60.6) | 40.8 (33.6-48) |
| Chen et al.36, 2005 | 21 (6.7-35.3) | 17.7 (8.6-26.7) |
| Price et al.37, 2008 | 46.3 (36.5-56.1) | 26.2 (20.8-31.7) |
| Marcucci et al.38, 2009 | 42.1 (34.6-49.7) | 28.5 (24.4-32.5) |
| Mangiacapra et al.39, 2010 | 39.7 (28.6-50.8) | 26.9 (19.9-33.9) |
| Kim et al.40, 2010 | 54.4 (48.6-60.2) | 50.4 (46.8-54) |
| Mangiacapra et al.41, 2012 | 42.1 (35.3-48.9) | 14.8 (12.5-17) |
| Ahn et al.42, 2012 | 33 (28.3-37.8) | 33.6 (30.3-36.8) |
| Jin et al.43, 2013 | 37.7 (22.5-53) | 27. 2 (19.3-35) |
| Park et al.44, 2013 | 62.9 (59.1-66.7) | 61.3 (59-63.6) |
| Mangiacapra et al.45, 2014 | 28.7 (22.3-35) | 30.1 (25.7-34.6) |
| Capranzano et al.46, 2016 | 77.4 (61-93.7) | 69.9 (61.7-78) |
| Mangiacapra et al.47, 2018 | 40. 3 (32.3-48.4) | 31.1 (26-36.1) |
| Fadhil et al.48, 2019 | 31.2 (17-45.4) | 8.9 (1.3-16.5) |
| Lee et al.49, 2019 | 68.3 (62.4-74.2) | 55.3 (51.1-59.5) |
| Lattuca et al.50, 2019 | 42.8 (37.9-47.6) | 31.7 (28.3-35) |
IC95%: intervalo de confianza del 95%.
Tabla 5 Frecuencia de hiperreactividad plaquetaria por estudio en los pacientes hipertensos y no hipertensos
| Estudio | Frecuencia de hipertensos con hiperreactividad plaquetaria % (IC95%) | Frecuencia de no hipertensos con hiperreactividad plaquetaria % (IC95%) |
|---|---|---|
| Aradi et al.29, 2010 | 43.4 (35.2-51.6) | 38 (23.5-52.4) |
| Salah et al.30, 2015 | 57.1 (39.3-74.9) | 26.6 (7.7-55.1) |
| Sibbing et al.31, 2009 | 19.7 (17.6-21.8) | 23.7 (16.1-31.2) |
| Siller-Matula et al.32, 2013 | 17.8 (13.6-22.1) | 22.5 (11.3-33.7) |
| Siller-Matula et al.32, 2013 | 27.5 (22.6-32.4) | 11.3 (1.8-20.7) |
| Wand et al.33, 2018 | Sin dato | Sin dato |
| Gianetti et al.34, 2006 | 41.5 (28.7-54.2) | 43.6 (33.9-53.3) |
| Gianetti et al.35, 2007 | 39.5 (28.2-50.7) | 44 (36.3-51.6) |
| Chen et al.36, 2005 | 18.1 (8.9-27.4) | 20 (6.3-33.6) |
| Price et al.37, 2008 | 32.8 (27.6-38) | 26.6 (12.6-40.7) |
| Marcucci et al.38, 2009 | 33.4 (29-37.8) | 29.1 (22.9-35.3) |
| Mangiacapra et al.39, 2010 | 31.9 (24.9-38.8) | 29 (16.9-41.1) |
| Kim et al.40, 2010 | 55.5 (51.3-59.8) | 47.4 (43-51.8) |
| Mangiacapra et al.41, 2012 | 32.9 (29-36.9) | 8 (5.8-10.1) |
| Ahn et al.42, 2012 | 34 (30.5-37.4) | 32.5 (28.2-36.8) |
| Jin et al.43, 2013 | 31.8 (20.1-43.6) | 28.5 (19.7-37.3) |
| Park et al.44, 2013 | 63.7 (61.1-66.2) | 59 (55.9-62.1) |
| Mangiacapra et al.45, 2014 | Sin dato | Sin dato |
| Capranzano et al.46, 2016 | 76.8 (67.8-85.8) | 63.7 (51.7-75.8) |
| Mangiacapra et al.47, 2018 | 35.3 (30.6-40.1) | 27.9 (18.2-37.6) |
| Fadhil et al.48, 2019 | 17.6 (7.8-27.4) | 19.1 (6.8-31.4) |
| Lee et al.49, 2019 | 64 (59.7-68.3) | 51.8 (46-57.5) |
IC95%: intervalo de confianza del 95%.
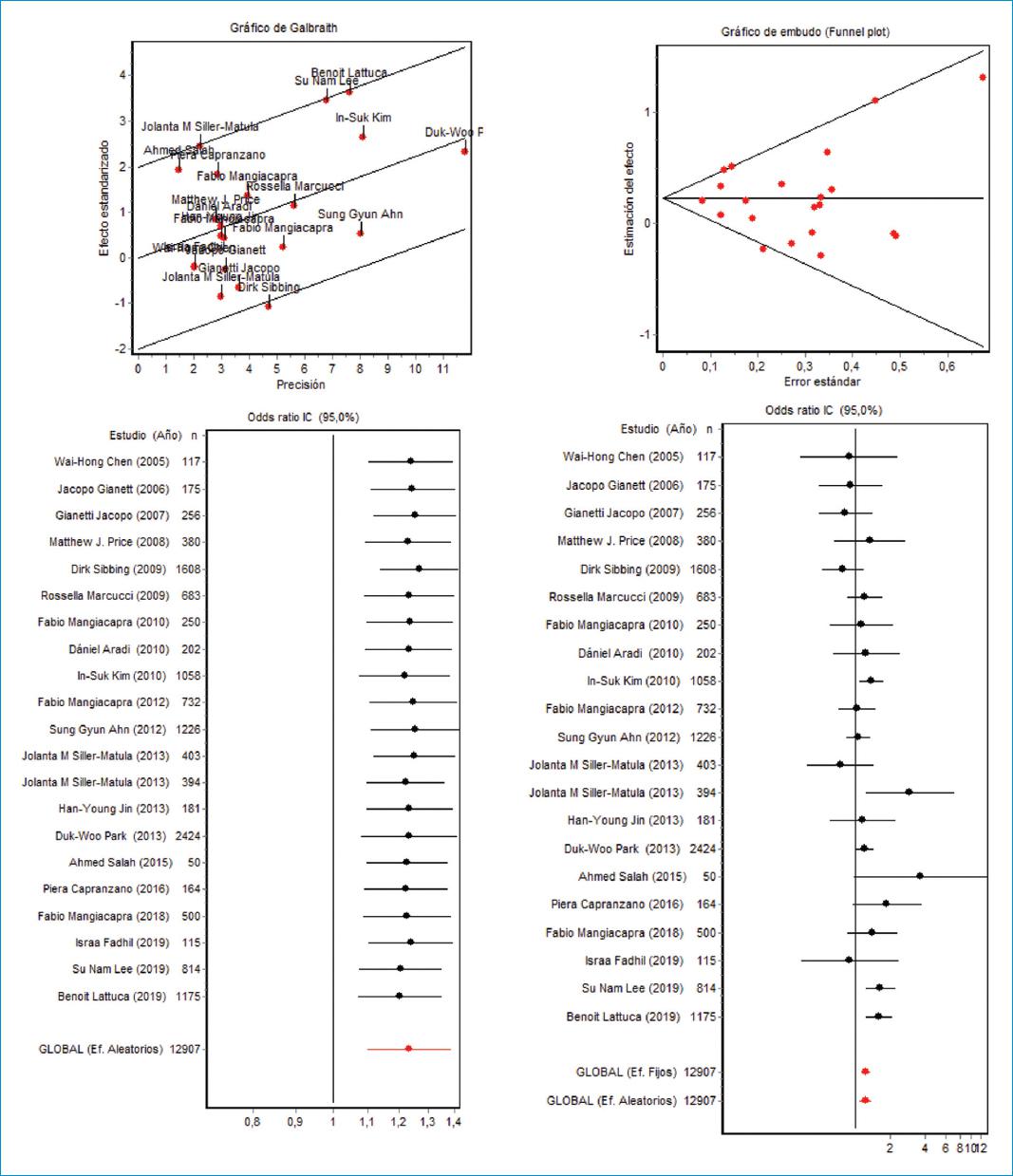
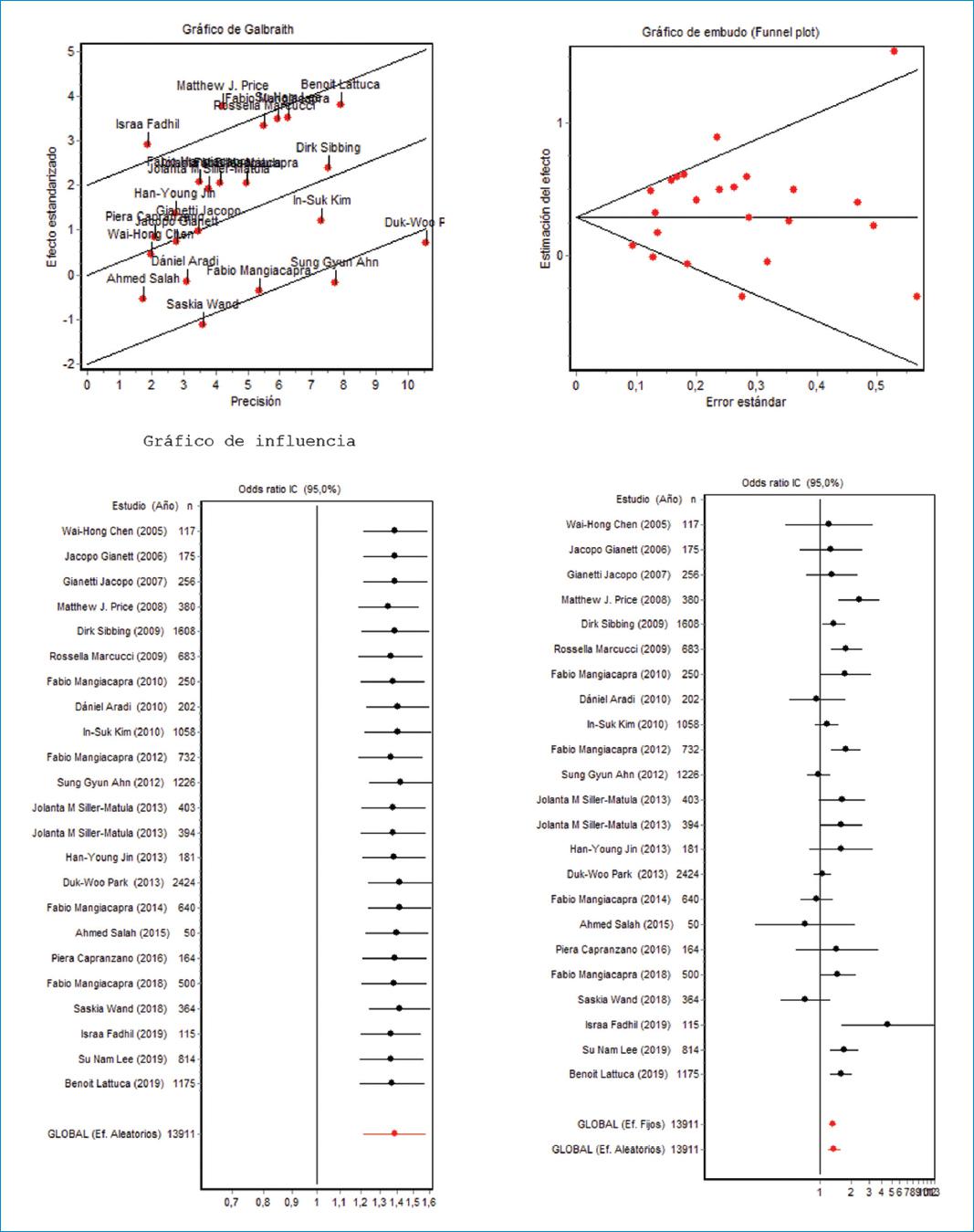
En el metaanálisis por razón de disparidad, para determinar la frecuencia de hiperreactividad plaquetaria en los pacientes diabéticos, se observó que no se presentó sesgo de publicación según el gráfico de funnel plot, dado que se hallaron estudios a ambos lados del eje X, y hay una buena sensibilidad, evidenciada en el gráfico de influencias; también se apreció que el análisis muestra heterogeneidad de acuerdo con el gráfico de Galbraith. El resultado global del metaanálisis por efectos aleatorios fue 1.38 (intervalo de confianza del 95% [IC95%]: 1.21-1.58) (Fig. 3), lo que indica que la hiperreactividad plaquetaria fue 1.38 veces mayor en los pacientes diabéticos que en aquellos que no lo eran, valor que es estadísticamente significativo. Por otro lado, en el metaanálisis para razón de disparidad, para determinar la frecuencia de hiperreactividad plaquetaria en los pacientes hipertensos, no se presentó un sesgo de publicación, hubo buena sensibilidad y el análisis mostró heterogeneidad; el resultado global por efectos aleatorios fue 1.23 (IC95%: 1.10-1.38) (Fig. 4), lo que indica que la hiperreactividad plaquetaria era 1.23 veces mayor en los pacientes hipertensos que en aquellos que no lo eran, resultado que fue estadísticamente significativo. También se realizaron metaanálisis por separado en aquellos pacientes que presentaron hiperreactividad plaquetaria y diabetes mellitus, a los cuales se les tomó la muestra y se obtuvo una odds ratio (OR) de 1.43 (IC95%: 1.03-1.99) antes de la intervención coronaria percutánea y de 1.48 (IC95%: 1.19-1.85) después de esta; dichos valores fueron estadísticamente similares. Esta situación también ocurrió cuando se analizaban los pacientes con hiperreactividad plaquetaria e hipertensión a quienes se les tomó la muestra antes de la intervención coronaria percutánea (OR: 1.25; IC95%: 0.76-2.04) y después de esta (OR: 1.45; IC95%: 1.13-1.86). Por ello, se utilizaron los datos en conjunto para el análisis final del metaanálisis y no se discriminó por el momento de toma de la muestra.
Discusión
Se ha demostrado una variabilidad en la respuesta a los antiagregantes, tanto a clopidogrel como a aspirina12, y por ello ha venido cobrando importancia la evaluación personalizada con equipos de agregometría plaquetaria para monitorizar la respuesta individual. Un metaanálisis realizado en 2011 demostró que el nivel de reactividad plaquetaria durante el tratamiento según el ensayo P2Y12 para clopidogrel, realizado con el equipo VerifyNow, se asociaba con eventos cardiovasculares a largo plazo después de una intervención coronaria percutánea, también conocidos como eventos cardiovasculares mayores, que incluyen muerte, infarto de miocardio y trombosis del stent13.
En el resultado obtenido en este trabajo en el primer metaanálisis (Fig. 3), la hiperreactividad plaquetaria fue 1.38 veces mayor en los pacientes diabéticos que en aquellos que no lo eran, en tanto que en el segundo (Fig. 4) fue 1.23 veces mayor en los pacientes hipertensos que en aquellos que no lo eran. De igual manera, se decidió realizar un metaanálisis de forma paralela teniendo en cuenta el momento de toma de la muestra, ya que en revisiones previas a la literatura se observó que la cirugía cardiovascular podía desempeñar un papel en la activación y el cambio en la función plaquetaria14. Por ello, se pretendía descartar esto como una posible fuente de sesgo; sin embrago, el análisis demostró que los resultados fueron estadísticamente similares cuando se realizaba el metaanálisis teniendo en cuenta el momento de toma de la muestra y cuando se realizaba de manera global. Todos estos resultados demuestran que la diabetes mellitus y la hipertensión tienen un impacto importante en el desarrollo de hiperreactividad plaquetaria.
La guía colombiana de prácticas clínicas para el SCA recomienda que, para los pacientes que acuden al servicio de urgencias con un SCA, se utilice una dosis de mantenimiento de aspirina entre 75 mg y 100 mg diarios después de la dosis de carga de 300 mg, mientras que para clopidogrel indica administrar una dosis de carga de 300 mg y adicionar 300 mg, más aún si el paciente será sometido a intervención coronaria percutánea15. Algunos estudios han probado que el aumento de la dosis tradicionalmente utilizada para clopidogrel de 300 mg antes de la intervención coronaria percutánea tiene un impacto positivo, ya que reduce los eventos cardiovasculares adversos mayores9. Por ello, se hace vital conocer si los pacientes presentan hiperreactividad plaquetaria, con el fin de adoptar conductas que impacten en la prevención de dichos eventos.
Los resultados de este estudio ayudan a mejorar el análisis y el abordaje inicial de los pacientes, pues comprueban una asociación entre la diabetes mellitus y la hipertensión con la hiperreactividad plaquetaria, muy relevante en nuestro medio. Para Colombia, un estudio realizado en 2019 determinó que la prevalencia de hipertensión fue del 24%, ligeramente más alta en los hombres (29%), con un aumento proporcional a la edad16; estos datos son importantes ya que, en su mayoría, los pacientes que son sometidos a intervención coronaria percutánea son hombres de edad avanzada. De igual manera, para la diabetes mellitus tipo 2 se ha establecido una prevalencia del 7.3%; en este estudio, el valor promedio de la frecuencia de hipertensión fue del 62.98%, mientras que para la diabetes mellitus fue del 30.93% (Tablas 4-5), cifras muy altas que podrían estar asociadas a la población estudiada, ya que se trata de pacientes, generalmente hombres de edad avanzada, que cursan con otras condiciones, como síndrome metabólico u obesidad. Lo anterior crea un escenario perfecto para el desarrollo de SCA, si bien es necesario considerar que en el informe de estadísticas vitales publicado en 2019 la hipertensión y la diabetes mellitus estaban entre las diez primeras causas de muerte en Colombia, con valores del 3.8% y el 3.4%, respectivamente17.
Estudios previos han demostrado que existe una mayor agregación y una mayor activación plaquetaria en los pacientes diabéticos que en aquellos que no lo son7. El mecanismo por el cual la diabetes mellitus se asocia con hiperreactividad plaquetaria se explica por múltiples factores, como disfunción endotelial, alteración de la fibrinólisis, aumento de los factores de coagulación y función plaquetaria alterada, que disminuye la respuesta a agentes antiplaquetarios18; además, se presenta una reducción de la producción de prostaciclina y de óxido nítrico (ON), que son considerados inhibidores. Así mismo, los niveles séricos de fibrinógeno están elevados, disminuyen los niveles de antioxidantes y hay una mayor expresión de moléculas de adhesión dependientes de la activación, como la GpIIb-IIIa y la P-selectina19. La expresión de superficie mejorada de estas moléculas de adhesión sugiere que las plaquetas también pueden comunicarse con los leucocitos y posiblemente desempeñan un papel en el daño tisular mediado por la inflamación vascular18. De igual manera, en la diabetes mellitus existe una mayor posibilidad de formar placa aterosclerótica20, cuya principal consecuencia es el daño endotelial. En condiciones normales, el endotelio presenta una superficie con propiedades antitrombogénicas, mediadas por su capacidad de producir y liberar sustancias que mantienen el equilibrio entre vasodilatadores, como ON, prostaciclina y bradicinina, así como vasoconstrictores, como prostanoides (prostaglandinas y tromboxano), endotelina y angiotensina II, pero cuando el paciente cursa con diabetes mellitus se genera un desequilibrio y se exhiben zonas de la pared vascular con predisposición a las lesiones ateroscleróticas por una permeabilidad aumentada, que se ve favorecida por la hipercolesterolemia plasmática, asociada a su vez con un aumento de transcitosis de colesterol unido a lipoproteínas de baja densidad (LDL) a través del endotelio vascular. Esto conduce a la acumulación de colesterol LDL en el espacio subendotelial, donde interacciona con proteoglicanos y proteínas que favorecen su modificación, lo que incrementa su aterogenicidad y su retención en la íntima vascular y da lugar a la formación y la progresión de la placa aterosclerótica, ya que dispara un proceso inflamatorio local que promueve las interacciones de células inflamatorias, plaquetas, elementos vasculares y lipoproteínas que regulan la expresión de genes y proteínas directamente involucradas en el proceso de remodelado vascular21.
En la hipertensión, el principal mecanismo para la hiperreactividad plaquetaria es la disfunción endotelial, ya que provoca un estrés hemodinámico que puede acarrear cambios en la función y en la estructura del endotelio. La fuerza circunferencial depende de la presión de la sangre en el interior del vaso, del radio de este y del grosor de la pared; por su parte, la fuerza tangencial depende del radio del vaso sanguíneo, de la viscosidad sanguínea y de la velocidad del flujo. A mayor elevación de la presión arterial, mayor es la magnitud de dichas fuerzas y la capacidad de deformar las células. También se da por medio de la alteración de sustancias como el ON, que se ha observado disminuido en los pacientes hipertensos22, alteración que se ve favorecida por la presencia de placa aterosclerótica. Diversos estudios han demostrado que la hipertensión contribuye al aumento de la adhesión de leucocitos a las células endoteliales, ya que incrementa los niveles plasmáticos de las isoformas solubles de moléculas de adhesión leucocitaria (sICAM 1 y sVCAM 1), lo que sugiere que la hipertensión eleva la adhesión de leucocitos a la superficie endotelial y facilita, así, el comienzo y el desarrollo de la enfermedad aterosclerótica23.
Otro dato importante obtenido en este estudio es la heterogeneidad marcada que se observa entre las diferentes frecuencias de hiperreactividad plaquetaria con ambos antiagregantes (Tabla 3). En el caso de la aspirina, fue evaluada en seis artículos con cuatro técnicas de agregometría diferentes. Una situación similar se observa cuando se evalúa el clopidogrel, para lo cual se contó con 17 artículos que utilizaron tres agregómetros diferentes. Llama la atención que cuando se evalúa el mismo agregómetro (VerifyNow), pero con valores de corte diferentes, se observa un cambio que pareciera estar asociado con el valor de corte, pues valores altos disminuyen la frecuencia y valores bajos la aumentan; es así como esas diferencias tan marcadas en las frecuencias podrían estar asociadas con el tipo de agregómetro utilizado para determinar la hiperreactividad plaquetaria24. Algunos autores han comparado los analizadores entre sí con el fin de determinar cuál es el que mejor refleja los niveles y la farmacocinética del medicamento, y han postulado al VerifyNow como uno de los que logran un equilibrio entre buena correlación y facilidad en el procesamiento25. Muchos concluyen que los sistemas de agregometría no son equiparables entre ellos y que, por tanto, se debe ajustar el valor de corte de acuerdo con la condición estudiada. Por ejemplo, para el caso de eventos cardiovasculares, como isquemia en pacientes sometidos a intervención coronaria percutánea, en el año 2011 se publicó un metaanálisis en el que se postula el valor de corte para VerifyNow en 230 PRU13; posteriormente, otro metaanálisis realizado en 2018 con el mismo tipo de pacientes, pero utilizando tres analizadores diferentes, sugirió un valor de corte para VerifyNow de 235 PRU26.
Finalmente, algunos autores han informado variaciones en cuanto a la respuesta a los antiagregantes, como clopidogrel, de acuerdo con la población analizada. Los estudios demuestran un aumento en el valor de corte de las pruebas de agregometría, principalmente con VerifyNow en población asiática, ya que no obtenían ninguna asociación con el desarrollo de eventos adversos cuando utilizaban los valores de corte que se establecieron para la población europea (PRU ≥ 240 para clopidogrel y ARU ≥ 550 para aspirina)27. Más tarde, otros estudios establecieron su propio valor de corte en ≥ 272 PRU amparándose en esa diferencia en cuanto a la respuesta asociada a su población28. Por esta razón, un estudio orientado en población colombiana sería vital y daría una idea más clara sobre la situación y si esta asociación, que ha sido observada en otros lugares del mundo, aplica para nuestro país.
Conclusiones
La diabetes mellitus y la hipertensión forman parte de la comorbilidad común en los pacientes sometidos a intervención coronaria percutánea y están asociadas con el desarrollo de hiperreactividad plaquetaria. El principal objetivo de la terapia utilizada después de la intervención coronaria percutánea es evitar el desarrollo de eventos adversos, como la isquemia, a largo plazo. Estudios como este permiten, además, identificar enfermedades de base asociadas a hiperreactividad plaquetaria y, por ende, a peor pronóstico, y ofrecen un enfoque más claro al plantear estudios clínicos futuros que puedan ayudar a evitar estas condiciones; incluso, se han propuesto algoritmos diagnósticos basados en pruebas de agregometría que toman cada vez mayor fuerza, ya que permitirían evaluar los casos en los que se requiere ajustar el tratamiento, todo esto en el marco de la terapia personalizada. Finalmente, se resalta la necesidad de realizar este tipo de estudios en nuestra población para poder determinar realmente cuál es la asociación y el verdadero comportamiento de la hiperreactividad plaquetaria en Colombia.