Introducción
La aterosclerosis es una enfermedad vascular crónica e inflamatoria, que conduce a disfunción endotelial, estenosis y oclusión de la luz del vaso sanguíneo afectado1. Es considerada como el principal mecanismo patogénico de la cardiopatía isquémica, una de las principales causas de mortalidad en el mundo2. De los 56,4 millones de muertes registradas en 2016, se calcula que 18,2 millones (32.26%) se atribuyeron a enfermedad cardiovascular (ECV), y de estos, 9,4 millones (51.6%), corresponden a cardiopatía isquémica3.
En Colombia, según resultados reportados por el Ministerio de Salud y Protección Social, las enfermedades del sistema circulatorio fueron la principal causa de muerte en hombres y mujeres entre los años 2005 a 2017. Entre estas sobresalió la mioardiopatía isquémica, responsable del 53.30% (38.618) de las muertes del grupo, con tasas ajustadas de mortalidad que oscilan entre 78,89 y 80,07 muertes por cada 100.000 habitantes4.
En el Distrito de Barranquilla, las causas de mortalidad que tienen mayor peso en el sistema sanitario son las enfermedades del sistema circulatorio, cuya tasa llegó a ser de 183,7 en el año 2005 y de 192 por cada 100.000 habitantes en el año 2017; con incremento del 4,3% en ese periodo. La cardiopatía isquémica es la principal causa de mortalidad por enfermedades del sistema circulatorio en dicho distrito. En hombres, las enfermedades del sistema circulatorio tuvieron una tasa de mortalidad de 220,4/100.000 habitantes en el año 2005 y de 237,4/100.000 habitantes en el 2017, con una tendencia al incremento en el periodo analizado. En mujeres también se evidenció el mismo patrón epidemiológico, con una tasa de 154,9/100.000 habitantes en el año 2005 y 159,4/100.000 habitantes en el 2017, y una tendencia al ascenso en los próximos años5.
Con base en la heterogeneidad de la enfermedad en cuestión, en la que aproximadamente el 50% de los casos carece de factores de riesgo clásicos o tradicionales6, cobra importancia el papel que desempeñan los factores de riesgo emergentes, como infección e inflamación, en la génesis y patogenia de las vasculopatías coronarias asociadas a la aterosclerosis. En este artículo se detallará la relación existente entre la infección por Porphyromonas gingivalis y la enfermedad inflamatoria aterosclerótica, ambas variables consideradas como problemas prioritarios en salud pública7. La potencial relación causal entre la enfermedad periodontal y la aterosclerosis, ha suscitado la elaboración de esta revisión panorámica con el objetivo de describir los mecanismos celulares y moleculares implicados en la etiopatogenia de la aterosclerosis coronaria asociada a la infección por Porphyromonas gingivalis.
Enfermedad coronaria aterosclerótica
La disfunción endotelial y la acumulación de lipoproteínas de baja densidad (LDL) dentro de la pared arterial, son eventos claves en el desarrollo y la progresión de la aterosclerosis8,9. El principal mecanismo patogénico que subyace a la génesis y al desarrollo de enfermedades del sistema circulatorio es la aterosclerosis, la cual es considerada como un proceso patológico complejo y progresivo de la pared arterial (endotelio vascular) que afecta especialmente a las arterias coronarias, cerebrales y periféricas10. Las lesiones vasculares ateroscleróticas son el resultado de complejas interacciones entre células inflamatorias, plaquetas, elementos vasculares y lipoproteínas que regulan la expresión de genes y proteínas directamente involucradas en el proceso de remodelado vascular, lo cual conlleva estenosis y oclusión de la luz del vaso afectado, y, por tanto, genera hipoxia y necrosis isquémica en órganos vitales, como corazón y cerebro11.
La respuesta inflamatoria se presenta durante todo el proceso aterogénico y está íntimamente ligada a la progresión y rotura de la placa ateroesclerótica “placa inestable o vulnerable”. La erosión o rotura de la placa trae como consecuencia la formación de un trombo intravascular “aterotrombosis”, lo cual genera isquemia e hipoxia en los tejidos circundantes. Si la irrigación no se reestablece o la oclusión vascular no se corrige, rápidamente este evento causa necrosis tisular, la cual es la base de las complicaciones asociadas a vasculopatías isquémicas en órganos vitales, como corazón, cerebro, riñón y tejido periférico en general12.
Factores de riesgo en enfermedad coronaria aterosclerótica
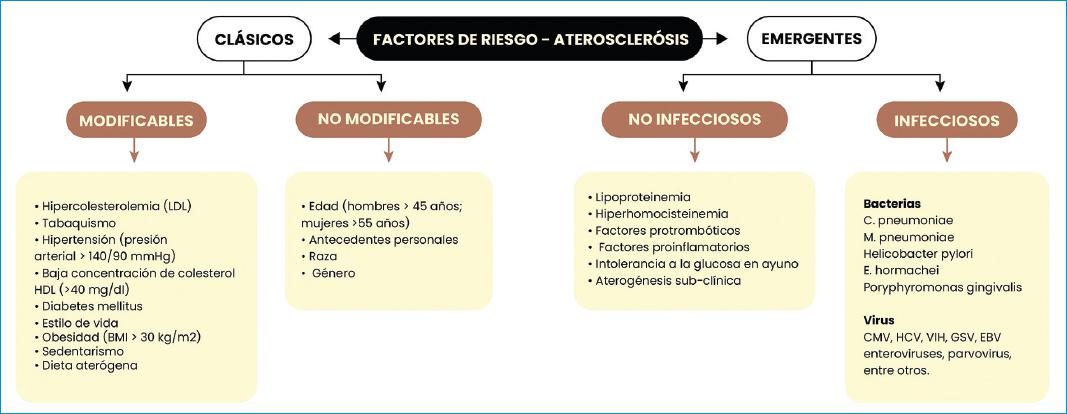
Existen factores de riesgo que participan en el origen y desarrollo de la aterosclerosis. En la actualidad se habla de dos tipos: clásicos, también llamados tradicionales, que a su vez se subdividen en modificables y no modificables; y los no clásicos (no tradicionales) que en el argot epidemiológico reciente se conocen como “emergentes” y sobre los cuales existe la mayor parte de las investigaciones básico-clínicas actuales13,14. En la figura 1 se describen los factores de riesgo más relevantes implicados en la génesis de la aterosclerosis.
Factores de riesgo emergentes
En los años recientes han aparecido factores de riesgo emergentes de tipo infeccioso con capacidad para generar una respuesta inflamatoria crónica en el endotelio vascular. Por tanto, favorecen la aterogénesis y su consecuente disfunción endotelial y daño vascular. Entre estos factores se destacan las infecciones por Chlamydophila pneumoniae, Porphyromonas gingivalis, Citomegalovirus, Herpesvirus 1, Herpesvirus 2, Helicobacter pylori, entre otros15.
Actualmente, se han intentado esbozar probables mecanismos fisiopatológicos entre aterosclerosis y otros tipos de infecciones; por ejemplo, se ha probado que la carga viral induce la secreción de compuestos protrombóticos como el factor tisular y la trombina16. Además, las endotoxinas bacterianas, en especial los LPS, estimulan la isoforma inducible de la óxido nítrico sintetasa (iNOS)17. Esta carga antigénica facilita la inducción de estímulos de proliferación celular, como es el caso del citomegalovirus (CMV), el cual interactúa con la proteína p53 e interfiere con el ciclo celular normal y facilita la proliferación desregulada de los miocitos18.
Son varias las hipótesis que se han formulado para explicar los posibles mecanismos existentes entre la infección por Helicobacter pylori y la aterosclerosis. Al parecer, la infección gastrointestinal crónica produce síndrome de malabsorción y déficit de vitaminas B6 y B12, factores esenciales para la conversión de homocisteína en metionina. Por consiguiente, el rol del patógeno sería indirecto, vinculado con una hiperconcentración de homocisteína (hiperhomocisteinemia), el cual ha sido considerado como un factor de riesgo emergente, al igual que las infecciones y la respuesta inflamatoria19.
Estos agentes se han propuesto como inductores o potenciadores de la aterogénesis ya que han sido identificados en lesiones ateromatosas de arterias coronarias. Porphyromonas gingivalis ha sido una de las más investigadas en relación con la aterosclerosis20,21.
Infección por Porphyromonas gingivalis como factor emergente de enfermedad coronaria aterosclerótica
El género Porphyromonas corresponde a un grupo de bacterias de morfología cocobacilar; miden de 0.5-0.8 mm x 1-3.5 mm. Forma parte de la microbiota correspondiente a la cavidad oral y la orofaringe. Desde el punto de vista estructural, posee fimbrias, es inmóvil (carece de flagelos), no presenta esporas, algunas cepas son capsuladas (assacharolítica), su nutrición depende de pequeños péptidos y aminoácidos y requiere de hemina como fuente de hierro22.
La enfermedad periodontal ha sido considerada tradicionalmente como una patología inflamatoria, crónica, de origen multifactorial, que tiene como factor etiológico primario una biopelícula de génesis bacteriana altamente organizada en un nicho ecológico favorable para su crecimiento y desarrollo; la cual con el concurso de factores adicionales de origen local y sistémico, ocasionan la contaminación y destrucción de los tejidos de soporte del diente (epitelios, tejido conectivo, ligamento periodontal, hueso alveolar, cemento radicular). Sus principales manifestaciones clínicas incluyen sangrado, movilidad dental, recesión gingival, formación de bolsa periodontal, disfunción masticatoria y pérdida del diente23.
Estudios recientes han demostrado que la enfermedad periodontal está asociada con las enfermedades cardiovasculares, mediante el hallazgo directo de Porphyromonas gingivalis en las placas aterogénicas. Sin embargo, aún falta mayor evidencia que avale la relación causal (Tabla 1)24-28.
Tabla 1 Hallazgo de Porphyromonas gingivalis en placas ateroscleróticas
| Referencia | Población estudiada | Número de casos de periodontitis/enfermedad aterosclerótica | Evidencia de Porphyromonas gingivalis en placas ateroscleróticas | Significancia estadística |
|---|---|---|---|---|
| Altayeb, et al. 201824 | 19 pacientes con aterosclerosis en coronarias y carótidas. | 10/19 | 11/19 (57.9%) | p < 0.05 |
| Atarbashi-Moghadam, et al. 201825 | 23 pacientes con aterosclerosis en coronarias y periodontitis. | 23/23 | 3/23 (13.05%) | p = 0.016 |
| Szulc, et al. 201526 | 91 pacientes con aterosclerosis en coronarias y carótidas. | 91/91 | 21/91 (23%) | N/A |
| López-Ilisástigui, et al. 201627 | 85 pacientes con aterosclerosis 85 pacientes controles. | 85/85 | 61/85 (71.8%) | p = 0.003 |
| Serra, et al. 201428 | 18 pacientes con aterosclerosis coronaria. | 18/18 | 12/18 (67%) | p < 0.05 |
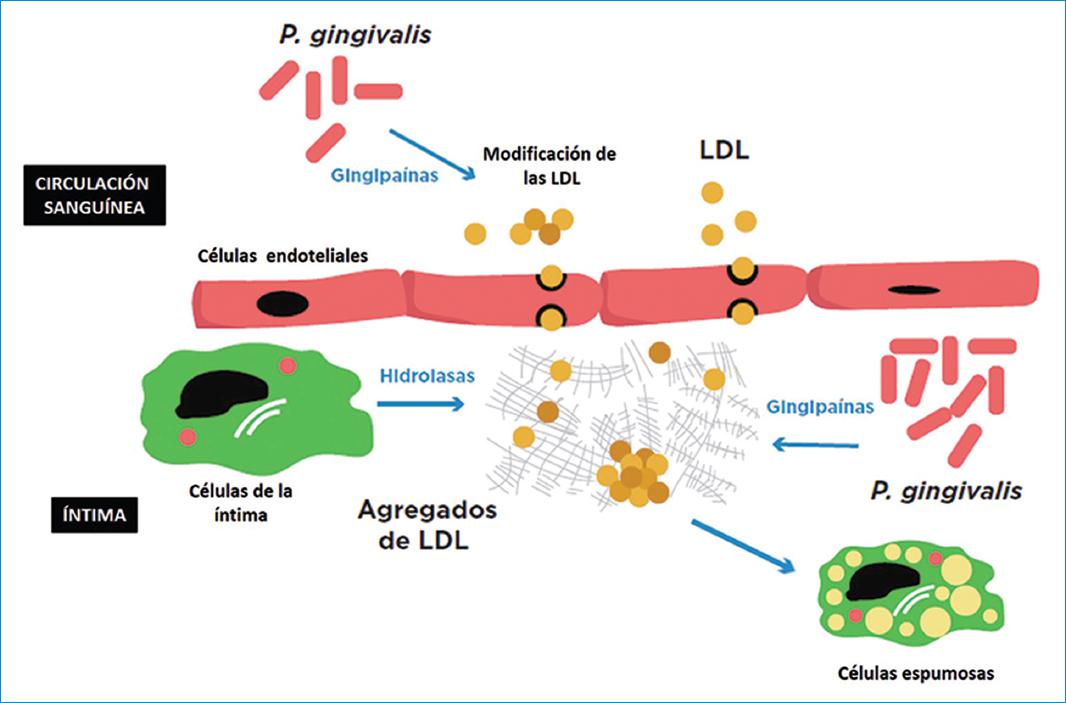
La evidencia científica propone dos mecanismos involucrados desde el punto de vista molecular: uno directo, en el que intervienen toxinas y biomoléculas sintetizadas por la bacteria, en el que se destaca el papel del LPS de la membrana externa y otros factores de virulencia, como las “gingipaínas”, en los procesos inflamatorios que subyacen al origen y desarrollo de la aterosclerosis asociada a las Infecciones por Porphyromonas gingivalis, y un mecanismo indirecto, asociado principalmente a la respuesta inmunológica desencadenada durante la infección (Tabla 2)29-44.
Tabla 2 Evidencia de los mecanismos moleculares en la etiopatogenia de aterosclerosis asociada a Porphyromonas gingivalis
| Referencia | Mecanismos moleculares: Porphyromonas gingivalis y aterosclerosis | Evidencia |
|---|---|---|
| Xu, et al. 202030 | LPS | Estructura del LPS de la membrana externa de Porphyromonas gingivalis. |
| Jia, et al. 201931 | LPS | Vínculo del complejo LPS de Porphyromonas gingivalis/proteína de unión al lipopolisacárido (LPS/LBP) y el receptor trimérico conformado por CD14, TLR4, MD2 |
| Nativel, et al. 201732 | LPS | LPS de Porphyromonas gingivalis, media la señalización proinflamatoria de manera exclusiva a través de TLR4. |
| Bin, et al. 201333 | LPS | Los resultados indicaron que NF- κ B era esencial para la expresión de VCAM1 en HAEC inducida por el LPS de P. gingivalis, proceso que es fundamental en la iniciación de la aterosclerosis. |
| Glurich, et al. 201934 | LPS | La infección persistente y localizada sobre el periodonto influye sobre los niveles basales y sistémicos de mediadores proinflamatorios. |
| Lin, et al. 201435 | LPS | Efecto de microcantidades de LPS sobre la respuesta inmune inflamatoria y el desarrollo de aterosclerosis. |
| Gualtero, et al. 201936 | LPS | Evaluación de la transcripción de 3 genes, la secreción de citocinas y 2 prostanoides y la adhesión de monocitos a cultivos 2D y 3D de HCAEC. |
| Fen Liu, et al. 201437 | LPS | Cambios en la expresión de los genes del metabolismo de lípidos en macrófagos. |
| Bugueno, et al. 201638 | LPS | Aumento en la expresión de genes proapoptóticos, incluidas las caspasas-1, 3, 9 y Bax-1 y disminución en la expresión de anti-apoptóticos Bcl-2. |
| Lönn, et al. 201839 | GINGIPAINAS | Oxidación de LDL (niveles de citocinas proinflamatorias). |
| Turunen, et al. 201540 | GINGIPAINAS | LDL modificadas con malondialdehído (MDA-LDL) y niveles de IgM (mimetismo molecular). |
| Kyrklund, et al. 201841 | GINGIPAINAS | Niveles de anticuerpos IgM de unión a lipoproteínas de baja densidad oxidada (OxLDL) con malondialdehído-acetaldehído inducido por las gingipaínas. |
| Cao, et al. 201542 | GINGIPAINAS | Cambios fenotípicos y proliferación de células de músculo liso aórtico de ratas. |
| Zhang, et al. 201643 | GINGIPAINAS | Cambios en la expresión de un número mayor de genes en células de musculo liso aórtico humano. |
| Bengtsson, et al. 201644 | GINGIPAINAS | Modificación de la expresión de los genes a través de la alteración del equilibrio entre dos proteínas implicadas en la inflamación. Disminución de la expresión génica de la Ang-1 e incremento en la expresión de Ang-2. |
Efecto aterogénico del LPS de la membrana externa de Porphyromonas gingivalis
El LPS está compuesto por una región lipídica y una glicosídica con funciones separadas y sinérgicas, o ambas, lo que hace de esta molécula uno de los factores de virulencia más relevantes en el proceso aterosclerótico30.
Cuando el LPS es liberado de la membrana externa de la bacteria, como consecuencia de la multiplicación o lisis, entra en contacto con varias proteínas del hospedero, entre ellas la proteína de unión al lipopolisacárido (LBP). El complejo LPS/LBP se une a un receptor trimérico, conformado por CD14, TLR4 y MD2 (factor mieloide de diferenciación 2) ubicado sobre la membrana de células endoteliales, monocitos y macrófagos, lo cual desencadena procesos de activación celular a través de una ruta de señalización canónica dependiente de MyD88 (proteína de diferenciación mieloide 88), que se une intracelularmente con una IRAK (cinasa asociada al receptor de la interleucina 1 (IL)-1). Esto induce a la activación del TRAF-6 (factor 6 asociado al receptor del factor de necrosis tumoral), que da lugar a que el NF-kB (factor de transcripción nuclear kappa B) se transloque al núcleo celular para iniciar la transcripción y posterior traducción de citocinas proinflamatorias29 (Fig. 2).
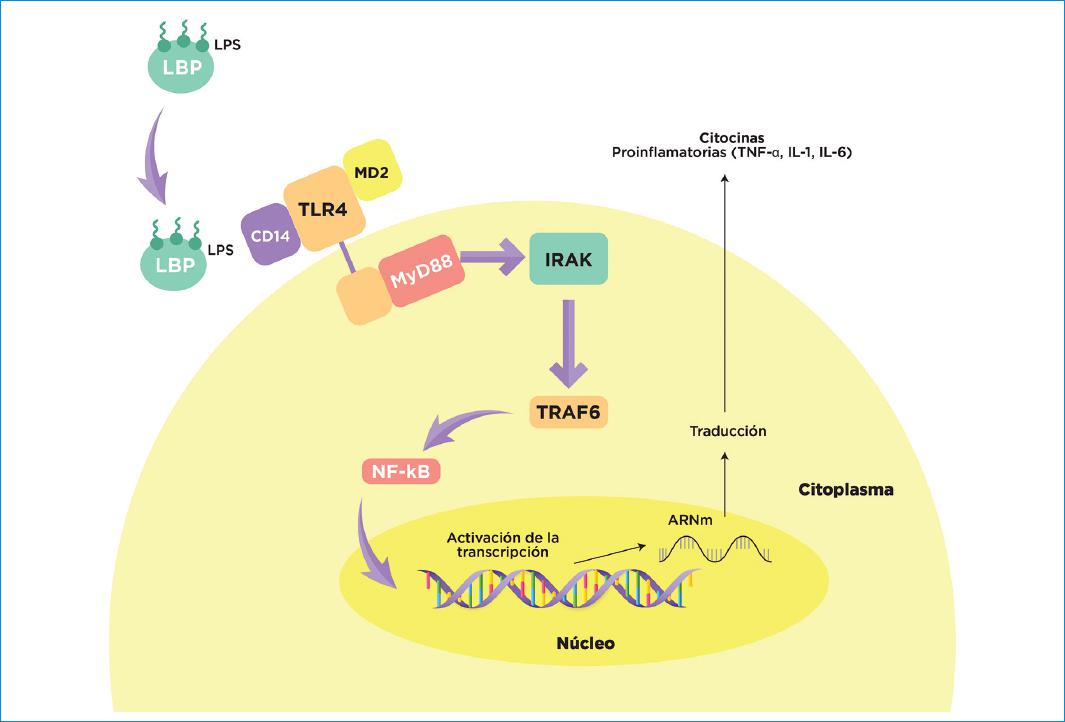
Figura 2 LPS de Porphyromonas gingivalis y su vinculación con la aterosclerosis. Procesos de señalización celular orquestada por la unión entre los LPS + el receptor trimérico TLR4/MD2/CD1. CD14 Clúster de diferenciación 14; IRAK: Cinasa asociada al receptor de la interleucina 1; LBP: proteína de unión a LPS; LDL Lipoproteína de baja densidad; IL: Interleucina; LPS: Lipopolisacárido; MD2 Factor de diferenciación mieloide tipo 2; MyD88: Proteína de diferenciación mieloide 88; NF-kB: Factor de transcripción nuclear kappa B; TLR4: Receptor tipo toll 4; TNF-α: Factor de Necrosis Tumoral a; TRAF-6: Factor 6 asociado al receptor del factor de necrosis tumoral.
Nativel, et al.32, en estudios estructurales y funcionales del lípido A sintético del LPS de Porphyromonas gingivalis, revelaron que puede activar las células a través del receptor TLR4 y no del receptor TLR2. La actividad de TLR2 activado por el LPS de Porphyromonas gingivalis podría atribuirse a una lipoproteína contaminante. En consecuencia, la interacción del LPS de Porphyromonas gingivalis con TLR2 o TLR4 sigue generando una controversia basada en el método de purificación de LPS de bacterias. Cuando se utilizó el extracto de LPS ultrapurificado activó sólo la vía del TLR4 y el uso del extracto estándar de LPS activó a los TLR2. Esto puede indicar que el LPS de Porphyromonas gingivalis media la señalización proinflamatoria exclusivamente a través de TLR4, mientras que la vía dependiente de TLR2 estaba relacionada con la presencia de contaminantes en la preparación de LPS32. En el mismo estudio, los investigadores demostraron la escasa liberación de citocinas en macrófagos murinos, lo cual podría estar relacionado con el débil reconocimiento de MD2 al lípido A penta-acilado de Porphyromonas gingivalis. En células endoteliales humanas, el lípido A penta-acilado es reconocido como un agonista por TLR4 e inductor de la expresión de citocinas proinflamatorias de manera significativa. Por tanto, se debe guardar cautela al extrapolar e inferir resultados de experimentos en ratones a seres humanos.
La investigación de Bin, et al.33, demostró que la expresión de moléculas VCAM-1 sobre las células endoteliales aórticas humanas (HAEC), fue inducida por el LPS de Porphyromonas gingivalis, a través de la activación del p38 de la proteína cinasa activada por mitógeno (MAPK p38). A pesar del protagonismo parcial de la molécula en el estudio, los resultados infieren la posible participación del LPS de Porphyromonas gingivalis en la aterogénesis a través de esta ruta molecular. El mismo estudio examinó el papel de la cinasa c-Jun N-terminal (JNK) y del factor nuclear kB (NF- k B) como vías de señalización celular para la expresión de VCAM1 inducida por el LPS de Porphyromonas gingivalis en HAEC. Los resultados evidenciaron que ambas vías (JNK y NF-kB) eran activadas por el LPS de Porphyromonas gingivalis. La inhibición de NF-kB por SN50 atenuó significativamente la expresión de VCAM1, mientras que la inhibición de JNK por SP600125 mejoraba la expresión VCAM-1. Por tanto, los resultados indicaron que el factor de transcripción NF-kB es fundamental para la expresión de VCAM1 endotelial, evento molecular fundamental en la aterogénesis. Se presume que la molécula traductora de señal JNK podría ser un supresor de la expresión de VCAM1 en HAEC. Sin embargo, serían necesarios más estudios para ratificar el escenario molecular en mención.
Los estudios de Glurich et al.34, en pacientes con enfermedades cardiovasculares y periodontales, demostraron que la infección persistente y localizada sobre el periodonto influye sobre los niveles basales y sistémicos de mediadores proinflamatorios, lo cual apoya la hipótesis infecciosa de la aterosclerosis.
Por su parte, Lin et al.35, evaluaron el efecto de las microcantidades de LPS – Porphyromonas gingivalis sobre la respuesta inmune inflamatoria y el desarrollo de aterosclerosis en conejos como modelos experimentales. Se demostró que los niveles séricos de IL-6, MCP-1 y TNF-α se elevaron significativamente ante la estimulación con LPS de Porphyromonas gingivalis (p < 0.05). También se evidenciaron cambios patológicos sugestivos de aterogénesis aórtica, con un incremento de células espumosas sobre el endotelio. En el mismo estudio, mediante la técnica de PCR en tiempo real, se observó un incremento en la expresión de TLR-2, MMP-9, MCP-1, TNF-α e IL-6. Lo anterior sustenta el potencial papel inflamatorio y aterogénico que ejerce el LPS de Porphyromonas gingivalis.
Gualtero et al.36, evaluaron la respuesta inflamatoria ejercida por LPS de periodontopatógenos (Aggregatibacter actinomycetemcomitans y Porphyromonas gingivalis) en cultivos de células endoteliales de arterias coronarias humanas (HCAEC). Se evaluó la transcripción de 3 genes, la secreción de 40 citocinas y 2 prostanoides, al igual que la adhesión de monocitos a los cultivos celulares 2D y 3D con o sin exposición a LPS (grupo control). En cultivos 3D tratados con LPS de A. actinomycetemcomitans, los niveles de IL-8, RANTES, G-CSF, ICAM-1, IL-6 y TXA2 fueron significativamente más altos que los de los controles (p < 0.05). En cuanto a la adhesión de monocitos, los cultivos 3D tratados con LPS de A. actinomycetemcomitans no difirió estadísticamente con respecto al grupo de control, pero fue significativamente mayor en los cultivos 2D tratados que en los controles. Los investigadores evidenciaron que el estímulo de las células endoteliales con LPS de Porphyromonas gingivalis no difirieron entre cultivos 3D y 2D según las variables secreción de citocinas, prostaglandinas y adhesión de monocitos. Estos datos indican que las HCAEC responden de manera diferente a estos dos tipos de LPS.
La investigación de Liu et al.37, sobre los efectos del LPS de Porphyromonas gingivalis en la expresión de genes implicados en el metabolismo del colesterol en macrófagos, demostraron que Porphyromonas gingivalis alteró la expresión de moléculas que regulan la captación de lípidos, al igual que la esterificación y transporte de colesterol. Esto facilita la acumulación de lípidos sobre el endotelio y la formación de células espumosas. Esta evidencia apoya la correlación positiva entre periodontitis y aterosclerosis; por tanto, la prevención y el tratamiento de la infección periodontal sería de gran importancia para minimizar el inicio y desarrollo de ateromas, al igual que, las futuras cardiopatías isquémicas.
Bugueno et al.38 estudiaron que Porphyromonas gingivalis modula diferencialmente el perfil de muerte celular en células endoteliales pretratadas con LDL oxidada y TNF-α, y demostraron un vínculo potencial entre la aterosclerosis y la periodontitis.
Gingipaínas bacterianas y su potencial aterogénico
Lonn et al. 39 demostraron, in vitro, que las gingipaínas bacterianas tienen la capacidad de oxidar LDL de forma directa ya que inducen la liberación de citocinas proinflamatorias y generan un ambiente proaterogénico. Sin embargo, los estímulos patogénicos que inducen los cambios y los mecanismos por los cuales esto ocurre in vivo aún son desconocidos.
Turunen et al.40, inmunizaron ratones knockout para el receptor de LDL (LDLR -/- mice) con el dominio de hemaglutinina de la gingipaína A de Porphyromonas gingivalis (Rgp44). La vacunación indujo la síntesis de anticuerpos de tipo IgM capaces de unirse a la LDL modificada con malondialdehído-acetaldehído. Se evidenció que la respuesta inmune mediada por la IgM va dirigida contra epítopos de reacción cruzada entre Porphyromonas gingivalis y LDL oxidadas (oxLDL), lo cual afectó la progresión de la aterosclerosis en los ratones de experimentación, atribuyendo propiedades ateroprotectoras en la inmunoglobulina secretada. En el mismo estudio se observó una asociación negativa significativa entre la lesión aterosclerótica y la IgA plasmática anti-Rgp44 en ratones inmunizados con Rgp44, lo que apoyó aún más al efecto antiaterogénico de la inmunización con Rgp44.
La creciente evidencia indica que los altos niveles de anticuerpos IgM contra oxLDL están asociados inversamente con enfermedades cardiovasculares, lo que sugiere un papel protector para los anticuerpos IgM. A pesar de esto, todavía no se comprenden los mecanismos por los cuales confieren dicha protección; una posible explicación puede ser que al unirse a las oxLDL inhiben la unión a los receptores captadores de macrófagos (scavenger), atenuando el efecto proaterogénico de los agentes oxidativos secretados por estas células. Otros estudios también abogan el rol ateroprotector que confiere la inmunización con Rgp44 de Porphyromonas gingivalis41.
Cao et al.42, determinaron el efecto cisteína proteasa de las gingipaínas de Porphyromonas gingivalis en la proliferación de células de músculo liso aórtico en ratas (RASMC). Estos resultados demostraron que las gingipaínas pueden promover la transformación fenotípica y la proliferación de RASMC y sus efectos fueron bloqueados por KYT-1 y KYT-36, ayudando a determinar que las gingipaínas R y K (Rgp y Kgp) contribuyen al desarrollo de la aterosclerosis.
Por otra parte, Zhang et al.44 investigaron los efectos de las gingipaínas y fimbrias en la regulación del perfil de expresión génica en células musculares lisas aórticas humanas. Los resultados evidenciaron que los eventos moleculares orquestados por la interacción del receptor de citocinas, la regulación del citoesqueleto de actina, la adhesión focal y la vía de señalización de MAPK, desempeñan un rol protagónico en las vías de señalización con propiedades aterogénicas. Lo anterior sugiere que las gingipaínas, especialmente la “gingipaína específica de arginina”, tiene un rol importante en la asociación entre periodontitis por Porphyromonas gingivalis y aterosclerosis (Fig. 3)43,44.
Bregnston et al.45 identificaron cómo la bacteria altera la expresión génica de las proteínas implicadas en la activación de la inflamación y, por tanto, en el desarrollo de la aterosclerosis. Los resultados mostraron que la bacteria al infectar las células musculares lisas de la aorta humana secreta las gingipaínas, las cuales alteran el equilibrio entre dos proteínas proinflamatorias “la angiopoyetina-1 (Ang-1) y la angiopoyetina-2 (Ang-2)”. Las gingipaínas indujeron la disminución de la expresión génica de la Ang-1 e incrementaron la expresión de Ang-2. Como consecuencia de este desequilibrio, se generó un ambiente proinflamatorio, mecanismo íntimamente implicado en el desarrollo de la aterosclerosis.
Conclusiones
Los mecanismos moleculares relacionados con Porphyromonas gingivalis, como el LPS y las gingipaínas, pueden contribuir a la patogenia de la aterosclerosis, de manera directa o indirecta. Se requieren más estudios para determinar el mecanismo subyacente de estos mecanismos moleculares en el proceso aterosclerótico. La evidencia científica aún no es clara en los diferentes artículos de investigación mundial. Respecto a la causalidad, la evidencia en el momento demuestra que los mecanismos moleculares de Porphyromonas gingivalis pueden ser un potencial factor de riesgo emergente asociados con el desarrollo de la aterosclerosis. La heterogeneidad genética y los factores socioculturales, ambientales y microbiológicos pueden generar sesgos que intervienen con los resultados observados. Por tanto, la infección por Porphyromonas gingivalis podría ser tan importante como la hipertensión arterial, la diabetes mellitus, la hipercolesterolemia, la obesidad, entre otros factores clásicos ampliamente estudiados y relacionados con la aterosclerosis. Se requieren mayores evidencias para apoyar la relación causa-efecto.
Aunque en Colombia la enfermedad periodontal ha sido considerada como un problema de salud pública, los estudios demostraron que no se llevan a cabo programas de prevención y promoción de salud oral. Así mismo, en un 56.6%, las consultas médicas no tienen en cuenta el estado periodontal en la anamnesis, pese a que los resultados demostraron en los encuestados tener conocimiento y estar de acuerdo con la asociación de la periodontitis con la aterosclerosis coronaria46. El estudio va dirigido a motivar a las instituciones de salud pública, universidades y entidades gremiales y científicas a construir políticas que generen un ambiente favorable para la detección temprana de la enfermedad periodontal, y reorientar, así, los servicios de salud para lograr una mayor interacción entre médicos y odontólogos.
Sería importante analizar la estructura del LPS de Porphyromonas gingivalis para obtener más información que permita demostrar si puede tener influencia en el tropismo por las células endoteliales y su potencial rol etiopatogénico en la placa aterosclerótica. Existe evidencia clara de una asociación epidemiológica entre la periodontitis y la aterosclerosis, como se discutió anteriormente; sin embargo, es incierta la relación causa y efecto entre las variables en cuestión. Por consiguiente, serían necesarios más estudios experimentales para demostrar la relación causal entre la infección por Porphyromonas gingivalis y la ateromatosis coronaria en humanos.