Introducción
La fibrilación auricular (FA) y la enfermedad renal crónica (ERC) a menudo coexisten y tienen una relación bidireccional; por una parte, los cambios metabólicos y hemodinámicos producidos por la ERC pueden alterar la función cardíaca y predisponer a la FA y, por otro, la aparición de FA puede doblar el riesgo de progresión de la ERC1. Además, ambas enfermedades comparten factores de riesgo como la HTA, la diabetes mellitus, la obesidad o la edad avanzada. Existen varios estudios que han encontrado una asociación significativa entre la prevalencia de FA y una TFGe reducida, con una prevalencia de FA entre los pacientes con ERC de entre el 10 y el 23%, incrementándose a medida que empeora la TFGe2-4.
La relación causal entre FA y ERC está mejor establecida en el caso de la ablación de FA, pues existen varios estudios que han encontrado una mejoría de la función renal en aquellos pacientes que tras el tratamiento permanecían libres de la arritmia5,6. Sin embargo, en el caso de la CVE la evidencia existente es más escasa; tan solo existen dos estudios que han relacionado una peor función renal con la presencia de recurrencias tras CVE7,8.
El objetivo de este estudio es evaluar los cambios producidos en la TFGe al año de seguimiento tras CVE de FA en población española y con la fórmula actualmente recomendada por la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) en la guía KDIGO. Además, como objetivo secundario se incluyó el análisis de biomarcadores (péptido natriurético cerebral [BNP], corina y galectina-3) como posibles predictores de la evolución de la función renal y recurrencias tras CVE.
Materiales y métodos
Diseño y población de estudio
Cohorte prospectiva de pacientes con FA persistente remitidos a nuestro centro de forma consecutiva y según práctica clínica habitual, para realizar una CVE programada. Solo se incluyeron aquellos en quienes se consiguió restaurar el ritmo sinusal de forma aguda. El periodo de reclutamiento fue de julio de 2015 a junio de 2017. El seguimiento se realizó durante 12 meses. Todos los pacientes firmaron el consentimiento informado para el estudio, previamente aprobado por el Comité Ético de Investigación Clínica de nuestro hospital.
Criterios de exclusión
a) Pacientes que rechazaron firmar el consentimiento informado.
b) Imposibilidad para realizar los seguimientos clínicos o la recogida de muestras biológicas.
c) Antecedente personal de insuficiencia renal grave (TFGe < 30 ml/min/1,73 m2).
d) Pacientes en hemodiálisis.
e) Infarto agudo de miocardio o intervención coronaria percutánea en los 6 meses previos a la CVE.
f) Ablación de FA en los 6 meses previos a la realización del estudio.
Evaluación de la función renal
La TGFe se estimó mediante la fórmula CKD-EPI según las recomendaciones de la guía KDIGO de 20129. La TFGe se midió en el momento basal y 3 y 12 meses tras la ablación o CVE. Se consideró mejora de la TFGe cualquier incremento en el seguimiento frente al valor basal.
Cardioversión eléctrica
La CVE se realizó en pacientes con una correcta anticoagulación, con fármacos antivitamina K (AVK) o anticoagulantes directos (ACO), al menos en las tres semanas previas al procedimiento. En el caso de pacientes con AVK se realizó una medición del INR semanal en las tres a cuatro semanas previas. En el caso de INR infraterapéutico (INR < 2) para pacientes con AVK u olvidos en la toma de medicación en caso de los ACOD, la CVE se pospuso hasta completar al menos tres semanas de anticoagulación correcta, o bien se realizó un ecocardiograma transesofáfico si el procedimiento no admitía cierta demora por la situación clínica del paciente. La CVE se llevó a cabo en la Unidad de reanimación tras un periodo de ayunas mayor o igual a 8 horas, bajo sedación profunda llevada a cabo por un anestesista, y los choques eléctricos fueron administrados por personal adscrito a la Unidad de Arritmias, mediante un desfibrilador bifásico Medtronic® (Minneapolis, MN, EE.UU.). Los choques se administraron con palas o parches, habitualmente en posición paraesternal-apical, con una energía de entre 200 y 360 J en función de las características del paciente, con un máximo de cuatro choques por paciente.
Seguimiento
Tras la CVE, los pacientes se revisaron en consulta de arritmias a los 3 y a los 12 meses con ECG y Holter-ECG de 24 horas. Se consideró recurrencia cualquier arritmia auricular (FA, flutter o taquicardia auricular) de duración ≥ 30 s.
Se realizó una analítica con control de la función renal basal, a los 3 y 12 meses, y se obtuvo una muestra de sangre para medir los niveles de BNP, corina y galectina-3 de forma basal y a los 12 meses.
Análisis estadístico
Las variables numéricas se describen como media ± desviación estándar o mediana (intervalo intercuartílico) en el caso de las variables no normales. Las variables categóricas se describen como frecuencias absolutas y relativas. Para comparar las posibles diferencias en las variables cualitativas entre los grupos según el tipo de FA y grupos de TFGe, se utilizó el test de la X2 de Pearson o el test exacto de Fisher cuando no se cumplían las condiciones de aplicabilidad. Para las variables numéricas se utilizó el test de la t de Student y ANOVA para muestras independientes o Mann-Whitney y Kruskall-Wallis en los casos no paramétricos. La normalidad de las variables se estudió con el test de Shapiro-Wilks. Se utilizó el modelo lineal general de medidas repetidas para comparar la evolución de los distintos parámetros en el seguimiento, considerando el tiempo como factor individual y el grupo de comparación (los distintos factores de riesgo cardiovascular, tratamientos, etc.) como factor interindividual. Para la comparación de los parámetros cualitativos en los distintos momentos, se empleó el test de McNemar. Se realizó un modelo de regresión lineal de efectos mixtos para analizar las variables que influyen en la variación de la TFGe, se ajustó por el tiempo, recurrencia y el resto de posibles variables confusoras, y se consideró a los pacientes como efecto aleatorio del modelo. En primer lugar, se ajustó el modelo nulo, al considerar únicamente la variabilidad del paciente (modelo I); en segundo lugar, se ajustó por la variable tiempo (modelo II) y, en tercer lugar, por las demás covariables (modelo III). Se realizó un modelo de regresión logística multivariante para analizar variables relacionadas con la recurrencia a los 12 meses.
Se incluyen en el modelo las variables con p < 0.10 en el bivariante. El método de selección de variables fue por pasos sucesivos hacia atrás. Para evaluar la capacidad predictiva del modelo se calcula la curva ROC y el área bajo la curva. Para todos los contrastes se consideró significativo un valor de p < 0,05. Los datos se analizaron con el software SPSS 19.0® (SPSS Inc.; Chicago, Illinois, EE.UU.).
Resultados
Características basales
Se incluyó a 92 pacientes con FA persistente, con una edad media de 64 ± 11 años (intervalo, 30-84 años), de los cuales 52 eran varones (56,5%). A 18 pacientes (19,6%) ya se les había realizado con anterioridad otra CVE. A 4 pacientes (4,3%) se les había realizado una ablación previa, en 2 pacientes de venas pulmonares y en otros 2 del istmo cavotricuspídeo. La mediana de tiempo en FA antes de la CVE fue de 4 meses [2-7 meses]. La TFGe basal fue de 86,5 [74,6-97,6 ml/min/1,73 m2 y la creatinina basal fue de 0,80 [0,72-0,94] mg/dl. Las demás características basales se resumen en la tabla 1.
Tabla 1 Características basales
| n = 92 | |
|---|---|
| Características clínicas | |
| - Edad, años | 64 ± 11 |
| - Varones, % | 57.0 |
| - IMC, kg/m2 | 31.3 ± 5.8 |
| - Hipertensión, % | 60.9 |
| - Diabetes mellitus, % | 8.7 |
| - Hipercolesterolemia, % | 38.0 |
| - Enfermedad pulmonar, % | 21,7 |
| - Cardiopatía estructural, % | 47.8 |
| - Tiempo en FA (meses) | 4 (2-7) |
| - CHA2DS2VASC, % | |
| 0-1 | 37.0 |
| ≥2 | 63.0 |
| Tratamiento médico, % | |
| - IECA/ARA-II | 64.2 |
| - Betabloqueantes | 90.2 |
| - Digoxina | 14.1 |
| - Estatinas | 31.5 |
| - Diuréticos | 55.4 |
| - Antiarrítmicos | 27.2 |
| - Anticoagulantes | |
| AVK | 64.1 |
| ACOD | 35.9 |
| Datos ecocardiográficos | |
| - FEVI, % | 54.6 ± 12.1 |
| - DTDVI, mm | 50.6 ± 6.3 |
| - Diámetro AI, mm | 44.9 ± 5.2 |
| Parámetros analíticos | |
| - Creatinina, mg/dl | 0.80 (0.72-0.94) |
| - TFGe, ml/min/1,73 m2 | 86.5 (74.6-97.6) |
| - BNP, pg/ml | 143.8 (95.7-206.0) |
| - Galectina-3, pg/ml | 328.1 (305.3-480.0) |
| - Corina, ng/ml | 4.4 (3.3-5.6) |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II;
AVK: anti- vitamina K; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; ACOD: anticoagulante directo;
AVK: anti- vitamina K; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; ACOD: anticoagulante directo;
TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media ± desviación estándar en el caso de variables normales, y como mediana (intervalo intercuartílico) en el caso de variables no normales.
Los pacientes se dividieron en tres grupos según su TFGe basal: grupo 1 (38 pacientes, 41,3%) con TFGe normal (≥ 90 ml/min/1,73 m2); grupo 2 (46 pacientes, 50%) con TFGe ligeramente reducida (60-89 ml/min/1,73 m2), y grupo 3 (8 pacientes, 8,7%) con TFGe moderadamente reducida (30-59 ml/min/1,73 m2). Los 8 pacientes con TFGe < 60 ml/min/1,73 m2 no tenían registrado en su historia el antecedente de insuficiencia renal; todos ellos eran hipertensos como posible causa del deterioro de la función renal. Las características clínicas, ecocardiográficas y analíticas de los pacientes agrupados según el grupo de TFGe basal se muestran en la tabla 2. Los pacientes con peor TFGe (grupos 2 y 3) tenían más edad, menor IMC, mayor proporción de HTA, mayor puntuación en la escala CHA2DS2VASc, mayor uso de IECA/ARA-II y diuréticos, y mayor concentración de BNP basal. También tenían una mayor tendencia a ser de sexo femenino y de mayor frecuencia de hipercolesterolemia.
Tabla 2 Características basales agrupadas según el grupo de TFGe
| FGe 30-59 (n = 8) | FGe 60-89 (n = 46) | FGe ≥ 90 (n = 38) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| - Edad, años | 73 ± 8 | 67 ± 11 | 58 ± 9 | < 0.001 |
| - Varones, % | 50.0 | 45.7 | 71.1 | 0.060 |
| - IMC, kg/m2 | 21.8 (21.6-22.2) | 30.3 (27.6-34.7) | 31.1 (28.8-36.d2) | 0.023 |
| - Hipertensión, % | 100 | 65.2 | 47.4 | 0.015 |
| - Diabetes mellitus, % | 0.0 | 10.9 | 7.9 | 0.587 |
| - Hipercolesterolemia, % | 75.0 | 39.1 | 28.9 | 0.050 |
| - Enfermedad pulmonar, % | 12.5 | 26.1 | 18.4 | 0.560 |
| - Cardiopatía estructural, % | 62.5 | 45.7 | 47.4 | 0.677 |
| - CHA2DS2-VASC, % | 0.0 | 23.9 | 60.5 | < 0.001 |
| 0-1 | 100.0 | 76.1 | 39.5 | |
| ≥ 2 | ||||
| Tratamiento médico, % | ||||
| - IECA/ARA-II | 87.5 | 73.9 | 50.0 | 0.028 |
| - Betabloqueantes | 87.5 | 89.1 | 92.1 | 0.869 |
| - Digoxina | 25.0 | 8.7 | 18.4 | 0.290 |
| - Estatinas | 50.0 | 35.6 | 23.7 | 0.264 |
| - Diuréticos | 100 | 58.7 | 42.1 | 0.009 |
| - Antiarrítmicos | 12.5 | 30.4 | 23.7 | 0.677 |
| - Tipo anticoagulación | 0.383 | |||
| AVK | 87.5 | 63.0 | 63.2 | |
| ACOD | 12.5 | 37.0 | 36.8 | |
| Datos ecocardiográficos | ||||
| - FEVI, % | 60.0 (38.5-63.7) | 60.0 (47.2-65.0) | 60.0 (45.0-65.0) | 0.907 |
| - DTDVI, mm | 49.0 ± 8.8 | 50.9 ± 4.9 | 50.7 ± 7.0 | 0.774 |
| - Diámetro AI, mm | 46.9 ± 6.4 | 44.4 ± 5.5 | 45.1 ± 4.7 | 0.526 |
| Parámetros analíticos | ||||
| - Creatinina, mg/dl | 1.28 ± 0.23 | 0.88 ± 0.17 | 0.73 ± 0.08 | < 0.001 |
| - FGe, ml/min/1,73 m2 | 50.3 ± 7.4 | 78.6 ± 9.0 | 100.1 ± 8.1 | < 0.001 |
| - BNP, pg/ml | 266.9 (147.9-329.3) | 161.0 (104.9-212.9) | 122.5 (75.5-167.7) | 0.001 |
| - Galectina-3, pg/ml | 402.1 ± 142.8 | 522.1 ± 401.0 | 428.2 ± 258.9 | 0.458 |
| - Corina, ng/ml | 4.5 ± 1.7 | 6.5 ± 6.0 | 5.2 ± 3.4 | 0.452 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; AVK: anti- vitamina K; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina;
IMC: índice de masa corporal; ACOD: anticoagulante directo; TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media ± desviación estándar en el caso de variables normales, y como mediana (intervalo intercuartílico) en el caso de variables no normales.
Resultados CVE
Se perdieron 12 pacientes en el seguimiento de los 3 meses y 8 en el de los 12 meses. De los pacientes que sí acudieron a revisión, 37 (46,5%) estaban libres de recurrencias a los 3 meses y 33 (39,3%) a los 12 meses. Todos ellos recurrieron en forma de FA persistente excepto uno que recurrió como FA paroxística. De los 37 pacientes sin recurrencia a los 3 meses, 10 (27,0%) estaban tomando FAA frente a 27 (73,0%) que no los tomaban (p = 0,698). De los 33 pacientes sin recurrencias a los 12 meses, 12 (36,4%) estaban tomando FAA al final del seguimiento frente a 21 (63,6%) que no los tomaban (p = 0,138). Cabe destacar que los pacientes con mayor diámetro de AI recurrieron con más frecuencia (45,5 ± 4,8 mm en los pacientes con recurrencias vs. 42,9 ± 4,6 mm en los pacientes sin recurrencias, p = 0,032), que hubo una tendencia a mayor edad (66 ± 10 años en los pacientes con recurrencias vs. 62 ± 10 años en los pacientes sin recurrencias, p = 0,067) y una menor proporción de enfermedad pulmonar en el grupo con recurrencias (33,3% en los pacientes sin recurrencias vs. 17,6% en los pacientes con recurrencias, p = 0,099). No hubo diferencias en el resto de variables estudiadas.
En cuanto a los biomarcadores, los pacientes con recurrencias presentaron cifras mayores de BNP basalmente (165,2 [104,2-235,7] pg/ml) frente a aquellos que no tuvieron recurrencias (55,5 [22,0-105,5] pg/ml) (p < 0,0001). No se encontró relación entre las cifras de BNP, galectina-3 ni corina, y las recurrencias.
No hubo ninguna complicación derivada de la CVE. Durante el seguimiento un paciente fue éxitus por sepsis de origen respiratorio, 6 pacientes precisaron una nueva CVE, 3 fueron sometidos a ablación de FA (2 más estaban en lista de espera de ablación) y uno precisó ablación del nodo aurículo-ventricular más implante de marcapasos.
Cambios en el filtrado glomerular
Al año de seguimiento y en el total de pacientes, la TFGe se redujo de 86,5 [74,6-97,6] a 84,5 [71,7-95,1] ml/min/1,73 m2 (p = 0,002) y la creatinina aumentó de 0,80 [0,72-0,94] mg/dl a 0,83 [0,74-0,97] mg/dl (p = 0,005).
No hubo diferencias en la TFGe basal en función de que se produjeran o no recurrencias a los 3 y a los 12 meses (Tabla 3).
Tabla 3 Modelo lineal general de medidas repetidas que analiza la TFGe de forma basal, a los 3 y 12 meses en función de la existencia o no de recurrencias a los 12 meses
| Recurrencias no | Recurrencias si | Valor p | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Basal | 3 meses | 12 meses | Basal | 3 meses | 12 meses | Grupo | Tiempo | Grupo x tiempo | |
| TFGe | 86.3 ± 16.3 | 83.0 ± 17.1 | 86.1 ± 14.8 | 83,7 ± 17.9 | 82.6 ± 15.0 | 81.1 ± 17.6 | 0.491 | 0.143 | 0.154 |
TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media ± desviación estándar.
La TFGe se redujo de media al final del seguimiento en -3,0 [-9,6 a 2,5 ml/min/1,73 m2, sin diferencia estadísticamente significativa entre los pacientes que presentaron recurrencia a los 12 meses y los que no (-2,9 [-9,7 a 2,8 frente a -2,0 [-6,7 a 2,7] ml/min/1,73 m2; (p = 0,387). Tampoco hubo diferencias en la TFGe según del grupo de TFGe del que se partiera, (grupo 1, -5,9 [-10,3 a -0,6 ml/min/1,73 m2; grupo 2, -2,2 [-8,4 a 8,0] ml/min/1,73 m2; grupo 3, 1,6 [-11,0 a 6,9 ml/min/1,73 m2; p = 0,121) (Fig. 1).
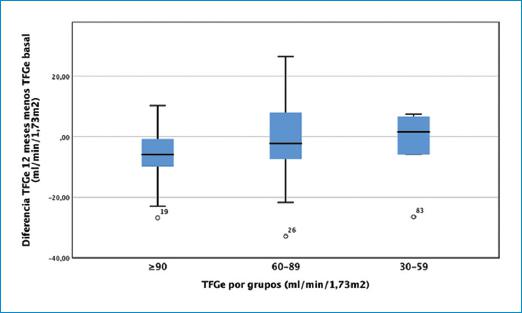
Figura 1 Evolución de la TFGe al año de seguimiento en función de la TFGe basal por grupos. TFGe: tasa de filtrado glomerular estimada.
En los pacientes que no tuvieron recurrencias a los 12 meses, basalmente había un 3% de ellos en el grupo 3 de TFGe, un 48,5% en el grupo 2 y un 48,5% en el grupo 1; y se mantuvo el mismo porcentaje de pacientes en cada grupo a los 12 meses (p = 1,000). En los pacientes que sí tuvieron recurrencias, se pasó de un 9,8 a un 11,8% de pacientes en el grupo 3, de un 49,0 a un 52,9% en el grupo 2, y de un 41,2 a un 33,3% en el grupo 1 (p = 0,445) (Fig. 2).
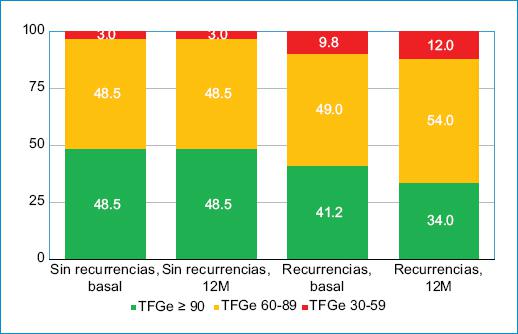
Figura 2 Cambios en el grupo de TFGe según la existencia o no de recurrencias a los 12 meses. TFGe: tasa de filtrado glomerular estimada.
Las características clínicas, ecocardiográficas y analíticas fueron similares entre los pacientes en quienes hubo mejoría de la TFGe al final del seguimiento y quienes no obtuvieron mejoría, aunque en el grupo de mejoría hubo una tendencia a una menor duración del tiempo en FA (meses), un menor diámetro de AI y unas cifras más elevadas de BNP. Los pacientes con mejoría de la TFGe partían de unas cifras de creatinina mayores y una TFGe menor basalmente (Tabla 4).
Tabla 4 Características basales agrupadas según la mejoría o no de la TFGe al año de seguimiento.
| Mejoría FGe (n = 27) | No mejoría FGe (n = 58) | p | |
|---|---|---|---|
| Características clínicas | |||
| - Edad, años | 66 ± 8 | 63 ± 12 | 0.558 |
| - Varones, % | 51.9 | 58.6 | 0.842 |
| - IMC, kg/m2 | 31.1 (28.9-33.0) | 30.6 (26.8-35.6) | 0.786 |
| - Hipertensión, % | 70.4 | 56.9 | 0.235 |
| - Diabetes mellitus, % | 3.7 | 10,.3 | 0.282 |
| - Hipercolesterolemia, % | 33.3 | 37.9 | 0.682 |
| - Enfermedad pulmonar, % | 25.9 | 22.4 | 0.722 |
| - Cardiopatía estructural, % | 44.4 | 44.8 | 0.974 |
| - CHA2DS2-VASC, % | 0.598 | ||
| 0-1 | 25.9 | 43.1 | |
| ≥ 2 | 74.1 | 56.9 | |
| - Ausencia de recurrencias al año | 44.4 | 37.5 | 0.545 |
| - Tiempo evolución FA (meses) | 4 (2-5) | 5 (3-8) | 0.154 |
| Tratamiento médico, % | |||
| - IECA/ARA-II | 70.4 | 58.6 | 0.298 |
| - Betabloqueadores | 86.2 | 96.3 | 0.261 |
| - Estatinas | 34.6 | 31.0 | 0.745 |
| - Diuréticos | 63.0 | 50.0 | 0.264 |
| - Antiarrítmicos | 25.9 | 27.6 | 0.873 |
| Datos ecocardiográficos | |||
| - FEVI, % | 55.0 (43.0-65.0) | 60.0 (50.0-65.0) | 0.358 |
| - DTDVI, mm | 51.2 ± 7.2 | 50.0 ± 5.4 | 0.520 |
| - Diámetro AI, mm | 43.3 ± 5.3 | 45.0 ± 4.6 | 0.180 |
| Parámetros analíticos | |||
| - Creatinina, mg/dl | 0.89 (0.77-1.09) | 0.76 (0.68-0.84) | < 0.0001 |
| - TFGe, mL/min/1,73 m2 | 76.1 ± 15.4 | 90.5 ± 15.3 | < 0.0001 |
| - BNP, pg/ml | 149.6 (114.9-214.9) | 135.2 (91.9-198.0) | 0.080 |
| - Galectina-3, pg/ml | 460.3 ± 290.9 | 463.4 ± 340.8 | 0.972 |
| - Corina, ng/ml | 4.0 (3.2-5.5) | 4.5 (3.3-5.6) | 0.623 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media ± desviación estándar en el caso de variables normales, y como mediana (intervalo intercuartílico) en el caso de variables no normales.
Evolución de los biomarcadores
El BNP se redujo en todos los pacientes de 143,8 [95,7-206,0] a 123,6 [56,3-211,7] pg/ml al año de seguimiento (p = 0,256), con diferencias significativas entre los pacientes que tuvieron recurrencias (151,8 ± 76,5 a 204,3 ± 177,9 pg/ml) frente a aquellos que no tuvieron recurrencias al año (225,5 ± 248,1 a 78,5 ± 93,8 pg/ml) (p < 0,0001). No se encontró relación entre el BNP y ninguna de las otras variables estudiadas.
Los valores de corina se incrementaron de 4,4 [3,3- 5,6] a 6,5 [5,1-11,0] ng/ml a los 12 meses (p = 0,004), sin diferencia estadísticamente significativa en función de la existencia o no de recurrencias (p = 0,877). Los pacientes en tratamiento con IECA/ARA-II tuvieron una mayor mejoría en las cifras de corina (p = 0,029). No hubo diferencias en el resto de las variables estudiadas.
Los valores de galectina-3 pasaron de los 352,3 [305,3-480,0] pg/ml en situación basal a 394,4 [291,8-658,3] pg/ml a los 12 meses (p = 0,588); no hubo relación con las recurrencias a los 12 meses (p = 0,382) ni con ninguna de las demás variables estudiadas.
Variables asociadas con la mejora de la función renal
Se produjo un descenso en el tiempo de la TFGe estadísticamente no significativo. El sexo femenino se asoció con un promedio de 14,7 unidades menos de TFGe que el masculino, a igualdad del resto de variables. A medida que aumenta la edad, la TFGe disminuye un promedio de 0,7 unidades. A medida que aumenta el IMC, la TFGe disminuye 0,1 unidades. Los pacientes con dislipemia tienen un promedio de 2,0 menos de TFGe.
Variables asociadas con las recurrencias
La edad y el tamaño de la AI son factores de riesgo para las recurrencias (OR: 1,062 [1,007-1,121] y 1,150 [1,020-1,296]), y la enfermedad pulmonar actúa como factor protector (OR: 0,285 [0,085-0,955]). La capacidad predictiva de este modelo es moderada, con un área bajo la curva de 0,747.
Discusión
En este studio, en pacientes con FA persistente tratados con CVE programada, se observa un empeoramiento de la TFGe al año de seguimiento, sin diferencias en función de la existencia de recurrencias, aunque hubo una tendencia a que la TFGe se mantuviera estable en el tiempo en los pacientes sin recurrencias a los 12 meses y de que empeorase en los pacientes con recurrencias. Tampoco se observó una mejoría de la TFGe en función del grupo de TFGe basal del que partieran, aunque sí hubo cierta tendencia a un empeoramiento en pacientes con TFGe basal ≥ 90 y 60-89 ml/min/1,73 m2, mientras que los pacientes con TFGe 30-59 ml/min/1,73 m2 mejoraron ligeramente. Por tanto, este estudio no confirma los hallazgos encontrados por Schmidt et al.7, quienes observaron una mejora de la TFGe en los pacientes sin recurrencias al año, y un empeoramiento en pacientes con recurrencies; así mismo, se encontró que los pacientes con insuficiencia renal ligera o moderada que se mantuvieron en ritmo sinusal al final del seguimiento, mejoraron su TFGe, mientras que los que tenían TFGe normales o insuficiencia renal grave no mejoraron en el seguimiento.
El efecto de la CVE sobre la optimización de la función renal es más controvertido que el efecto de la ablación de FA, posiblemente, por la alta tasa de recurrencias de la CVE y el escaso porcentaje de pacientes que permanece libre de arritmias en el seguimiento. Lo anterior impide demostrar la mejoría de la función renal atribuida al mantenimiento del ritmo sinusal observado en los pacientes tratados con ablación. Otra posible explicación fisiopatológica para la ausencia de mejoría de la función renal sería que la CVE no modifica el sustrato fisiopatológico de la FA, por lo que se produce un menor remodelado inverso de la AI con los potenciales beneficios hemodinámicos que puede conllevar. Hasta la fecha, tan solo se han publicado los estudios de Schmidt y et al.7,8, los cuales ofrecen resultados contradictorios con el nuestro. Otro grupo liderado por Hellman et al.10 describe una complicación tras la CVE relativamente frecuente en su población, consistente en el desarrollo de insuficiencia renal que puede llegar incluso a necesitar diálisis; dicha entidad se asocia con un peor pronóstico en su estudio, y se atribuye a factores hemodinámicos; sin embargo, este hallazgo no ha sido confirmado posteriormente en otros estudios. A la luz de los datos disponibles en la literatura no es posible recomendar la CVE como método para mejorar la función renal en pacientes con FA.
En el análisis multivariante de las variables asociadas a mejoría de la TFGe se encontró que los pacientes varones tenían mejor TFGe y los de más edad, peor TFGe, en posible relación con que ambas variables están incluidas en el cálculo de la fórmula CKD-EPI. Los pacientes con mayor IMC presentaron una peor TFGe en el seguimiento; la obesidad predispone a la nefropatía diabética y a la nefroesclerosis secundaria a HTA, y produce cambios hemodinámicos asociados al desarrollo de ERC11.
En el análisis multivariante, las variables asociadas a la aparición de recurrencias fueron la edad y el mayor tamaño de AI. La edad no tiene un efecto en la tasa de éxito aguda tras CVE, pero al año de seguimiento se ha observado que los pacientes más jóvenes tienen más posibilidad de mantenerse en ritmo sinusal12. También, acorde con nuestros resultados, múltiples estudios han relacionado la dilatación auricular con la presencia de recurrencias tras CVE12-15; esta asociación se explica porque, generalmente, a mayor tamaño auricular, mayor remodelado auricular y fibrosis, que con frecuencia son irreversibles. Otros factores asociados en la literatura con recurrencies, como la duración de la FA o la ausencia de fármacos antiarrítmicos, no se han encontrado como predictores en nuestro estudio. Contrario a la información disponible12,16, nuestro trabajo ha encontrado que los pacientes con antecedente de enfermedad pulmonar presentan menos recurrencias que aquellos que no tenían dicho antecedente, sin que exista una explicación plausible para ello. Nuestro estudio tampoco encontró una mayor tasa de recurrencias en pacientes con peor TFGe, como sí hallaron Schmidt et al.7,8.
Respecto a los biomarcadores, en nuestro estudio el BNP se redujo al año de seguimiento. Los pacientes que no tuvieron recurrencias a los 12 meses presentaron unas cifras de BNP basal significativamente más bajas en el análisis bivariante que los que sí tuvieron recurrencies; además, los pacientes sin recurrencias presentaron una disminución de las cifras de BNP al final del seguimiento, mientras que los pacientes con recurrencias tuvieron un incremento de las cifras, pero no se encontró relación en el análisis multivariante entre las cifras de BNP y la presencia de recurrencias. Beck-da-Silva et al.17 observaron que en los pacientes remitidos a CVE, una cifra de BNP basal más baja se asociaba con el mantenimiento del ritmo sinusal dos semanas despúes de la CVE. Por el contrario, Shin et al. y Wozakowska-Kaplon et al.18,19 no encontraron que los niveles de NT- proBNP o BNP basales fueran predictores de éxito a largo plazo tras CVE. Finalmente, los resultados de dos metaanálisis realizados en pacientes con CVE parecen apoyar la utilidad de las cifras de BNP y NT-proBNP como predictores del éxito de la CVE20,21.
La corina es una proteína transmembrana que transforma el propéptido natriurético auricular y el pro-BNP en sus formas activas. Existe escasa evidencia del papel que desempeña la corina en la FA, pero existen estudios que relacionan unas cifras bajas de corina con peor pronóstico en pacientes con insuficiencia cardíaca22. En nuestro estudio se produjo un incremento de las cifras de corina en el seguimiento, lo cual podría estar relacionado con una mejoría de la función cardiaca tras la ablación.
Por otro lado, la galectina-3 es una proteína profibrótica que se ha asociado con el remodelado estructural auricular producido por la FA23. Se han publicado varios estudios que han encontrado que unos niveles elevados de galectina-3 de forma basal predicen la aparición de recurrencias tras ablación de FA24-26; sin embargo, no existen publicaciones que relacionen la galectina-3 con las recurrencias tras CVE y nuestro estudio tampoco ha encontrado dicha asociación.
La falta de asociación en nuestro trabajo entre la evolución de los biomarcadores y la mejora de la TFGe, así como con las recurrencias, podría deberse a un tamaño muestral insuficiente puesto que sí se observa cierta tendencia. Los pacientes incluidos en nuestro estudio eran los derivados para CVE, según la práctica clínica habitual, y, por tanto, los resultados serían extrapolables a la mayor parte de dicha población. No obstante, en el futuro sería importante que se llevaran a cabo estudios multicéntricos, con mayor tamaño muestral, y que no excluyeran a pacientes con ningún grado de afección renal.














