Introducción
La circulación de Fontan es una medida quirúrgica paliativa para los pacientes con enfermedades congénitas cardíacas complejas no susceptibles de reparación biventricular, con base en una redirección pasiva del retorno venoso sistémico hacia la circulación pulmonar. La causa de estas cardiopatías es bastante diversa, con cohortes heterogéneas y morfologías ventriculares muy diferentes1.
A pesar del aumento de la supervivencia a corto y mediano plazos, la disfunción ventricular y el desarrollo de insuficiencia cardíaca son inevitables en la etapa adulta. La valoración funcional precisa es en particular importante para la detección temprana y la toma de decisiones terapéuticas, pero esto se dificulta por la geometría y anatomía ventriculares, además de la ventana acústica subóptima que muestran estos pacientes. Las medidas de ecocardiografía convencional tienen una falta de sensibilidad en la detección temprana de la disfunción con una elevada variabilidad y una escasa correlación con la FE determinada por resonancia magnética cardíaca (RMC), considerada la norma de referencia para el cálculo volumétrico, anatómico y funcional2.
Sin embargo, las técnicas de deformación miocárdica por speckle tracking echocardiography (STE) y RMC-feature tracking (RMC-FT) han surgido como herramientas novedosas para la valoración global y regional de la función ventricular. Son independientes de la morfología y geometría ventricular, así como de las condiciones de precarga y del ángulo de insonación, en el caso de la ecocardiografía3,4, y no suponen una adquisición de imágenes adicionales ni aumento del tiempo de posprocesamiento en la RMC. La técnica de feature tracking se basa en el seguimiento de una alteración (feature) generada por la heterogeneidad del músculo cardíaco debido al brillo tisular, rugosidad y estructuras anatómicas como las trabeculaciones y los músculos papilares. El software identifica dicho feature en un segmento tisular definido en una pequeña ventana y en el siguiente frame busca una alteración similar en la escala de grises en los pixeles contiguos y trata de seguirla en los sucesivos frames a lo largo de todo el ciclo cardíaco.
En los ventrículos únicos (VU) de morfología derecha se ha descrito una disminución de la tolerancia al ejercicio y la función ventricular, con peor pronóstico y evolución5-7, con valores disminuidos de strain con respecto a la población sana8-12 y los VU de morfología izquierda13-15. Tampoco queda bien establecida su correlación con la FE calculada por RMC16.
El objetivo fue analizar la función ventricular mediante STE y RMC-FT en pacientes con derivación cavo-pulmonar total (DCPT) comparada con valores de RMC convencional para determinar posibles diferencias de acuerdo con la morfología del VU y su implicación en el diagnóstico temprano de disfunción ventricular.
Materiales y métodos
Estudio observacional unicéntrico que incluyó a 64 pacientes con circulación de Fontan en edad pediátrica seguidos en el centro de los autores desde diciembre de 2010 hasta diciembre de 2018. Los criterios de inclusión fueron: estadio intermedio de derivación cavopulmonar parcial (Glenn), derivación cavo-pulmonar total (DCPT) después de los 2.5 años de vida y una edad mínima en el momento del estudio de 3.5 años. Los diagnósticos iniciales incluían cardiopatías congénitas complejas y se consideró la de mayor relevancia para su clasificación en VU de morfología derecha o izquierda1.
Este estudio recibió aprobación del Comité de Ética e Investigación del hospital y se obtuvo el consentimiento informado de los familiares de todos los pacientes.
Valoración ecocardiográfica
Todos los pacientes fueron objeto de un ecocardiograma transtorácico por un cardiólogo pediátrico experimentado de acuerdo con las recomendaciones de la American Society of Echocardiography en niños17. Se utilizó un ecógrafo iE33 (Philips Medical Systems, Best, Netherlands), según los protocolos establecidos por este servicio, con un frame rate de 60 a 90 frames/s. Se ajustaron calidad de imagen y resolución temporal de acuerdo con las técnicas regulares con objeto de optimizar la definición del borde endocárdico. Todas las imágenes se grabaron y almacenaron digitalmente para un análisis posterior fuera de línea con el software Xceleraâ (Philips Medical Systems) y QLab 10.7 (Philips Medical Systems, Best, Netherlands) para el estudio de STE.
Se obtuvieron valores de strain y strain rate máximos longitudinales a partir de los planos de dos cámaras y aplical (4 cámaras). El strain y strain rate máximos circunferenciales se calcularon a partir de imágenes en eje corto paraesternal de los músculos papilares, de tal modo que éstos quedaron en la parte trabeculada incluidos en la cavidad ventricular. El ventrículo accesorio no se incluyó en la cuantificación de volumen ni masa ventricular.
Tras una demarcación manual inicial del endocardio, el sistema implementaba el movimiento de speckles a lo largo del ciclo cardíaco y realizaba una segmentación miocárdica y análisis del movimiento ventricular automatizados18. Con posterioridad se llevó a cabo una comprobación visual del seguimiento durante el ciclo cardíaco con ajuste manual del trazado hasta conseguir que todo el miocardio quedara incluido y existiera un correcto seguimiento de los speckles trazados. Se efectuaron tres mediciones en tres ciclos cardíacos diferentes y se calculó la media aritmética para determinar el strain longitudinal global (GLS) y circunferencial global (GCS) y sus correspondientes strain rates globales.
Valoración por RMC
Se realizó RMC en todos los pacientes con equipos Panorama 1.0T (Philips Medical Systems®) y MAGNETOM® (Skyra Syngo MR E11 (―3T―) Siemens) en un plazo máximo de seis meses anteriores o posteriores a la realización de la ecocardiografía sin existir ningún procedimiento quirúrgico o intervencionista entre ambos estudios. Se excluyó a los pacientes portadores de marcapasos o cualquier dispositivo no compatible con RMC.
Se calcularon los volúmenes telediastólico y telesistólico, masa ventricular, volumen sistólico, gasto cardíaco y FE. Todos estos valores se indexaron por la superficie corporal (BSA). Se definió la disfunción ventricular como una FE < 45%.
El análisis de deformación miocárdica se llevó a cabo mediante el software CVI 42® (Circle Cardiovascular Imaging, Calgary, Canada) en los ejes corto y longitudinal de cuatro y dos cámaras.
Se delimitaron manualmente los contornos endocárdico y epicárdico en telesístole y telediástole y el software efectuó los trazados a lo largo de todo el ciclo cardíaco de forma automática, con comprobación visual de la exactitud del seguimiento y corrección manual para conseguir un tracking adecuado.
Se obtuvieron valores máximos globales de strain y strain rate longitudinal, circunferencial y radial, FE y volúmenes telesistólico y telediastólico en 2D y 3D. Se calcularon los valores de strain regional circunferencial de las porciones basal, media y apical ventriculares, luego de realizar la segmentación miocárdica de acuerdo con los modelos informados en las publicaciones médicas (seis en el plano longitudinal y otros seis en el transversal)18,19.
El análisis en 3D se llevó a cabo a partir de la interpolación de los contornos telesistólico y telediastólico obtenidos en los planos longitudinal y eje corto en 2D, hasta crear mapas de vectores de contractilidad (Fig. 1) y modelos volumétricos tridimensionales en movimiento (Fig. 2).
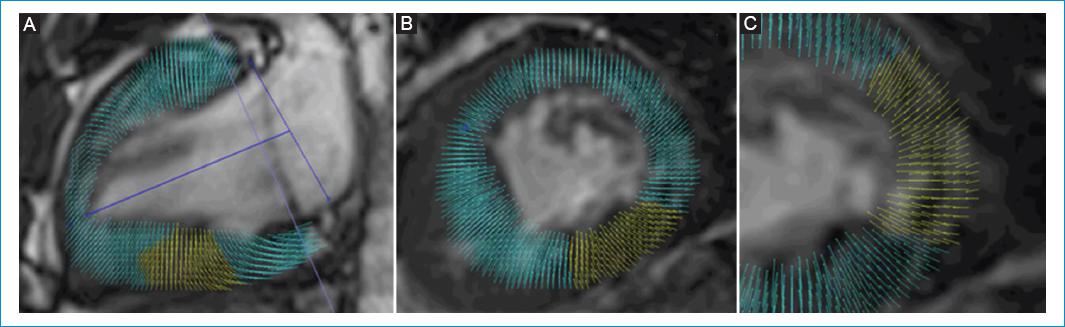
Figura 1 Mapa de vectores a partir de imágenes de 2D RMC – FT. Vectores que indican la dirección de la contracción miocárdica en eje longitudinal. A: en eje corto. B: en detalle. C: en paciente con ventrículo único de morfología izquierda.
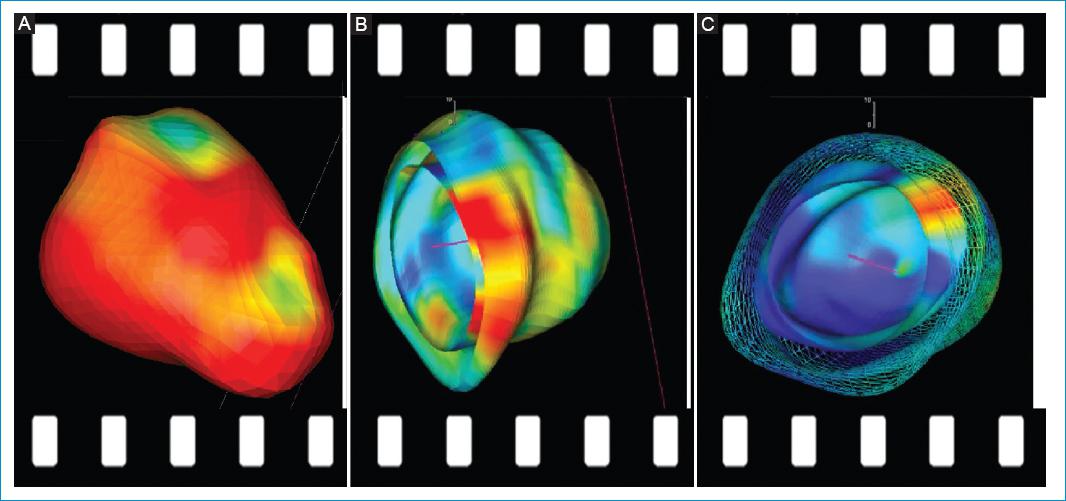
Figura 2 Reconstrucción en 3D por RMC-FT. Paciente con VU de morfología derecha. Reconstrucción a partir de los valores de strain longitudinal, circunferencial y radial. A: volumen completo en 3D. B: modelo por capas opacas de endocardio y epicardio. C: modelo por capas con malla epicárdica. Permite apreciar movilidad de endocardio y pericardio por separado.
Para la inclusión en el estudio era necesario al menos un correcto tracking de cuatro de los seis segmentos en el caso del GLS y el GCS.
Reproducibilidad y factibilidad
La variabilidad intraobservador e interobservador de los parámetros de deformación miocárdica se calculó a partir de 10 estudios seleccionados al azar. Para calcular la variabilidad intraobservador, el mismo observador repitió las mediciones al menos dos semanas después para evitar un sesgo de recuerdo. Para la variabilidad interobservador, otro cardiólogo pediátrico experimentado efectuó las mediciones en los mismos 10 estudios de forma anónima e independiente.
Se expresó la reproducibilidad como el coeficiente de correlación intraclase (CCI) con su respectivo intervalo de confianza y se consideró excelente un coeficiente > 0.75, bueno entre 0.6 y 0.74 y pobre < 0.4.
Análisis estadístico
El análisis estadístico se llevó a cabo con el sistema SAS 9.4 (SAS Institute Inc. 2013, Cary, NC). Las variables cuantitativas se expresaron como media y desviación estándar entre paréntesis (DE) o bien como su rango. Las variables cualitativas se describieron mediante frecuencias absolutas y frecuencias relativas expresadas en porcentaje. Las comparaciones entre variables cuantitativas continuas y cualitativas se llevaron a cabo fundamentalmente con la U de Mann-Whitney. Para las correlaciones cuantitativas se utilizó el coeficiente de correlación de Pearson. Se consideraron valores estadísticamente significativos con p < 0.05.
Resultados
Se incluyó a un total de 67 pacientes con una edad media de 15.5 años (3.9-26.2 años) a los que se realizó una DCPT en edad pediátrica con un tiempo medio de seguimiento desde la cirugía de 9.7 ± 4.7 años. Se excluyó a tres pacientes portadores de dispositivos no compatibles con RMC. Todos los pacientes tenían una corrección mediante conducto extracardíaco, salvo uno con túnel lateral intraauricular. Ningún paciente mostró dehiscencias en el conducto de Fontan ni en la conexión de Glenn. Los gradientes en aorta ascendente y descendente fueron normales y ningún paciente presentaba disfunción significativa en los planos pulmonar, hepático o renal.
De los 64 pacientes incluidos, 26 (40.6%) presentaban morfología de VU derecho y 38 (59.4%) de VU izquierdo. No se identificaron diferencias significativas entre ambos grupos en las variables demográficas, clínicas o grado funcional de la NYHA (Tabla 1). La ecocardiografía reconoció mayor grado de insuficiencia en las válvulas auriculoventriculares (AV) de VU de morfología derecha (p < 0.001), sin ser significativa en el caso de la válvula sistémica (p = 0.196).
Tabla 1 Características generales de la población de estudio
| Variable | Total (n = 64) | VD (n = 26) | VI (n = 38) | p |
|---|---|---|---|---|
| Género (masculino) | 39 (60.9%) | 15 (57.7%) | 24 (63.2%) | 0.795 |
| Edad al estudio (años) | 15.6 (5.6) | 16.4 (4.7) | 15 (6.1) | 0.516 |
| Edad DCPT (años) | 5.8 (2.4) | 6.2 (2.5) | 5.7 (2.4) | 0.274 |
| BSA (m2) | 1.4 (0.4) | 1.5 (0.3) | 1.4 (0.4) | 0.978 |
| FC reposo (lpm) | 81 (19) | 81 (16) | 82 (21) | 0.956 |
| Sat basal de O2 (%) | 93 (4) | 94 (5) | 92 (4) | 0.823 |
| TAS (mmHg) | 111 (12) | 113 (11) | 110 (13) | 0.349 |
| TAD (mmHg) | 64 (10) | 62 (9) | 64 (11) | 0.691 |
| Morfología de VU | 64 (100%) | 26 (40.6%) | 38 (59.4%) | |
| Tipo de cardiopatía | ||||
| HLHS | 12 (18.9%) | |||
| Atresia tricúspide | 22 (34.4%) | |||
| Atresia/estenosis pulmonar | 7 (10.9%) | |||
| DORV | 7 (10.9%) | |||
| DILV | 7 (10.9%) | |||
| Canal AV disbalanceado | 5 (7.8%) | 4 (6.2%) | 1 (1.6%) | |
| Otros | 4 (6.2%) | 3 (4.6%) | 1(1.6%) | |
| Fenestración Fontan | 17 (26.6%) | 9 (52.9%) | 8 (47.1%) | 0.641 |
Datos expresados como media (DE). DCPT: derivación cavopulmonar total; BSA: superficie corporal; VI: ventrículo izquierdo; VD: ventrículo derecho; VU: ventrículo único; TAS: tensión arterial sistólica; TAD: tensión arterial diastólica; FC: frecuencia cardíaca; HLHS: hipoplasia de cavidades izquierdas; DORV: ventrículo derecho de doble salida; DILV: ventrículo izquierdo de doble entrada; AV: auriculoventricular.
Análisis volumétrico y funcional por RMC convencional
La FE media global de la muestra fue de 53.8% ± 8.8%, con 53.4% ± 9.6% en VD y 54.2% ± 8.4% en VI. Siete pacientes (11.1%) presentaron disfunción ventricular, dos de ellos (7.7%) con VU derecho y 5 (13.5%) con izquierdo. Sin embargo, la morfología ventricular no se relacionó con disfunción (p = 0.69) ni con la FE de forma cuantitativa (p = 0.9).
No se identificó una relación en el análisis de volúmenes telediastólicos y telesistólicos entre ambos grupos, aunque sí una ligera tendencia a un mayor volumen telediastólico en aquéllos con morfología derecha (97.1 ± 27.1 ml/m2) respecto de la izquierda (83.5 ± 27.8 ml/m2) cercana a la significación estadística (p = 0.051). Tampoco hubo diferencias en el grado de regurgitación aórtica ni en los índices cardíaco y sistólico (Tabla 2). Sin embargo, los VU derechos sí mostraron mayor insuficiencia de la válvula AV objetivada por RMC (p = 0.026).
Tabla 2 Datos funcionales y volumétricos de RMC convencional totales y distribuidos de acuerdo con la morfología ventricular
| Variables | Total (n = 64) | VD (n = 26) | VI (n = 38) | p |
|---|---|---|---|---|
| VTd VU (ml/m2) | 89.1 ± 28.1 | 97.1 ± 27.1 | 83.5 ± 27.8 | 0.051 |
| VTs VU (ml/m2) | 41.3 ± 17.9 | 45 ± 19.2 | 38.7 ± 16.7 | 0.163 |
| FE VU (%) | 53.8 ± 8.8 | 53.4 ± 9.6 | 54.2 ± 8.4 | 0.900 |
| IC (l/min/m2) | 3.7 ± 1.2 | 3.9 ± 1.1 | 3.6 ± 1.3 | 0.289 |
| IS (l/latido/m2) | 4.8 ± 1.5 | 5.25 ± 1.5 | 4.53 ± 1.5 | 0.071 |
| R VAo (%) | 1.6 ± 2.7 | 1.78 ± 2.2 | 1.47 ± 3 | 0.108 |
Datos expresados como media ± DE. FE: fracción de expulsión; IC: índice cardíaco; IS: índice sistólico; R VAo: regurgitación de válvula aórtica; VD: ventrículo derecho; VI: ventrículo izquierdo; VTd: volumen telediastólico; VTs: volumen telesistólico; VU: ventrículo único.
Análisis de deformación miocárdica por STE
Los valores de strain y strain rate totales fueron inferiores a los de la población sana y todos ellos fueron menores en VU de morfología derecha, aunque tan sólo el GLS tuvo significación estadística (–17.2% ± 2.7% vs. –19.6% ± 3.5%; p = 0.005) (Tabla 3).
Tabla 3 Parámetros de deformación miocárdica por STE. Valores totales y de acuerdo con la morfología del ventrículo único
| Variables | Total (n = 64) | VD (n = 26) | VI (n = 38) | p |
|---|---|---|---|---|
| GLS (%) | –18.6 ± 3.4 | –17.2 ± 2.7 | –19.6 ± 3.5 | 0.005 |
| GCS (%) | –16.1 ± 4.3 | –15.3 ± 4.7 | –16.6 ± 4.1 | 0.121 |
| GLR (s-1) | 1.14 ± 0.3 | 1.1 ± 0.3 | 1.15 ± 0.3 | 0.608 |
| GCR (s-1) | 1.17 ± 0.4 | 1.13 ± 0.4 | 1.19 ± 0.4 | 0.500 |
Datos expresados como media ± DE. GLS: strain longitudinal global; GCS: strain circunferencial global; GLR: strain rate longitudinal global; GCR: strain rate circunferencial global; VD: ventrículo derecho; VI: ventrículo izquierdo.
Se reconoció una vinculación significativa entre todos los valores totales de strain y strain rate y la presencia de disfunción. Al analizar la FE de forma cuantitativa, el GCS mostró una correlación más marcada (r = –0.406), con valores menores que el GLS (Tabla 4).
Tabla 4 Resultados de strain y strain rate por STE clasificados de acuerdo con la presencia o ausencia de disfunción
| Variables | Disfunción | FEVU(p) | r | p |
|---|---|---|---|---|
| GLS | –16.03 ± 3.94 | –19.03 ± 3.16 | –0.354 | 0.013 |
| GCS | –12.75 ± 2 | –16.66 ± 4.2 | –0.406 | 0.021 |
| GLR | 0.89 ± 0.2 | 1.17 ± 0.33 | 0.237 | 0.02 |
| GCR | 0.89 ± 0.23 | 1.22 ± 0.37 | 0.374 | 0.039 |
Datos expresados como media ± DE y su significación estadística (p). Coeficientes de correlación (r) entre los parámetros de deformación miocárdica y la FE calculada por RMC convencional. GLS: strain longitudinal global; GCS: strain circunferencial global; GLR: strain rate longitudinal global; GCR: strain rate circunferencial global; FEVU(p): fracción de expulsión de ventrículo único preservada.
Análisis funcional por RMC-FT
Los volúmenes telesistólico y telediastólico obtenidos por RMC-FT fueron significativamente mayores en los VU de morfología derecha: VTd de VI: 75.91 ± 34.05 ml/m2 y de VD: 90.52 ± 28.72 ml/m2 (p = 0.009) y VTs de VI: 39.92 ± 19.45 ml/m2 y de VD: 51.1 ± 18.57 ml/m2 (p = 0.004).
La FE por esta misma técnica también fue menor en los VD (43.7% ± 8.1% vs. 48.1% ± 6.2%; p = 0.051) sin alcanzar la significación estadística. Se observó un nexo significativo entre la FE calculada por RMC-FT y la disfunción por RMC convencional (p < 0.001) de forma global y por morfología ventricular, con coeficiente de correlación de r = 0.699 en el análisis cuantitativo.
Los valores de strain y strain rate en 2D y 3D se hallaban por debajo de los considerados normales, pero muy similares entre sí (Tabla 5). Al analizarlos de acuerdo con la morfología del VU, todos los parámetros de strain y strain rate en 2D y 3D fueron significativamente menores en los VU derechos, con excepción del GRS en 3D (Tabla 6). También se ha encontrado una correlación significativa entre el strain y strain rate totales y por morfología por STE y sus homólogos por RMC-FT, con valores mayores de STE que de RMC-FT (Tabla 7).
Tabla 5 Resultados de strain y strain rate globales y regionales por RMC-FT en 2D y 3D. Valores totales y de acuerdo con la morfología del ventrículo único
| Total (n = 64) | Izquierdo (n = 38) | Derecho (n = 26) | ||||
|---|---|---|---|---|---|---|
| 2D | 3D | 2D | 3D | 2D | 3D | |
| Globales | ||||||
| GLS (%) | –14.04 ± 2.15 | –12.27 ± 3.77 | –14.5 ± 2.23 | –13.04 ± 2.24 | –13.38 ± 1.87 | –11.27 ± 4.98 |
| GCS (%) | –13.8 ± 2.61 | –13.98 ± 3.1 | –14.5 ± 2.7 | –15.08 ± 3.43 | –12.79 ± 2.15 | –12.57 ± 1.87 |
| GRS (%) | 20.95 ± 5.17 | 24.61 ± 10.7 | 22.33 ± 5.39 | 26.64 ± 11.9 | 18.91 ± 4.14 | 22.12 ± 8.39 |
| GLR (s-1) | 0.8 ± 0.19 | 0.76 ± 0.21 | 0.84 ± 0.18 | 0.82 ± 0.23 | 0.75 ± 0.19 | 0.68 ± 0.15 |
| GCR (s-1) | 0.76 ± 0.17 | 0.76 ± 0.28 | 0.8 ± 0.16 | 0.82 ± 0.33 | 0.7 ± 0.16 | 0.7 ± 0.18 |
| GRR (s-1) | 1.05 ± 0.32 | 1.74 ± 0.87 | 1.16 ± 0.34 | 1.94 ± 0.88 | 0.89 ± 0.22 | 1.14 ± 0.8 |
| Regionales | ||||||
| Basal (%) | –11.83 ± 3.37 | –12.33 ± 3.25 | –12.89 ± 3.18 | –13.53 ± 3.37 | –10.38 ± 3.13 | –10.79 ± 2.36 |
| Medio (%) | –13.97 ± 2.98 | –14.47 ± 3.36 | –14.9 ± 2.99 | –15.73 ± 3.55 | –12.71 ± 2.52 | –12.86 ± 2.29 |
| Apical (%) | –16.6 ± 3.05 | –16 ± 3.91 | –17.06 ± 3.37 | –16.93 ± 4.13 | –15.99 ± 2.5 | –14.8 ± 3.32 |
Datos expresados como media ± DE. 2D: dos dimensiones; 3D: 3 dimensiones; GLS: strain longitudinal global; GCS: strain circunferencial global; GRS: strain radial global; GLR: strain rate longitudinal global; GCR: strain rate circunferencial global; GRR: strain rate radial global.
Tabla 6 Relación entre parámetros de deformación miocárdica por RMC-FT en 2D y 3D globales y regionales y la morfología de VU
| 2D | 3D | |
|---|---|---|
| Globales | ||
| GLS (%) | p = 0.026 | p = 0.044 |
| GCS (%) | p = 0.006 | p = 0.002 |
| GRS (%) | p = 0.004 | p = 0.093 |
| GLR (s-1) | p = 0.043 | p = 0.009 |
| GCR (s-1) | p = 0.032 | p = 0.003 |
| GRR (s-1) | p = 0.002 | p = 0.047 |
| Regionales | ||
| Inicial (%) | p = 0.005 | p = 0.002 |
| Medio (%) | p = 0.003 | p = 0.001 |
| Apical (%) | p = 0.042 | p = 0.035 |
P: significación estadística; GLS: strain longitudinal global; GCS: strain circunferencial global; GRS: strain radial global; GLR: strain rate longitudinal global; GCR: strain rate circunferencial global; GRR: strain rate radial global.
Tabla 7 Correlación entre parámetros de deformación miocárdica por STE y RMC-FT en dos (2D) y tres dimensiones (3D)
| Variables | GLS | GCS | GLR | GCR |
|---|---|---|---|---|
| 2D GLS | r = 0.523 /p < 0.001 | p = 0.073 | p = 0.006 | p = 0.021 |
| 2D GCS | p < 0.001 | r = 0.475 /p < 0.001 | p = 0.036 | p < 0.001 |
| 2D GLR | p < 0.001 | p < 0.001 | r = 0.412 /p = 0.001 | p = 0.001 |
| 2D GCR | p < 0.001 | p = 0.001 | p = 0.011 | r = 0.457 /p < 0.001 |
| 3D GLS | r = 0.342 /p = 0.009 | p = 0.130 | p = 0.457 | p = 0.111 |
| 3D GCS | p = 0.003 | r = 0.381 /p = 0.006 | p = 0.013 | p = 0.005 |
| 3D GLR | p = 0.004 | p = 0.018 | r = 0.383 /p = 0.003 | p = 0.002 |
| 3D GCR | p = 0.005 | p = 0.005 | p = 0.013 | r = 0.430 /p = 0.002 |
Datos expresados para cada variable como coeficiente de correlación (r) y su significación estadística (p). GLS: strain longitudinal global; GCS: strain circunferencial global; GLR: strain rate longitudinal global; GCR: strain rate circunferencial global.
En el análisis circunferencial regional se registró un gradiente basal-apical creciente significativo, tanto en los valores totales como en los ventrículos de ambas morfologías. Además, los VU de morfología derecha tuvieron cifras significativamente menores para cada uno de los segmentos en 2D y 3D en relación con los de morfología izquierda (Tabla 5).
Reproducibilidad y factibilidad
En un 64.3% de los ecocardiogramas, uno o dos segmentos no pudieron interpretarse de modo adecuado por ventana subóptima, en particular localizados en la región basal septal. En el caso de la RMC no fue necesario excluir ningún segmento por limitación en la calidad de imagen.
La variabilidad intraobservador e interobservador analizada para el GLS por STE fue de buena a excelente, con CCI de 0.62 (IC, 0.13-0.87) y de 0.77 (IC, 0.38-0.93), respectivamente. En el caso de la RMC-FT, el GLS tuvo un CCI de 0.58 (IC, 0.10-0.86) intraobservador y de 0.83 (IC, 0.52-0.95) interobservador.
Discusión
Este estudio demuestra que los valores de strain y strain rate por STE y RMC-FT, tanto globales como regionales, están disminuidos en los pacientes con circulación univentricular tras la intervención de Fontan con respecto a la población sana. Este descenso es más acusado en el caso de los VU de morfología derecha. La hipótesis de que los ventrículos sistémicos de morfología derecha poseen una peor adaptación a la sobrecarga de volumen y presión se ha demostrado en cardiopatías como la transposición de grandes arterias20. Sin embargo, es más confuso en el caso de los VU, en los que hay series sin diferencias pronósticas entre ambas morfologías y otras en las que un VU derecho se relaciona con una FE disminuida y un aumento de la morbimortalidad5-7,13,21-24. Esto podría explicarse por la heterogeneidad de las cohortes en cuanto al tipo de cardiopatía, técnica quirúrgica y tiempo de evolución desde la intervención.
La disfunción por RMC convencional y la FE de forma cuantitativa no se relacionaron con la morfología ventricular en esta muestra (p = 0.690 y p = 0.9, respectivamente), aunque sí parece existir una tendencia a los valores menores en VU derechos, con resultados similares en el cálculo de FE por RMC-FT (p = 0.191).
La hipertrofia compensadora de los VD podría mantener valores de FE similares a los de VI a expensas de un cociente masa/volumen alterado que sí reflejaría una alteración de la contractilidad y los parámetros de deformación miocárdica25.
La insuficiencia de la válvula AV fue más frecuente y de mayor grado por ecocardiografía (p < 0.001) y RMC (p = 0.026) junto con unos volúmenes telesistólicos y telediastólicos por RMC-FT significativamente mayores (p = 0.009 y p = 0.004) en VU derechos. Estos hallazgos parecen ser parte del mecanismo adaptativo a la sobrecarga de presión y volumen y se consideran factores de riesgo de morbimortalidad26,27.
Los resultados notificados en las publicaciones médicas de STE en función de la morfología ventricular son controvertidos. Por un lado, estudios como el de Ríos, et al.15 demuestran valores significativamente menores de GLS y GCS en VU derechos en una cohorte de 100 pacientes con DCPT; Kaneko, et al.13 presentan una disminución de GLS pero no de GCS en estos mismos VU (–16.6% en VD vs. –20.5% en VI; p = 0.01). En cambio, autores como Petko, et al.14 no objetivaron diferencias significativas de GLS entre VU derechos e izquierdos (–17.9 ± 3.2% vs. –18.5 ± 3.5%, respectivamente).
Este estudio mostró valores muy similares a los publicados en ambas morfologías, con cifras de GCS menores que GLS. Aunque todos los parámetros de strain y strain rate fueron menores en los VU de morfología derecha, sólo el GLS mostró un nexo significativo, en consonancia con lo ya descrito.
Además, es importante señalar que los valores de GLS de VI estaban muy cercanos a los considerados como normales en la población sana (–19.58 ± 3.5%)9,10,12. Este mismo hecho también lo señalaron López, et al.11 en su estudio comparativo de VU de morfología izquierda con pacientes sanos (GLS, –18.7% vs. –18.2%, respectivamente). Sin embargo, Singh, et al.8 obtuvieron valores de strain globales y regionales disminuidos en pacientes con VU de morfología izquierda en comparación con pacientes sanos (GLS, –17.7 ± 1.5% vs. –14.2 ± 3.3%; y GCS, –20.5 ± 1.8% vs. –17.5 ± 4.4% en sanos y con VU, respectivamente). Es probable que el tiempo de evolución sea un factor determinante, con una primera etapa posquirúrgica con valores disminuidos y una normalización posterior a medida que el VU desarrolla mecanismos adaptativos. Este proceso puede ser distinto en ambas morfologías, de tal modo que la diferente disposición de las fibras miocárdicas (sobre todo longitudinales en VD y circunferenciales en VI) modifique, a través de su hipertrofia, la contractilidad longitudinal o circunferencial. Los valores disminuidos de GLS en VU derechos hacen pensar en mecanismos compensatorios insuficientes y una adaptación subóptima como ventrículo sistémico tras la DCPT.
Este análisis por RMC-FT reflejó un descenso de los valores globales y regionales de strain y strain rate en 2D y 3D respecto de la población sana28,29 que fue significativamente más marcado en el caso de VU derechos.
Se han encontrado pocos trabajos que comparen valores de strain por RMC-FT en pacientes con Fontan30,31 y menos aún si se considera la morfología ventricular. Ishizaki, et al.32 han analizado en fecha reciente la relación de efectos adversos con GLS en 2D en ventrículos de ambas morfologías, con obtención de valores muy similares a éstos (–14.3% ± 4.5% en VI y –13.1% ± 5.4% en VD).
Por otro lado, Ravesh, et al.30 observaron la misma correlación entre el strain por STE y RMC-FT de este estudio, con valores menores por RMC-FT, sin ser equivalentes entre sí. El gradiente basal-apical creciente observado en este análisis regional se mantuvo en ambas morfologías con valores significativamente menores en VU derechos. También Hu, et al.31 describieron hallazgos similares y los relacionaron con la alteración del loop cardíaco y la ausencia de fibras helicoidales en estos pacientes33-35.
Conclusiones
Los VU derechos presentaron valores globales y regionales de strain y strain rate por STE y RMC-FT disminuidos respecto de la población sana y de VU de morfología izquierda a pesar de mantener FE similares. Por lo tanto, puede afirmarse que el GLS por STE y el GLS y GCS por RMC-FT podrían ser marcadores tempranos de disfunción en VU derechos que tengan FE conservada por RMC.
Los parámetros de deformación miocárdica (STE y RMC-FT) deben considerarse como un método diagnóstico factible y reproducible en pacientes con DCPT y utilizarse de forma complementaria en el diagnóstico y vigilancia de la función ventricular.














