Introducción
La válvula aórtica St. Jude Trifecta® (St. Jude Medical, Inc., St. Paul, MN, EE.UU.) es una bioprótesis de pericardio bovino con stent, de última generación, diseñada para posicionamiento aórtico supraanular1. Consiste en tejido pericárdico bovino ensamblado en un stent de titanio cubierto por poliéster y pericardio porcino2. Por ser una válvula de reciente aparición en el mercado, aún no hay suficiente seguimiento a largo plazo en el ámbito mundial.
El proceso de ensamblaje fue diseñado para maximizar el desempeño hemodinámico y optimizar la durabilidad de la válvula. Su manufactura se inicia sobre un stent de titanio, radioopaco, para la visualización, cortado con láser, con los postes cubiertos con poliéster al igual que todo el molde de titanio. Un anillo de silicona encapsula el borde inferior de la prótesis para mejorar las características de implantación (Fig. 1)2.

Figura 1 Vávula St. Jude Trifecta®: stent de titanio recubierto por tejido pericárdico porcino, postes valvulares con tubo de poliéster, anillo de silicona que encapsula el borde inferior de la válvula y valvas de pericardio bovino.
El stent está cubierto por tejido pericárdico porcino, incluyendo el borde inferior, lo cual reduce la cantidad de material expuesto al flujo sanguíneo. El pericardio porcino es más delgado que el pericardio bovino y proporciona un contacto de tejido con tejido a las valvas bovinas. Este contacto tejido-tejido fue diseñado para minimizar el riesgo de abrasión de las valvas y el deterioro valvular estructural3-5.
Las valvas son elaboradas a partir de un mismo fragmento de pericardio bovino y cortadas según el tamaño de la prótesis valvular; luego son fijadas con sutura a los postes del stent. Una vez montada la válvula, se lleva a un proceso de fijación de baja presión. Cada válvula es evaluada para asegurar su adecuado funcionamiento y luego llevada a un tratamiento anticalcificante (tecnología Linx AC-St. Jude®)6 lo cual disminuye los aldehídos libres, extrae lípidos7 y minimiza la retoma de colesterol8, con lo que se pretende disminuir la calcificación y el deterioro estructural de la bioprótesis.
El tamaño valvular de la prótesis St. Jude Trifecta® inicia a partir de 19 mm y va incrementando cada 2 mm hasta el tamaño 29 mm.
La estenosis valvular aórtica calcificada es la lesión valvular más frecuente y es la principal causa de reemplazo valvular aórtico9, seguido por la insuficiencia valvular aórtica y la dilatación de la raíz aórtica asociada a patología valvular.
El riesgo de morbimortalidad es mayor para pacientes de género femenino vs. masculino (3.9 vs. 3.0%). Cuando se adiciona revascularización miocárdica quirúrgica el riesgo de mortalidad intrahospitalaria aumenta a un 4.2%10.
La sobrevida (incluyendo la mortalidad intrahospitalaria) tras el remplazo valvular aórtico es del 75% a 5 años, 60% a 10 años y 40% a 15 años11,12. Varios factores contribuyen a estos resultados: la posible naturaleza paliativa de la intervención, la regresión incompleta del remodelado ventricular izquierdo tras el reemplazo valvular13, el mal control de la anticoagulación en pacientes con prótesis mecánicas14, la reoperación por deterioro estructural de las bioprótesis y, finalmente, las condiciones de base propias de cada paciente que modifican su expectativa de vida.
El objetivo principal de esta investigación es la evaluación del comportamiento hemodinámico de la bioprótesis St. Jude Trifecta®, basados en el gradiente medio posoperatorio, el área de orificio efectivo, la libertad de reoperación por deterioro valvular estructural y la valoración de la mejoría clínica, medida a través de la recuperación de la clase funcional según la New York Heart Association-NYHA.
Materiales y métodos
Estudio observacional descriptivo de seguimiento a una cohorte, en el que incluyeron 165 pacientes llevados a cirugía de cambio valvular aórtico en quienes se implantó una prótesis valvular aórtica St. Jude Trifecta® entre marzo de 2012 y diciembre de 2018. Al momento del implante, todos los pacientes fueron evaluados en relación a superficie corporal, anillo aórtico y orificio efectivo indexado proporcionado por la prótesis a utilizar.
Se incluyeron todos los pacientes adultos, mayores de 18 años, llevados a cirugía de reemplazo valvular aórtico con o sin otras cirugías cardiacas asociadas.
Se excluyeron aquellos en quienes la cirugía fue catalogada como emergente (menos de 24 horas del ingreso hospitalario).
A todos se les realizó ecocardiograma transesofágico intraoperatorio para valoración preoperatoria y posoperatoria inmediata. Se definió mortalidad quirúrgica como aquella que ocurre entre la cirugía y el día 30 posoperatorio. En el manejo posquirúrgico todos los pacientes recibieron warfarina (para alcanzar INR promedio de 2.5) durante los tres primeros meses posoperatorios, además de estatinas y ácido acetilsalicílico (100 mg vía oral al día). El resto de medicación fue ordenada según la condición clínica y las comorbilidades de cada paciente.
Técnica quirúrgica
Las cirugías se realizaron por esternotomía media convencional, miniesternotomia y minitoracotomía lateral derecha. Las técnicas de canulación central o periférica fueron definidas de acuerdo con las necesidades quirúrgicas de cada procedimiento. Bajo circulación extracorpórea, normotermia y utilizando protección miocárdica con cardioplejía anterógrada del Nido®, se realizó aortotomía en s itálica, se identificó la patología valvular aórtica, se realizó resección de la válvula nativa o protésica y se decalcificó el anillo aórtico, en los casos en los cuales fue necesario. Se calculó el área “proyectada” de orificio efectivo indexado (OEI)15, para lo cual se utilizó el medidor del anillo aórtico proporcionado por el manufacturador y se calculó en relación a la superficie corporal del paciente el orificio efectivo indexado (OEI); con base en esta medida, se eligió el tamaño adecuado de la prótesis, medidas todas encaminadas a disminuir la posibilidad de desproporción prótesis-paciente (mismatch).
La válvula se implantó de manera supraanular con puntos separados. En este estudio, 68 pacientes (41.2%) requirieron procedimientos concomitantes; los más comunes fueron revascularización miocárdica, reemplazo valvular mitral y cambio de la aorta ascendente.
Recolección de datos y seguimiento
El seguimiento se hizo a través de evaluación clínica y ecocardiográfica en el posoperatorio inmediato, de 1 a 3 meses, a los 6 meses y luego en forma anual, lo cual incluye algunos pacientes con seguimiento hasta 6 años posquirúrgicos.
La información fue recolectada de manera prospectiva en una base de datos diseñada para este fin.
Datos ecocardiográficos
La recolección de datos ecocardiográficos se realizó tanto en el preoperatorio como en el posoperatorio. Las medidas para la evaluación de las válvulas protésicas fueron tomadas de acuerdo con los criterios de la Sociedad Americana de Ecocardiografia16,17. Se registraron los datos de fracción de eyección ventricular izquierda, diámetro sistólico y diastólico del ventrículo izquierdo, presión sistólica de la arteria pulmonar (PSAP), anillo aórtico, gradientes transvalvulares (medio y pico-medidos en mmHg) y orificio efectivo indexado (OEI-medido en cm2/m2). El objetivo fue implantar válvulas que proporcionaran un OEI adecuado para la superficie corporal del paciente (> 0.85 cm2/m2). La desproporción prótesis-paciente o mismatch (PPM) se definió como moderada (OEI >0.66 cm2/m2 y ≤ 0.85 cm2/m2) y grave (OEI ≤ 0.65 cm2/m2)15.
Análisis estadístico
Los datos se obtuvieron de las historias clínicas y del formato de seguimiento; la información se llevó a una base de datos de Microsoft Excel (Microsoft Corp) y el análisis fue con SPSS versión 21.
Resultados
Datos demográficos
El estudio incluyó 165 pacientes de los cuales el 53.3% (88) eran hombres y el 46.7% (77) eran mujeres. La media de edad fue 69.6 años (con un rango de edad mínima de 30 años y máxima de 90 años, DE = 9,1).
Las indicaciones para reemplazo valvular aórtico fueron: estenosis en 110 pacientes (66.7%), insuficiencia en 35 (21.2%), doble lesión valvular (estenosis + insuficiencia mayor o igual a grado II en 20 (12.1%); enfermedades asociadas, como endocarditis valvular nativa en 6 pacientes (3,64%) y disfunción valvular protésica en 3 pacientes (1.81%, 2 válvulas biológicas y 1 mecánica). La información demográfica se presenta en la tabla 1.
Tabla 1 Características y factores previos a la cirugía
| Caraterísticas | n = 165 n (%) |
|---|---|
| Edad: media (DE) años | 70,2 (9.1) |
| Género | |
| Masculino | 88 (53,3) |
| Femenino | 77 (46,7) |
| Comorbilidades | |
| – HTA | 93 (56.3) |
| – Hipotiroidismo | 12 (7,2) |
| – Dislipidemia | 24 (14,4) |
| – Enfermedad coronaria | 40 (24,2) |
| – Diabetes mellitus | 14 (8,4) |
| – EPOC | 18 (10,9) |
| – Insuficiencia mitral | 18 (10,9) |
| – Cirugía cardiaca previa | 3 (1,8) |
| – Insuficiencia renal crónica | 7 (4,2) |
| – Cirugía asociada | 68 (41.2) |
| – Bypass coronario | 40 (24.2) |
| – Cambio valvular mitral | 18 (10.9) |
| – Cirugía de Bentall | 8 (4.8) |
| – Bentall + bypass coronario | 2 (1.2) |
| Vías de acceso utilizadas | |
| – Esternotomía | 122 (73,9) |
| – Cirugía mínimamente invasiva | 43 (26,06) |
Se realizaron procedimientos concomitantes en 68 pacientes (41.2%), incluyendo bypass coronario en 40 pacientes (24.24%) y cambio valvular mitral en 18 pacientes (10.9%); otros procedimientos se describen en la tabla 1. En cuanto a la vía de acceso utilizada, fue esternotomía convencional en 122 pacientes (73.9%) y cirugía mínima invasiva en 43 pacientes (26.06%) (para discriminación de las cirugías ver tabla 1).
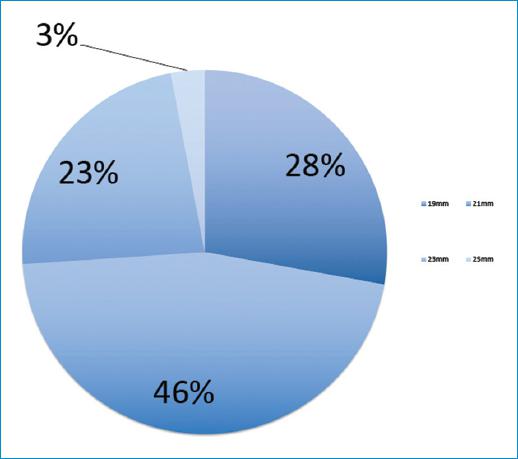
Se implantaron 46 válvulas St. Jude Trifecta® número 19 mm (27.8% pacientes); 76 válvulas (46.0%) número 21 mm, 38 válvulas (23%) número 23 mm y 5 válvulas (3.0%) número 25 mm (Fig. 2).
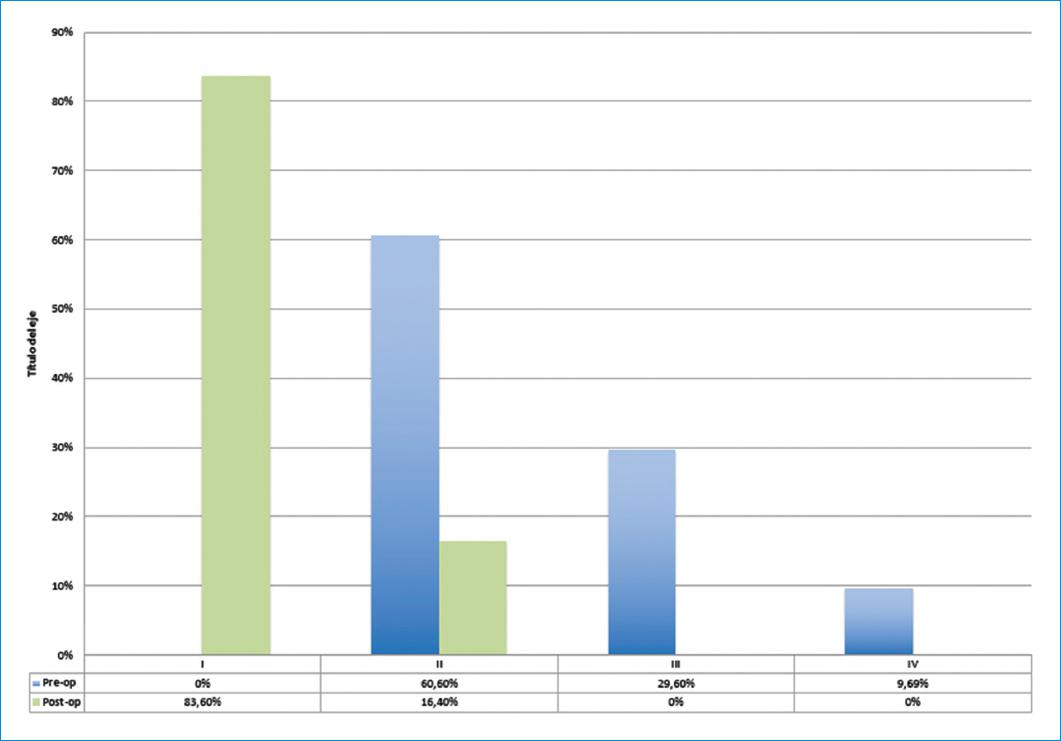
El promedio de EuroSCORE logístico II fue 4.18 (mínimo 0.56 y máximo 24.35). En la valoración preoperatoria, el 60.6% (100) estaban en clase funcional de la NYHA II, el 29.6% (49) III y el 9,69 %16 en IV.
Resultados hemodinámicos
En el preoperatorio, la fracción de eyección promedio fue de 54.7% (rango 20-75%); el diámetro diastólico del ventrículo izquierdo promedio fue de 47.5 mm (rango 22-79), el promedio de la presión sistólica de la arteria pulmonar fue 41.8 mmHg (rango 20-80), el área valvular aórtica prequirúrgica (Tabla 2) promedio fue 0.54 cm (mínima 0.22 cm y máxima 1.2 cm), el anillo aórtico (Tabla 3) promedio fue de 20.6 mm (mínimo 15 mm y máximo 26 mm) y el gradiente medio transvalvular aórtico promedio fue de 52 mmHg (mínimo 19 mmHg y máximo 118 mmHg). El área de superficie corporal promedio fue de 1.61 m2 (rango 1.2-2.0).
Los resultados hemodinámicos posoperatorios están representados en las tablas. El promedio de área de orificio efectivo indexado (AOEI) (Tabla 4) fue de 1.06 cm2/m2 teniendo en cuenta todos los tamaños valvulares (mínimo 0.88 cm2/m2 y máximo 1.55 cm2/m2); al evaluar cada tamaño de prótesis valvular (Tabla 5), el promedio de AOEI fue de 1.025 cm2/m2 para pacientes en quienes se implantó una prótesis St. Jude Trifecta® de 19 mm; de 1.089cm2/m2 para pacientes con prótesis de 21 mm, de 1.085 cm2/m2 para la prótesis 23 mm y de 1.069 cm2/m2 para la de 25 mm.
Tabla 4 Área OEI POP (cm2/m2)
| Área | cm2/m2 |
|---|---|
| PROMEDIO | 1.06 |
| MINIMO | 0.88 |
| MÁXIMO | 1.55 |
OEI: orificio efectivo indexado POP: postoperatorio
Tabla 5 Tamaño valvular protésico
| Tamaño | AOEI promedio |
|---|---|
| 19 | 1,025 |
| 21 | 1,089 |
| 23 | 1,085 |
| 25 | 1,069 |
AOEI: area orificio efectivo indexado
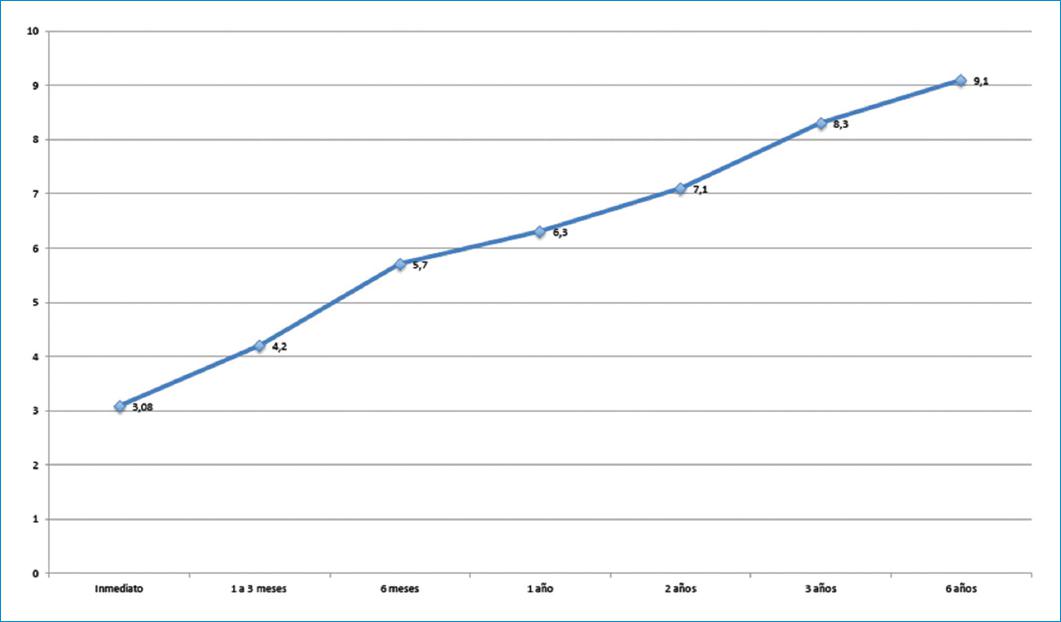
El gradiente medio transvalvular (Tabla 6 y Fig. 3) en el posoperatorio inmediato, teniendo en cuenta el tamaño de todas las prótesis, fue, en promedio, de 3.08 mmHg; de 1 a 3 meses posoperatorios fue de 4.2 mmHg, a los 6 meses posoperatorios fue de 5. 7 mmHg, a 1 año fue de 6.3 mmHg, a los 2 años fue de 7.1 mmHg, a los 3 años fue de 8.3 y a los 6 años fue de 9.1 mmHg.
Resultados clínicos
Se realizó cirugía de reemplazo aórtico aislada en 97 pacientes y combinada en 68 (CABG la más asociada). La mortalidad quirúrgica global (n = 165) fue del 2.42% (4 pacientes), 2 de los cuales fallecieron por sepsis, 1 en falla ventricular refractaria y 1 por isquemia mesentérica. De los 4 fallecidos, 1 paciente de 84 años (isquemia mesentérica) fue en cirugía aislada por estenosis aórtica; es decir, la mortalidad aislada en reemplazo valvular aórtico fue del 1.03% (1 de 97), y la mortalidad en cirugía combinada fue 3 de 68 (4.41%). El índice global de mortalidad fue de 0.6. Durante el seguimiento han muerto 5 pacientes por causas no cardíacas. Excluyendo los pacientes con mortalidad operatoria, todos los pacientes fueron seguidos mínimo a 3 y 6 meses. A 6 años se han perdido 50 pacientes del seguimiento (30.3%). No se presentaron casos de endocarditis valvular protésica ni de eventos tromboembólicos tempranos ni tardíos. A la fecha de cierre del estudio (diciembre 2018) no se ha requerido reintervención por disfunción valvular protésica en los pacientes que alcanzaron el seguimiento.
Excluyendo los pacientes fallecidos o aquellos en quienes se perdió el seguimiento, la clase funcional ha mejorado en todos los pacientes seguidos; el 83.6% pacientes se encuentran en clase funcional NYHA I. En el posoperatorio no se encontraron pacientes en clase funcional de la NYHA III o IV (Fig. 4).
Discusión
Las características de una prótesis aórtica ideal incluyen una técnica de implante fácil y segura, ausencia de trombogenicidad intrínseca que evite la necesidad de anticoagulación, bajo gradiente transvalvular y un área de orificio fisiológico que pueda adaptarse a condiciones de ejercicio y durabilidad a largo plazo (libertad de deterioro estructural)6,16,18,19.
Existe una clara tendencia mundial al mayor uso de bioprótesis, inclinación que se apoya en evitar la anticoagulación oral de por vida y en la mejoría en cuanto a durabilidad y comportamiento hemodinámico de las bioprótesis actuales. En términos generales, la proporción mundial es 80% de implante de válvulas biológicas, frente a un 20% de válvulas mecánicas20. Durante las últimas cuatro décadas, las válvulas bioprotésicas han tenido una gran mejoría en su durabilidad y funcionamiento hemodinámico, basados en el diseño de la válvula y el procesamiento tisular que disminuye la calcificación1,21-24. La válvula St. Jude Trifecta® incorpora diferentes características de diseño, incluyendo un anillo supraanular que se ajusta al anillo aórtico nativo y proporciona un adecuado espacio libre a las arterias coronarias nativas; el diseño y material del stent maximiza el funcionamiento hemodinámico, a la vez que minimiza el estrés sobre las valvas, las cuales permiten una apertura cilíndrica completa durante la sístole. El stent de titanio tiene distensibilidad intrínseca, lo que potencialmente permite mayor expansión de la prótesis en condiciones de alta carga como en el ejercicio. Adicionalmente, posee una tecnología anticalcificante Lincx AC®1, características de construcción, diseño y comportamiento hemodinámico que la convierten en una prótesis ideal para el reemplazo valvular aórtico.
Los resultados obtenidos, similares a estudios previos, corroboran el buen funcionamiento hemodinámico de la válvula St. Jude Trifecta®1. La apertura cilíndrica de la prótesis proporciona gradientes y áreas de orificio efectivo indexado que sobrepasan otras válvulas aórticas con stent disponibles y se aproximan a aquellas prótesis sin stent (más conocidas como “stentless”)6,25-31. El buen funcionamiento hemodinámico disminuye también la incidencia de mismatch (desproporción) prótesis-paciente. En series con prótesis de generaciones anteriores y con diferentes definiciones de mismatch, se ha reportado prevalencia de PPM moderado hasta en 51% de los pacientes llevados a cambio valvular aórtico29-31 y prevalencia de 2 a 11% para mismatch grave15. En este estudio no hubo ningún caso de mismatch (similar a lo reportado por Bavaria et al.)32. Como protocolo de nuestro servicio, siempre se calcula el OEI previsto por la válvula a implantar, según la superficie corporal de cada paciente. La presencia de mismatch grave prótesis-paciente (AOEI ≤ 0.65cm2/m2) ha mostrado llevar en diversos estudios a disminución significativa en la sobrevida a largo plazo, ya que el aumento en el gradiente de presión transvalvular resulta en un aumento en la presión de trabajo ventricular que evita la regresión posoperatoria de la hipertrofia ventricular y la normalización de la función ventricular15. En nuestro estudio se observó una mortalidad global posquirúrgica del 2.42%, en cirugía aislada del 1.03% y en cirugía combinada del 4.41%, cifras que concuerdan con lo reportado por la Sociedad de Cirujanos Torácicos (STS: National data Base-Society of Thoracic Surgeons) para el año 2018, que fue del 1.4 al 3.0% para cirugía aislada y del 3.5 al 9% para cirugía combinada33. La morbilidad de los pacientes del presente estudio es similar a la de series de casos aisladas o trabajos multicéntricos reportados, especialmente en Europa32.
Limitaciones
El análisis del estudio se debe hacer frente a las limitaciones del seguimiento, que alcanzó el 70% de todos los pacientes. A pesar de ser intervenidos por el mismo grupo quirúrgico y bajo el mismo protocolo y definiciones de mistmatch, AOEI y seguimiento clínico, no se registro la variable años de entrenamiento de cada cirujano.
Conclusiones
El análisis de los datos de esta serie de pacientes permite concluir que la bioprótesis aórtica St. Jude Trifecta® para reemplazo valvular aórtico proporciona, a mediano plazo, buenos resultados hemodinámicos y clínicos, los cuales fueron demostrados por: 1) bajos gradientes transvalvulares en el posoperatorio inmediato y hasta 6 años posoperatorios en el grupo de pacientes que completaron el seguimiento; 2) provee un área de orificio indexado efectiva que evita el mismatch prótesis-paciente; 3) recuperación de la clase funcional de la NYHA, y 4) al seguimiento no se presentaron casos de reoperación por deterioro valvular estructural. Es fundamental continuar el análisis de los pacientes para obtener conclusiones a largo plazo e intentar alcanzar un mayor seguimiento del grupo intervenido.