Introducción
En la población general, la fibrilación auricular tiene una prevalencia del 1% en menores de 60 años y hasta del 12% en mayores de 75 años. Esta enfermedad aumenta cinco veces el riesgo de ataque cerebrovascular y dos veces el riesgo de mortalidad por cualquier causa1,2. Para reducir la probabilidad de eventos cardioembólicos, las guías recomiendan iniciar anticoagulación oral en pacientes con fibrilación auricular si el CHA2DS2VASc es ≥ 2 en hombres y ≥ 3 en mujeres (recomendación fuerte, buen nivel de evidencia)2,3.
En individuos en hemodiálisis, la prevalencia de fibrilación auricular es mayor: 4% en menores de 55 años y hasta 22% en mayores de 75 años4. Los pacientes con fibrilación auricular y deterioro grave de la función renal tienen, particularmente, un muy alto riesgo de ataque cerebrovascular, muerte y sangrado mayor5. La combinación de estos factores y la falta de evidencia de alta calidad sobre la eficacia y la seguridad de la anticoagulación en la prevención de eventos cardioembólicos ponen de manifiesto el enorme desafío que enfrentan los clínicos cuando tienen que decidir si anticoagular o no al paciente con fibrilación auricular y enfermedad renal crónica de grado 5. De acuerdo con la guía americana de 2019, la anticoagulación con warfarina o apixabán «podría ser razonable» en individuos con puntaje CHA2DS2VASc ≥ 2 (≥ 3 en mujeres) y tasa de filtración glomerular (TFG) < 15 ml/min (recomendación débil, evidencia de estudios no aleatorizados)3. La guía europea de 2020 no emite recomendaciones específicas, pero señala que los datos provenientes de estudios observacionales hacen cuestionable el beneficio de la anticoagulación oral en este escenario6. La guía canadiense de 2020 sugiere la «no anticoagulación de rutina» en pacientes con TFG < 15 ml/min (recomendación débil, baja calidad de la evidencia)7.
Este artículo revisa los factores que se asocian con una mayor incidencia de ataque cerebrovascular y sangrado, y la evidencia disponible sobre la anticoagulación en individuos con fibrilación auricular y enfermedad renal crónica de grado 5. Al final, se propone un algoritmo para la toma de decisiones en este escenario.
Riesgo de ataque cerebrovascular en pacientes con enfermedad renal crónica
La tasa de eventos cerebrovasculares es más alta en los pacientes en hemodiálisis que en aquellos con enfermedad renal crónica sin diálisis y que en personas con función renal normal. Los pacientes en hemodiálisis tienen cinco veces más riesgo de ataque cerebrovascular8 y una menor probabilidad de supervivencia luego de ocurrido el evento, comparados con la población general9. Los fenómenos que explican este riesgo extraordinariamente alto de morbimortalidad cardiovascular son complejos, y algunos aún inciertos. Una posible explicación es que la enfermedad renal avanzada aumenta significativamente el riesgo de fibrilación auricular, como consecuencia de varios mecanismos: niveles fluctuantes de electrolitos séricos, hiperactividad del sistema nervioso simpático e isquemia miocárdica silente, entre otros10. Aunque hay evidencia de que la fibrilación auricular aumenta el riesgo de eventos cerebrovasculares en pacientes en hemodiálisis11,12, otros estudios no han encontrado esta asociación13,14.
Por su parte, la enfermedad renal crónica parece elevar de forma independiente el riesgo de ataque cerebrovascular15. Un análisis post hoc del estudio ROCKET AF encontró que en la población con fibrilación auricular y TFG < 60 ml/min hubo un aumento estadísticamente significativo del riesgo de ataque cerebrovascular o embolia sistémica. Además, por cada 10 ml/min de reducción en la TFG el riesgo de presentar el desenlace se incrementó en un 12% (intervalo de confianza del 95% [IC95%]: 1.068-1.164)16. Las razones para una mayor incidencia de ataque cerebrovascular en pacientes con enfermedad renal crónica avanzada son múltiples e incluyen elevación de la presión arterial, aterogénesis prematura, disfunción endotelial, calcificación vascular acelerada y aumento de los factores procoagulantes5,17. No obstante, adicionar el deterioro de la función renal a las principales escalas de predicción clínica (R2CHADS2, CHADS2-R y CHA2DS2VASc-R) no ha demostrado mejorar su poder de discriminación16,18,19.
Riesgo de sangrado en pacientes con enfermedad renal crónica
La presencia de enfermedad renal crónica en pacientes con fibrilación auricular está asociada con un incremento en la incidencia de sangrado20. El riesgo hemorrágico se relaciona con la magnitud del deterioro de la función renal, siendo especialmente alto en la población en terapia de reemplazo renal. Uno de cada siete pacientes en hemodiálisis tiene un evento de sangrado mayor que requiere hospitalización en los primeros 3 años desde el inicio de la diálisis21.
Los pacientes en diálisis crónica tienen un incremento de 10 veces el riesgo de sangrado intracerebral y una edad más temprana de ocurrencia del evento, comparados con personas con función renal normal22. Así mismo, los que están en hemodiálisis tienen mayor probabilidad de presentar hemorragia digestiva que la población general23,24. El riesgo de sangrado en estos pacientes es multifactorial: alteración en la función y la estructura plaquetarias por la uremia, malnutrición, anemia, comorbilidad, déficit de vitamina K, accesos vasculares y exposición a heparina durante la hemodiálisis, entre otros25,26.
En pacientes con fibrilación auricular, las guías recomiendan emplear escalas para predecir el riesgo de sangrado, como HASBLED, HEMORR2HAGES o ATRIA2,3. Si bien tienen buen rendimiento en la población general, carecen de adecuada validación y parecen subestimar el riesgo en los pacientes en diálisis27,28. Además, aunque incluyen la función renal dentro de las variables a evaluar, no discriminan por TFG ni por modalidad de terapia de reemplazo renal.
Warfarina en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5
La evidencia disponible acerca del uso de warfarina en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5 proviene de pequeñas cohortes prospectivas y retrospectivas, con las limitaciones inherentes a este tipo de estudios, y de revisiones sistemáticas de estudios observacionales, con un alto grado de heterogeneidad. El uso de warfarina es controversial porque los resultados de los estudios observacionales (Tabla 1) no son consistentes en demostrar una reducción en el riesgo de ataque cerebrovascular isquémico, y algunos han reportado un aumento en la incidencia de sangrado intracerebral y sangrado mayor4,29-46. Por ejemplo, Chan et al.29 evaluaron una cohorte de pacientes con fibrilación auricular en hemodiálisis, 746 de ellos anticoagulados con warfarina y 925 sin anticoagulación. Encontraron que la warfarina no solo no redujo el riesgo de ataque cerebrovascular, sino que lo aumentó en un 93%, y además produjo un incremento no significativo de eventos hemorrágicos y muertes. Por el contrario, Friberg et al.31 estudiaron 3766 pacientes con fibrilación auricular en hemodiálisis anticoagulados con warfarina y los compararon con 9669 sin anticoagulación, reportando una reducción significativa del 22% en el riesgo de ataque cerebrovascular y del 25% en la mortalidad por todas las causas, pero también una tendencia a más episodios de sangrado.
Tabla 1 Estudios observacionales que evaluaron la anticoagulación con warfarina en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5 con o sin diálisis
| Autor (año de publicación) | Diseño | Fármaco y comparador (tamaño de muestra) | Función renal | HR de ACV (IC95%) | HR de sangrado mayor (IC95%) | HR de mortalidad todas las causas (IC95%) | Ref. |
|---|---|---|---|---|---|---|---|
| Chan et al. (2009) | Cohorte retrospectiva | Warfarina (746) vs. no warfarina (925) | HD | 1.93 (1.29-2.89) | 1.04 (0.73-1.46) | 1.10 (0.94-1.29) | 29 |
| Lai et al (2009) | Cohorte retrospectiva | Warfarina (129) vs. no warfarina (96) | HD o TFG ≤ 15 ml/min | ERC: 0.71 (0.43-1.16) HD: 1.69 (0.72-3.97) |
No reportado | No reportado | 39 |
| Wizemann et al. (2010) | Cohorte retrospectiva | Warfarina (509) vs. no warfarina (2736) | HD | ≤ 65 años: 1.29 (0.45-3.68) 66-75 años: 1.35 (0.69-2.63) > 75 años: 2.17 (1.04-4.53) |
No reportado | No reportado | 4 |
| Phelan et al. (2011) | Cohorte retrospectiva | Warfarina (141) vs. no warfarina (704) | HD | Rate ratio: 5.52; p = 0.02 para el grupo warfarina | Rate ratio: 1.35: p = 0.593 para el grupo warfarina | No reportado | 40 |
| Winkelmayer et al. (2011) | Cohorte prospectiva | Warfarina (249) vs. no warfarina (2064) | HD | 0.92 (0.61-1.37) | 1.11 (0.83-1.48) | 1.06 (0.90-1.24) | 41 |
| Olesen et al. (2012) | Cohorte retrospectiva | Warfarina (178) vs. no warfarina (723) | HD al alta | ERC: 0.85 (0.69-1.05) HD: 0.43 (0.26-0.71) |
ERC: 1.36 (1.17-1.58) HD: 1.27 (1.01-1.60) |
No reportado | 42 |
| Bonde et al. (2014) | Cohorte retrospectiva | Warfarina (260) vs. no warfarina (882) | HD al alta | No reportado | No reportado | ERC: 0.63 (0.59-0.67) HD: 0.85 (0.72-1.00) |
43 |
| Carrero et al. (2014) | Cohorte prospectiva | Warfarina (66) vs. no warfarina (882) | TFG ≤ 15 ml/min | 0.54 (0.42-0.69) | 0.97 (0.78-1.21) | 0.68 (0.61-0.76) | 44 |
| Shah et al. (2014) | Cohorte retrospectiva | Warfarina (756) vs. no warfarina (870) | HD | 1.14 (0.78-1.67) | 1.44 (1.13-1.84) | No reportado | 45 |
| Wakasugi et al. (2014) | Cohorte prospectiva | Warfarina (28) vs. no warfarina (32) | HD | 3.36 (0.67-16.86) | 0.85 (0.19-3.80) | 1.00 (0.40-2.50) | 46 |
| Findlay et al. (2015) | Cohorte prospectiva | Warfarina (118) vs. no warfarina (175) | HD | 1.02 (0.53-1.95) | No reportado | 0.67(0.50-0.89) | 30 |
| Friberg et al. (2015) | Cohorte retrospectiva | Warfarina (3766) vs. no warfarina (9669) | HD | 0.78 (0.70-0.87) | 1.09 (0.99-1.20) | 0.75 (0.71-0.79) | 31 |
| Genovesi et al. (2015) | Cohorte prospectiva | Warfarina (134) vs. no warfarina (156) | HD | 0.12 (0.00-14.41) | 3.96 (1.15-13.64) | 0.96 (0.59-1.56) | 32 |
| Wang et al. (2015) | Cohorte retrospectiva | Warfarina (59) vs. no warfarina (82) | HD | 1.01 (0.380-2.70) | 3.26 (1.13-9.40) | 0.82 (0.37-1.81) | 33 |
| Shen et al. (2015) | Cohorte retrospectiva | Warfarina (1838) vs. no warfarina (10446) | HD | 0.83 (0.61-1.12) | No reportado | 1.01 (0.92-1.11) | 34 |
| Tanaka et al. (2016) | Cohorte prospectiva | Warfarina (46) vs. no warfarina (47) | HD | No reportado | No reportado | 0.71 (0.24-2.04) | 35 |
| Yodogawa et al. (2016) | Cohorte retrospectiva | Warfarina (30) vs. no warfarina (54) | HD | 1.07 (0.20-5.74) | 5.40 (0.59-49.66) | No reportado | 36 |
| Yoon et al. (2017) | Cohorte retrospectiva | Warfarina (2921) vs. no warfarina (7053) | HD | ACV isquémico: 1.06 (0.90-1.26) ACV hemorrágico: 1.44 (1.09-1.91) |
Sangrado gastrointestinal 7.5% vs. 6.6% | No reportado | 37 |
| Tan et al. (2017) | Cohorte retrospectiva | Warfarina (1651) vs. no warfarina (4114) | HD y DP | No reportado | 1.48 (1.32-1.66) | No reportado | 38 |
ACV: ataque cerebrovascular; DP: diálisis peritoneal; ERC: enfermedad renal crónica; HD: hemodiálisis; HR: hazard ratio; IC95%: intervalo de confianza del 95%; TFG: tasa de filtración glomerular. Creación propia.
En ausencia de ensayos clínicos aleatorizados, la mejor evidencia disponible son las revisiones sistemáticas con metaanálisis de estudios observacionales (Tabla 2)47-54. Los resultados muestran que la warfarina no reduce la incidencia de ataque cerebrovascular ni de embolia sistémica, pero sí se asocia, consistentemente, con un aumento en el riesgo de sangrado. Por ejemplo, Dahal et al.48 revisaron siete estudios observacionales de pacientes con fibrilación auricular en hemodiálisis, comparando la anticoagulación con warfarina frente a la no anticoagulación, y encontraron que la warfarina se asoció con una tendencia no significativa a más eventos cerebrovasculares, aunque la heterogeneidad de los estudios fue alta, y con un aumento significativo en el riesgo de sangrado mayor. Por su parte, Randhawa et al.54 publicaron un metaanálisis de 15 estudios observacionales con 47.480 pacientes con fibrilación auricular en hemodiálisis, en el que encontraron que no hubo diferencias estadísticamente significativas en el riesgo de ataque cerebrovascular entre los usuarios de warfarina y los no anticoagulados, pero sí una tendencia de la warfarina a incrementar el sangrado mayor.
Tabla 2 Metaanálisis de estudios observacionales comparando warfarina frente a no anticoagulación en pacientes con fibrilación auricular y enfermedad renal crónica en diálisis
| Autor (año de publicación) | N.º estudios incluidos | ACV isquémico o embolia sistémica (IC95%) | Sangrado mayor (IC95%) | Mortalidad (IC95%) | Ref. |
|---|---|---|---|---|---|
| Liu et al. (2015) | 11 | HR: 0.95 (0.66-1.35) I2: 79.5% |
HR: 1.27 (1.04-1.54) I2: 43.4% |
HR: 1.03 (0.96-1.11) I2: 0% |
47 |
| Dahal K et al. (2016) | 7 | HR: 1.12 (0.69-1.82) I2: 76% |
HR: 1.30 (1.08-1.56) I2: 24% |
HR: 0.96 (0.81-1.13) I2: 57% |
48 |
| Lee et al. (2016) | 8 | HR: 1.5 (1.13-1.99) I2: 59% |
HR: 1.27 (1.03-1.56) I2: 69% |
HR: 0.67 (0.37-1.21) I2:96% |
49 |
| Nochaiwong et al. (2016) | 14 | HR: 0.99 (0.89-1.10) I2: 34.9% |
HR: 1.35 (1.11-1.64) I2: 59.3% |
HR: 1.0 (0.96-1.04) I2:0% |
50 |
| Tan et al. (2016) | 20 | HR: 0.92 (0.74-1.16) I2: 68.1% |
HR: 1.21 (1.01-1.44) I2: 48.3% |
No reportado | 51 |
| Harel et al. (2017) | 14 | HR: 0.77 (0.55-1.07) I2: 69% |
HR: 1.19 (0.8-1.76) I2: 78% |
HR: 0.89 (0.72-1.11) I2:79% |
52 |
| Van Der Meersch et al. (2017) | 12 | HR: 0.74 (0.51-1.06) I2: 70% |
HR: 1.21 (1.03-1.43) I2: 34% |
HR: 1.0 (0.92-1.09) I2:14% |
53 |
| R:andhawa et al. (2020) | 15 | HR: 0.96 (0.82-1.13) I2: 52.6% |
HR: 1.20 (0.99-1.47) I2: 66% |
HR: 0.95 (0.83-1.09) I2:85.3% |
54 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; I2: medida de heterogeneidad.
Creación propia.
Por tanto, la evidencia actual no soporta la anticoagulación con warfarina en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5, no solo porque no es clara su eficacia en la prevención del ataque cerebrovascular isquémico, sino porque se asocia con un aumento en la frecuencia de sangrado clínicamente significativo, en especial intracerebral y gastrointestinal.
Apixabán en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5
Todos los anticoagulantes orales de acción directa (ACOD) tienen diferentes proporciones de excreción renal. El compromiso grave de la función renal produce acumulación de estos medicamentos en el plasma y tiempos prolongados de eliminación, lo que incrementa el riesgo de sangrado55,56. Los ensayos clínicos controlados que demostraron la seguridad y la eficacia de dabigatrán, rivaroxabán, apixabán y edoxabán en el tratamiento de la fibrilación auricular excluyeron a los pacientes con TFG < 25-30 ml/min57-60.
El apixabán es el único ACOD aceptado por algunas sociedades científicas para el tratamiento de la fibrilación auricular en pacientes con enfermedad renal crónica de grado 5. En una cohorte retrospectiva61 se analizaron los datos de los pacientes con enfermedad renal crónica en hemodiálisis y fibrilación auricular tratados con apixabán y warfarina en una relación 1:3. Se incluyeron 25.523 pacientes, de los cuales 2351 fueron tratados con apixabán y 23.172 con warfarina. El riesgo de ataque cerebrovascular/embolia sistémica fue similar para ambos grupos (hazard ratio [HR]: 0.88; IC95%: 0.69-1.12), pero el uso de apixabán se asoció con un riesgo menor de complicaciones hemorrágicas (HR: 0.72; IC95%: 0.59-0.87) en comparación con warfarina. Un análisis de sensibilidad mostró que la dosis estándar de 5 mg cada 12 horas de apixabán se asoció con una reducción de las complicaciones embólicas y muerte en comparación con la dosis de 2.5 mg cada 12 horas (HR: 0.61, IC95%: 0.37-0.98; HR: 0.64, IC95%: 0.45-0.92, respectivamente) y en comparación con los usuarios de warfarina (HR: 0.64, IC95%: 0.42-0.97 para embolia y HR: 0.63, IC95%: 0.46-0.85 para muerte)61. Cabe señalar que las complicaciones hemorrágicas fueron menores en el grupo de apixabán, pero se presentaron en cerca del 20% de los pacientes62. Los resultados de esta cohorte apuntaban al prometedor uso de apixabán en la enfermedad renal crónica de grado 5 y sirvieron para que la guía americana de 2019 lo incluyera dentro de sus recomendaciones4.
El ensayo clínico RENAL-AF, que comparó apixabán frente a warfarina, fue detenido tempranamente y a la fecha no hay publicación de sus resultados. La información parcial sugiere que no hay diferencias en las tasas de ataque cerebrovascular ni de sangrado entre los dos grupos63.
Recientemente se publicó una cohorte retrospectiva de pacientes con fibrilación auricular y enfermedad renal crónica en hemodiálisis, 521 tratados con apixabán y 1561 no anticoagulados. El 40% de los pacientes no anticoagulados y el 34% de los pacientes con uso de apixabán tenían antecedente de ataque cerebrovascular. Los autores reportan que, en comparación con la no anticoagulación, el apixabán no se asoció con una menor incidencia del desenlace primario, que fue un compuesto de ingreso hospitalario por nuevo ataque cerebrovascular isquémico o hemorrágico, ataque isquémico transitorio o embolia sistémica (HR: 1.24; IC95%: 0.69-2.23). En cambio, el apixabán se asoció con una incidencia significativamente mayor de sangrado fatal o intracraneal en comparación con no anticoagular (HR: 2.74; IC95%: 1.37-5.47)64.
La evidencia disponible señala que, en la población con fibrilación auricular y enfermedad renal crónica de grado 5, el apixabán posiblemente sea más seguro que la warfarina, pero no parece reducir las complicaciones embólicas. Además, el uso de apixabán se relaciona con un mayor riesgo de sangrado en comparación con la no anticoagulación.
Abordaje del paciente con fibrilación auricular y enfermedad renal crónica de grado 5
Hay varios ensayos clínicos en curso que buscan resolver los cuestionamientos sobre el beneficio y la seguridad de la anticoagulación en pacientes con fibrilación auricular y enfermedad renal crónica de grado 5 (AXADIA-NCT02933697, AVKDIAL NCT02886962, SAFE-HDNCT03987711).
Nosotros sugerimos no anticoagular a la mayoría de los pacientes con fibrilación auricular que están en hemodiálisis, porque no hay evidencia consistente de la reducción de ataque cerebrovascular/embolia sistémica, pero sí una clara asociación de la anticoagulación con más episodios de sangrado. Proponemos que podría considerarse la anticoagulación en los siguientes escenarios: candidatos a trasplante renal, prevención secundaria o baja carga de comorbilidad, toda vez que no existan factores adicionales que incrementen la probabilidad de sangrado (Fig. 1). El paciente debe ser informado de los riesgos y los potenciales beneficios de la intervención. En caso de que se decida anticoagular, se sugiere apixabán. En pacientes en lista de espera para trasplante renal sugerimos cambiar a warfarina por la facilidad de revertir la anticoagulación una vez se disponga de donante. Los pacientes con enfermedad renal crónica de grado 5 sin diálisis o en diálisis peritoneal han sido excluidos de la mayoría de los estudios, por lo que los datos son escasos para hacer recomendaciones.
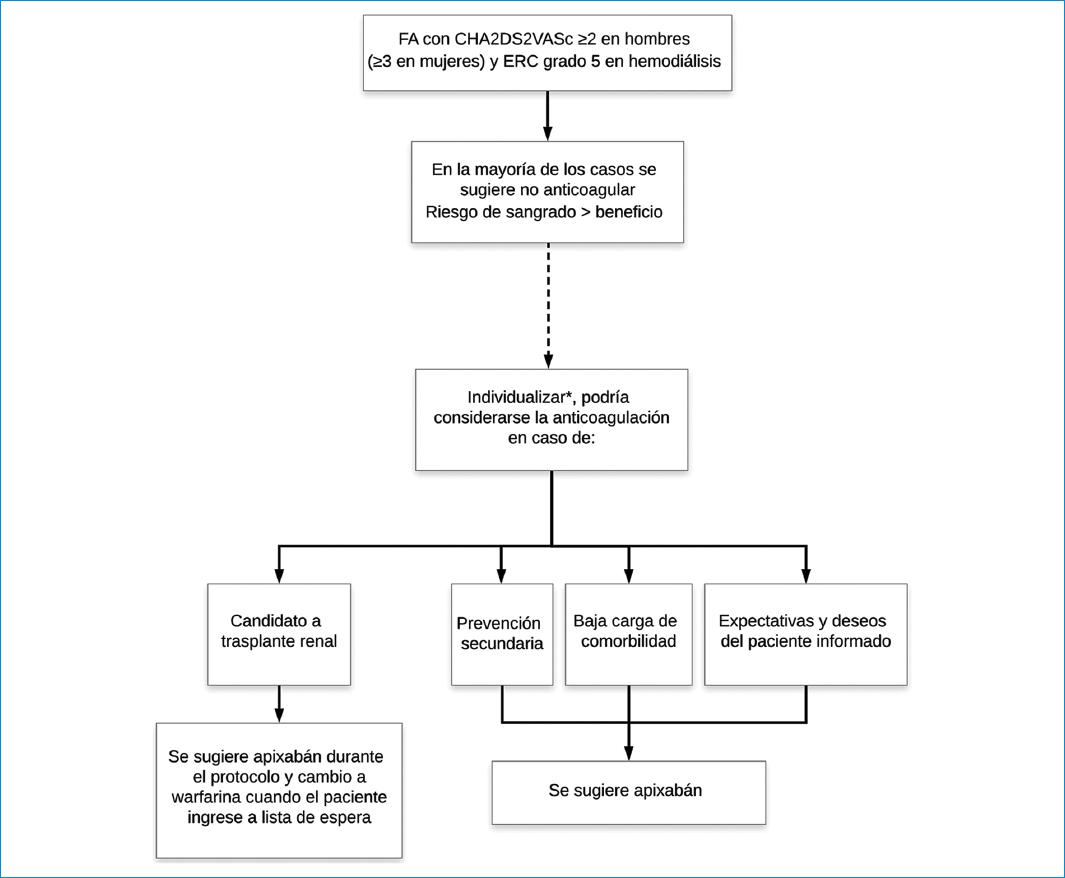
Figura 1 Abordaje del paciente con fibrilación auricular y enfermedad renal crónica de grado 5.*Tener en cuenta otros factores que incrementan la probabilidad de sangrado y que no apoyan la decisión de anticoagular: trombocitopenia < 100.000, antecedente de sangrado mayor o sangrado clínicamente relevante, uso de ASA o AINE, cirrosis, fragilidad, etc.














