Introducción
La pandemia causada por la COVID-19 (enfermedad por coronavirus 2019) inició en diciembre de 2019 al confirmar casos de neumonía con una etiología desconocida en la ciudad de Wuhan, provincia de Hubei, China. El 9 de enero de 2020 se reconoció que el patógeno causante era un nuevo tipo de coronavirus, que se nombraría SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2). Este virus es perteneciente a la familia Coronaviridae, orden nidovirales y género betacoronavirus, con proteínas S (spike o espícula) en su membrana y capacidad infectante al unirse, entre otros, con la enzima convertidora de angiotensina 2 (ECA2), permitiendo su entrada a ciertas células del organismo1. Aunque la mayoría de las manifestaciones son de origen respiratorio, existe afectación de otros sistemas, como el sistema cardiovascular, en el cual el signo más común es la taquicardia, y en estudios de seguimiento a pacientes recuperados de infección por SARS-CoV-2 se ha encontrado que el 44% tenían anormalidades cardiovasculares.
Dani et al.2 mencionan «COVID postaguda», conocido coloquialmente como «COVID prolongada», surgiendo como un nuevo síndrome que comprende un grupo de síntomas que incluyen disnea, dolor precordial, intolerancia ortostática y palpitaciones que pueden durar semanas o meses, incluso después de una enfermedad leve. Herrera et al.3 han propuesto el término europeo de «COVID crónica o de largo plazo».
La intolerancia ortostática y la taquicardia sinusal en reposo están catalogadas dentro del síndrome de intolerancia ortostática transitoria de la denominada infección «COVID prolongada»2. En el síndrome de COVID prolongada se ha documentado que las manifestaciones cardiovasculares son frecuentes, y dentro de ellas, los trastornos de la frecuencia cardiaca (FC), como taquicardia/bradicardia, en una relación 8:24.
Por ello, los intereses de este artículo son explicar las causas y los mecanismos fisiopatológicos propuestos de la taquicardia sinusal post-COVID-19, su persistencia como signo aislado y no asociado a enfermedades coexistentes en la COVID-19, así como proponer un algoritmo para identificación, estratificación y estrategias terapéuticas.
Fisiopatología de la infección y manifestaciones cardiovasculares
De acuerdo con las características, el virión SARS-CoV-2 interacciona con las células mediante la proteasa transmembranal serina 2 (TMPRSS2), que escinde la proteína S del virus, internalizándose por medio de la ECA2, con una afinidad de 10 a 20 veces mayor que el SARS-CoV, inducida por la subunidad S21,5,6. El virus SARS-CoV-2 se presenta clínicamente como un cuadro neumónico bilateral y difuso con potencial afectación en la mucosa oral, gastrointestinal, hepática, renal y cardiaca, por la presencia de estos receptores1,5,6. La infección del SARS-CoV-2 interactúa con el sistema renina-angiotensina-aldosterona cuando el virión SARS-CoV-2 se internaliza a las células de varios tejidos, principalmente en el pulmón a través de los neumocitos tipo 2 uniéndose a la ECA2, la cual transforma la angiotensina 2 a angiotensina 1-7, que cuenta con efectos vasodilatadores, antiproliferativos y antiinflamatorios1,5,6.
El SARS-CoV-2 induce la producción de daño cardiaco agudo e insuficiencia cardiaca, con un aumento en los niveles de troponina asociados a mayor mortalidad, relacionada con la respuesta inflamatoria sistémica y la activación de la respuesta inmunitaria excesiva propiciada por una «tormenta de citocinas», cuyo efecto es un extenso daño tisular con disfunción de la coagulación. Aunado a una placa coronaria preexistente, causa una lesión endotelial, la consecuente oclusión del vaso afectado y un riesgo elevado de infarto agudo de miocardio1,7.
Los niveles séricos de interleucina (IL) 6 y de proteína C reactiva (inducida por IL-6) persisten elevados incluso 45 días después de la infección, asociados a la progresión y la gravedad de la enfermedad8. Con la inflamación sistémica existente y la alteración pulmonar hipóxica se promueven la agregación plaquetaria, la trombosis pulmonar y el daño de las células endoteliales; estos desencadenan un estado de hipercoagulabilidad y daño miocárdico con alteraciones orgánicas y falla sistémica1,5,6. La afectación del aparato cardiovascular también puede ocurrir por diseminación hemática y linfática desde las vías respiratorias. La unión del SARS-CoV-2 con la ECA2 expresada en los cardiomiocitos, los fibroblastos cardiacos y las células del endotelio coronario se asocia con la entrada del virus a las células, alteración de las vías de señalización, replicación del virus dentro de la célula afectada, salida del virus de la célula (por lisis celular) y alteración de la membrana del sarcolema para infectar otras células cardiacas, lo que explicaría la alta incidencia de manifestaciones en el sistema cardiovascular1,7.
Normalmente la respuesta inmunitaria innata y adaptativa limita la replicación del virus dentro de la célula; sin embargo, el virus puede persistir dentro del miocardio. En un estudio9, los pacientes recuperados de la infección por la COVID-19 (78%) tenían compromiso cardiovascular detectado por resonancia magnética estandarizada, independientemente de las condiciones preexistentes, la gravedad, el tiempo desde el diagnóstico y la presencia de síntomas cardiacos.
Hipotensión
Se asocia con disfunción sistólica ventricular izquierda en el contexto de choque por la acción directa del virus o el aumento de citocinas proinflamatorias, como la IL-1 y el factor de necrosis tumoral alfa y en hospitalización representa un 50.9 % de los casos1,7,10.
Arritmias
Tiene una prevalencia del 16.7 a 19.6% en hospitalización y 44.44% en la unidad de cuidados intensivos (UCI). Es una consecuencia de la toxicidad sobre el tejido miocárdico, incluso en fase de convalecencia. El daño miocárdico es sinérgico con la hipoxia, el estrés neurohormonal, la liberación de citocinas y las alteraciones hidroelectrolíticas1,7. Hay una mayor incidencia de taquicardia ventricular y fibrilación ventricular en pacientes con lesión miocárdica que en aquellos sin lesión miocárdica, lo que sugiere una fuerte relación entre compromiso cardiaco y arritmia en los pacientes con COVID-195. Chen et al.11 encontraron que la hipopotasemia en el paciente con COVID-19 es frecuente y se asoció a elevación de K+ urinario (mmol/g de creatinina), y en casos graves persiste a pesar de la sustitución exógena de K+, al no conseguir su normalización sérica. Menores niveles de K+ urinario se correlacionan con el equilibrio del sistema renina-angiotensina-aldosterona y la función de la ECA2 vuelve a su estado basal.
Fibrilación auricular
El metaanálisis realizado por Liao et al.12, que incluyó 56 estudios, reportó una incidencia general de arritmias posterior a la COVID-19 del 16.8%, de las cuales se demostró una incidencia del 8.2% para fibrilación auricular/flutter auricular/taquicardia auricular. Yu et al.4 encontraron un caso de fibrilación auricular paroxística transitoria en un estudio que incluyó a 121 sujetos; ocurrió 8 días después de la hospitalización, con una duración de 1 día y remitió espontáneamente sin tratamiento.
Daño miocárdico asociado a isquemia miocárdica
Los pacientes con factores de riesgo para enfermedades coronarias presentan un riesgo elevado de síndrome coronario agudo (SCA), por el aumento de la demanda miocárdica de oxígeno debido al proceso infeccioso o al efecto de las citocinas circulantes asociadas al proceso inflamatorio7. El infarto agudo de miocardio se puede clasificar en tipo I, debido a la rotura de una placa de ateroma, y tipo II, por alteración en el aporte/demanda de oxígeno y frecuentemente secundario a una enfermedad grave. La trombosis microvascular en los vasos coronarios por el proceso de coagulación intravascular diseminada contribuye a la lesión del miocardio5. El daño miocárdico se relaciona con la gravedad del proceso inflamatorio y la disfunción ventricular; favorece la aparición de daño renal agudo, coagulopatías agudas y arritmias ventriculares malignas5,7.
Taquicardia
En un estudio realizado por Yu et al.4 se observó que la manifestación más frecuente fue la taquicardia sinusal, particularmente en pacientes afebriles entre la segunda y la tercera semana de hospitalización, que no se explicaba por la coexistencia de hipotensión arterial.
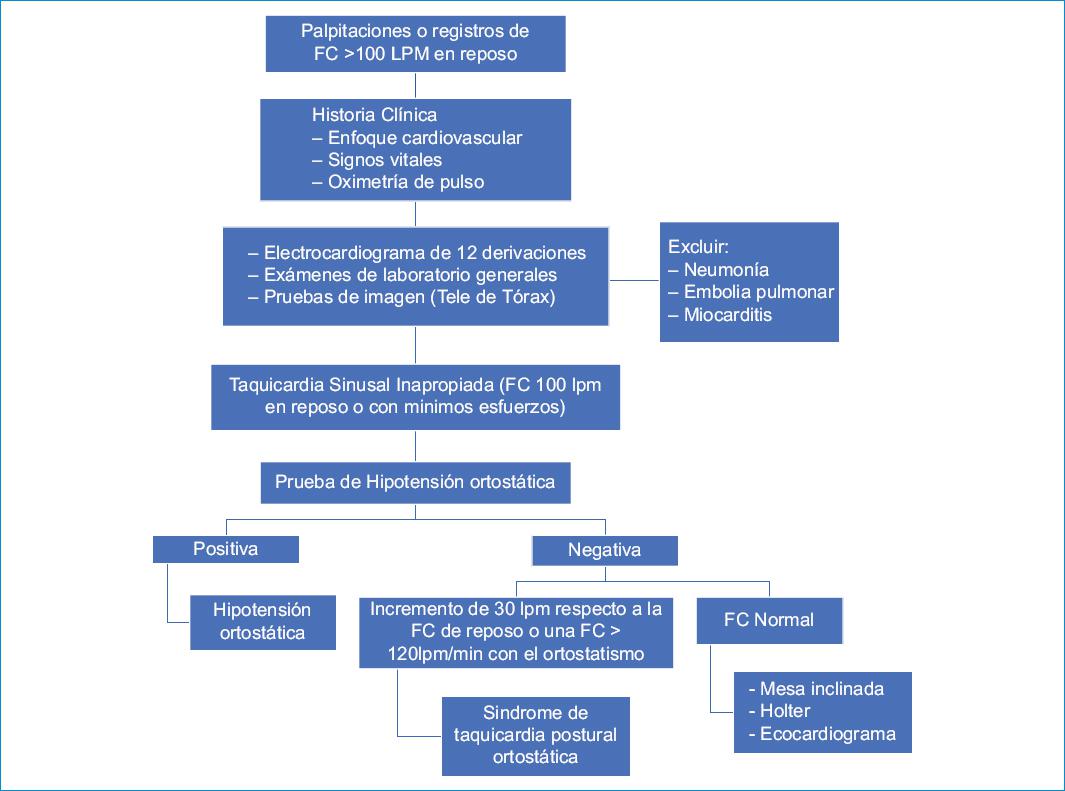
Durante el seguimiento de la recuperación de la COVID-19, según el estudio realizado por Yu et al.4 se registró taquicardia sinusal en el 71.9%, definida como una FC > 100 latidos por minuto (lpm). Las formas de presentación de taquicardia sinusal son las siguientes:
– Taquicardia sinusal inapropiada: FC en reposo elevada no paroxística > 100 lpm o una frecuencia promedio > 90 lpm medido con un monitor ambulatorio de 24 horas13.
– Taquicardia postural ortostática (TPO): se define como un síndrome clínico de intolerancia ortostática caracterizado por un incremento en la FC ≥ 30 lpm, generalmente con FC que supera los 120 lpm en bipedestación, en un intervalo de 10 minutos en esta posición u obtenido en una prueba de inclinación (head-up tilt), y no debe asociarse a hipotensión ortostática (disminución en la presión arterial sistólica ≥ 20 mmHg o disminución ≥ 10 mmHg de la presión arterial diastólica)14.
– Disfunción del nodo sinusal: según Rizo et al.15, es «la incapacidad en la adecuada formación de los impulsos sinusales o en su propagación a las aurículas debido a un trastorno intrínseco del nodo sinusal que provoca un conjunto de síntomas, signos y manifestaciones electrocardiográficas características, que forman parte del complejo clínico electrofisiológico denominado disfunción sinusal».
Mecanismos fisiopatológicos propuestos para explicar la taquicardia post-COVID-19
Según Cimino et al.16, debido a que la mayoría de los coronavirus comparten una estructura viral y una vía de infección similar, los mecanismos de infección propuestos para otros coronavirus también pueden ser aplicables al SARS-CoV-2, por lo que planteamos los siguientes mecanismos fisiopatológicos (Tabla 1):
Tabla 1 Mecanismos fisiopatológicos en la taquicardia sinusal post-COVID
| 1. Disfunción autonómica | Intrínseca | Taquicardia postural |
| Sindrome de Nodo enfermo | ||
| Extrínseca | ||
| 1. Cambio a una respuesta linfocitica TH1* y actividad parasimpática hacia una TH2+ y simpática | Sueño | |
| Glutatión | ||
| Hipoxia Pulmonar Ventilatoria | ||
| 2. Hipopotasemia | ||
| 3. Tromboembolia Pulmonar (TEP) | ||
| 4. Miocarditis | ||
| 5. Medicamento usados como terapia a la infeccion por COVID-19 | ||
*TH1: T helper 1, +TH2: T helper 2
1. Disfunción autónoma: La amplia expresión de ECA2 en los tejidos nerviosos, como en el centro autonómico a nivel de la médula inferior, y la naturaleza neurotrópica del SARS-CoV-2, podrían convertir a las fibras nerviosas cardiacas en un sitio de alta invasión17. La variación y la selección natural le permiten crear nichos, como el sistema nervioso central, con menor amenaza inmunológica para su supervivencia18.
La hipoxemia, la inflamación y la microtrombosis causan daño a los receptores de estiramiento pulmonar, a las fibras C en la pared alveolar, a los barorreceptores en los senos carotídeos y a los metaborreceptores generalizados, los cuales son fundamentales para integrar el ciclo respiratorio, la FC y la resistencia vascular en los cambios de presión arterial y ventilatoria. Esto compromete la capacidad de respuesta a estímulos locales, la actividad de impulso en las fibras glosofaríngeas, vagales aferentes, y el flujo de salida reflejo17.
La disfunción autónoma puede ser de dos tipos: intrínseca, cuando la afectación es directa al sistema nervioso autónomo (SNA), y extrínseca, cuando preexisten cardiopatías19.
A. Disfunción autónoma intrínseca
– Taquicardia postural ortostática
Habitualmente la caída en el retorno venoso, que sucede al tomar la postura erguida, produce un menor estiramiento de estos receptores, disminuyendo la descarga aferente al sistema nervioso e incrementando la descarga simpática, generando vasoconstricción sistémica. Al tomar la posición erguida causa hipotensión que estimula los receptores de alta presión en el seno carotídeo, reduciendo la descarga vagal eferente al nodo sinusal, produciendo un incremento de la FC (de 10 a 15 lpm) y de la presión diastólica (de 10 mmHg), con cambio mínimo o nulo en la presión sistólica. El volumen sanguíneo torácico disminuye en un 30% y con menor gasto cardiaco (aumenta la FC como mecanismo compensador), y esto activa el sistema renina-angiotensina-aldosterona; cuanto más bajo sea el volumen, mayor será su grado de activación. Si el proceso no se limita, generará hipotensión y aumento mantenido de la FC, suficientes para producir hipoperfusión cerebral, hipoxia y pérdida de la consciencia20.
Dani et al.21 plantearon la hipótesis de que la disfunción autónoma presentada en la COVID-19 podría estar mediada por el propio virus, mediante dos mecanismos:
– El primero, por la tormenta de citocinas proinflamatorias en respuesta al SARS-CoV-2 que resulta de una activación simpática, a diferencia de la estimulación vagal que resulta en una respuesta antiinflamatoria.
– Un segundo mecanismo es el inmunomediado (síndromes neurológicos), por el cual algunos trastornos autonómicos, como los observados en la hipotensión ortostática (OH) y en la TPO, se asocian con anticuerpos, por ejemplo, para los adrenoceptores a/b y los receptores muscarínicos y nicotínicos. Por lo tanto, se especula sobre un mecanismo inmunomediado por un componente autoinmunitario subyacente al síndrome post-COVID-19 que puede ser la etiología de este trastorno19,21.
Miglis et al.22 reportaron el caso de una paciente que desarrolló TPO varios meses después de la infección confirmada por SARS-CoV-2 (por tomografía computarizada, reacción en cadena de la polimerasa y anticuerpos IgG e IgM). Las pruebas autónomas demostraron características de TPO hiperadrenérgica y una taquicardia postural exagerada; persisten 5.5 meses después del inicio de los síntomas. La infección es un desencadenante bien descrito de TPO, con un 28-41% de los pacientes reportando su inicio después de un pródromo viral22.
– Disfunción del nodo sinusal
Aunque la mayoría de los casos reportados de disfunción del nodo sinusal relacionados a COVID-19 se presentan con bradiarritmias, incluyendo asistolia, algunos pacientes pueden registrar taquicardia sinusal en el seguimiento. Se ha demostrado que algunos coronavirus pueden propagarse al centro cardiorrespiratorio medular a través de quimiorreceptores y mecanorreceptores en el pulmón y las vías respiratorias inferiores. La mortalidad asociada a COVID-19 puede ser el resultado de una disfunción de este centro en el tronco encefálico o de una disfunción autonómica por alteración del sistema nervioso cardiaco intrínseco, con la subsecuente disfunción del nodo sinusal16. Las taquiarritmias auriculares inducen la remodelación celular del nodo sinusal, y debido a la elevada frecuencia de taquicardia durante la COVID-19 se explica una taquicardia persistente posterior a esta23.
B. Disfunción autónoma extrínseca
En la COVID-19, como se mencionó anteriormente, existe un riesgo de presentar un SCA, lo que genera un daño isquémico a los nervios autónomos cardiacos y el SNA cardiaco responde de forma aguda para preservar la homeostasis. Esto implica un aumento de la actividad simpática y una disminución de la actividad parasimpática para mantener la contractilidad cardiaca y el gasto cardiaco. Además, la tormenta de citocinas estimula una señalización aferente alterada y persistente. Esto da lugar a una reorganización funcional del SNA y a alteraciones en el procesamiento neuronal, lo que conduce a una alteración entre el control central (sistema nervioso central) y el periférico (ganglios cardiacos intratorácicos). La disfunción cardiaca puede causar cambios a corto y largo plazo en las redes neuronales, lo que resulta en respuestas reflejas exageradas19.
2. Cambio de una respuesta linfocítica tipo Th1 y actividad parasimpática hacia una linfocítica tipo Th2 y simpática
Debido a la naturaleza neurotrópica del SARS-CoV-2, proponemos una vía fisiopatológica similar a la infección por otro virus, como el de la inmunodeficiencia humana, el cual muestra neurotropismo, ya que se han reportado altas concentraciones en el hipocampo, los ganglios basales y otras regiones implicadas en la regulación hipotalámica. La activación de la respuesta al estrés del huésped por parte del virus permite el cambio del equilibrio inmunitario del huésped a linfocitos T helper (Th) 2, y al alterar la inmunidad del huésped por la modulación del equilibrio simpático-vagal e impulsar el equilibrio autonómico hacia un sesgo simpático puede contribuir a un entorno inmunitario más favorable a los virus y sesgado por Th218.
A. Sueño
Al igual que algunos virus respiratorios que interrumpen el sueño del huésped, período que normalmente está dominado por el sistema parasimpático y Th1, se sustituye por una respuesta simpática y Th2. La alteración del sueño perturba el ciclo sueño-vigilia, por modulación directa en el sistema nervioso central e indirectamente sobre los centros del sueño, por modulación endocrina (cortisol, melatonina), desencadenado por accesos de tos nocturna que despiertan al huésped18.
B. Glutatión
La alta expresión de ECA2 en el hígado hace de este un blanco potencial para infección por SARS-CoV-2, tanto en el sujeto sano como en el paciente con enfermedad hepática preexistente. La incidencia de lesión hepática asociada específicamente a COVID-19 varía del 14.8% al 53%. Se ha demostrado lesión hepática en pacientes con SARS, manifestada por elevación leve y moderada de la alanina aminotransferasa y de la aspartato aminotransferasa durante la etapa temprana de la enfermedad, además de disminución de la albúmina sérica y aumento de los niveles séricos de bilirrubina24. Se ha demostrado que al modular la inmunidad del huésped se interrumpe la vía hepática del glutatión, que normalmente promueve la función Th1, y que su depleción desplaza el equilibrio inmunitario hacia el sesgo Th2. El glutatión también ha estado potencialmente implicado en el deterioro de la actividad vagal a través de la pérdida de capacidad de respuesta al estrés oxidativo, con una actividad simpática incrementada18.
Velarde et al.24 reportan que en las biopsias hepáticas de pacientes con COVID-19 se observó esteatosis microvesicular y actividad inflamatoria portal y lobulillar leves; sin embargo, aún se desconoce si el daño hepático observado es debido al propio virus o a la lesión hepática idiosincrásica por fármacos, sustentada por el uso empírico de múltiples fármacos con gran potencial hepatotóxico, como remdesivir, atazanavir, ritonavir/lopinavir, ribavirina, tocilizumab, cloroquina, estatinas y fingolimod24,25.
C. Hipoxia pulmonar ventilatoria
En el caso del SARS-CoV-2, muchos de los hallazgos tomográficos han mostrado afectación del parénquima pulmonar con densidades en vidrio esmerilado de distribución periférica y bilateral. Dado lo anterior, la tomografía computarizada de tórax se ha considerado fundamental en el proceso diagnóstico de la afectación pulmonar por este virus, debido a su alta sensibilidad en la detección de cambios parenquimatosos compatibles con la enfermedad (hasta el 88%)26.
En regiones con menor ventilación relativa y oxigenación, el reflejo autonómico periférico activa la respuesta vasoconstrictora hipóxico-pulmonar para mantener una hematosis óptima, disminuyendo la perfusión a regiones hipóxicas. Esto significa que en las áreas con menor ventilación (PaO2 < 50 mmHg) se activa una respuesta vasoconstrictora en la microvasculatura, y de esta forma se permite una redistribución del flujo sanguíneo para lograr una relación ventilación/perfusión adecuada. La mayor actividad de la respuesta vasoconstrictora hipóxico-pulmonar en las regiones periférica y basal del pulmón puede estar asociada con una actividad simpática y Th2 relativamente mayor en estas regiones, siendo estas áreas las de mayor afectación en la infección por SARS-CoV-218.
3. Hipopotasemia
En la COVID-19, la hipopotasemia se desarrolla debido a un aumento drástico en la depleción de K+ a través de la orina. Este virus, al degradar la ECA2, conduce al sistema renina-angiotensina-aldosterona hacia un eje alterno del receptor de tipo 1 (AT1) de la unión Enzima convertidora de angiotensina-Angiotensina II (ECA-Ang II), que es el principal mecanismo contrarregulador del eje central del sistema renina-angiotensina-aldosterona. El efecto final de la alteración del sistema renina-angiotensina-aldosterona es el aumento de la liberación distal de Na+ y agua al túbulo colector del riñón y una mayor secreción de K+. Los niveles adecuados de K+ plasmático previenen la insuficiencia miocárdica mediante el debilitamiento de la hiperpolaridad celular y la despolarización11.
4. Tromboembolia pulmonar
Ya se ha mencionado que la hipercoagulabilidad sanguínea es un hallazgo común en los pacientes hospitalizados por COVID-19. Su efecto sobre la coagulación pulmonar y el desarrollo resultante de tromboembolia pulmonar (TEP) podría deberse a citocinas proinflamatorias, disfunción endotelial e hipoxia, que condicionan un aumento del riesgo de eventos tromboembólicos, a lo que se añaden otros factores de riesgo como la hospitalización prolongada, la ventilación mecánica o el ingreso en la UCI27,28.
En algunas UCI, más del 20% de los pacientes con COVID-19 desarrollaron TEP, y hasta el 30% si se cuenta con un evento tromboembólico (trombosis venosa profunda, ictus, infarto de miocardio, coagulación intravascular diseminada, etc.); con una edad media de 50-60 años, la mayoría estaban ingresados en la UCI y tenían factores de riesgo cardiovascular (índice de masa muscular ~30 kg/m2) o alteraciones bioquímicas (linfocitopenia, trombocitopenia, elevación de troponina, proteína C reactiva alta, etc.)27. El diagnóstico de TEP se hizo con una media de 19 días del inicio de los síntomas29.
El cor pulmonale agudo es una complicación de los pacientes con síndrome de dificultad respiratoria aguda, causado por el colapso alveolar, la vasoconstricción pulmonar hipóxica y la ventilación mecánica, factores que aumentan la resistencia vascular pulmonar y la carga del ventrículo derecho. En la COVID-19, el riesgo de insuficiencia del ventrículo derecho se reduce por disminución de la vasoconstricción pulmonar hipóxica y mayor distensibilidad pulmonar; sin embargo, la TEP es un diagnóstico probable cuando hay insuficiencia del ventrículo derecho30.
5. Miocarditis
Es la complicación cardiológica más común en pacientes con COVID-19, descrita como una alteración de las concentraciones séricas de biomarcadores cardiacos, especialmente la troponina I por encima del percentil 99, además de anormalidades de novo en estudios electrocardiográficos (como la prolongación del intervalo QT) y ecocardiográficos (incluida la disminución de la fracción de eyección a < 50%)1. El cuadro clínico de la miocarditis per se presenta signos y síntomas como taquicardia, pulso irregular, dolor torácico, galope e ingurgitación yugular.
En la COVID-19 grave, la miocarditis se asocia a falla cardiaca aguda con un incremento de la mortalidad del 50% al 70%, seguida de cicatriz regional y realce pericárdico en estudios de resonancia magnética. La reducción aguda de la fracción de eyección del ventrículo izquierdo se explica por los cambios en las propiedades de membrana de los miocitos cardiacos secundarios a la replicación del virus en el miocardio (efecto directo) o, de manera indirecta, a la respuesta sistémica inflamatoria7,10.
En la resonancia magnética, el aumento de las medidas de T1 (tiempo de relajación longitudinal) nativa representa fibrosis miocárdica difusa o edema, mientras que la T2 (tiempo de relajación transversal) nativa es específica para el edema. Ambas están aumentadas en el proceso inflamatorio activo, pero aquellos que han sanado y persisten con un aumento de las medidas nativas T1, pero con niveles de T2 normales, presentan daño miocárdico difuso residual9.
6. Medicamentos usados como terapia para la COVID-19
Las interacciones entre medicamentos y enfermedades pueden ser responsables de algunas de las taquiarritmias cardiacas notificadas1,5,31. Algunos fármacos, como la ribavirina, se asocian a alteraciones en la presión arterial (hipertensión o hipotensión), arritmias y SCA. Ha sido frecuente desde el inicio de la pandemia el uso de corticoides orales e intravenosos en etapas iniciales o avanzadas de la enfermedad, que predisponen a taquicardia sinusal32.
En el paciente con síndrome de respuesta inflamatoria sistémica, el tratamiento es personalizado y depende del uso de inmunomoduladores para reducir la inflamación sistémica antes de que produzca disfunción multiorgánica. Los corticosteroides con inhibidores de citocinas, como tocilizumab (inhibidor de IL-6) o anakinra (antagonista del receptor de IL-1), y la inmunoglobulina intravenosa modulan el sistema inmunitario que está en un estado hiperinflamatorio, pero su uso se asocia a cardiotoxicidad, episodios tromboembólicos, hipertensión arterial e hipercolesterolemia32.
La ivermectina se ha usado debido a la inhibición de la proteína importina a/b 1, encargada del transporte nuclear de proteínas virales y que potencialmente inhibiría la actividad de transporte nuclear del SARS-CoV-2; sin embargo, se asocia a taquicardia, hipotensión ortostática y prolongación del intervalo PR25.
Se sugiere el algoritmo mostrado en la figura 1 para su estratificación.
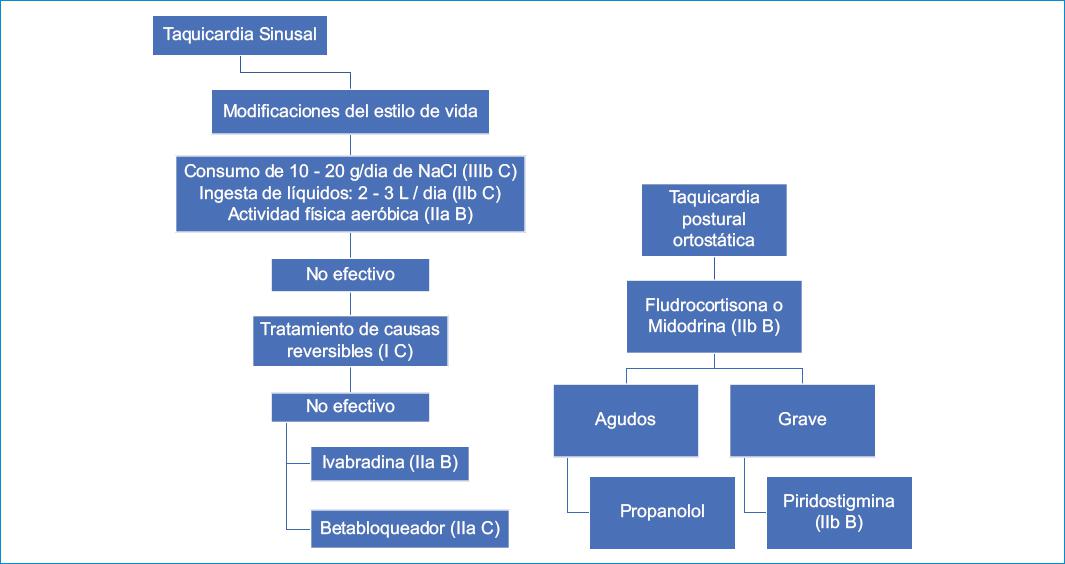
Tratamiento de la taquicardia sinusal post-COVID-19 (Fig. 2)
Modificaciones del estilo de vida
– Aumento en el consumo de NaCl y agua: con el propósito de expandir el volumen plasmático y prevenir la taquicardia refleja asociada con la deshidratación crónica. Se recomienda un consumo de NaCl de 10-12 g por día y un volumen diario de líquidos de 2-3 litros33,34.
– Medias compresivas al aumentar el retorno venoso.
– El entrenamiento físico es el eje central del tratamiento, basado en un programa de ejercicio regular, graduado y supervisado, con reacondicionamiento aeróbico y con algún entrenamiento de resistencia para los muslos.
Tratamiento farmacológico
1. Se recomienda el uso de betabloqueantes como tratamiento de primera línea en la terapia de la taquicardia sinusal inapropiada cuando se documenta hipersensibilidad beta-adrenérgica durante las pruebas de función autonómica, ya que disminuyen el tono simpático. La selección del tipo de betabloqueante debe ser individualizada. Se recomienda el empleo de betabloqueantes de acción larga, comenzando con dosis bajas (por ejemplo, metoprolol en formulación retardada 25 o 50 mg/día) y titulando posteriormente para así evitar la aparición de efectos secundarios. En algunos casos pueden ser necesarias dosis lo suficientemente altas para ocasionar efectos adversos, como fatiga crónica.
A. En TPO: los betabloqueantes no selectivos son preferibles porque bloquean adicionalmente la vasodilatación beta-2 mediada por adrenalina33,34.
2. Ivabradina: puede emplearse en monoterapia como primera línea o en combinación con betabloqueantes a dosis de 5 o 7.5 mg/12 h. Es posible evitar los efectos adversos habitualmente asociados con el uso de betabloqueantes. Sin embargo, el bloqueo de los canales If (current funny) en el nodo sinusal puede perturbar el circuito de retroalimentación subyacente al control barorreceptor del equilibrio autonómico, lo que aumenta la actividad simpática del corazón; por ello, es posible que su uso prolongado propicie efectos proarrítmicos. Se debe administrar de forma conjunta con un betabloqueante cuando sea posible33,34.
A. El 60% de los pacientes con TPO tuvieron una mejoría sintomática. Se debe administrar idealmente con betabloqueantes concomitantes para la terapia a largo plazo34.
3. Bloqueadores de los canales de calcio (no dihidropiridinas): han mostrado un beneficio moderado en el control sintomático. La combinación de betabloqueantes y bloqueadores de los canales de calcio es útil en el 65-70% de los casos. Dosis elevadas pueden causar hipotensión arterial.
4. Evidencia de trastornos autonómicos: uso de fludrocortisona y midodrina. Benéfico en pacientes con hipotensión ortostática33,34.
A. Pacientes con Na+ urinario de 24 h < 170 mmol/l: la fludrocortisona asociada con el aumento en la ingesta de agua es bastante efectiva. Debe administrarse con precaución en varones ancianos por sus efectos adversos en el tracto urinario. En el paciente con TPO grave se recomienda la administración de fludrocortisona a dosis de 0.05-0.2 mg/día33.
B. La midodrina reduce significativamente la taquicardia ortostática. Tiene un inicio rápido con solo efectos breves y generalmente se administra tres veces al día. El medicamento únicamente debe administrarse durante el día, ya que puede causar hipertensión supina34.
C. Las dosis bajas de propranolol reducen de forma aguda la FC permanente y mejoran los síntomas en pacientes con TPO, mientras que las dosis más altas no son bien toleradas33.
5. Agentes simpaticolíticos: clonidina y reserpina. Poca evidencia de sus beneficios a largo plazo33.
6. Inhibidores de la colinesterasa: el uso de piridostigmina ha demostrado resultados favorables a corto plazo, con limitada información a largo plazo. En los pacientes con TPO grave se recomienda una dosis de 30 mg/día33.
La duración de la terapia se recomienda en un promedio de 2 años con esquema de dosis-reducción.
Tratamiento invasivo
La ablación con radiofrecuencia es un recurso radical y reservado a pacientes refractarios al esquema de tratamiento, mediante la modificación del nodo sinusal a través de la aplicación de radiofrecuencia en la porción superior de la crista terminalis, evitando la ablación completa del nodo sinusal que ocasionaría la aparición de un ritmo de escape nodal, lo que a menudo conlleva la necesidad de implante de un marcapasos. En casos refractarios se ha empleado un abordaje epicárdico. Esta mejoría es limitada y, a pesar de una tasa elevada de disminución de los síntomas a corto plazo, existe recurrencia (10-30%) a largo plazo, con un empeoramiento en los síntomas y un deterioro en la calidad de vida33. Es de suma importancia la realización de un correcto diagnóstico diferencial con la TPO, ya que en tal caso el procedimiento agravaría los síntomas del paciente33.
Debe hacerse seguimiento continuo con una visita al menos una vez al año. Sin embargo, esta actitud debe ser individualizada, según las necesidades del paciente, mediante electrocardiograma basal periódico, monitorización Holter de 24 horas (correlacionar la sintomatología con la presentación de taquicardia sinusal y la respuesta al tratamiento) y ecocardiograma bidimensional si hay signos clínicos de cardiopatía aguda o crónica33.
Conclusiones
La COVID-19 ha impactado al mundo desde su inicio, propagación, manifestaciones y desenlaces, siendo un reto para la atención a la salud. Las enfermedades cardiovasculares forman parte de este amplio espectro, entre ellas la taquicardia sinusal post-COVID, que es frecuente y multifactorial. Este trabajo reúne las teorías fisiopatológicas múltiples que enfocan las vías de posible desarrollo y persistencia en la etapa de COVID-19 prolongada, donde destaca una actividad simpática a una respuesta refleja exagerada, así como la integración de una propuesta para su identificación y atención temprana, teniendo impacto en la clase funcional del paciente y la integración a su vida cotidiana. El reto de futuras investigaciones será identificar las vías de afectación que eviten la progresión y el daño cardiovascular para prevenir secuelas inmediatas y tardías, como la taquicardia sinusal post-COVID.