Introducción
En las últimas décadas, los avances en las terapias han llevado a una mejoría sustancial en la sobrevida de muchos pacientes con cáncer. No obstante, se ha observado un incremento de su morbimortalidad debido a los efectos secundarios de la quimioterapia y la radioterapia, siendo la enfermedad cardiovascular (ECV) uno de los más frecuentes1. La base patogénica de esta evolución clínica sería el desarrollo de cardiotoxicidad, ya sea por efectos directos de los medicamentos sobre la función y la estructura cardíacas, o por un desarrollo acelerado de la ECV, especialmente en pacientes con factores de riesgo previos2.
La cardiotoxicidad secundaria al tratamiento quimioterápico puede manifestarse en un amplio abanico de presentaciones clínicas como isquemia miocárdica, insuficiencia cardíaca, valvulopatía, arritmia, hipertensión arterial, enfermedad tromboembólica venosa, afectación vascular periférica, hipertensión pulmonar y complicaciones pericárdicas1. Los mecanismos mediante los cuales estos medicamentos pueden provocar isquemia miocárdica son diversos, y van desde el vasoespasmo, la lesión endotelial o la trombosis arterial aguda, hasta modificaciones del metabolismo lipídico que causan aterosclerosis prematura1,3. A continuación se presenta el caso de un paciente oncológico con factores de riesgo cardiovascular, que presenta un cuadro de angina inestable tras iniciar la quimioterapia. A propósito del caso, se discuten los mecanismos subyacentes a la isquemia aguda y se enfatiza la necesidad de individualizar la estratificación de riesgo antes de iniciar la terapia oncológica específica.
Caso clínico
Paciente de sexo masculino, de 66 años de edad, fumador e hipertenso y portador de enfermedad coronaria crónica, con antecedente de infarto agudo de miocardio con elevación del segmento ST en 2003, tratado con angioplastia primaria sobre la arteria descendente anterior media, sin que se lograra la resolución de una lesión grave de un primer ramo diagonal, de fino calibre. Recibió tratamiento con aspirina, enalapril, bisoprolol y atorvastatina, asociados a las medidas higiénico-dietéticas usuales en prevención secundaria. En enero de 2019 fue diagnosticado de cáncer de esófago locorregional avanzado, por lo que fue tratado con poliquimioterapia neoadyuvante perioperatoria basada en tres ciclos sucesivos preoperatorios de capecitabina/oxaliplatino/epirubicina. Previo al inicio del tratamiento, abandonó el hábito tabáquico y fue valorado por el equipo de cardiología, que constató una adecuada clase funcional para actividades de la vida diaria y ausencia de sintomatología cardiovascular. El electrocardiograma basal mostró ritmo sinusal, onda P y segmento PR normales, eje eléctrico medio frontal: -15o, complejo QRS de 90 ms, fraccionado en DII, onda T aplanada en DI y aVL, y QTc normal. Tras el tercer ciclo de poliquimioterapia, instaló angor típico, clase funcional II (Canadian Cardiovascular Society), que progresó en dos a tres semanas a clase funcional III. Se solicitó paraclínica con el fin de descartar posibles factores desestabilizantes de la isquemia miocárdica, destacándose un valor de hemoglobina de 11,3 g/dl y recuento plaquetario de 220.000/ml. El resto de la analítica fue normal. El ecocardiograma-Doppler transtorácico constató fracción de eyección del ventrículo izquierdo del 68% (método elipsoide), motilidad sectorial normal y ausencia de alteraciones valvulares. A continuación, se solicitó un centellograma de perfusión miocárdica con Tc99m-MIBI (SPECT gatillado) sensibilizado con vasodilatadores, que evidenció defectos de perfusión compatibles con isquemia miocárdica grave extensa, inducida por el estrés farmacológico, asociados a cambios funcionales de alto riesgo (Fig. 1). La angiografía coronaria (Fig. 2) mostró restenosis oclusiva de la angioplastia previa, estenosis moderada en circunfleja distal y estenosis leve proximal y moderada del tercio medio de la coronaria derecha. Se procedió a la cirugía de revascularización coronaria mediante tres anastomosis (arteria mamaria interna-arteria descendente anterior, puente venoso-segundo marginal obtuso y venoso-arteria descendente posterior), que transcurrió sin incidentes. Tras una buena evolución clínica, recibió el alta a los siete días posteriores al acto quirúrgico. Un mes después fue sometido a esofagectomía en dos tiempos (abdominal y torácico), sin complicaciones.
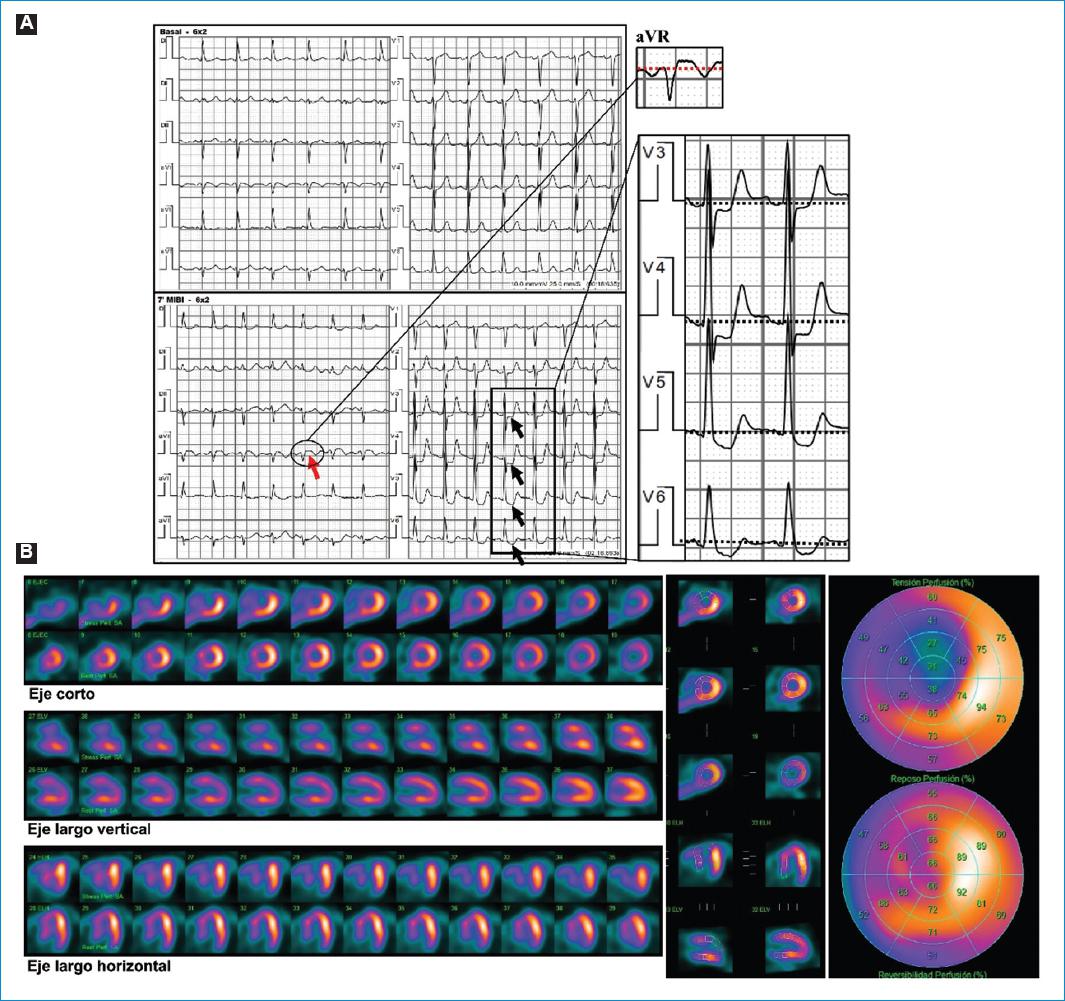
Figura 1 Hallazgos funcionales observados tras iniciar la quimioterapia. A: test de provocación de isquemia sensibilizado con vasodilatadores (0,56 mg/kg de dipiridamol). Durante la inyección de Tc99m-MIBI se observó infradesnivel-ST horizontal en V3-V6, máximo en V4 donde alcanza 2 mm (flechas negras), acompañado de supradesnivel-ST de 1 mm en aVR (flecha roja). El paciente refirió angor tras la infusión del dipiridamol, que persistió hasta 7 minutos luego de la administración de aminofilina y cedió con dinitrato de isosorbida sublingual. B: las imágenes del centellograma de perfusión miocárdica por SPECT gatillado muestran defectos de perfusión reversibles en ápex, regiones anterior y anteroseptal, con extensión parcial a la región inferoseptal, compatibles con isquemia grave y extensa inducida por el estrés farmacológico con dipiridamol. En el posestrés se comprobó caída significativa de la FEVI (62 a 31%) e hipocinesia global de predominio anterior.
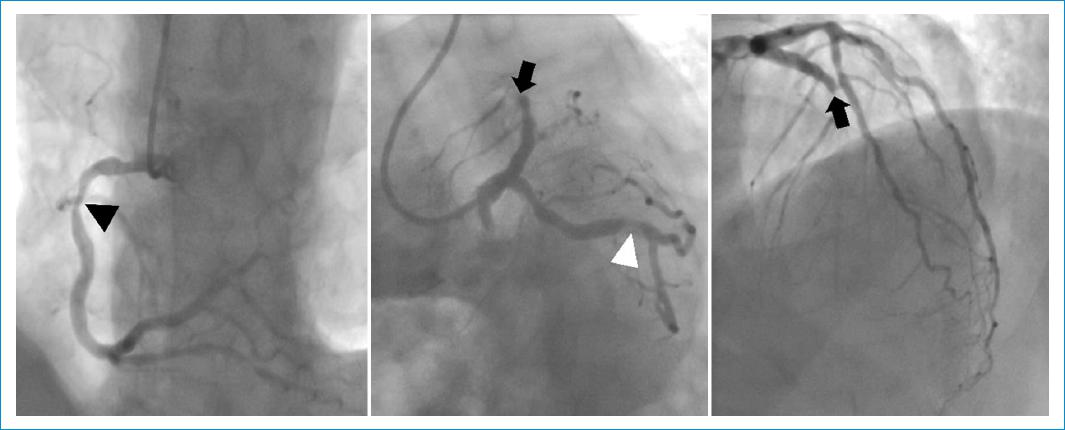
Figura 2 Angiografía coronaria. Restenosis oclusiva de angioplastia previa sobre la arteria descendente anterior media (flecha negra), estenosis del 50% en la arteria circunfleja distal (punta de flecha blanca) y estenosis leve proximal y del 50% en la arteria coronaria derecha media (punta de flecha negra).
Discusión
La enfermedad cardiovascular es la primera causa de muerte en los pacientes que sobreviven al cáncer. Aunque su manifestación más frecuente es la insuficiencia cardíaca, también pueden observarse enfermedad coronaria, hipertensión arterial y arritmias, en función de los medicamentos utilizados, solos o combinados, y de la dosis1,4.
Los citostáticos comúnmente asociados al desarrollo de isquemia miocárdica aguda son el 5-fluorouracilo y su profármaco, la capecitabina5,6, que representa el segundo medicamento mayormente asociado a cardiotoxicidad luego de las antraciclinas6. Se postula que el mecanismo primario de la isquemia asociada al 5-fluorouracilo y la capecitabina es la disfunción endotelial, que, a su vez, puede desencadenar espasmo y trombosis coronaria5. Los defectos de perfusión centellográficos de alto riesgo observados precozmente tras la QT han sido escasamente reportados. Los hallazgos vistos en el caso, alejan la hipótesis del vasoespasmo y apoyan la posibilidad de disfunción endotelial, ruptura de placa, o ambas, como principales mecanismos subyacentes.
Los estudios histopatológicos del endotelio arterial en animales de experimentación han encontrado que el 5-fluorouracilo puede causar citólisis extensa, denudación de la lámina elástica interna, agregación plaquetaria y formación de fibrina a nivel cardíaco5,7. Sin embargo, la asociación de estos agentes con el riesgo de trombosis del stent permanece sin definir8. En nuestro caso, se postula que la quimioterapia podría haber acelerado la evolución de la placa de ateroma sobre un vaso ya intervenido, desencadenando la desestabilización de los síntomas en un paciente con enfermedad coronaria establecida.
Algunos estudios observacionales exploraron la relación entre factores de riesgo cardiovascular y cardiotoxicidad, y encontraron que la edad mayor a 55 años, el tabaquismo y la ECV preexistente se asociaban con mayor riesgo de daño miocárdico posterior a la quimioterapia. Sin embargo, la relación de causalidad entre el tratamiento con 5-fluorouracilo y capecitabina y la cardiotoxicidad sigue siendo incierta6,9. Con base en estas evidencias, actualmente se recomienda mantener un adecuado control de los factores de riesgo antes de iniciar la quimioterapia con fluoropirimidinas1,10, como se efectuó en este paciente. La Sociedad de Angiografía e Intervenciones Cardiovasculares (SCAI, por su sigla en inglés) recomienda mantener el tratamiento con inhibidor de la enzima convertidora de angiotensina, betabloqueador (de preferencia carvedilol o nevibolol), aspirina y estatina, realizar un ecocardiograma basal y repetir la ecocardiografía a los 5 años si el paciente permanece asintomático8.
Un adecuado balance riesgo-beneficio sobre la terapia oncológica representa siempre un gran desafío clínico. Por tanto, es primordial la estratificación correcta y oportuna del riesgo individual y el seguimiento clínico estricto por parte del cardiólogo, en estrecha colaboración con el equipo oncológico. Las nuevas evidencias que provean los estudios prospectivos amplios deberían contribuir a individualizar mejor esta estratificación de riesgo y evitar eventos graves como el descrito. Más aún, los ensayos clínicos multicéntricos llevados a cabo en pacientes con diferentes perfiles de riesgo cardiovascular podrían definir, en un futuro cercano, la utilidad de uno o más fármacos en la prevención de los eventos coronarios que ocurren durante o posterior a la quimioterapia.
Conclusión
Los pacientes oncológicos con riesgo cardiovascular elevado y/o enfermedad coronaria establecida requieren una evaluación exhaustiva y un seguimiento cardiológico estrecho, que busca disminuir el riesgo de complicaciones cardíacas graves durante y luego del tratamiento oncológico específico.














